柴达木地区患根腐病枸杞根际土壤微生物多样性分析
方泰军 侯璐 白露超

摘要:为了解枸杞受根腐病菌侵染后植株根组织与根际土壤中真菌与细菌群落结构以及多样性,采用高通量测序技术对柴达木地区患根腐病枸杞的根组织和根际土壤样本进行分析。结果表明,根际土壤中的细菌群落丰度略高于根组织,而真菌多样性和丰度在根际土壤和根组织样本中无显著差异。在门水平,细菌群落中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)的相对丰度较高,真菌群落中子囊菌门(Ascomycota)和担子菌门(Basidiomycota)的相对丰度较高;在属水平,细菌中以假单胞菌(Pseudomonas)为主,真菌中以枝孢属(Cladosporium)和被孢霉属(Mortierella)为主。相关性分析显示,细菌群落在根组织和根际土壤样本中差异较大,而真菌群落在根组织和根际土壤样本间相关性较高;枝孢属(Cladosporium)和被孢霉属(Mortierella)的相对丰度在根组织和根际土壤中均显著上调,初步推测这2属真菌可能与枸杞根腐病发病相关。
关键词:枸杞;根腐病;高通量测序;微生物多样性
doi:10.13304/j.nykjdb.2022.0530
中图分类号:S154.3 文献标志码:A 文章编号:10080864(2024)01013307
枸杞(Lycium barbarum)是茄科枸杞属的多年生落叶灌木。在中国,其主要分布在青海至山西的黄河两侧,以及青海省的柴达木盆地和甘肃的河西走廊[1]。柴达木盆地的高海拔和强光照为枸杞提供了良好的生长条件[2]。然而,在枸杞规模化种植过程中,随着年限的增加,根腐病愈发严重,导致枸杞大面积死亡,枸杞果实的质量和产量严重下降[3]。根腐病常发生于植物根部,发病初期,根韧皮部褐化变黑,病斑沿根部向茎杆扩散;发病后期,韧皮部腐烂脱落,造成整株死亡[45]。
土传病原体影响土壤健康和粮食产量,其对作物造成的严重破坏是世界性难题[6]。研究表明,隐花疫霉会影响酪氨酸代谢相关基因的表达,从而导致非洲菊患根腐病[7]。茄病镰刀菌也是土传病原菌,可导致胡椒患根腐病,降低其产量[8]。大多数土传病原体通常具有广泛的宿主范围[9-11]。植物根腐病的发生往往由多种病原共同作用所致,因此,研究植物根系微生物的多样性对于综合考虑植物发病原因具有重要意义[12]。Natacha等[13]通过研究拟南芥根际和周围土壤中的细菌群落,发现土壤中含有与拟南芥生长相互作用的微生物。这一发现也为枸杞根腐病从传统药剂防治到生物防治提供了新的思路。因此,本研究通过高通量测序研究患病枸杞根组织和根际土壤中的微生物多样性及群落组成,明确患根腐病后枸杞根组织和根际土壤中的微生物多样性及群落结构,为枸杞根腐病的病因探索以及防治奠定理论基础。
1 材料与方法
1.1 样品采集及测序
于2020 年7 月在青海省都兰县诺木洪农场(36°20′—36°30′N,96°15′—96°35′E)枸杞种植区随机选择相同树龄、长势一致且患根腐病的植株6株,将其挖出,采集细根作为根样品,并将附着在根部表面0~4 mm土壤用灭菌后的镊子和毛刷进行收集,作为根际土样品。将采集到的根样品和土壤样品用无菌塑封袋保存,干冰运送至北京百迈客生物科技有限公司进行DNA提取、PCR扩增以及高通量测序。土壤样品编号分别为S1、S2、S3、S4、S5和S6;根系样品编号分别为R1、R2、R3、R4、R5和R6。其中,土壤样品S5在试验过程中意外受损,未纳入后续分析。
1.2 数据处理
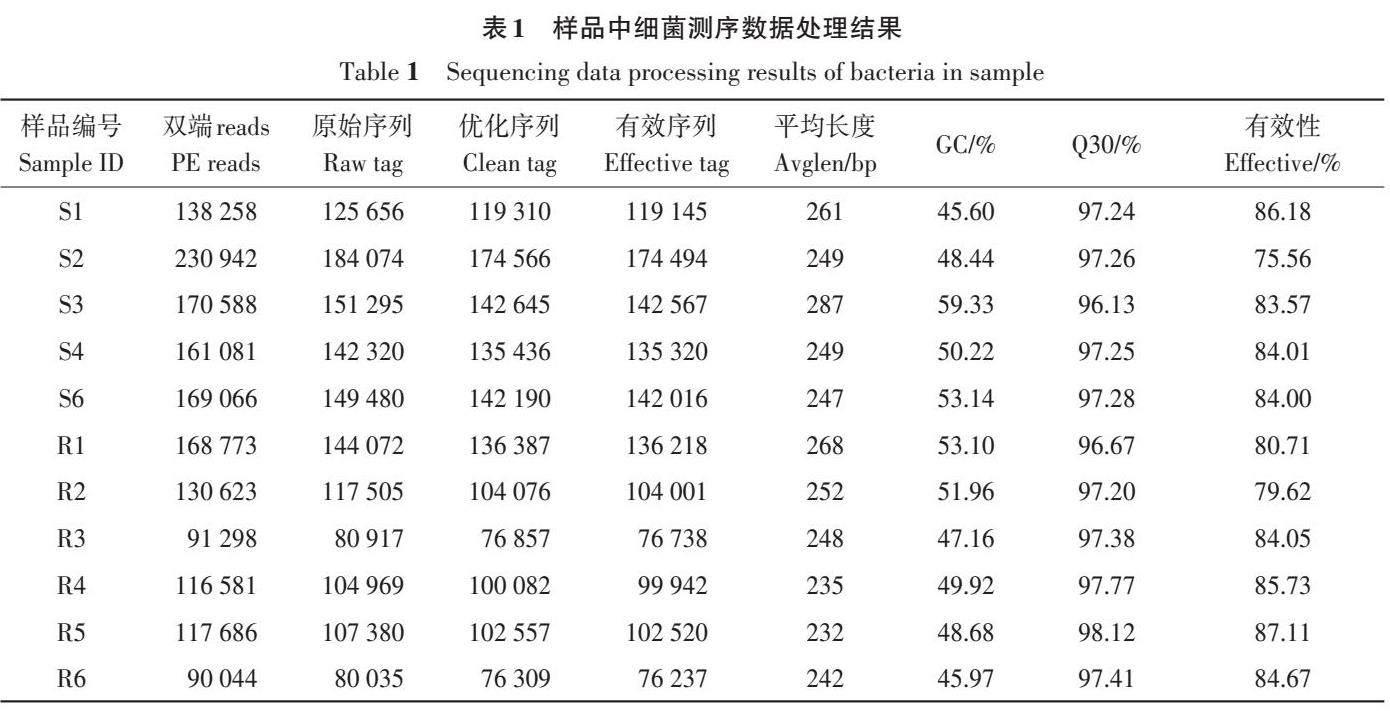
测序得到的原始数据通过FLASH v1.2.7软件进行拼接,得到原始序列(raw tags),然后利用Trimmomatic v0.33软件对原始序列进行过滤,获得优化序列(clean tags),并用UCHIME v4.2软件,鉴定去除嵌合体序列,得到有效序列(effectivetags)。最后统计数据处理各阶段的序列数、平均序列长度(average length,Avglen)、GC 含量、Q30质量值以及有效序列占双端reads 数的比例(Effective)等参数对测序数据进行评估。
2 结果与分析
2.1 测序数据质量评估
样品中细菌测序结果如表1所示,11个样本测序得到90 044~230 942个PE reads;对每个样本reads 进行拼接,获得80 035~184 074 个原始序列;经过滤后,获得76 309~174 566个优化序列;去除嵌合体后,获得了76 237~174 494个有效序列。样本平均序列长度为232~287 bp,GC含量≥45.60%,Q30≥97.20%,有效序列占比≥75.56%。
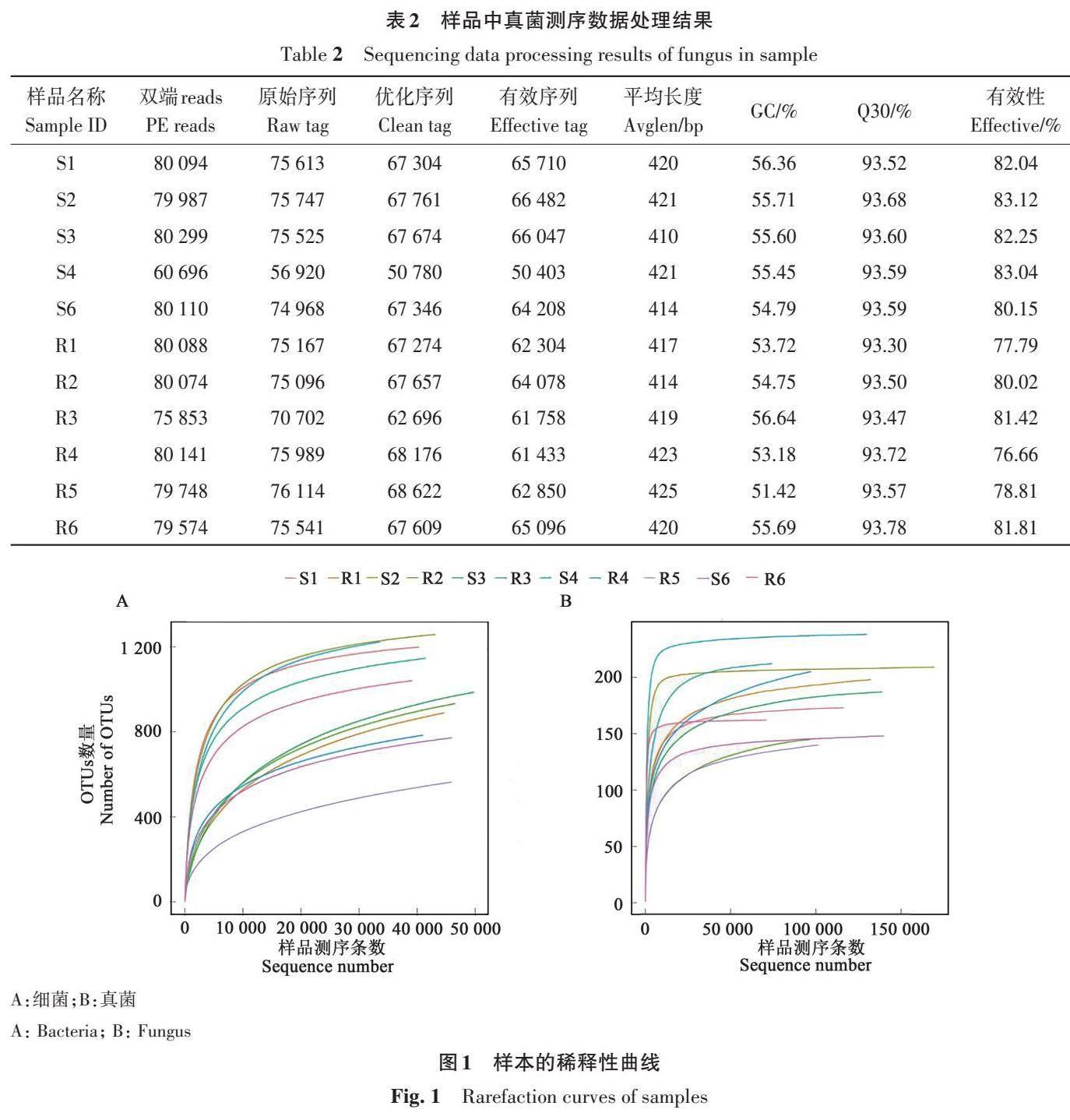
样品中真菌测序结果如表2所示,11个样本测序得到60 696~80 299 个PE Reads;对所有reads进行拼接,获得56 920~75 989个原始序列;经过滤后,获得50 780~68 622个优化序列;去除嵌合体后,获得了50 403~66 482个有效序列。样本平均序列长度为410~425 bp,GC含量≥51.42%,Q30≥93.30%,有效序列占比≥76.66%。
2.2 α 多样性分析
由图1可知,随着样品测序数量的增加,稀释曲线逐渐趋于平缓,在增加测序深度后,操作分类单位(operational taxonomic units, OTUs)数量并没有明显的增加,由此表明测序结果已涵盖样本绝大多数物种信息。
细菌α多样性结果如表3所示,11个样本聚类得到564~1 258 个OTUs,覆盖率达99.45% 以上,Ace指数和Chao1指数显示S1、S2、S4样本的物种丰度较高,即土壤样本细菌在物种丰度上略高于根组织样本;Shannon指数和Simpson指数在土壤和根组织样本间无明显差异。
真菌α多样性结果如表4所示,11个样本聚类得到140~238个OTUs,覆盖率在99.97%以上,其中S1、S2、S4、R6样本的覆盖率为100%,表明测序结果基本覆盖11组样本的真菌种类。S4样品的Ace指数、Chao1指数、Shannon指数最高,且该样品的Simpson指数最小,表明该样品中真菌群落的丰度及多样性均较高,其余样品间差异较小。
2.3 群落组成分析
2.3.1 门水平 对OTUs 进行注释和差异分析,结果( 图2)表明,在细菌中,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)在土壤和根组织中相对丰度较高(图2A);在真菌中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉菌门(Mortierellomycota)在土壤和根组织中相对丰度较高。R2、R3、R4和R6样品中变形菌门的相对丰度最高;S1、R1、R5 和R6 样品中的蓝细菌门(Cyanobacteria)的相对丰度高于其他样品(图2B)。细菌中,变形菌门的相对丰度(Proteobacteria)在根系和土壤中差异较大,拟杆菌门(Bacteroidetes)次之;真菌中,子囊菌门(Ascomycota)的相对丰度在土壤和根中差异较大,其次是担子菌门(Basidiomycota)。
2.3.2 属水平 在属水平,共鉴定了263个细菌属和106个真菌属,分别有44和32个属在根组织和土壤间存在显著差异。在细菌中,假单胞菌(Pseudomonas)在R2和S3样品中的相对丰度较高(图3A);在真菌中,枝孢属(Cladosporium)、被孢霉属(Mortierella)、链格孢属(Alternaria)、赤霉菌属(Gibberrlla)和球腔菌属(Mycosphaerella)的相对丰度较高(图3B)。
2.4 β 多样性分析
主成分分析结果(图4)显示,细菌群落在根和土壤样品间组成差异较大(PC1 解释了属内20.8%的变异);真菌群落在根和土壤样品间差异较小(PC1解释了群落中25.3%的变异)。由此表明,患根腐病枸杞根组织和土壤样本的真菌群落结构相似度较高。
3 讨论
根腐病给枸杞产业造成巨大的经济损失[14],因此,寻找主要病原菌对防治根腐病具有重要意义。本研究利用高通量测序分析了青海省柴达木地区患根腐病枸杞根和土壤中细菌和真菌的多样性及群落结构。11个样品的真菌测序结果共获得50 403 至66 482 个有效序列,细菌测序获得76 237至174 494个有效序列;稀释曲线结果表明测序深度能够反映样本内物种信息。基于真菌序列的主成分分析结果表明,根组织和土壤样品中真菌的群落结构相似性较高,推断柴达木地区枸杞根腐病可能是由1种或多种真菌造成。
真菌的孢子可以通过空气、水或土壤远距离传播[15]。在生命周期的大部分时间,生活在土壤中的真菌被称为兼性腐生真菌[16]。大多数植物病原菌属于子囊菌属和担子菌属,本研究表明,根组织及其根际土壤中,子囊菌门和担子菌门的相对丰度较高,且在不同样本间差异显著。研究指出,立枯丝核菌、镰刀菌、腐霉菌和拟盘多毛孢菌等真菌是草莓黑根病的主要病原菌[17]。
研究表明,枝孢属真菌作为常见的病原菌可对柚子、雪松等植物造成病害[1819];被孢霉属真菌在杨梅衰弱病植株根际土中的相对丰度高于健康植株[20]。这2种真菌在本研究中的相对丰度也较高,推测它们以无性菌丝、分生孢子的形式在土壤和病株中越冬,待条件合适时,分生孢子萌发并产生芽管侵入伤口,然后产生孢子,从而进行多次再感染,致使枸杞植株感病。
参考文献
[1] YAO R, HEINRICH M, ZOU Y, et al .. Quality variation of gouji(fruits of Lycium spp.) in China: a comparative morphologicaland metabolomic analysis [J/OL]. Front Pharmacol., 2018, 9:151 [2022-05-10]. https://doi.org/10.3389/fphar.2018.00151.
[2] CHEN C, SHAO Y, LI Y, et al.. Trace elements in Lyciumbarbarum L. leaves by inductively coupled plasma massspectrometry after microwave assisted digestion and multivariateanalysis [J]. Spectrosc. Lett., 2015, 48:775-780.
[3] 王凤宝,付金锋,董立峰,等.多倍体菜用枸杞新品种天精 3号选育[J].核农学报,2013,27(6):723-730.
WANG F B, FU J F, DONG L F, et al.. Selection and breeding ofthe new mixoploid lycium chinense miller variety Tianjing 3 [J]. J.Nucl. Agric. Sci., 2013, 27(6):723-730.
[4] CORRADO C, MINCUZZI A, SCHENA L, et al .. First report ofcollar and root rot caused by Phytophthora nicotianae on Lyciumbarbarum [J/OL]. J. Plant Pathol., 2018, 100: 361 [2022-05-10]. https://doi.org/10.1007/s42161-018-0076-0.
[5] 任如红,胡毅敏,李红叶,等.杨梅根腐病的早期诊断[J].浙江林学院学报,2000(1):117-121.
REN R H, HU Y M, LI H Y, et al.. Early diagnosis of root rot inChinese strawberry [J]. J. Zhejiang For. Coll., 2000(1):117-121.
[6] WANG L, LI X. Steering soil microbiome to enhance soilsystem resilience [J]. Crit. Rev. Microbiol., 2019, 45: 5-6,743-753.
[7] MUNIR N, CHENG C Z, XIA C S, et al .. RNA-Seq analysisreveals an essential role of tyrosine metabolism pathway inresponse to root-rot infection in Gerbera hybrida [J/OL]. PloSOne, 2019, 14(10): 223519 [2022-05-10]. https://doi.org/10.1371/journal.pone.0223519.
[8] MOREIRA E C, PINHEIRO D G, GORDO S, et al ..Transcriptional profiling by RNA sequencing of black pepper(Piper nigrum L.) roots infected by Fusarium solani f. sp.piperis [J/OL]. Acta Physiol. Plant, 2017, 39(10):239 [2022-05-10]. https://doi.org/10.1007/s11738-017-2538-y.
[9] MANTIRI F R, SAMUELS G J, RAHE J E, et al .. Phylogeneticrelationships in Neonectria species having Cylindrocarponanamorphs inferred from mitochondrial ribosomal DNAsequences [J]. Can. J. Bot., 2001, 79:334-340.
[10] MAVRODI O V, WALTER N, ELATEEK S, et al.. Suppression ofrhizoctonia and pythium root rot of wheat by new strains ofPseudomonas [J]. Biol. Control, 2012, 62(2):13-25.
[11] TEWOLDEMEDHIN Y T, MAZZOLA M, BOTHA W J, et al ..Characterization of fungi (Fusarium and Rhizoctonia) andoomycetes (Phytophthora and Pythium) associated with appleorchards in South Africa [J]. Eur. J. Plant Pathol., 2011, 130(2):215-229.
[12] WU Z, HAO Z, SUN Y, et al .. Comparison on the structure andfunction of the rhizosphere microbial community betweenhealthy and root-rot Panax notoginseng [J]. Appl. Soil Ecol.,2016, 107:99-107.
[13] NATACHA B, HORTON M W, BERGELSON J, et al.. Bacterialcommunities associated with the leaves and the roots of Arabidopsisthaliana [J/OL]. PloS One, 2013, 8:e56329 [2022-05-10]. https://doi.org/10.1371/journal.pone.0056329.
[14] CAO Y T, LIU J L. Review on the diseases and insects ofLycium barbarum L. [J]. Plant Dis. Pests, 2014, 5(6):8-12.
[15] ROCHON D. Fungal transmission of plant viruses [J]. Annu.Rev. Phytopathol., 2009, 34(1):87-108.
[16] LIU Y, SUN Q, LI J, et al .. Bacterial diversity among the fruitbodies of ectomycorrhizal and saprophytic fungi and theircorresponding hyphosphere soils [J]. Sci. Rep., 2018, 8(1):1-10.
[17] DINLER H, BENLIOGLU S, BENLIOGLU K. Rhizoctoniafragariae causes black root rot on strawberry seedlings inTurkey [J]. Australas. Plant Dis. Notes, 2018, 13(1):1-3.
[18] 吕靖雯,刘蕊,李国华,等.柚果面枝孢菌斑点病病原鉴定[J].浙江大学学报(农业与生命科学版),2018,44(6):687-694.
LYU J W, LIU R, LI G H, et al .. Identification of pathogenscausing fruit spot disease on Citrus grandis [J]. J. ZhejiangUniv. (Agric. Life Sci.), 2018, 44(6):687-694.
[19] 雷桂林,刘云龙,刘雪峰,等.雪松针叶枯斑病病原鉴定及其生物学特性研究[J].林业科学研究, 2003(4):453-458.
LEI G L, LIU Y L, LIU X F, et al .. Determination of necroticspot pathogen on needle of Cedrus deodara and the biologicalcharacteristics of the pathogen [J]. For. Res., 2003(4):453-458.
[20] 任海英,王程安,俞浙萍,等.杨梅衰弱病根际土壤真菌的定量检测与分析[J].植物病理学报,2022,52(4):529-536.
REN H Y, WANG C A, YU Z P, et al .. Quantitative detectionand analysis of rhizospheric soil fungi in decline disease ofMyrica rubra [J]. Acta Phytopathol. Sin., 2022, 52(4):529-536.
(责任编辑:张冬玲)

