真菌诱导子调控紫草素合成的分子机制探究
李相吴 刘自扬 徐玉俊 祝建波 吴燕民
摘要:为探讨真菌诱导子调控紫草素合成的分子机制,以新疆紫草无菌苗为试材,经尖孢镰刀菌、立枯丝核菌制备成的诱导子生物诱导后,对其根部进行RNA测序和分析。结果表明,与对照组比较,尖孢镰刀菌试验组差异表达基因1 735个;立枯丝核菌试验组差异表达基因1 043个。GO(gene ontology)分析发现,2个试验组差异表达基因主要富集在细胞过程、细胞组分中膜和分子功能中催化活性等生物学过程。KEGG(kyotoencyclopedia of genes and genomes)分析发现,2个试验组在植物与病原菌互作、植物激素信号转导途径和苯丙素合成等通路均有大量差异表达基因富集。2个试验组差异表达情况相同的转录因子主要包括bHLH、AP2/ERF-ERF和LOB等,并发现参与紫草素合成及其正向调控的AeGHQH、AeDSH1、AeAP、AePAL、AeDI2、AePGT、AeHMGR、AeG10H 基因在2个试验组均上调表达,其中尖孢镰刀菌试验组上调表达较显著。以上结果从分子水平探究了新疆紫草对真菌诱导子生物诱导的响应机制,为未来真菌诱导子应用于新疆紫草种植生产奠定了理论基础。
关键词:新疆紫草;真菌诱导子;转录组;差异表达基因
doi:10.13304/j.nykjdb.2022.0622
中图分类号:S567.23+9;Q756 文献标志码:A 文章编号:10080864(2024)01007811
新疆紫草[Arnebia euchroma(Royle)Johnst]又名软紫草,为紫草科软紫草属多年生草本植物,一般生长在高海拔植被覆盖的山地砾石质阳坡或半阳坡。紫草以干燥根入药[1],药效成分主要为紫草素及其衍生物,具有消炎、抗病毒、抗菌、抗氧化、保肝和抑制肿瘤等药理作用[2]。此外,紫草素因其色价高、附着能力强,素有“红色素之王”美誉,在化妆品生产和食品加工等方面也有着广泛应用。随着对紫草素需求量的不断增长,野生新疆紫草遭受疯狂采挖,加之其生长环境受到破坏,导致野生资源接近枯竭。因此,如何有效快速提高新疆紫草的紫草素产量、解决日益增长的需求成为科研人员亟待解决的科学问题和研究方向。
诱导子是指能引发植物生长代谢过程发生变化,诱导产生“植保素”开启自身防疫反应与过敏反应的关键因子。1986年,Cruickshank等[3]研究发现,丛梗孢菌(Monilinia fructicola)菌丝体提取物能显著提高菜豆(Phaseolus vulgaris L.)果皮的次生代谢产物菜豆素合成,并首次提出真菌诱导子这一概念。近年来,大量研究表明真菌诱导子在促进药用植物合成药效成分中发挥着重要作用[4]。Wang等[5]以内生真菌孔球孢霉(Gilmaniellasp.)真菌诱导子处理茅苍术[Atractylodes lancea(Thunb.)DC.]无菌苗,发现其苍术酮生成量得以显著提高。Arghavani等[6]利用立枯丝核菌诱导子对新疆紫草愈伤组织进行处理,发现立枯丝核菌诱导子的作用效果显著,其紫草素生成量为对照组7倍,其余类型诱导子试验组均为对照组2倍左右。由此表明,真菌诱导子在诱导新疆紫草合成紫草素中具有广阔的应用前景。
尽管真菌诱导子在次生代谢产物合成上的应用已有较多研究,但对其作用机制却鲜有报道。近年来,高通量测序技术成为了探究药用植物次生代谢产物合成及其调控机制的重要手段。因此,本研究对真菌诱导子诱导的新疆紫草无菌苗根部转录组进行研究与分析,以期从分子层面上解析真菌诱导子调控新疆紫草的紫草素合成机制,为真菌诱导子应用于新疆紫草种植生产提供基础理论资料。
1 材料与方法
1.1 试验材料
真菌诱导子菌种包括立枯丝核菌(Rhizoctoniasolani)和尖孢镰刀菌(Fusarium oxysporum)均由中国农业科学院植物保护研究所蒋细良课题组提供;新疆紫草种子由石河子大学生命科学学院祝建波课题组提供。
1.2 试验方法
1.2.1 活性真菌诱导子制备 挑适量真菌菌丝体接种于装有100 mL PDA(potato dextrose agar)液体培养基(无琼脂)的250 mL 锥形瓶中,28 ℃、180 r·min-1 暗培养7 d;然后将菌液超声波破碎30 min,用滤纸反复抽滤掉大多数菌丝体至无明显菌丝;再用250目至1 000目的过滤网以目数逐级递加的方式将菌丝过滤干净;最后在超净工作台中用0.22 μL滤膜对所得到的发酵液进行抽滤,至发酵液中无真菌及孢子。采用蒽酮比色法、改良型BCA法蛋白质浓度测定试剂盒(C503051)对制备的真菌诱导子多糖、蛋白进行定量[78],无菌水调至多糖、蛋白含量分别为1 675.74、1 420.00 μg·mL-1时待用。
1.2.2 真菌诱导子诱导新疆紫草幼苗 选取生长状况一致、苗龄15 d的新疆紫草无菌幼苗,向其培养基分别添加20 mL·L-1制备好的立枯丝核真菌诱导子(R20)、尖孢镰刀真菌诱导子(F20)进行诱导处理,以不添加诱导子为对照组(CK),共3个试验组。分别在诱导0 和12 h剪取新疆紫草幼苗根部,以0 h为对照。每个试验组3个重复,共9个样本(R20-1、R20-2、R20-3、F20-1、F20-2、F20-3、CK-1、CK-2和CK-3)用于转录组测序分析。
1.2.3 新疆紫草幼苗根部总RNA提取、cDNA文库及其测序 使用植物总RNA 提取试剂盒(DP432、天根生化科技有限公司)提取新疆紫草幼苗根部总RNA,并通过1.5%琼脂糖凝胶电泳检测其完整性。利用NanoDrop OneC超微量分光光度计(赛默飞世尔科技有限公司)对其含量和纯度进行检测。使用带Oligo (dT)的磁珠富集纯化mRNA,将mRNA进行随机打断成短片段;再以获得短片段mRNA为模板,反转录合成双链cDNA;然后利用AMPure XP beads纯化cDNA,并对经纯化的双链cDNA进行末端修复、加A尾并连接测序接头、片段大小选择,最后通过PCR 富集得到cDNA文库。构建好的cDNA文库质检合格后,采用Illumina HiSeqTM 2000测序仪对其进行测序[9]。
1.2.4 差异表达基因筛选及功能注释 使用DESeq2软件[10]对新疆紫草试验组与对照组基因差异表达量以每百万Reads中来自比对到某一基因每千碱基长度的Reads 数目(fragments perkilobase of transcript per million mapped reads,FPKM)进行统计分析,从而获得差异表达基因。在差异表达量统计分析过程中对原假设检验得到的P值(P-value)进行多重检验,得到矫正后P值,即错误发现率(false discovery rate,FDR)。本研究以FDR<0.01且差异倍数(fold change,FC)≥1.5作为筛选标准,筛选差异表达基因(differentially expressedgenes,DEGs),并对差异表达基因进行COG(cluster of orthologous groups of proteins)、GO(geneontology)、KEGG(kyoto encyclopedia of genes andgenomes)、NR(non-redundant protein)、swiss-prot(Swiss-Prot Protein)、KOG(eukaryotic orthologousgroups)和 Pfam(protein family)功能注释。
2 结果与讨论
2.1 测序数据质控及组装
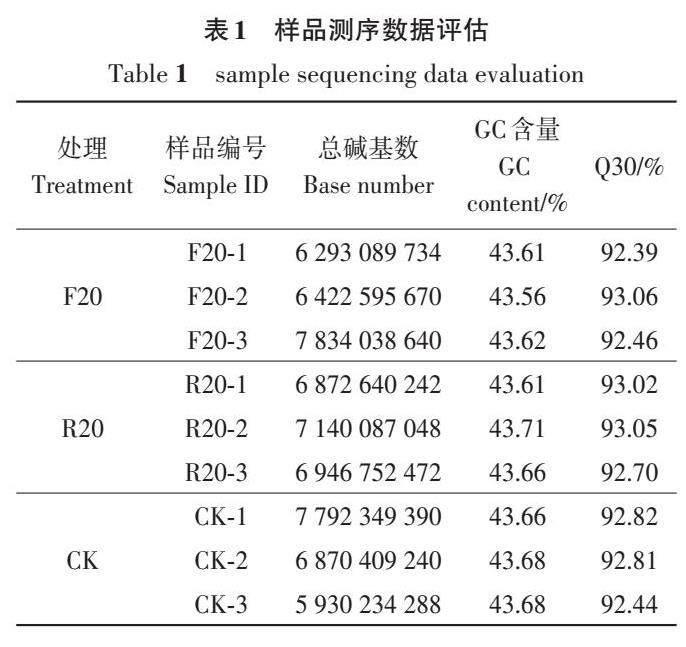
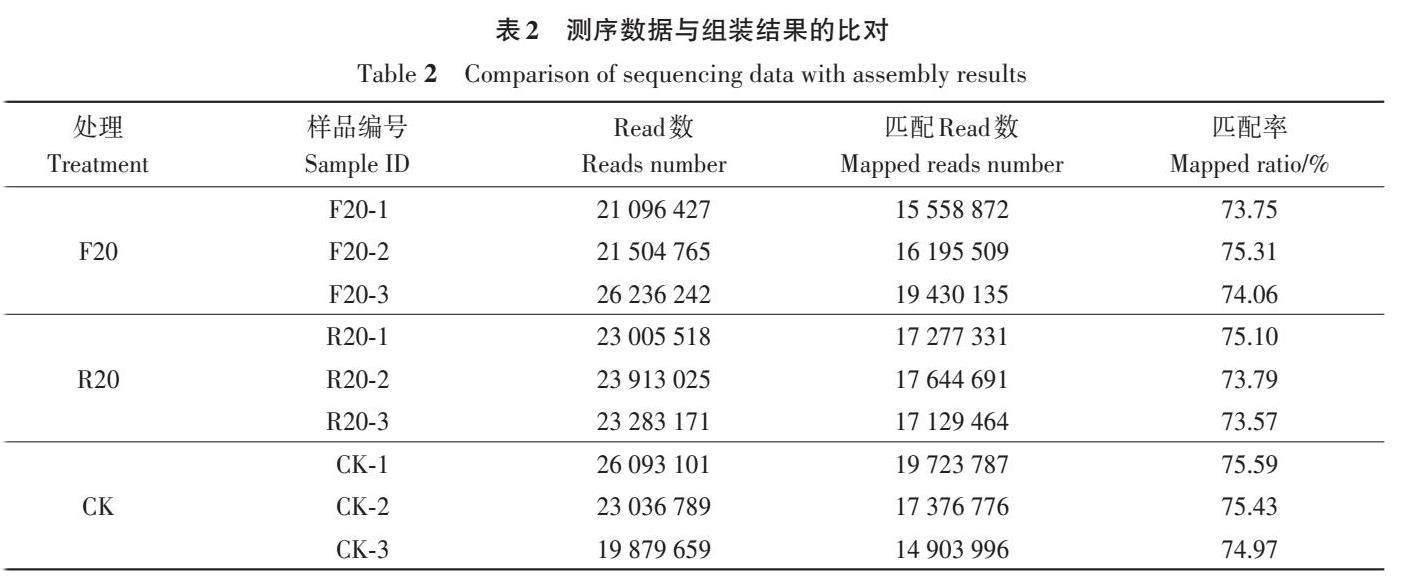
高通量转录组测序结果(表1)显示,各样品的Clean data均能达到5.93 Gb以上,GC含量在43%左右,其Q30(碱基准确率99.9%)均不低于92.39%。Clean reads与经Trinity软件组装建立的Transcript库或Unigene库进行序列比对,匹配率均在73%以上(表2)。以上结果表明,本研究获得的转录组测序数据质量较高,可用于后续的生物信息分析。
2.2 差异表达基因分析
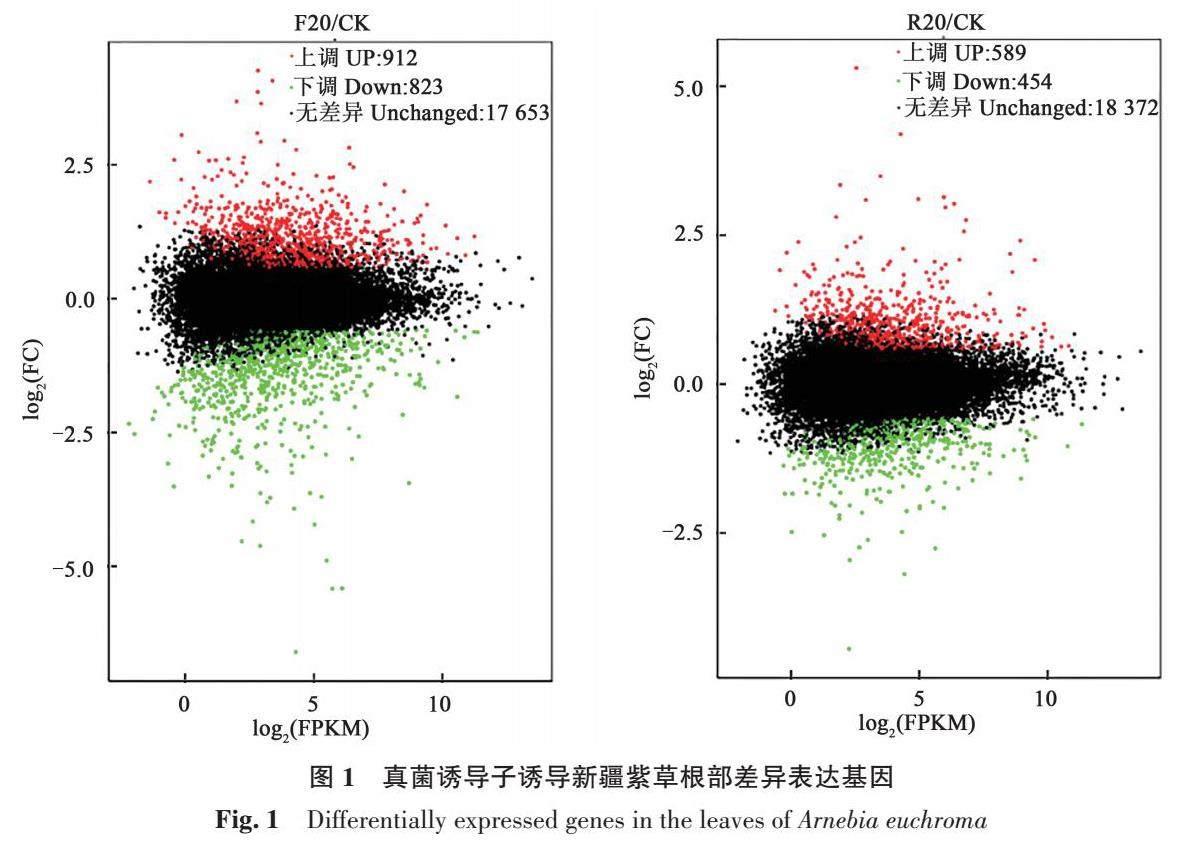
基因在表达过程中具有时空特异性,在不同内部环境与外界刺激作用下,部分基因的表达水平存在显著差异,将这部分基因称为差异表达基因(DGEs)。对基因表达进行差异分析,结果(图1)表明:与CK相比较,F20有1 735个基因呈现差异表达,其中912个基因上调,823个基因下调;R20有1 043个基因呈现差异表达,其中589个基因上调,454个基因下调。
2.3 差异基因功能注释
为更全面地分析差异表达基因的基因功能相关信息,对筛选出的差异表达基因在COG、GO、KEGG 等7 大数据库中进行比对,结果(表3)表明,F20 与CK 的差异表达基因在COG、GO、KEGG、KOG、Pfam、Swiss-Prot 和NR 分别注释到517、1 276、1 063、758、1 294、1 188 和1 555 个;R20与CK的差异表达基因分别注释到317、785、651、439、775、731和943个。
2.4 差异表达基因GO 富集分析
对于F20 与CK 的差异表达基因进行GO 富集,共有1 276个DGEs 被显著富集在42个GO功能节点(term)。其中,生物学过程(biological process,BP)注释到的差异表达基因被分为16个GO功能节点中,主要包括细胞过程(cellular process,459个)、代谢过程(metabolic process,440个)、单个有机体过程(single-organism process,387个);细胞组分(cellularcomponent,CC)注释到的差异表达基因被分为15个GO功能节点,主要包括膜(membrane,461个)、膜成分(membrane part,407个)、细胞(cell,383个);分子功能(molecular function,MF)注释到的差异表达基因被分为11个GO功能节点,主要包括催化活性(catalytic activity,638 个)、结合蛋白(bindingprotein,407个)、转运活性(transporter activity,108个)等(图2)。
对R20与CK的差异表达基因进行GO富集,共有785个DGEs被显著富集在45个GO功能节点(term)。其中,生物学进程(BP)部分注释到的差异表达基因被分为19 个功能节点;细胞组分(CC)部分注释到的差异表达基因被分为15个功能节点;分子功能(MF)部分注释到的差异表达基因被分为11个功能节点(图2)。
综上所述,尽管真菌诱导子的种类不同,但其DGEs被注释富集到主要的GO 功能节点几乎无明显差异,表明2类真菌诱导子对新疆紫草诱导效果存在相似性;同时也表明以上生物学过程在新疆紫草根部响应真菌诱导子生物诱导中发挥着重要作用。
2.5 差异表达基因KEGG 通路富集分析
对F20与CK 的差异表达基因进行KEGG 通路富集分析,共有516 个DGEs 被注释富集在119条代谢通路中。其中,富集差异表达基因较多的20 条代谢通路包括植物激素信号传导(Plant hormone signal transduction,54 个)、植物-病原菌互作(Plant-pathogen interaction,37个)、苯丙素合成(Phenylpropanoid biosynthesis,33个)、植物促分裂原活化蛋白激酶(mitogen-activatedprotein kinase,MAPK)信号转导(MAPK signalingpathway-plant,32个)等(图3)。
对R20与CK的差异表达基因进行KEGG通路富集分析,共有330 个DEGs 被注释富集在104条代谢通路中。其中,富集差异表达基因较多的20条代谢通路包括植物激素信号传导途径(38个)、淀粉与蔗糖代谢途径(25个)、植物-病原菌互作(21个)、苯丙素合成(19个)和植物MAPK信号转导(17个)等(图3)。
由此推测,2种真菌诱导子均能与新疆紫草根部产生互作关系,从而诱导植物激素信号转导途径的响应,同时刺激次生代谢苯丙素类物质合成与调控。
2.6 转录因子
调控基因的表达依赖于转录因子的参与,其可通过整合多个信号途径来响应植物受到的外界刺激,进而开启次生代谢合成等相关途径。对真菌诱导子生物诱导新疆紫草过程中的差异表达转录因子进行分析,结果(图4)显示,F20和R20试验组共同差异表达的转录因子达55 个,其中bHLH 家族(9 个)、AP2/ERF-ERF(4 个)和LOB(4 个)转录因子富集到的差异表达基因数量较多,它们可能与新疆紫草应对真菌诱导子生物胁迫调节其紫草素合成相关。前20个差异表达的转录因子如表4所示。
2.7 参与紫草素合成及调控的基因表达验证
筛选出8个参与紫草素合成及正向调控的相关基因进行qRT-PCR 验证,在NCBI(www.ncbi.nlm.nih.gov)网站进行blast序列比对,验证基因注释,如图5 所示。AePAL、AeHMGR 基因为紫草素合成通路中苯丙素合成途径与萜类骨架合成途径的关键基因[1112];AePGT 基因参与紫草素的重要前体—— 香叶基对羟基苯甲酸(GHB)的合成[13];AeGHQH、AeG10H 和AeDSH1 基因属于细胞色素P450 家族[14-16],参与下游紫草素的合成与修饰;AeDI2 和AeAP 基因参与紫草素的合成调控;AeDI2为黑暗诱导基因[17];AeAP 基因参与紫草素的分泌与运输[18]。
以这8个基因的表达量(FPKM值)为计量单位,进行表达模式聚类分析,结果(图5)显示,2个试验组中这8个基因表达量(FPKM值)均高于对照组,且F20试验组整体高于R20试验组。由此表明,2种真菌诱导子均促进了新疆紫草的紫草素合成相关基因表达,其中F20试验组的效果更为显著。
3 讨论
真菌诱导子主要来源于真菌发酵液、菌丝体及其代谢产物。在诱导植物次生代谢产物合成过程中,普遍认为真菌诱导子被植物细胞视为外来信号,进而与细胞膜上的受体蛋白识别结合,开启膜内外信号转导过程,促使参与次生代谢产物合成及其调控的相关基因表达,最终达到提高次生代谢产物合成效率的目的[19]。
根部作为新疆紫草生物合成药效成分的主要器官,同时也是真菌诱导子生物诱导下反应最为敏感的器官之一。对各诱导处理下的根部进行转录组测序,结果表明,与对照组比较,尖孢镰刀菌和立枯丝核菌试验组分别有1 735、1 043个基因呈现差异表达;对筛选出的差异基因在COG、GO、KEGG等7大数据库中进行比对注释,获得了大多数基因的相关信息。在GO功能富集中,发现2个试验组被富集到的主要功能节点无明显差异,均为催化活性、结合蛋白、转运活性、细胞膜、细胞进程、代谢过程、单一有机体过程等,这与周雅涵[20]研究膜醭毕赤酵母与壳寡糖诱导柑橘的结果基本一致,表明植物通过调控基因表达及生物学进程来应对真菌诱导子的生物胁迫。在KEGG通路富集中,2个试验组在植物激素信号转导、植物与病原菌互作及苯丙素合成等通路均有大量差异表达基因富集,表明2种真菌诱导子可能与新疆紫草产生了互作[21]。植物激素作为调控植物生命活动进程的关键内源性因子,被构建成复杂的信号网络,精密调控生理生长来应对外界环境变化[22]。
真菌诱导子增强了新疆紫草植物激素信号转导过程。当遭到病原菌侵染时,植物会通过苯丙素生物合成途径合成黄酮类和酚类(香豆素类、木脂素类),进而转化成木质素、植保素等,从而阻碍病原菌侵入或者通过自身的杀菌作用抑制病原菌的生长[23]。在真菌诱导子诱导作用下,新疆紫草可能通过调节苯丙素类物质代谢途径中相关基因的表达,从而生成相关次生代谢产物,参与应对真菌诱导子的生物胁迫。
转录因子在应对生物胁迫、调节植物次生代谢产物合成中扮演着重要角色。在2种真菌诱导子诱导的新疆紫草根部,共同差异表达的转录因子55 个,其中bHLH、AP2/ERF-ERF 与LOB 家族转录因子较多,它们在调节植物次生代谢产物合成均有相关报道[24-26]。作为水杨酸信号的主要调控因子,MYC2 属bHLH 蛋白家族[27],在苹果(Malus pumila Mill)中发现MdMYC2 的过表达可增强花青素积累[28];此外,葡萄(Vitis vinifera L.)的VvbHLH1转录因子可增加拟南芥中类黄酮的积累,并提高植株抗逆性[29]。Zhang等[30]发现,红豆杉[Taxus chinensis (Pilger) Rehd.] 中TcERF12、TcERF15转录因子参与紫杉醇合成调控[31],而紫杉醇可作为植保素提高植物抗病性。研究发现,LOB转录因子参与调节植物次生代谢产物合成,提高植物抗病性等[3233]。由此表明,真菌诱导子在诱导过程中,转录因子调控植物次生代谢产物的合成过程,进一步提高植物的抗病性。但不同转录因子在调控基因表达方面存在特异性,其具体调节机制还有待深入研究。
分析参与新疆紫草的紫草素合成及调控基因表达情况,结果显示,2个真菌诱导子试验组共有8 个基因呈现差异表达且均有不同程度上调。Hao等[34]用茉莉酸甲酯诱导新疆紫草细胞悬浮系合成紫草素的研究也得到类似的结果。由此可见,2种真菌诱导子均能促进新疆紫草的紫草素合成。真菌诱导子在诱导药用植物合成药效成分时,不同诱导子对同一植物的诱导作用可能效果不同,导致次生代谢产物合成效率存在差异[35]。本研究中,尖孢镰刀菌试验组相关基因表达的上调程度明显高于立枯丝核菌试验组,与前人研究结果一致。
综上所述,本研究用尖孢镰刀菌(F20)、立枯丝核菌(R20)制备的2种诱导子对新疆紫草无菌苗进行诱导,并通过对其根部进行RNA-seq获得了大量丰富的转录本信息。对差异表达基因的功能进行注释与分析,GO分析发现2个试验组被富集到的主要功能节点无明显差异,均为生物学过程中细胞过程、细胞组分中膜和分子功能中催化活性等;KEGG分析发现2个试验组在植物与病原菌互作、植物激素信号转导途径、苯丙素合成等通路均有大量DEGs富集。新疆紫草响应2种真菌诱导子生物诱导的相同转录因子主要包括bHLH、AP2/ERF-ERF和LOB等;参与紫草素合成及其正向调控的AeGHQH、AeDSH1、AeAP、AePAL、AeDI2、AePGT、AeHMGR、AeG10H 基因在2 个试验组中均上调表达,其中尖孢镰刀真菌诱导子试验组上调程度高于立枯丝核菌试验组。本文从分子水平阐述了新疆紫草在真菌诱导子生物诱导的响应机制,为未来真菌诱导子应用于新疆紫草种植生产奠定了理论基础。
参考文献
[1] 国家药典委员会.中华人民共和国药典-一部[M].北京:中国医药科技出版社,2020:355-356.
National Pharmacopoeia Committee. Pharmacopoeia of the Peoples Republic of China-part1 [M]. Beijing: ChineseMedicine Science and Technology Press, 2020:355-356.
[2] WANG Y, ZHU Y, XIAO L, et al ... Meroterpenoids isolatedfrom Arnebia euchroma (Royle) Johnst. and their cytotoxicactivity in human hepatocellular carcinoma cells [J]. Fitoterapia,2018, 131(11):236-244.
[3] CRUICKSHANK I, PERRIN D R. The isolation and partialcharacterization of monilicolin A, a polypeptide withphaseollin-inducing activity from Monilinia fructicola [J]. LifeSci., 1968, 7(10):449-458.
[4] OKSMAN-CALDENTEY K, VERPOORTE R, VAN DERHEIJDEN R, et al ... Engineering the plant cell factory forsecondary metabolite production [J]. Transgenic Res., 2000,9(4):323-343.
[5] WANG Y, DAI C C, CAO J L, et al.. Comparison of the effects offungal endophyte Gilmaniella sp. and its elicitor on atractylodeslancea plantlets [J]. World J. Microbiol. Biotechnol., 2011, 28(2):575-584.
[6] ARGHAVANI P, HAGHBEEN K, MOUSAVI A. Enhancementof shikalkin production in Arnebia euchroma callus by a fungalelicitor, Rhizoctonia solani [J]. Iranian J. Biotechnol., 2015,13(4):10-16.
[7] 晏琼,胡宗定,吴建勇.生物与非生物诱导子协同作用对丹参毛状根培养生产丹参酮的影响[J].中国中药杂志,2006(3):188-191.
YAN Q, HU Z D, WU J Y. Synergistic effects of biotic andabiotic elicitors on the production of tanshinones in Salviamiltiorrhiza hairy root culture [J]. China J. Chin. MateriaMedica, 2006(3):188-191.
[8] 田佩雯.白及内生真菌诱导子对宿主生长和主要活性物质的影响及调控[D].南宁:广西大学,2019.
TIAN P W. Effects and regulation of endophytic fungal elicitorsfrom Bletilla striata on host growthand main substances [D].Nanning: Guangxi University, 2019.
[9] 饶龙兵,杨汉波,郭洪英,等.不同倍性桤木属植物的转录组测序和分析[J].分子植物育种.2016,14(11):3047-3055.
RAO L B, YANG H B, GUO H Y, et al .. Analysis ontranscriptome sequenced for alnus plants with different ploidy [J].Mol. Plant Breed., 2016, 14(11):3047-3055.
[10] LOVE M I, HUBER W, ANDERS S. Moderated estimation of foldchange and dispersion for RNA-seq data with DESeq2 [J/OL].Genome Biol., 2014, 15(12):550 [2022-06-02]. https://doi.org/10.1186/s13059-014-0550-8
[11] GAISSER S, HEIDE L. Inhibition and regulation of shikoninbiosynthesis in suspension cultures of Lithospermum [J].Phytochemistry, 1996, 41(4):1065-1072.
[12] SYK?OWSKA-BARANEK K, PIETROSIUK A, NALIWAJSKIM R, et al .. Effect of L-phenylalanine on PAL activity andproduction of naphthoquinone pigments in suspension culturesof Arnebia euchroma (Royle) Johnst [J]. In Vitro Cellular Dev.Biol. Plant, 2012, 48(5):555-564.
[13] YAZAKI K, KUNIHISA M, FUJISAKI T, et al .. Geranyldiphosphate: 4-hydroxybenzoate geranyltransferase fromLithospermum erythrorhizon: cloning and characterization of akey enzyme in shikonin biosynthesis [J]. J. Biol. Chem., 2002,277(8):6240-6246.
[14] WANG S, WANG R S, LIU T G, et al .. CYP76B74 catalyzesthe 3-hydroxylation of geranylhydroquinone in shikoninbiosynthesis [J]. Plant Physiol. (Bethesda), 2019, 179(2):402-414.
[15] 梁玖雯,李锬,王瑞杉,等.新疆紫草中2条CYP450 基因的干扰毛状根体系的建立及其影响研究[J].中国中药杂志,2020,45(14):3422-3431.
LIANG J W, LI T, WANG R S, et al .. Establishment of RNAinterfered hairy root system of two CYP450 genes in Arnebiaeuchroma and its influence [J]. China J. Chin. Materia Medica,2020, 45(14):3422-3431.
[16] LIAO M, ZENG C, LIANG F. Two new dimericnaphthoquinones from Arnebia euchroma [J]. Phytochem. Letters,2020, 37(1):106-109.
[17] YAZAKI K, MATSUOKA H, SHIMOMURA K, et al .. A noveldark-inducible protein, LeDI-2, and its involvement in rootspecificsecondary metabolism in Lithospermum erythrorhizon [J].Plant Physiol. (Bethesda), 2001, 125(3):1831-1841.
[18] YAMAMURA Y N C U, SAHIN F P, NAGATSU A, et al ..Molecular cloning and characterization of a cDNA encoding anovel apoplastic protein preferentially expressed in a shikoninproducingcallus strain of Lithospermum erythrorhizon [J]. PlantCell Physiol., 2003, 44(4):437-446.
[19] SAHA S, PAL D. Elicitor Signal Transduction Leading to theProduction of Plant Secondary Metabolites [M]. Cham: SpringerInternational Publishing, 2020:1-39.
[20] 周雅涵.水杨酸、膜醭毕赤酵母、壳寡糖诱导柑橘果实抗病性及其生物学机制研究[D].重庆:西南大学,2017.
ZHOU Y H. Salicylic acid, Pichia membranaefaciens andoligochitosan induced disease resistance of citrus fruit and thepossible biological mechanisms involved [D]. Chongqing: SouthwestUniversity, 2017.
[21] 瞿巾卓.酿酒葡萄细胞对内生真菌诱导子的代谢响应与机制[D].昆明:云南大学,2020.
JU J Z. Metabolic response and mechanism of Wine grape cellsto elicitors from fungal endophytes [D]. Kunming: YunnanUniversity, 2020
[22] 张明菊,朱莉,夏启中.植物激素对胁迫反应调控的研究进展[J].湖北大学学报(自然科学版).2021,43(3):242-253.
ZHANG M J, ZHU L, XIA Q ZAND. Research progress on theregulation of plant hormones to stress responses [J]. J. HubeiUniv., 2021, 43(3):242-253.
[23] SHAH L, ALI A, ZHU Y L, et al .. Wheat defense response toFusarium head blight and possibilities of its improvement [J].Physiol. Mol. Plant Pathol., 2017, 98(2):9-17.
[24] NEMESIO-GORRIZ M, BLAIR P B, DALMAN K, et al ..Identification of Norway spruce MYB-bHLH-WDR transcriptionfactor complex members linked to regulation of the flavonoidpathway [J/OL]. Front. Plant Sci., 2017, 8:305 [2022-06-02].https://doi.org/10.3389/fpls.2017.00305.
[25] GRAEFF M, STRAUB D, EGUEN T, et al .. Microproteinmediatedrecruitment of constans into a topless trimericcomplex represses flowering in Arabidopsis [J/OL]. PLoSGenet., 2016, 12(3): e1005959 [2022-06-02]. https://doi.org/ 10.1371/journal.pgen.1005959.
[26] DENG B, HUANG Z, GE F, et al .. An AP2/ERF familytranscription factor PnERF1 raised the biosynthesis of saponins inpanax notoginseng [J]. J. Plant Growth Regul., 2017, 36(3):691-701.
[27] GAUTAM J K, GIRI M K, SINGH D, et al .. MYC2 influencessalicylic acid biosynthesis and defense against bacterial pathogensin Arabidopsis thaliana [J]. Physiol. Plantarum., 2021, 173(4):2248-2261.
[28] KAZAN K, MANNERS J M. MYC2: the master in action [J].Mol. Plant, 2013, 6(3):686-703.
[29] WANG F, ZHU H, CHEN D, et al.. A grape bHLH transcriptionfactor gene, VvbHLH1, increases the accumulation of flavonoidsand enhances salt and drought tolerance in transgenic Arabidopsisthaliana [J]. Plant Cell. Tissue Organ Cult., 2016, 125(2):387-398.
[30] ZHANG M, LI S T, NIE L, et al .. Two jasmonate-responsivefactors, TcERF12 and TcERF15, respectively act as repressorand activator of tasy gene of taxol biosynthesis in Taxuschinensis [J]. Plant Mol. Biol., 2015, 89(4-5):463-473.
[31] EL-SAYED A S A, MOHAMED N Z, SAFAN S, et al ..Restoring the taxol biosynthetic machinery of aspergillus terreus byPodocarpus gracilior pilger microbiome, with retrieving theribosome biogenesis proteins of WD40 superfamily [J]. Sci. Rep.,2019, 9(1):11512-11534.
[32] HAN Z, YANG T, GUO Y, et al .. The transcription factorPagLBD3 contributes to the regulation of secondary growth inPopulus [J]. J. Exp. Bot., 2021, 72(20):7092-7106.
[33] TANG X M, WANG X, HUANG Y, et al ... Natural variations ofTFIIAγ gene and LOB1 promoter contribute to citrus cankerdisease resistance in Atalantia buxifolia [J]. PLoS Genetics.2021, 17(1): e1009316 [2022-06-02]. https://doi.org/10.1371/journal.pgen.1009316.
[34] HAO H, LEI C, DONG Q, et al ... Effects of exogenous methyljasmonate on the biosynthesis of shikonin derivatives in callustissues of Arnebia euchroma [J]. Appl. Biochem. Biotechnol.,2014, 173(8):2198-2210.
[35] WANG C G, WU J Y, MEI X G. Enhancement of taxolproduction and excretion in Taxus chinensis cell culture byfungal elicitation and medium renewal [J]. Appl. Microbiol.Biotechnol., 2001, 55(4):404-410.
(责任编辑:张冬玲)

