川明参轮作对烟地土壤微生物群落结构的影响
张东艳+赵建+杨水平+莫静静+何大敏+王军+苟剑渝+张雪+蒋卫+温明霞

[摘要] 土壤微生物是土壤质量的重要指标,为探索川明参种植对烟地微生物影响,该文采用Illumina MiSeq高通量测序研究了川明参对植烟土壤中细菌和真菌在门和属水平上的群落结构变化。结果表明,川明参种植增加了烟地土壤细菌和真菌的生物多样性,且对真菌的影响大于细菌,极大的增加了真菌的序列数,分别获得32 978个细菌16S rDNA序列和32 229个真菌18S rDNA序列。没有改变细菌前三大优势菌门类,但含量上分别使变形菌和酸杆菌降低1.73%,1.4%,放线菌增加0.65%,使真菌优势门子囊菌减少27.99%成为次优势菌,次优势菌担子菌增加23.69%成为优势菌;改变了原烟地属水平的群落结构,使优势属及丰度都发生了变化,变化较大的细菌如uncultured Acidobacteriaceae Subgroup-1,Gemmatimonas,Subgroup-2,uncultured Nitrosomonadaceae等,真菌如norank Sordariales,norank Agaricomycetes,Phialophora等,且拮抗微生物及生理类群微生物丰度增加,病原菌减少。因此,川明参种植能改善烟地土壤微生物。
[关键词] 川明参;烟草;高通量测序;细菌;真菌
[Abstract] Soil microbes are the important indicator of soil quality. For exploring Chuanminshen violaceum planting to microbial effects in tobacco soil,this paper adopted Illumina MiSeq high-throughput sequencing to research the change of bacteria and fungi at the phylum and genus in the soil. The results showed that the Ch. violaceum planting increased the biodiversity of bacteria and fungi. The influence on fungi was greater than that on bacteria. It greatly increased the sequence of fungi,it obtained 32 978 16S rDNA and 32 229 18S rDNA sequence number. There was no change of the top three phylums in bacteria,but the content changed,Proteobacteria and Acidobacteria reduced by 1.73% and 1.4% respectively,and Actinobacteria increased by 0.65%. The advantage phylum Ascomycete in tobacco reduced by 27.99% to be second advantage phylum after Ch. violaceum planting,and the second advantage phylum Basidiomycete increased by 23.69% to become the first dominant fungi. At the genus,Ch. violaceum planting changed the order of dominant genus and the abundance was also changed. Some changed largely such as uncultured Acidobacteriaceae Subgroup-1,Gemmatimonas,Subgroup-2,uncultured Nitrosomonadaceae for bacteria,norank Sordariales,norank Agaricomycetes,Phialophora for fungi. Especially the rotation increased antagonistic microbes and physiological microbes and decreased pathogenic microbes. So the Ch. violaceum planting can improve the microbe community in tobacco soil.
[Key words] Chuanminshen violaceum;tobacco;high-throughput sequencing;bacteria;fungi
doi:10.4268/cjcmm20162412
土壤微生物是陆地生态系统中有机物的主要分解者和转化者[1],其群落结构在很大程度上决定着土壤的生物活性,且能对土壤的微小变化作出敏感的反应,因此被认为是土壤生态系统变化的预警及敏感指标。土壤微生物除了受土壤颗粒大小、土壤水分的影响以外,还受到地上植被凋落物、根系、土壤动物残体以及经营措施的影响[2]。根系分泌物中丰富的糖类、氨基酸类、有机酸及酚酸等物质,为土壤微生物的生长和繁殖提供了充足的营养,并且不同植物的根系分泌物对微生物群落结构具有选择塑造作用[3]。
烟草[4-7]和中草药[8-9]在栽培过程中连作障碍严重,轮(间套)作是消减连作障碍的有效措施。研究表明,与水稻[10-11]、玉米[12-13]、蒜[14-15]、绿肥[16-17]等作物轮作及间套作,对于改善土壤微生物种群结构和消减烟草连作障碍具有很好效果。我国是中草药的大国,在烟区进行中药材和烟草合理配置,實行药烟轮(间套)作,将有利于药烟协同发展和种植业增收增效。有研究表明,药用植物套种花生能有效调节土壤微生物区系的定向发展而缓解花生连作障碍[18];棉花枯萎病严重地块,改种1年薄荷之后连续种植棉花9年,枯萎病仍没有发生[19]。川明参在西南山区广泛种植,在茬口上可以和烟草实现年内轮作,并且川明参茎叶枯落物水浸液对烟草幼苗生长有一定化感增益效应[20],但有关川明参与烟草轮作效应及对烟地土壤微生物种群影响尚未见报道。本文采用Illumina MiSeq技术,对大田烟-川明参轮作土壤微生物细菌V3-V4可变区及真菌18S区进行基因测序分析,玉米地为对照,研究烟-川明参种植的土壤微生物效应,以期为川明参与烟草轮作种植提供理论和实践指导。
1 材料与方法
1.1 试验地概况
试验地点位于贵州省遵义市遵义县八里村,属亚热带季风气候,年均气温14.7 ℃,年均降水量1 200 mm。土壤类型为黄壤,pH 5.7,土壤肥力:有机质含量13 300 mg·kg-1,有效氮 64.0 mg·kg-1,有效磷 36.30 mg·kg-1,有效钾 112.5 mg·kg-1。
1.2 试验设计
田间试验分3个处理:玉米-休闲、烟-休闲、烟-川明参轮作,分别用K0,K1,K2表示,3个重复。具体方案为,选取前茬为玉米-冬闲且土壤条件均匀一致的地块,整地后划分为6 m×20 m的9个小区,随机选取6小区连作烟,其余3小区连作玉米,第1年秋冬季都休闲。第2年,观察到连作烟病害严重,待烟收获后,任选植烟的3小区于秋冬种植一年生川明参,其余秋冬季继续休闲。本试验于2015年9月3日将一年生川明参苗植于地中,2015年12月7日各处理同时采集土壤样品。
1.3 土样采集
土壤样品为混合土样,用直径为4 cm的土钻按混合采样法采0~20 cm土层,每个土样由5~8个采集点的土壤混合,用四分法取适量于土袋中,迅速带回实验室。去除土样中的动植物残体等杂质,混合均匀后,保存在-80 ℃,用于分析土壤微生物群落结构。
1.4 土壤微生物总DNA的提取和测序
土壤微生物总DNA 的提取采用E.Z.N.A. Soil DNA Kit试剂盒,提取出的总DNA送到上海美吉生物医药科技有限公司进行Illumina Miseq高通量测序。细菌16S rDNA扩增引物采用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),真菌18S rDNA扩增引物采用SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA-3′)和SSU1196R(5′-TCTGGACC TGGTGAGTTTCC-3′)。
1.5 数据处理
1.5.1 有效序列和优化序列数据统计 采用多个样品平行测序的方法,所以各样品中的序列均引入了一段标示其样本来源信息的barcode标签序列及前引物(forward primer)序列。本次分析根据barcode标签序列和前引物序列筛选出有效序列后,将测序接头与barcode序列去除,并对处理后的有效序列进行数据统计。为了得到更高质量及更精准的生物信息分析结果,对有效序列进行去杂,得到优化序列后对其进行数据统计。
1.5.2 OTU-based分析 对所有样品进行OTU生成并对OTU进行生物信息统计分析。Miseq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接成一条序列,同时对reads的质量和拼接效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,在97%的相似水平下对所有序列进行OTU划分,进行生物信息统计分析。软件平台Usearch(vsesion 7.1)。
1.5.3 细菌和真菌群落多样性分析 群落物种的丰富度(richness)和多样性(diversity)分别用Ace,Chao和Shannon,Simpson指数表示,测序深度指数用Coverage表示。软件平台mothur(version v.1.30.1)指数分析,用于指数评估的OTU相似水平为97%。
1.5.4 群落结构分析 将优化序列根据数据库中的参考序列在门和属水平进行鉴定,比较3个处理中细菌和真菌的分布情况。
2 结果与分析
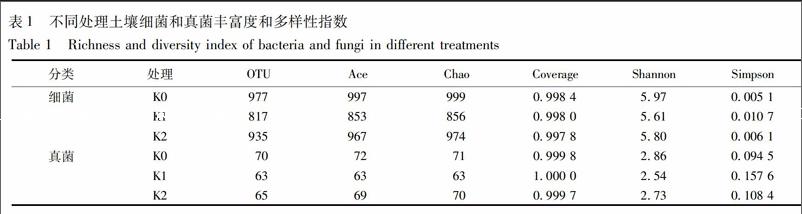
2.1 16S rDNA和18S rDNA基因测序质量及多样性统计分析
K0,K1,K2所得有效序列分别为:细菌34 312,34 382,32 978条,真菌20 308,25 369,32 229条,抽平至最低序列细菌32 978,真菌20 308条后,菌群多样性统计结果见表1。各样品测序覆盖率均在0.99以上,说明样品中序列未被测到的概率较低,测序量足以覆盖样品菌群组成[21]。97%相似性归并后,K0,K1,K2所含细菌OTU个数分别为977,817,935,所含真菌OTU个数分别为70,63,65,生物信息统计分析得,K0可划分为细菌29门60纲119目205科285属,真菌6门22纲35目40科40属;K1可划分为细菌25门51纲102目175科249属,真菌6门20纲34目39科41属;K2可划分为细菌26门55纲112目188科269属,真菌6门21纲32目38科38属。Ace,Chao指数是对菌群丰度进行的评估,Shannon和 Simpson是对菌群多样性进行的评估,Shannon值越大,表明群落多样性越高,Simpson值越大,说明群落多样性越低。由表1可知,无论是细菌还是真菌,Ace,Chao,Shannon值均是K0>K2>K1,Simpson是K0 2.2 门水平群落结构 门水平下的细菌和真菌群落结构见图1。3个处理含量大于2%的细菌优势门类有11门,其中变形菌Proteobacteria 24.26%~31.73%、酸杆菌Acidobacteria 20.90%~22.30%、放线菌Actinobacteria 6.01%~10.37%、绿湾菌Chloroflexi 5.94%~11.57%、拟杆菌Bacteroidetes 5.83%~9.07%和芽单胞菌Gemmatimonadetes 5.36%~8.24%,这6个菌门丰度均在5%以上,共计达76.99%~86.47%。疣微菌门Verrucomicrobia,Saccharibacteria,Parcubacteria,厚壁菌Firmicutes,浮霉菌Planctomycetes,这几门含量相对较少。与K0相比,K1中Proteobacteria,Acidobacteria,Actinobacteria,Bacteroidetes增多7.47%,0.97%,3.71%,2.50%,而Chloroflexi,Gemmatimonadetes,Verrucomicrobia,Parcubacteria,Planctomycetes減少3.29%,1.9%,2.64%,1.76%,1.05%。与K1相比,K2中前三大优势菌门与K1相同,含量上Proteobacteria和Acidobacteria分别降低1.73%,1.4%,Actinobacteria增加0.65%,而Chloroflexi,Bacteroidetes减少2.34%,3.24%,Gemmatimonadetes,Saccharibacteria,Parcubacteria,Firmicutes,增加2.98%,1.09%,2.47%,0.94%。
3个处理的真菌门类为子囊菌Ascomycota、担子菌Basidiomycota、接合菌Zygomycota、球囊菌Glomeromycota、壶菌Chytridiomycota,且均有>1%的真菌(Others)在GenBank中没有被明确的分类。与K0相比,Ascomycota在K1中增加了13.45%成为绝对优势菌,次优势菌Zygomycota在K1中降低了16.61%,而Basidiomycota增加了9.58%成为K1的次优势菌,Glomeromycota在K1中减少了5.59%,Chytridiomycota变化不大。与K1相比,K2中的Ascomycota减少27.99%成为次优势菌,而Basidiomycota增加23.69%成为优势菌。
2.3 属水平群落结构
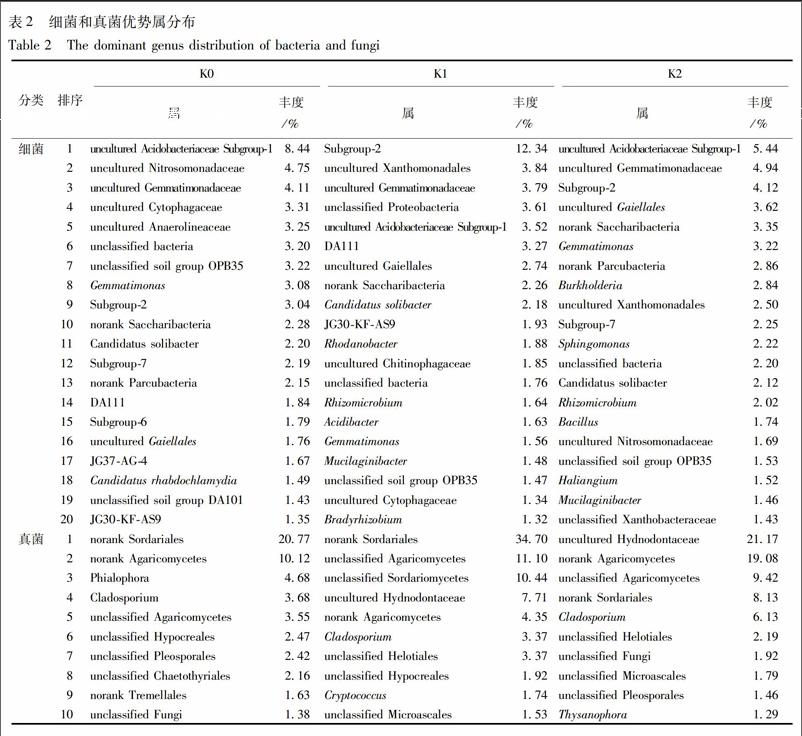
K0,K1,K2分别所含细菌285,249,269属,真菌40,41,38属。按丰度排序,细菌前20优势属丰度之和占53.09%~56.57%,真菌前10优势属丰度之和占52.86%~80.23%,见表2。其中,不可培养酸杆菌亚群-1 uncultured Acidobacteriaceae Subgroup-1,不可培养的芽单胞菌科uncultured Gemmatimonadaceae,待定土壤菌群OPB35 unclassified soil group OPB35,待定细菌unclassified bacteria,芽单胞菌属Gemmatimonas,Subgroup-2,norank Saccharibacteria,暂定土壤细菌unclassified Candidatus solibacter,不可培養的放线菌uncultured Gaiellales共9属都出现各处理细菌前20优势属中,但丰度上发生了变化,其中变化较大的例如:uncultured Acidobacteriaceae subgroup-1为玉米地(K0)的第1优势属(8.44%),在烟地(K1)中降至第5(3.52%),而川明参种植后(K2)又升至第1优势属(5.44%);Gemmatimonas在K0中位居第8(3.08%),在K1中降至第16(1.56%),在K2中升至第6(3.22%);Subgroup-2在K0中居第9(3.04%),在K1中升至第1(12.34%),在K2中降至第3(4.12%)。除上述之外,不可培养的亚硝化单胞菌科uncultured Nitrosomonadaceae作为K0的第2优势属(4.75%),没有出现在K1的前20属,川明参种植后(K2),升至第16属(1.69%);不在K0前20属的不可培养的黄色单胞菌目uncultured Xanthomonadales,作为K1的第2优势属(3.84%),川明参种植后降至第9属(2.50%)。
在真菌前10属中(除去未鉴定出的真菌),3个处理共有4属:未命名粪壳菌目norank Sordariales、未命名伞菌纲norank Agaricomycetes、枝孢属Cladosporium、待定伞菌纲unclassified Agaricomycetes,其中丰度变化较大的有:norank Sordariales为K0的第1优势属(20.77%),K1中也为第1优势属(34.70%),在K2中降至第4属(8.13%);norank Agaricomycetes为K0的第2优势属(10.12%),在K1中降至第5属(4.35%),川明参种植后升至第2属(19.08%)。除此之外,Phialophora为K0的第3优势属(4.68%),均未出现在K1和K2的前10属;未出现在K0前10属的待定粪壳菌纲unclassified Sordariomycetes和uncultured Hydnodontaceae,分别在K1中增至第3(10.44%)和第4(7.71%),而川明参种植后使前者降至前10之后,后者增至第1(21.17%)。
由上可以看出,川明参种植改变了原烟地细菌和真菌属水平的群落结构,优势属及其丰度均发生了变化。
2.4 土壤特异微生物的变化
土壤特异微生物包括拮抗微生物、生理类群微生物、病原微生物等[22],其对植物积极的作用主要有抑制病原菌、参与养分循环以及分泌植物生长调节剂等[23-24],消极的作用主要是产生病害,见表3。作物对土传病害的抗性与拮抗微生物密切相关,Bacillus,Pseudomonas,Burkholderia,Catenulispora,Mycobacterium,Sphingomonas,Bdellovibrio等可以通过产生抗生素类物质或溶菌作用等方式对土传病原菌产生拮抗作用,除Bdellovibrio外,川明参种植均使原烟地的拮抗微生物丰度增加,且Burkholderia和Sphingomonas增幅最大。生理类群微生物参与土壤碳氮循环,直接影响土壤肥力,细菌中如固氮菌Gemmatimonas,Devosia,Dongia,Frankiales,硝化和亚硝化细菌Nitrospira,Nitrosomonadaceae,Mizugakiibacter,纤维素分解菌Cytophaga,Cellvibrio等。真菌中的球囊菌Glomeromycota即丛枝菌根(Arbuscular mycorrhizae,AM)能与地球上90%以上的陆生维管植物根系建立互惠共生体系[25],为植物提供养分[26],改善其营养特性[27-28],其在3个处理中,K0中含8.66%,烟地(K1)中降低至4.07%,川明参种植后增至7.56%。土传病原菌能够引起各种土传病,对于细菌,致病菌如Ralstonia,Xanthomonadales,Conexibacter,Rudaea,Aquicella等,其中Ralstonia能引发烟草青枯病[29],Xanthomonadales能使叶片、茎秆、果实上产生病斑[30]。而大多数土壤真菌同时为植物病原菌,如壶菌Chytridiomycota能引起玉米褐斑病、马铃薯癌肿病;柔膜菌Helotiales引起向日葵、油菜、花生、烟草、十字花科蔬菜、莴苣、番茄、菜豆等多种植物的菌核病,危害很大;肉座菌Hypocreales能引起小麦赤霉病、水稻恶菌病;格孢腔菌Pleosporales大多危害果树和树木的叶片,枝条,果实和枝干,引起的病害一般称为黑星病;枝孢属Cladosporium能引起烟草煤污病。总的来看,与玉米地(K0)相比,烟地(K1)中有益菌和有害菌增减不一,与烟地相比,川明参地(K2)中拮抗菌和生理类群微生物增多,而病原菌减少。连作烟地K1中Bacillus,Sphingomonas等有益菌属数量减少与陈冬梅、岳冰冰等[31-32]得到相一致的结果,而川明参种植后均使其含量增加。
3 讨论
3个处理土壤(K0,K1,K2)所测得的细菌有效序列数虽差别不大,但种群结构发生了比较大的改变,主要细菌门类虽大致一致,但优势门类丰度与排序发生改变;在细菌属水平上,前20个优势属仅9属为共有,且各属相对含量发生了不同程度的增减。烟地K1与玉米地K0同源,川明参地K2来源于烟地K1,由此可以看出细菌的群落结构与土壤环境密切相关[33],但又因种植作物不同而改变,与陈丹梅等结果近似[34]。真菌也是如此,甚至因作物不同而改变更大。K0,K1,K2真菌有效序列数呈较大幅度递增,门和属的优势顺序都有较大改变,前10个优势属中仅4属为共同所有。土壤中一些特异细菌和真菌尤其关联作物营养和植物病害的菌类也发生很大变化。土壤微生物的上述变化,当归因于作物生长尤其根系分泌活动。根系分泌物是植物与根际微生物相互作用的中间媒介,不同作物的根系分泌物数量和种类各不相同,对微生物的代谢、生长发育和多样性都有影响[35]。烟草和川明参种植后,根系分泌物会为微生物提供充足的营养,同时对其也有选择塑造作用,尤其川明参根系分泌物中的药性成分(在取土样时能够闻到很强的中药味)。轮作虽仅短短3个月,但影响仍然深刻。无论是细菌还是真菌,烟草连作(K1)较大幅度降低土壤微生物多样性,而烟地轮作川明参(K2)则提高了多样性,使土壤微生物朝种植玉米(K0)方向修复。
烟草土传病害严重,然而并未在K1和K2土样中检测到疫霉属Phytophthhora、炭疽菌属Colletotrichum、鐮刀菌属Fusarium和丝核菌属Rhizoctonia等常见的影响烟草正常生长的病原真菌,也仅仅只检测到很少量的致病细菌劳尔氏菌属Ralstonia,而谭渊等[36]对不同种植年限黄连根系土壤细菌的研究未在发病土样中检测到影响药用植物正常生长的病原细菌,秦越等[37]在马铃薯连作栽培研究中也未检测出马铃薯致病真菌,由此说明引发病害的原因很复杂,出现的病症可能不仅仅是由致病微生物造成的,可能涉及多方面因素,如气候、栽培管理措施等,还可能因采样时期而错过致病菌的高峰期[38]。对作物土传病害的抑制在一定程度上是土壤微生物群体的作用,当微生物群落结构越丰富、多样性越高时对抗病原菌的综合能力就越强[39]。川明参种植后增加了真菌含量,但也增加了真菌的多样性,多种真菌同时存在,互相制约,可防止某些病原菌过度繁殖。
4 结论
川明参种植增加了原烟地土壤微生物的多样性,改变了其群落结构,使有益菌增加,有害菌减少。但针对川明参与烟草轮作以及两者之间能否互消连作障碍仍需持续深入探索。
[参考文献]
[1] Kennedy A C,Smith K L. Soil microbialdiversity the sustainability of agricultural soils[J]. Plant Soil,1995,170(1):75.
[2] 李娇,蒋先敏,尹华军,等. 不同林龄云杉人工林的根系分泌物与土壤微生物[J]. 应用生态学报,2014,25(2):325.
[3] 吴林坤,林向民,林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报,2014,38(3):298.
[4] 苏海燕,程传策,宫长荣,等. 连作对烤烟化学成分和中性致香物质的影响[J]. 江西农业学报,2010,22(5):5.
[5] 邓阳春,黄建国. 长期连作对烤烟产量和土壤养分的影响[J]. 植物营养与肥料学报,2010,16(4):840.
[6] 晋艳,杨宇虹,段玉琪,等. 烤烟连作对烟叶产量和质量的影响研究初报[J]. 烟草科技,2002(1):41.
[7] 张继光,申国明,张久权,等. 烟草连作障碍研究进展[J]. 中国烟草科学,2011,32(3):95.
[8] 孙雪婷,李磊,龙光强,等. 三七连作障碍研究进展[J]. 生态学杂志,2015,34(3):885.
[9] 张敏,谈献和,张瑜,等. 中药材连作障碍[J]. 现代中药研究与实践,2012,26(1):83.
[10] 王诚浩,匡传富,唐文帮. 烟稻轮作系统水稻除草剂用量对烟草叶片的影响及其土壤残留[J]. 作物研究,2015,29(8):864.
[11] 何录秋,王长新,张延春,等. 湖南烟稻轮作区轮作水稻高产栽培技术[J]. 耕作与栽培,2004(4):45.
[12] 田苗,戴林建,钟喜,等. 施肥对湘南烟区玉米茬烤烟烟叶产量与品质的影响[J]. 作物研究,2013,27(3):263.
[13] 方树民,唐莉娜,陈顺辉,等. 作物轮作对土壤中烟草青枯菌数量及发病的影响[J]. 中国生态农业学报,2011,19(2):377.
[14] 阳显斌,李廷轩,张锡洲,等. 烟蒜轮作与套作对土壤农化性状及烤烟产量的影响[J]. 核农学报,2015,29(5):980.
[15] 唐彪,张锡洲,阳显斌. 烟蒜轮作与套作对烤烟产量及根际土壤磷组分的影响[J]. 应用生态学报,2015,26(7):1977.
[16] 官会林,郭云周,张云峰,等. 绿肥轮作对植烟土壤酶活性与微生物量碳和有机碳的影响[J]. 生态环境学报,2010,19(10):2366.
[17] 刘国,王树林,沙富云,等. 长期绿肥还田对烤烟产质量及土壤改良的影响[J]. 中国农学通报,2013,29(4):173.
[18] Dai C C,Xie H,Wang X X,et al. Intercropping peanut with traditional Chinese medicinal plants improves soil microcosm environment and peanut production in subtropical China[J]. Afr J Biotechnol,2009,8(16):3739.
[19] 李玉奎. 利用药用植物薄荷防治棉花枯萎病的初步研究[J]. 中国农业科学,1988,21(3):65.
[20] 赵新梅,王军,莫静静,等. 三种作物茎叶枯落物水浸液对烟草幼苗生长的化感效应[J]. 草业学报,2016,25(9):37.
[21] Aldrete-Tapia A,Escobar-Ramirez M C,Tamplin M L,et al. High-throughput sequencing of microbial communities in Poro cheese,an artisanal Mexican cheese[J]. Food Microbiol,2014,44:136.
[22] 乔蓬蕾,吴凤芝,周新刚. 连作对作物根际土壤微生物菌群及酶活性影响[J]. 沈阳农业大学学报,2013,44(5):524.
[23] Lakshmanan V,Selvaraj G,Bais H P. Functional soil microbiome: belowground solutions to an aboveground problem[J]. Plant Physiol,2014,166(2):689.
[24] Berendsen R L,Pieterse C,Bakker P. The rhizosphere microbiome and plant health[J]. Trends Plant Sci,2012,17(8):478.
[25] Reinhardt D. Programming good relations-development of the arbuscular mycorrhizal symbiosis[J]. Curr Opin Plant Biol,2007,10(1):98.
[26] 张晶,张惠文,李新宇,等. 土壤真菌多样性及分子生态学研究进展[J]. 应用生态学报,2004,15(10):1958.
[27] 卢鑫萍,杜茜,闫永利,等. 盐渍化土壤根际微生物群落及土壤因子对AM真菌的影响[J]. 生态学报,2012,32(13):4071.
[28] Gianinazzi S,Gollotte A,Binet M N,et al. Agroecology: the key role of arbuscular mycorrhizas in ecosystem services[J]. Mycorrhiza,2010,20(8):519.
[29] 周训军,王静,杨玉文,等. 烟草青枯病研究进展[J]. 微生物学通报,2012,39(10):1479.
[30] Boch J,Bonas U. Xanthomonas AvrBs3 family-type Ⅲ effectors: discovery and function[J]. Annu Rev Phytopathol,2010,48:419.
[31] 岳冰冰. 烤煙连作改变了根际土壤微生物的多样性[D]. 哈尔滨:东北林业大学,2012.
[32] 陈冬梅,杨宇虹,晋艳,等. 连作烤烟根际土壤自毒物质成分分析[J]. 草业科学,2011,28(10):1766.
[33] 袁小凤,彭三妹,王博林,等. 利用DGGE和454测序研究不同浙贝母种源对根际土壤真菌群落的影响[J]. 中国中药杂志,2014,39(22):4304.
[34] 陈丹梅,陈晓明,梁永江,等. 种植模式对土壤酶活性和真菌群落的影响[J]. 草业学报,2015,24(2):77.
[35] 王学翠,童晓茹,温学森,等. 植物与根际微生物关系的研究进展[J]. 山东科学,2007,20(6):40.
[36] 谭渊,陈强,刘汉军,等. 不同种植年限黄连根系土壤细菌PCR-DGGE分析[J]. 中国中药杂志,2015,40(16):3147.
[37] 秦越,马琨,刘萍. 马铃薯连作栽培对土壤微生物多样性的影响[J]. 中国生态农业学报,2015,23(2):225.
[38] 张继光,郑林林,石屹,等. 不同种植模式对土壤微生物区系及烟叶产量与质量的影响[J]. 农业工程学报,2012,28(19):93.
[39] Janvier C,Villeneuve F,Alabouvette C,et al. Soil health through soil disease suppression: which strategy from descriptors to indicators[J]. Soil Biol Biochem,2007,39(1):1.
[责任编辑 吕冬梅]

