北京欧文氏菌4个糖基转移酶活性测定及蛋白相互作用分析
常晓宁 郭金英 荣成博 谷彤彤 刘宇


摘要:北京欧文氏菌(Erwinia beijingensis)可引起刺芹侧耳细菌性软腐病,为明确该病原菌中糖基转移酶的功能,以糖基转移酶基因为研究对象,构建重组表达载体进行表达纯化;并测定蛋白活性,分析蛋白间相互作用。结果表明,成功构建了原核表达载体,获得4个可溶性蛋白。经亲和层析柱纯化获得MshA、WbnH2、EpsH及TuaG 蛋白,活性测定显示4 个蛋白均可以利用UDP-糖,并优先利用UDP-半乳糖。GST pull down 证实WbnH2及TuaG蛋白分别与MshA及EpsH蛋白在体外具有相互作用。以上研究结果为进一步研究北京欧文氏菌糖基转移酶基因功能奠定了基础。
关键词:北京欧文氏菌;软腐病;糖基转移酶;原核表达
doi:10.13304/j.nykjdb.2022.0736
中图分类号:Q933 文献标志码:A 文章编号:10080864(2024)01012508
软腐病作为一种重要的侵染性病害,给农业生产带来了严重的经济损失[1-4]。近年来,刺芹侧耳细菌性软腐病(bacterial soft-rot disease)在韩国[5]及中国的北京[6]、广州[7]等地均有发现。感染该病害的子实体上出现水渍状病斑,严重时整个子实体腐烂[89]。本课题组前期鉴定表明,北京地区刺芹侧耳细菌性软腐病的病原菌为北京欧文氏菌(Erwinia beijingensis),该病原菌上存在1 个和多糖合成相关的可移动元件,推测其与致病性相关。胞外多糖是由细菌分泌、暴露在细胞表面的多糖[1011],可以保护细菌免受干燥等恶劣环境的影响[12],对病原菌的毒力至关重要[1314]。糖基转移酶(glycosyltransferases,GT)是产生多种复杂糖缀合物所必需的酶[15],负责将单糖共价连接到多种有机底物,并催化糖的附着[16]。大多数糖基化蛋白暴露于细胞表面,通常参与细胞间识别、信号转导和免疫调节等[17]。研究证明,糖基转移酶作为重要的毒力因子在致病过程中发挥关键作用[18-20]。通过分析,发现北京欧文氏菌中存在6个糖基转移酶基因,分别为mshA、wbnH1、wbnH2、EpsH、tuaG 和1422,其中,EpsH、tuaG 及1422 基因属于糖基转移酶GTA 型超家族(Glycosyltransferase _GTA-type superfamily); mshA、wbnH1、wbnH2 基因属于糖基转移酶GTB 型超家族(Glycosyl transferase _GTB-type superfamily)。
为进一步了解这些糖基转移酶基因的功能,本研究拟构建糖基转移酶基因的原核表达载体,然后转化大肠杆菌BL21(DE3)进行诱导表达纯化,并对其酶学性质进行分析,同时利用GST pulldown分析蛋白间的相互关系,旨在明确糖基转移酶基因在北京欧文氏菌中的作用,为刺芹侧耳细菌性软腐病的防治奠定基础。
1 材料与方法
1.1 菌株与质粒
北京欧文氏菌LMG 27579T 由本实验室分离并保存,大肠杆菌DH5α由本实验室保存,大肠杆菌BL21(DE3)pLysS 购自北京全式金生物技术有限公司。
1.2 主要试剂
1.2.1 主要试剂 氨苄西林购自上海金畔生物科技有限公司;TBST (TBS with Tween-20, 10×)、卡那霉素、BCA 蛋白检测试剂盒、BeyoECL Plus(超敏ECL化学发光试剂盒)购自上海碧云天生物技术有限公司;LB MILLER 肉汤培养基购自美国BD公司;异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)购自宝日医生物技术(北京)有限公司;NP-40裂解液、脱脂奶粉、二硫苏糖醇购自北京酷来搏科技有限公司;一抗Anti-6×His tag 抗体[EPR20547]-ChIP Grade 购自艾博抗(上海)贸易有限公司;二抗Anti-rabbit lgG、HRPlinkedAntibody 购自美国Cell SignalingTechnology (CST)公司;Fast Blue蛋白染色液购自中科瑞泰(北京)生物科技有限公司;Ni-NTA树脂购买自凯杰企业管理(上海)有限公司;谷胱甘肽琼脂糖、还原型谷胱甘肽购自sigma-aldrich 西格玛奥德里奇(上海)贸易有限公司;质粒小提试剂盒、琼脂糖凝胶回收试剂盒购买于天根生化科技(北京)有限公司;无缝克隆试剂盒购买于中美泰和生物技术(北京)有限公司。JY92-Ⅱ超声波细胞粉碎机购自宁波新芝生物科技股份有限公司所用引物(表1)由生工生物工程(上海)有限公司合成。
1.2.2 培养基及主要试剂配置 LB(luriabertani)液体培养基:2 g LB粉末溶于100 mL去离子水中;LB固体培养基:2 g LB粉末,2 g琼脂粉溶于100 mL去离子水中;121 ℃,高压灭菌30 min。使用时根据试验要求按照1∶1 000比例添加相应抗生素。
缓冲液A:20 mmol·L?1 Tris-HCl,50 mmol·L?1NaCl,pH 8.0。
缓冲液B:20 mmol·L?1 Tris-HCl,50 mmol·L?1NaCl,5%甘油,pH 8.0。
缓冲液C:20 mmol·L?1 Tris-HCl,50 mmol·L?1NaCl,5 mmol·L?1 DTT,5%甘油,pH 8.0。
缓冲液D:20 mmol·L?1 Tris-HCl,50 mmol·L?1NaCl,5 mmol·L?1 DTT,0.4% NP40,pH 8.0。
缓冲液E:20 mmol·L?1 Tris-HCl,50 mmol·L?1NaCl,5 mmol·L?1 DTT,pH 8.0。
洗脱缓冲液A:20 mmol·L?1 Tris-HCl,1 mol·L?1咪唑,pH 8.0。
洗脱缓冲液B:20 mmol·L?1 Tris-HCl,20 mmol·L?1 GSH。
1×糖基转移酶反应液:50 mmol·L?1 Tris-HCl(pH 7.5),5 mmol·L?1 MnCl2。
1.3 试验方法
1.3.1 重组质粒表达载体构建 以北京欧文氏菌LMG 27579T 基因组DNA 为模板,设计合成引物wbnH2-F 和wbnH2-R,wbnH2 基因PCR 体系(50 μL)包含:5×Phusion 10 μL,10 mmol·L?1 dNTP1 μL,正、反向引物各2.5 μL,模板DNA 1 μL,DMSO 1.5 μL,Phusion DNA 聚合酶0.5 μL。PCR程序为:98 ℃ 30 s;98 ℃ 10 s,60 ℃ 10 s,72 ℃1 min,35个循环;72 ℃ 10 min。10%琼脂糖凝胶电泳检测PCR产物,使用琼脂糖凝胶回收试剂盒切胶回收。利用限制性内切酶Xho I/EcoR Ⅰ双酶切pGEX-KG载体,利用无缝克隆试剂盒将目的基因片段与pGEX-KG 质粒载体连接,连接体系(10 μL)包含:wbnH2 DNA 片段4 μL,pGEX-KG1 μL,Mix酶5 μL;50 ℃反应15 min。反应完成后将连接产物转化至DH5α大肠杆菌中,涂布于含有50 mg·L?1氨苄西林(ampicillin,Amp)的抗性平板,37 ℃倒置过夜培养,获得重组克隆;提取质粒送北京诺赛基因组研究中心有限公司测序验证,测序正确的命名为pGEX-wbnH2。将其余5个糖基转移酶基因委托中美泰和生物技术(北京)有限公司分别构建到pGEX-及pET-30a-载体,获得表达质粒分别命名为pET-30a-mshA、pET-30awbnH1、pET-30a-EpsH、pGEX-6p-1-tuaG、pET-30a-1422 及pGEX-6p-1-1422。
1.3.2 重组蛋白诱导表达 将上述构建成功的重组质粒分别转化大肠杆菌BL21(DE3)感受态细胞,构建重组表达菌株并进行诱导表达。
挑取pET-30a-载体的E. coli BL21/ pET-30amshA、E. coli BL21/pET-30a- wbnH1、E. coli BL21/pET-30a-EpsH 及E. coli BL21/pET-30a-1422 菌株单克隆接种于含有50 mg·L?1 卡那霉素(kanamycin,Kan)的LB 液体培养基中,挑取pGEX-KG- 载体的E. coli BL21/pGEX-wbnH2、E.coli BL21/pGEX-6p-1-tuaG、E. coli BL21/pGEX-6p-1-1422 菌株单克隆接种于含有50 mg·L?1 氨苄西林的LB液体培养基中,37 ℃、180 r·min?1振荡过夜培养。将所得培养物按照1∶10比例转接到带有相应抗生素的新鲜培养液中,培养至OD600为0.6~0.8,取出部分菌液命名为未诱导组;其余菌液加入IPTG过夜诱导,180 r·min?1振荡过夜培养。在上述条件下,对IPTG 终浓度(0.1 mmol·L?1 和1.0 mmol·L?1)及诱导温度(16 ℃和37 ℃)做优化和筛选。
离心收集菌体,pET-30a-载体的菌株使用缓冲液B将细胞重悬,pGEX-KG载体的菌株用缓冲液C将细胞重悬。使用超声破碎仪在冰浴条件下对细胞超声破碎裂解,破碎至菌液澄清,在4 ℃条件下离心(12 000 r·min?1、10 min)获得上清液,SDS-PAGE检测蛋白诱导情况。
1.3.3 重组蛋白纯化 将上一步经诱导获得可溶性蛋白的E. coli BL21/pET-30a-mshA、E. coli BL21/pET-30a-EpsH、E. coli BL21/pGEX-wbnH2、E. coliBL21/pGEX-6p-1-tuaG 菌株进行大量培养表达,并进行纯化。
pET-30a-载体的菌株使用镍离子金属鳌合亲和层析介质(Ni-NTA)树脂进行纯化。取500 μL的Ni-NTA镍柱加入纯化柱中,无菌水冲洗5个柱体积,缓冲液A平衡5个柱体积,将诱导后的蛋白上清液过滤上柱,并加入10 mmol·L?1 咪唑1 mL(除去非特异性结合),冰上摇动结合4 h。用缓冲液A 洗脱至无杂带,再用洗脱缓冲液A 配置成20~300 mmol·L?1 咪唑洗脱并收集目的蛋白。SDS-PAGE 电泳检测,利用超滤管对收集的蛋白液进行脱盐处理。将纯化好的蛋白保存于?80 ℃超低温冰箱。
pGEX-KG-载体的菌株使用谷胱甘肽琼脂糖进行纯化。取500 μL溶解好的的谷胱甘肽琼脂糖加入纯化柱中,无菌水冲洗5个柱体积,缓冲液E平衡5个柱体积,将上清液过滤上柱,冰上摇动结合4 h,用缓冲液A洗脱至无杂蛋白,用洗脱缓冲液B洗脱并收集目的蛋白。SDS-PAGE电泳检测,用超滤管对收集的蛋白液进行脱盐处理。将纯化好的蛋白保存于?80 ℃超低温冰箱。
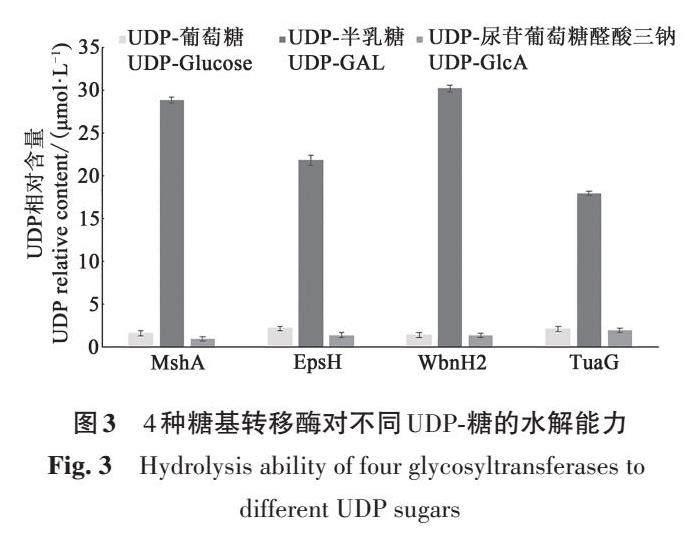
1.3.4 糖基转移酶活性测定 利用Pomega UDPGlo糖基转移酶测定试剂盒,参照MIDDLETON[18]的方法并稍作改进,分析4个糖基转移酶蛋白对UDP- 半乳糖(UDP-GAL)、UDP- 葡萄糖(UDPGlucose)、UDP-尿苷葡萄糖醛酸三钠(UDP-GlcA)的水解能力。将纯化的MshA、EpsH、WbnH2、TuaG蛋白利用BCA蛋白检测试剂盒标定蛋白含量,在不存在受体的情况下,在含有50 mmol·L?1Tris(pH7.5)和5 mmol·L?1 MnCl2 的25 μL 1×糖基转移酶反应液中,将蛋白质与100 mmol·L?1 的单一UDP-糖在室温下孵育30 min,添加25 μL 的UDP-Glo检测试剂来终止水解反应,并在室温下孵育1 h,使用酶标仪检测发光值。
1.3.5 GST pull down 分析 ① MshA 蛋白与WbnH2、TuaG 蛋白互作分析。取500 μL 谷胱甘肽琼脂糖(glutathione-agarose)加入到纯化柱中,使用无菌水分别冲洗5个柱体积,再用缓冲液A分别冲洗5个柱体积,将WbnH2、TuaG及GST蛋白(阴性对照)的蛋白裂解液,分别加入到各层析柱中,冰上摇动结合4 h。弃流出液,使用缓冲液A冲洗柱体洗脱杂蛋白。洗脱完成后,将每个纯化柱中分别加入200 μL的MshA蛋白,并用缓冲液A 补充至500 μL,冰上摇动结合4 h,4 ℃结合过夜。用缓冲液A、D冲洗柱体洗脱去除杂蛋白,用洗脱缓冲液B洗脱目的蛋白,收集样品,加入一定量的蛋白上样缓冲液,10% SDS-PAGE电泳检测,同时用His 抗体进行Western-blot 检测。用Western-blot电转仪于300 mA 低温转膜1h,加入含有5%脱脂牛奶的封闭液中封闭1h,TBST(TBSwith Tween-20)洗涤,加入一抗室温摇动孵育3 h并4 ℃孵育过夜。TBST洗涤3次,加入二抗,室温摇动孵育1 h,TBST洗涤3次。使用超敏ECL化学发光试剂盒孵育2~3 min,用凝胶成像仪成像并拍照记录。② EpsH蛋白与WbnH2、TuaG蛋白互作分析。方法同①。
2 结果与分析
2.1 重组载体可溶性蛋白筛选结果
对构建成功的糖基转移酶蛋白表达载体进行小量诱导表达,同时对IPTG 浓度及诱导温度进行筛选,结果表明E. coli BL21/pET-30a-mshA(图1A)、E. coli BL21/pET-30a-EpsH(图1B)、E.coli BL21/pGEX-6p-1-tuaG( 图1C)在16 ℃ 、0.1 mmol·L?1 IPTG 情况下诱导可获得可溶性蛋白;E. coli BL21/pGEX-wbnH2 在16 ℃、1.0 mmol·L?1IPTG情况下诱导可获得可溶性蛋白(图1D)。
2.2 糖基转移酶蛋白纯化结果
对pET-30a- 载体的E. coli BL21/pET-30amshA和E. coli BL21/pET-30a-EpsH 进行大量诱导表达,并利用Ni柱纯化,利用不同浓度咪唑洗脱;对pGEX-载体的E. coli BL21/pGEX-wbnH2、E. coliBL21/pGEX-6p-1-tuaG 利用谷胱甘肽琼脂糖纯化,利用GSH 洗脱。结果表明,MshA(图2A 泳道8、9)、EpsH(图2B泳道4)、WbnH2(图2C泳道3)及TuaG(图2D 泳道3)目的条带大小正确、杂带较少、蛋白水平相对较高,因此收集对应泳道蛋白,并利用超滤管进行脱盐处理,保存至?80 ℃超低温冰箱,备用。
2.3 糖基转移酶蛋白活性测定结果
利用Pomega UDP-Glo 糖基转移酶测定试剂盒测试4个蛋白在没有受体底物的情况下对UDP-半乳糖(UDP-GAL)、UDP-葡萄糖(UDP-Glucose)、UDP-尿苷葡萄糖醛酸三钠(UDP-GlcA)的水解能力,在水解后通过检测游离UDP来评估反应,以无酶反应作为空白对照。结果(图4)表明,4个蛋白均可以水解UDP-糖,其中4 种蛋白均优先利用UDP-半乳糖,对UDP-葡萄糖、UDP-尿苷葡萄糖醛酸三钠的水解能力相似,无明显差异。WbnH2蛋白对UDP-半乳糖的水解能力最强;TuaG对UDP-半乳糖的水解能力低于其他3种蛋白。
2.4 蛋白互作分析
利用GST pull down 分析WbnH2、TuaG 蛋白分别与MshA、EpsH蛋白的互作情况, SDS检测结果(图4)表明,蛋白目的条带正确,可进行Western-blot 检测。Western-blot 检测结果(图5)表明, WbnH2、TuaG蛋白分别与MshA、EpsH蛋白结合后,western-blot能检测到MshA、EpsH 蛋白,而GST蛋白与MshA、EpsH蛋白结合洗涤去除非特异结合后,Western-blot检测不到,说明WbnH2、TuaG蛋白分别与MshA、EpsH蛋白在体外具有相互作用。
3 讨论
病原细菌分泌的胞外多糖有助于细菌入侵宿主 [4],同时影响细菌的多种行为。研究表明,丁香假单胞菌(Pseudomonas syringae)[14]、水稻黄单胞菌(Xanthomonas oryzae pv. oryzae)、沙门氏菌(Salmonella)[21]等引起宿主致病的原因均与胞外多糖有关。细菌多糖由糖基转移酶(GT)合成,GT是个酶家族,负责将碳水化合物残基从供体转移至受体底物[22]。报道指出,糖基转移酶是重要的毒力因子,如糖基转移酶MoGt2 在稻瘟病菌发病机制中起重要作用[23];嗜冷黄杆菌(Flavobacterium psychrophilum)中的2型糖基转移酶基因fpgA 与毒力相关[24];布鲁氏菌属(Brucellaspp.)中的糖基转移酶促进多糖的产生[25]。糖基转移酶相互作用介导病原菌对宿主的黏附,侵入性致病菌不可分型流感嗜血杆菌(nontypeableHaemophilus influenzae, NTHi)可引发中耳炎等疾病,其糖基转移酶HMW1C/2C将黏附蛋白HMW1/2糖基化,从而黏附于宿主上皮细胞,导致宿主发病[26];Fap1是一种黏附素,糖基转移酶Gtf1与Gtf2互作,增强Gtf1对黏附素Fap1的糖基化修饰,从而增强副血链球菌(Streptococcus parasanguinis)对宿主的致病能力[27]。
本研究从北京欧文氏菌中筛选出6个糖基转移酶基因,为了解其蛋白特性,分别将目的基因克隆入pET-30a 及pGEX 载体,构建了重组表达质粒,并进一步用质粒转化BL21(DE3)感受态细胞,利用IPTG诱导4个基因,获得可溶性表达蛋白。4个糖基转移酶蛋白对UDP-半乳糖有较强的水解能力,且蛋白在体外存在相互作用,为进一步研究糖基转移酶基因在北京欧文氏菌中的作用奠定了基础。
参考文献
[1] WANG Q, ZHANG C, WU X, et al .. Chitosan augmentstetramycin against soft rot in kiwifruit and enhances itsimprovement for kiwifruit growth, quality and aroma [J].Biomolecules, 2021, 11(9):1257-1270.
[2] LIU M, WU F, WANG S, et al .. Comparative transcriptomeanalysis reveals defense responses against soft rot in Chinesecabbage [J]. Hortic. Res., 2019, 6:68-86.
[3] SUN M, LIU H, HUANG J, et al .. A loop-mediated isothermalamplification assay for rapid detection of Pectobacteriumaroidearum that causes soft rot in konjac [J]. Int. J. Mol. Sci.,2019, 20(8):1937-1950.
[4] YAKOVLIEVA L, WALVOORT M. Processivity in bacterialglycosyltransferases [J]. ACS Chem. Biol., 2019, 15(1):3-16.
[5] KIM M K, LEE S M, SEUK S W, et al .. Characterization of thercsA gene from Pantoea sp. strain PPE7 and its influence onextracellular polysaccharide production and virulence onPleurotus eryngii [J]. Plant Pathol. J., 2017, 33(3):276-287.
[6] XU F, YAN H, LIU Y, et al .. A re-evaluation of the taxonomyand classification of the type Ⅲ secretion system in apathogenic bacterium causing soft rot disease of Pleurotuseryngii [J]. Curr. Microbiol., 2021, 78(1):179-189.
[7] 赖亮民,胡晶晶,王艳,等.刺芹侧耳软腐病病原菌鉴定及其致病机制[J].食用菌学报,2021,28(2):89-99.
LAI L M, HU J J, WANG Y, et al .. Identification andpathogenic mechanisms of pathogens causing soft rot diseasein Pleurotus eryngii [J]. Acta Edulis Fungi, 2021, 28(2):89-99.
[8] 张瑞颖,胡丹丹,顾金刚,等.刺芹侧耳细菌性软腐病病原菌分离鉴定[J].食用菌学报,2013,20(3):43-49.
ZHANG R Y, HU D D, GU J G, et al .. Identification andcharacterization of an Erwinia sp. causing bacterial soft-rotdisease on pleurotuseryngii cultivated in China [J]. Acta EdulisFungi, 2013, 20(3):43-49.
[9] 马元伟,马康,王守现,等.一株刺芹侧耳软腐病致病菌新种的分离与鉴定[C]//第十届全国食用菌学术研讨会论文汇编,北京,2014:382-389.
MA Y M, MA K, WANG S X, et al .. Isolation and identificationof a novel pathogenic bacteria, causing soft-rot diease ofPleurotus eryngii [C]// Proceedings of the 10th NationalSymposium on edible fungi, Beijing, 2014:382-389.
[10] LERMINIAUX N A, MACKENZIE K D, CAMERON A.Salmonella pathogenicity island 1 (SPI-1): the evolution andstabilization of a core genomic type three secretion system [J].Microorganisms, 2020, 8(4):2-22.
[11] KLEE S M, SINN J P, CHRISTIAN E, et al .. Virulencegenetics of an Erwinia amylovora putative polysaccharidetransporter family member [J]. J. Bacteriol., 2020, 202(22):1-19.
[12] ROBERTS, IAN S. The biochemistry and genetics of capsularpolysaccharide production in bacteria [J]. Annu. Rev.Microbiol., 1996, 50(1):285-315.
[13] ASKARIAN F, UCHIYAMA S, MASSON H, et al .. The lyticpolysaccharide monooxygenase CbpD promotes Pseudomonasaeruginosa virulence in systemic infection [J]. Nat. Comm.,2021, 12(1):1-19.
[14] BAE N, PARK H J, PARK H, et al .. Deciphering the functionsof the outer membrane porin OprBXo involved in virulence,motility, exopolysaccharide production, biofilm formation andstress tolerance in Xanthomonas oryzae pv. Oryzae [J]. Mol.Plant Pathol., 2018, 19(12):2527-2542.
[15] JEON J G, ROSALEN P L, FALSETTA M L, et al .. Natural products in caries research: current (limited) knowledge,challenges and future perspective [J]. Caries Res., 2011, 45(3):243-263.
[16] BISWAS A, THATTAI M. Promiscuity and specificity ofeukaryotic glycosyltransferases [J]. Portland Press OpenAccess., 2020, 48(3):891-900.
[17] LU Q, LI S, SHAO F. Sweet talk: protein glycosylation inbacterial interaction with the host [J]. Trends Microbiol., 2015,23(10):630-641.
[18] MIDDLETON D R, ACEIL J, MUSTAFA S, et al ..Glycosyltransferases within the psrP locus facilitatepneumococcal virulence [J]. J. Bacteriol., 2021, 203(7):389-400.
[19] JIANG Y L, JIN H, YANG H B, et al .. Defining the enzymaticpathway for polymorphic O-glycosylation of the pneumococcalserine-rich repeat protein PsrP [J]. J. Biol. Chem., 2017, 292(15):6213-6224..
[20] DENG Q, WU H, GU Q, et al .. Glycosyltransferase FvCpsAregulates fumonisin biosynthesis and virulence in Fusariumverticillioides [J]. Toxins, 2021, 13(10):718-730.
[21] ECHEVERZ M, GARC?A B, SABALZA A, et al .. Lack of thePGA exopolysaccharide in Salmonella as an adaptive trait forsurvival in the host [J]. PLoS Genetics, 2017, 13(5):816-843.
[22] EMI L, TYKESSO N, YAN G, et al .. Deciphering the mode ofAction of the processive polysaccharide modifying enzymedermatan sulfate epimerase 1 by hydrogen-deuterium exchangemass spectrometry [J]. Chem. Sci., 2016, 7(2):1447-1456.
[23] DENG S, SUN W, DONG L, et al .. MoGT2 is essential formorphogenesis and pathogenicity of Magnaporthe oryzae [J].Msphere, 2019, 4(5):309-319.
[24] P?REZ-PASCUAL D, G?MEZ E, GUIJARRO J A. Lack of atype-2 glycosyltransferase in the fish pathogen Flavobacteriumpsychrophilum determines pleiotropic changes and loss ofvirulence [J]. Veterinary Res., 2015, 46(1):1-9.
[25] DABRAL N, JAIN-GUPTA N, SELEEM M N, et al ..Overexpression of Brucella putative glycosyltransferase WbkAin B. abortus RB51 leads to production of exopolysaccharide [J].Front. Cellular Infect. Microbiol., 2015, 5(4):54-68.
[26] SUSAN G, KATHERINE, et al .. Structural determinants of theinteraction between the TpsA and TpsB proteins in theHaemophilus influenzae HMW1 two-partner secretion system [J].J. Bacteriol., 2015, 197(10):1769-1781.
[27] ECHLIN H, ZHU F, LI Y, et al .. Gap2 promotes the formation ofa stable protein complex required for mature fap1 biogenesis [J].J. Bacteriol., 2013, 195(10):2166-2176.
(责任编辑:张冬玲)

