人FOXA1蛋白的原核表达、纯化及蛋白互作分析
谭拥军 陈竹林++陈团辉++向勤��

摘要:构建FOXA1的原核表达载体,诱导表达并纯化后获得人FOXA1的C端和N端蛋白片段,为寻找FOXA1的互作蛋白提供材料基础.提取人乳腺癌细胞MCF7的总RNA,逆转录成cDNA,设计引物PCR克隆FOXA1的cDNA,再以此为模板扩增FOXA1的C端、N端cDNA片段,分别并克隆进带有GST标签的原核表达载体pGEX4T1,构建重组表达质粒.双酶切及测序鉴定正确后,转化至大肠杆菌BL21 Rosetta DE3,经IPTG诱导,Glutathione Sepharose 4B亲和纯化,通过SDSPAGE电泳及Western blot确定FOXA1蛋白的表达.与MCF7细胞裂解液孵育,进行GSTPull down试验,检测纯化蛋白与FOXA1已知互作蛋白TLE3的相互作用.成功构建pGEX4T1FOXA1C和 pGEX4T1FOXA1N的原核表达载体;在大肠杆菌中诱导目的蛋白表达;经Glutathione Sepharose 4B纯化后,获得了人FOXA1的C端蛋白片段GSTFOXA1C与N端蛋白片段GSTFOXA1N;证实GSTFOXA1C能与FOXA1已知互作蛋白TLE3的相互作用.
关键词:转录因子FOXA1;原核表达;相互作用蛋白
中图分类号:Q786 文献标识码:A
转录因子FOXA1属于叉头框(Forkhead Box, Fox)转录因子家族的FOXA亚家族[1].FOX基因广泛地分布于从酵母到人的各种真核生物中,构成一个庞大的转录因子家族.其中在哺乳动物中就拥有40个以上成员,分别参与细胞分化、增殖、代谢及细胞凋亡等生理过程的调节[2]. FOXA1是该家族最早被克隆的成员[3].
FOXA1蛋白介导许多蛋白的相互作用,调节发育、代谢和肿瘤的发生.FOXA1的功能区域由 DNA结合区和转录激活区构成.作为先锋转录因子,FOXA1的羧基端能与核心组蛋白H3,H4相互作用[4] 加强了FOXA1蛋白与核小体的结合能力.有研究表明转录因子FOXA1 羧基端的转录激活区可以招募TLE3/GRG3结合到染色质上[5].而FOXA1 DNA结合区可以干扰转录因子NKX2.1与DNA的结合功能从而抑制NKX2.1转录复合物的形成,抑制脑肺和甲状腺的发育[6].此外,FOXA1的DNA结合区还介导FOXA1与雄激素受体(AR)的相互作用[7],而在乳腺癌细胞株中,雌激素的应答在一定程度上依赖于FOXA1的表达[8-9].
为了进一步研究FOXA1在细胞中扮演的角色,本研究通过基因工程技术体外构建表达载体,诱导可溶性融合蛋白 GSTFOXA1C和GSTFOXA1N 的高效表达并亲和纯化.利用 GSTPull down技术,在乳腺癌细胞MCF7中证实GSTFOXA1C可与已知的FOXA1结合蛋白TLE3发生相互作用,证明纯化蛋白结构正确且能与其互作蛋白发生互作,为进一步寻找FOXA1的互作蛋白提供材料基础.
1材料与方法
1.1菌种、质粒、细胞系
大肠杆菌DH5α感受(北京鼎国),大肠杆菌BL21 Rosetta(DE3)感受态(广州百恩维),质粒pGEX4T1由本实验室保存,乳腺癌细胞MCF7为本实验室冻存.
1.2主要试剂
限制性内切酶BamHI,XhoI,T4 DNA连接酶均购自Fermentas公司,MMLV逆转录酶购于Promega公司,DNA高保真聚合酶购于TOYOBO公司,PCR 引物由上海生工生物公司合成,Glutathione Sepharose 4B购于GE,GST抗体购于碧云天,V5抗体购于Millpore公司.
1.3重组质粒pGEX4T1FOXA1N,pGEX4T1FOXA1C的构建及其鉴定
根据NCBI检索到的人源FOXA1的cDNA序列以及空载体PGEX4T1的多克隆位点确定FOXA1的上下游引物如表1所示.上游引物为CCC GGA TCC ATG TTA GGA ACT GTG AAG,下划线为BamH I 酶切位点,下游引物为CGC TCT AGA GGA AGT GTT TAG GAC GGG,下划线为EcoR I 酶切位点.以人的乳腺癌细胞MCF7提取细胞总RNA,逆转录成cDNA,再以cDNA为模板进行PCR扩增,扩增条件为94 ℃ 2 min ;98 ℃ 10 s,68 ℃ 90 s,68 ℃ 10 min,32个循环.将 PCR产物克隆入pGEX4T1质粒中,双酶切鉴定后送上海生工测序.以测序正确的pGEX4T1FOXA1为模板,FOXA1C上游引物GCG CGA ATT CAA CCA CCC GTT CTC CAT CAA,FOXA1C下游引物GCG CCT CGA GTC ATT GGT AGT ACG CCG GCT CCA G;FOXA1N上游引物GCG CGA ATT CAT GTC CTA GGC CAA CCC GG,FOXA1N下游引物GCG CCT CGA GCT AGG CGT GCG GGT AGC TGC GC.分别克隆FOXA1的C端(第397到第461个氨基酸)、N端(第66到第218个氨基酸).
1.4GSTFOXA1C,GSTFOXA1N融合蛋白的纯化及其鉴定
将测序正确的pGEX4T1FOXA1N,pGEX4T1FOXA1C转化入BL21 Rosetta DE3感受态细胞,挑取阳性单克隆,加入含有氨苄青霉素和氯霉素的LB培养基中,37 ℃,培养至OD值在0.6~1.0之间,加入终浓度为0.8 mmol/L IPTG,32 ℃诱导4 h后收集菌液,溶菌酶酶解30 min,超声破碎,取上清加入GSTbeads室温孵育30 min后,加入Elution Buffer洗脱,收集洗脱后的蛋白,考染和免疫印迹鉴定.
1.5GST pull down
MCF7细胞培养至60%~90%时,脂质体转染带V5标签的TLE3真核表达质粒,48 h后收集转染后的细胞,加入500 μL IP裂解液冰上裂解1 h,13 000 r/min,4 ℃,离心15 min,收集上清,即为总的细胞裂解液.向收集的细胞裂解液中加入20 μL GSTbeads,4 ℃,孵育2 h,离心收集上清,一分为二,分别加入20 μL GSTbeads和纯化后的GSTFOXA1C,GSTFOXA1N蛋白,4 ℃旋转结合2 h,4 000 r/min离心收集珠子,用预冷的GST Lysis Buffer漂洗3次,加入Elution Buffer洗脱,收集洗脱后的蛋白,进行考染和免疫印迹鉴定.
2结论
2.1人FOXA1基因全长的扩增
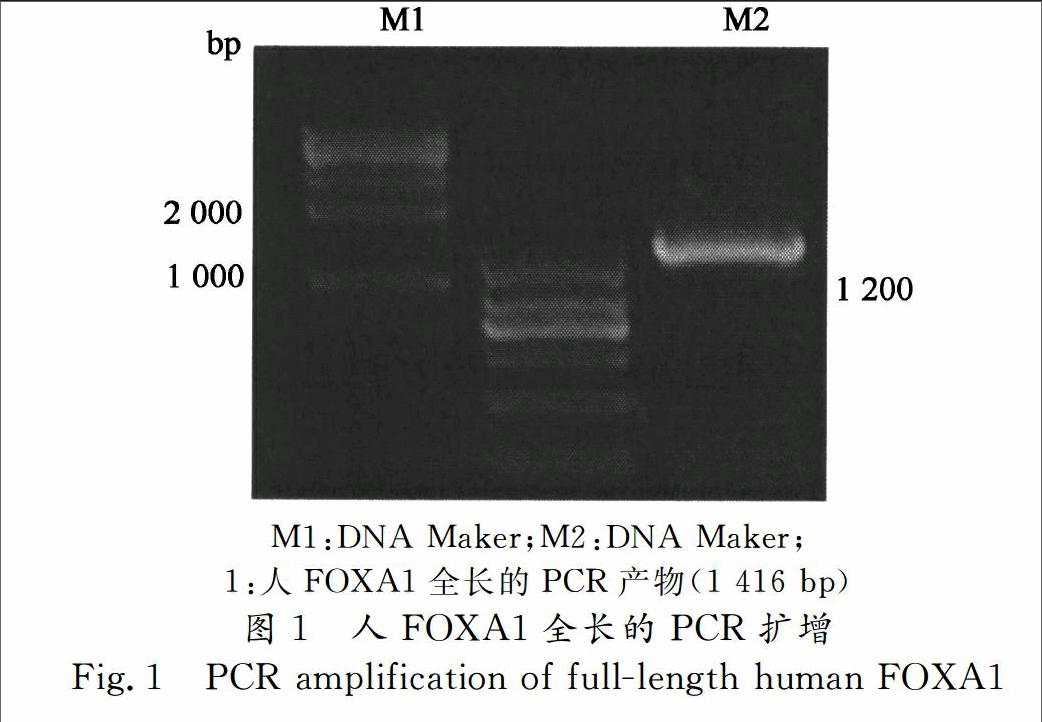
MCF7细胞 RNA的提取按照Total RNA KitI试剂盒(Omega,USA)进行,运用MMLV逆转录酶(Invitrogen,USA)将RNA反转录为cDNA.通过NCBI查询人FOXA1的cDNA序列设计一对引物,再以cDNA为模板PCR扩增人的FOXA1全长(图1)所示,通过PCR扩增出来的FOXA1 cDNA大小为1 400 bp左右,与NCBI查询的大小基本一致.
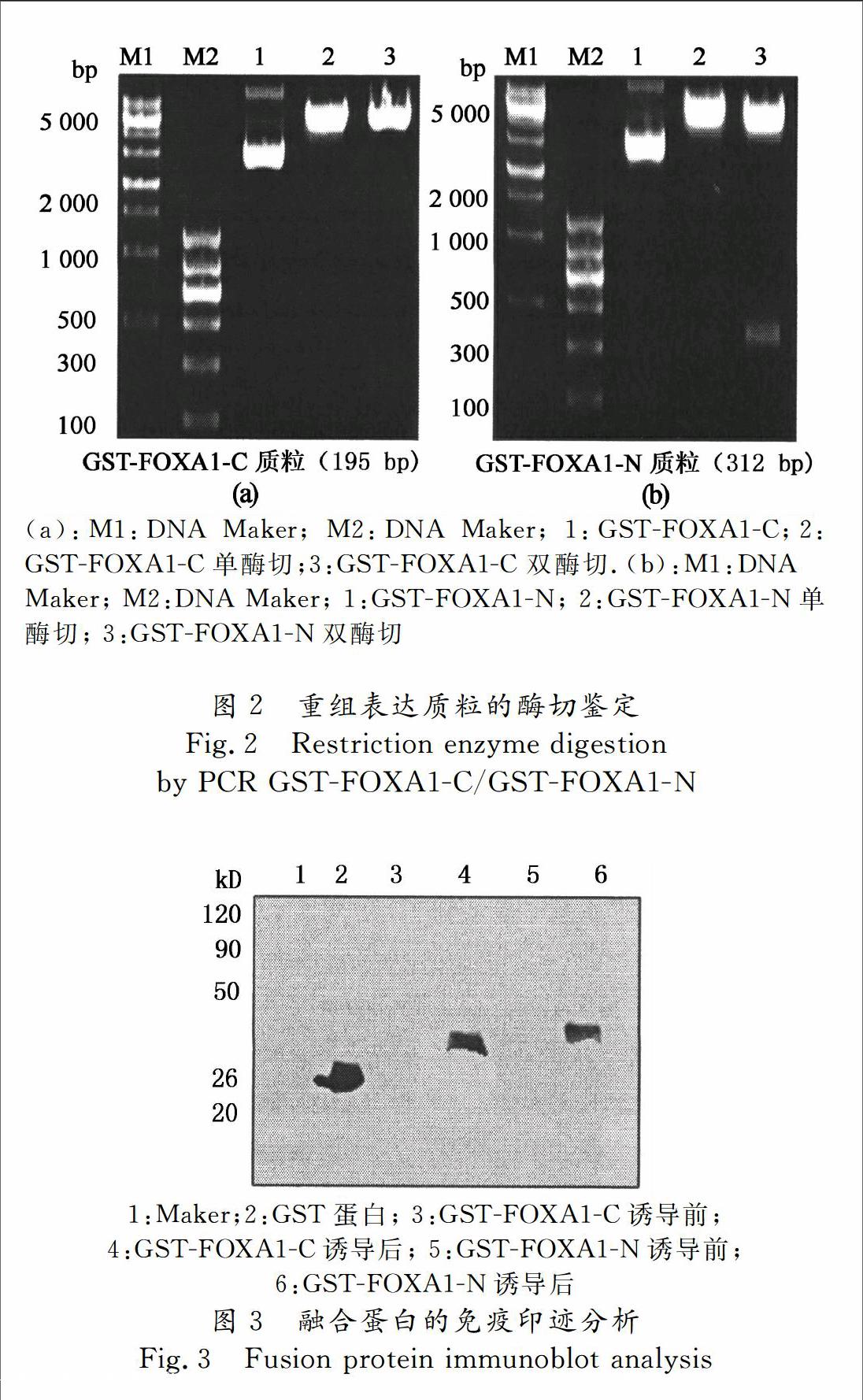
2.2重组质粒pGEX4T1FOXA1N,pGEX4T1FOXA1C的构建
再以此为模板扩增FOXA1C/FOXA1N,大小分别为196 kb,459 kb,与预期大小一致.将PCR克隆获得的片段克隆至表达载体PGEX4T1,进行双酶切鉴定如图2所示.我们已经讨论了FOXA1的结构域蛋白在生物体内发挥了重要作用,为了进一步研究其在生物体内的功能,所以克隆出人FOXA1的羧基端和氨基 端蛋白,为后续试验奠定材料基础.
2.3GSTFOXAC及GSTFOXA1N融合蛋白的表达及鉴定
将pGEX4T1,pGEX4T1FOXA1N,pGEX4T1FOXA1C 3个质粒分别转化进BL21 Rosetta DE3感受态细胞,挑取阳性克隆大规模培养,经IPTG诱导后,收集菌液,Western blot法检测显示,GSTFOXAC及GSTFOXA1N融合蛋白均能有效表达(图3).
2.4GSTFOXAC与GSTFOXA1N融合蛋白的纯化
将pGEX4T1,pGEX4T1FOXA1N,pGEX4T1FOXA1C 3个质粒分别转化进BL21 Rosetta DE3感受态细胞,挑取阳性克隆大规模培养,经IPTG诱导后,收集菌液,酶解,超声破碎.上清用GSTSepharose4B亲和珠纯化后,经考马斯亮蓝染色结果显示,虽出现不同程度的降解,但均能有效地获得较高浓度的目的GSTFOXAC及GSTFOXA1N融合蛋白(图4).
2.5GSTpull down结果分析
将带有GSTFOXA1C与GSTFOXA1N融合蛋白的珠子与过表达的V5TLE3蛋白的MCF7细胞裂解液孵育后,用V5抗体进行Western blot 法检测(图5)结果显示,GSTFOXA1C融合蛋白可以与TLE3 蛋白发生结合,而GST蛋白和GSTFOXA1N融合蛋白在同一位置无此条带,说明FOXA1C端蛋白结构域能够有效的与TLE3 蛋白特异地相互作用,具有与FOXA1全长蛋白部分相似的生物学功能.
1:过表达V5TLE3蛋白的MCF7细胞裂解物(Input);2:GST蛋白与Input孵育后的Pull down产物;3:GSTFOXA1N融合蛋白与Input孵育后的Pull down产物;4:GSTFOXA1C融合蛋白与Input孵育后的Pull down产物
2.6Pull down结果的考马斯亮蓝分析
将带有GSTFOXA1C融合蛋白的珠子与MCF7细胞裂解液孵育后,同时用GST蛋白与MCF7细胞裂解液孵育的结果作为对照,再用洗脱液将Pull down产物洗脱下来,经考马斯亮蓝染色发现,GSTFOXA1C融合蛋白能够拖下许多与FOXA1C端相结合的互作蛋白,从而为后面的实验奠定材料基础(图6).
1:Protein Maker;2:Input:MCF7 cell lysis;3:对照组GST Pull down 洗脱产物;4:对照组 GST Pull down 上清;5:实验组GSTFOXA1C Pull down洗脱产物;6:实验组GSTFOXA1C洗脱上清;7:GSTFOXA1C蛋白;8:GST蛋白
3讨论
GST Pull down技术是体外确定两个已知蛋白是否相互作用以及筛选与已知融合蛋白相互作用的未知蛋白的有效方法. 本实验成功构建GSTFOXA1结构域蛋白的表达载体,这种构建基因的某一段的结构域蛋白研究其生物功能并不少见,有文章报道过构建转录因子FOXO基因的结构域蛋白研究它与目的蛋白的甲基化作用[10].再摸索诱导条件后以比较优化的条件诱导出GSTFOXA1C和GSTFOXA1N融合蛋白,作为后续试验的诱饵蛋白.将高表达V5TLE3的MCF7细胞裂解液中与GSTFOXA1C诱饵蛋白以最佳时间孵育后,成功捕捉与其已知的结合蛋白TLE3,证实实验制备的融合蛋白具有生物活性.随后再次在MCF7裂解中以GSTFOXA1C为诱饵蛋白进行GST Pull down,将产物进行SDSPAGE后考马斯亮蓝染色发现成功捕捉到相互作用的蛋白.
FoxA1是Fox转录因子家族中的一员,该转录因子属于“螺旋转角螺旋”类蛋白的一个亚群.Fox家族蛋白功能涉及胚胎发育、细胞周期调控、糖类和脂类代谢、生物老化、免疫调节等多种生物学过程, 其突变和表达异常与发育畸形、代谢性疾病以及肿瘤发生有关[11-12].已有文章得出结论FOXA1与TLE3在乳腺癌中相互作用,本文通过进行GST Pull down成功验证这一结论并证实制备的蛋白具有生物活性.
TLE基因最早在1968年被发现,现已知的家族成员共有19个[13],是典型的转录辅助抑制因子家族蛋白.在哺乳动物中,它包括TLE(transducinlike enhancer of split)1~4(人类).Gro / TLE蛋白家族不能直接与DNA结合,而是被各种不同类型的转录因子所招募[14].有研究证实转录因子FOXA1 羧基端的转录激活区可以招TLE3/GRG3结合到染色质上.本实验通过利用GSTFOXA1C与TLE3的体外相互作用验证两者相互作用.
乳腺癌现已成为人类的一大杀手,越来越多的研究证明FOXA1在乳腺癌中发挥了重要的作用,使其有望成为肿瘤治疗的新靶点[15-16].本文成功克隆了人的FOXA1,FOXA1C,FOXA1N基因并获得有活性的人FOXA1C和FOXA1N蛋白,为后续进一步寻找FOXA1的互作蛋白和制备抗体奠定了良好的基础.
参考文献
[1]KAESTNER K H, KNOCHEL W,MARTINEZ D E. Unified nomenclature for the winged helix/forkhead transcription factors[J]. Genes Dev, 2000,14(2): 142-146.
[2]HANNENHALLI S, KAESTNER K H. The evolution of fox genes and their role in development and disease[J]. Nat Rev Genet, 2009,10(4): 233-240.
[3]LAI E.HNF3A, a hepatocyteenriched transcription factor of novel structure is regulated transcriptionally[J]. Genes Dev, 1990,4(8):1427-1436.
[4]CIRILLO L A.Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA4[J]. Mol Cell, 2002,9(2): 279-289.
[5]SEKIYA T,ZARET K S.Repression by Groucho/TLE/Grg proteins: genomic site recruitment generates compacted chromatin in vitro and impairs activator binding in vivo[J]. Mol Cell, 2007,28(2): 291-303.
[6]MINOO P.Physical and functional interactions between homeodomain NKX2.1 and winged helix/forkhead FOXA1 in lung epithelial cells[J]. Mol Cell Biol, 2007,27(6): 2155-2165.
[7]GAO N.The role of hepatocyte nuclear factor3 alpha (Forkhead Box A1) and androgen receptor in transcriptional regulation of prostatic genes[J].Mol Endocrinol,2003,17(8):1484-1507.
[8]CARROLL J S.Chromosomewide mapping of estrogen receptor binding reveals longrange regulation requiring the forkhead protein FOXA1[J]. Cell, 2005:122(1): 33-43.
[9]LUPIEN M.FOXA1 translates epigenetic signatures into enhancerdriven lineagespecific transcription[J].Cell,2008,132(6):958-70.
[10]YAMAGATA K.Arginine methylation of FOXO transcription factors inhibits their phosphorylation by Akt[J].Mol Cell, 2008,32(2): 221-231.
[11]TAN Y,RAYCHAUDHURI P,COSTA R H.Chk2 mediates stabilization of the FoxM1 transcription factor to stimulate expression of DNA repair genes[J]. Mol Cell Biol, 2007,27(3):1007-1016.
[12]LEHMANN O J.Fox's in development and disease[J]. Trends Genet,2003,19(6):339-344.
[13]CHEN G,COUREY A J.Groucho/TLE family proteins and transcriptional repression[J]. Gene, 2000,249(1/2): 1-16.
[14]FISHER A L,CAUDY M.Groucho proteins: transcriptional corepressors for specific subsets of DNAbinding transcription factors in vertebrates and invertebrates[J]. Genes Dev,1998,12(13):1931-1940.
[15]CANCER Genome Atlas N. Comprehensive molecular portraits of human breast tumours[J]. Nature,2012,490(7418): 61-70.
[16]LEHMANN B D.Identification of human triplenegative breast cancer subtypes and preclinical models for selection of targeted therapies[J]. J Clin Invest,2011,121(7): 2750-2767.

