柑橘CitSERK—LIKE基因原核表达载体的构建与表达
葛晓霞
摘要:用RT-PCR扩增伏令夏橙体细胞胚发生类受体蛋白激酶(somatic embryogenesis receptor-like kinase,SERK)基因ORF区全长,克隆入载体,酶切后亚克隆入原核表达载体,并用SDS-PAGE观察CitSERK-LIKE基因的原核表达情况。结果显示,成功构建了pET-CitSERK1-like原核表达重组质粒,该重组质粒在大肠杆菌中可经IPTG诱导表达分子量约为69 ku的融合蛋白,与预测蛋白一致。
关键词:柑橘;CitSERK1-like;表达载体;构建;原核表达
中图分类号: S188;S666.01
文献标志码: A
文章编号:1002-1302(2016)04-0022-03
植物体细胞胚胎发生作为植物细胞全能性的一种表达方式,是高等植物合子胚发育早期事件中基因表达调控研究的理想模型[1]。体细胞胚发生类受体蛋白激酶(somatic embryogenesis receptor-like kinase)是在体细胞胚发生过程中发挥重要作用的一类激酶,属于LRR-RLK亚家族。Schmidt等首先从胡萝卜悬浮培养的胚性细胞中分离出第1个SERK基因,并发现它只在胚性细胞内表达且只表达到体细胞胚的球形期[2]。在其他物种中,体细胞胚发生过程与SERK基因紧密地联系在一起,相继在多个物种中克隆并鉴定了SERK基因,如鸭茅[3]、苜蓿[4-5]、水稻[6]、小麦[7]、马铃薯[8]、柑橘[9-10]、仙客来[11]、菠萝[12-13]等。
本研究在前期克隆获得柑橘体细胞胚发生类受体蛋白激酶基因CitSERK1-like的基础上[10],构建了CitSERK1-like的原核表达载体,为今后大量表达、纯化CitSERK1-like蛋白和开展相关的功能研究奠定了基础。
1 材料与方法
1.1 pMD-CitSERK1-like克隆载体的获得
根据GenBank登录的CitSERK-like基因序列 (登录号为FJ851422),设计正反向引物,FP:5′-ATGAAGACTAAGGTTTGGGCT-3′;RP:5′-TCACCTTGGACCAGATAACTC-3′。PCR 反应在 PTC-200 Thermocycler 中进行。20 μL反应体系为:0.2 μmol/L dNTP,1.5 mmol/L MgCl2,1 U Ex Taq DNA 聚合酶 (TaKaRa,Japan) ,1×buffer,正反向引物各 0.4 μmol/L,50ng模板cDNA。扩增程序为:94℃变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,33个循环;72 ℃延伸10 min,4 ℃保存。扩增产物在1.8%琼脂糖凝胶上分离后,用E.Z.N.ADNA 回收试剂盒 (Omega,USA) 回收备用。载体的连接参照TaKaRa公司的pMD18-T Vector试剂盒说明书进行,经PCR检测、测序验证pMD-CitSERK1-like重组质粒构建成功。
1.2 pET-CitSERK-like原核表达载体的构建
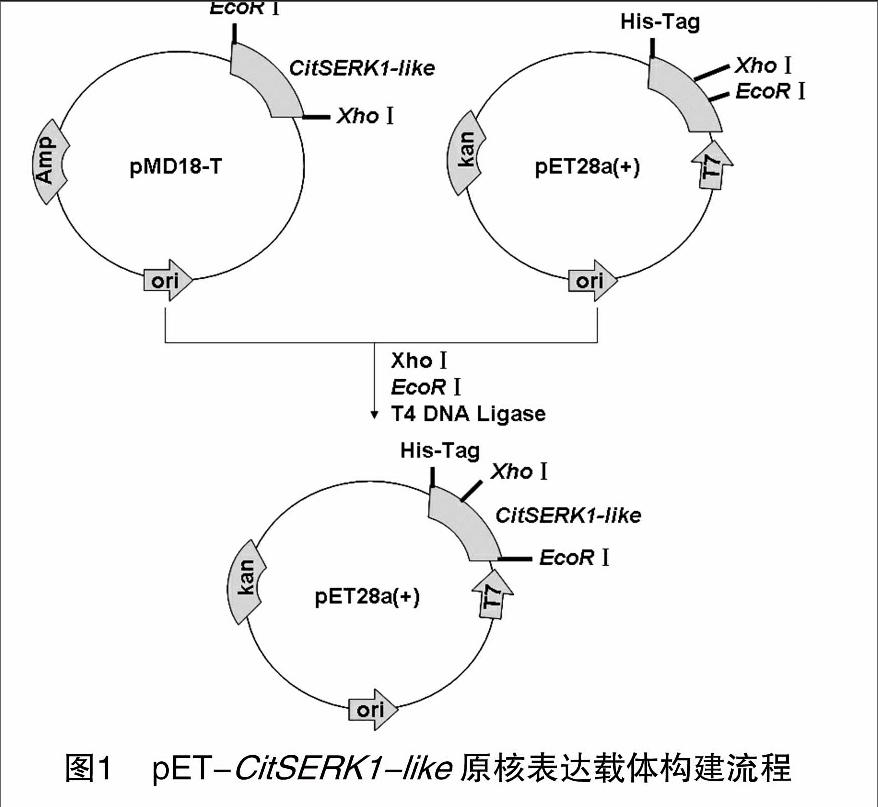
构建CitSERK1-like原核表达载体引物序列为:YHF:5′-CGGAATTCATGAAGACTAAGGTTTGGGCT-3′ (EcoRⅠ),YHR:5′-GCCTCGAGTCACCTTGGACCAGATAAC-3′ (XhoⅠ),以稀释的质粒pMD-CitSERK1-like为模板进行PCR扩增:94 ℃ 5 min;94 ℃ 30 min,55 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min。将PCR产物电泳检测回收、测序,用EcoRⅠ、XhoⅠ双酶切质粒,回收酶切片段,与经EcoRⅠ、XhoⅠ双酶切的pET-28a (+) 载体进行连接,获得重组质粒pET-CitSERK1-like,构建流程参见图1。经PCR检测、酶切、测序验证ORF正确后用于蛋白表达。
1.3 pET-CitSERK-like原核表达载体的诱导表达
将重组质粒pET-CitSERK1-like和空白载体pET-28a (+) 分别转化表达菌株E. coli BL21,挑取阳性克隆,接种于3 mL LB液体培养基 (含卡那霉素),37 ℃振荡培养过夜,按1 ∶100的比例接种于新鲜LB液体培养基中,于37 ℃振荡培养至D600 nm约为0.6~1.0时,加IPTG 1.0 mmol/L分别诱导0、1、2、3、4、5、6、7 h。其间收集菌液,4 ℃、12 000 g离心1 min,弃上清液,沉淀用100 μL SDS凝胶加样缓冲液 (Tris-HCl 50 mmol/L,pH值6.8;SDS 2%;二硫苏糖醇100 mmol/L;溴酚蓝0.1%;甘油10%) 重悬,混匀后沸水浴5 min,12 000 g 离心1 min,取20 μL上清液于12%的SDS-PAGE电泳检测。样品在浓缩胶中以40 V电压电泳,当溴酚蓝到达分离胶和浓缩胶界面时,将电压调至80 V,直至溴酚蓝接近凝胶边缘时,停止电泳,取出凝胶。切除浓缩胶,将分离胶置于考马斯亮蓝R-250染色液中染色,脱色后进行观察。
2 结果与分析
2.1 pMD-CitSERK1-like克隆载体的获得
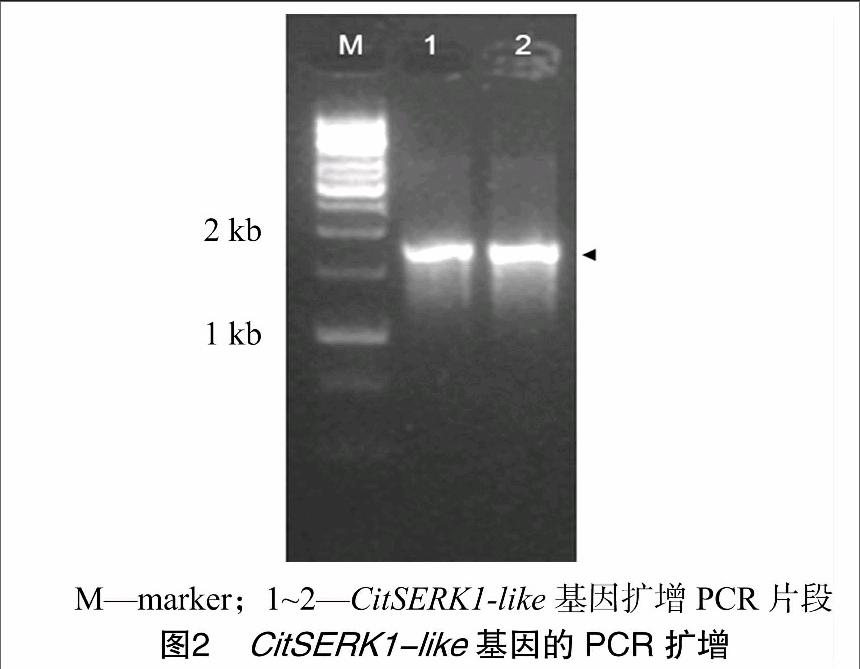
从伏令夏橙甘油诱导1个月的胚性愈伤中克隆SERK基因,随机挑取多个克隆测序,获得包含完整的SERK ORF cDNA序列的单克隆。序列分析结果表明,CitSERK1-like cDNA 序列长度为1 866 bp (图2),编码621个氨基酸,预测分子量均为69.125 ku。
2.2 pET-CitSERK-like原核表达载体构建
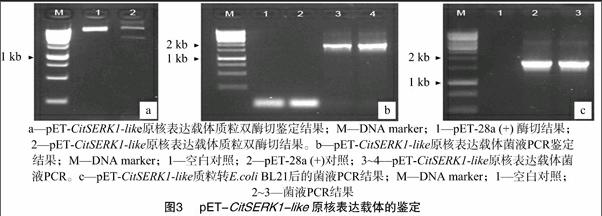
用分别带有EcoRⅠ、XhoⅠ酶切位点的1对引物扩增CitSERK-like基因的编码区全长,扩增产物在用EcoRⅠ、XhoⅠ酶切与纯化后,连接到使用同样2个酶酶切、纯化过的pET-28a (+) 载体上,构建获得原核表达载体pET-CitSERK1-like。含该表达载体的克隆经PCR检测、酶切验证,图3结果表明,PCR扩增片段、酶切片段与CitSERK-like基因编码区片段大小相同。测序确认读码框正确后,转化至大肠杆菌菌株BL21中诱导蛋白表达。
2.3 CitSERK-like基因的原核表达与SDS-PAGE分析
重组质粒pET-CitSERK1-like转入E.coli BL21后,用IPTG诱导其表达。结果表明,pET-CitSERK1-like能够表达1条约69 ku的特异蛋白 (箭头所示),与预测的含有六联组氨酸标签 (6×His Tag) 的融合蛋白的分子量大小吻合,而空白对照pET-28a (+) 质粒表达的蛋白中没有此带(图4)。
3 讨论
在高等植物中,体细胞胚发生为基因工程、细胞工程等生物技术改良品种提供了良好的试验体系[14]。体细胞胚发生类受体蛋白激酶在植物生命活动中是极其重要的一类激酶,目前,拟南芥[15]、水稻[6]、莴苣[16]等多个物种中相继获得转基因植株,证明该基因在植物体细胞胚发生过程中发挥重要作用。同时,该基因在参与植物生命活动,如植物发育[4,17]、激素信号转导[18-19]和抗逆反应[6]等方面具有非常重要的生理功能。虽然在不同物种中已分离鉴定出众多体细胞胚发生类受体蛋白激酶,但目前对其信号转导和配体识别等方面了解还并不清晰,要阐明体细胞胚类受体蛋白激酶在体胚发生过程中的作用,还需从蛋白质水平进一步研究。本研究构建了柑橘CitSERK-like基因的原核表达载体,经IPTG诱导,在大肠杆菌中成功表达了含His-tag的融合蛋白,为进一步进行蛋白纯化以及验证CitSERK1-like蛋白功能创造了条件。
参考文献:
[1]Zimmerman J L. Somatic embryogenesis:a model for early development in higher plants[J]. The Plant Cell,1993,5(10):1411-1423.
[2]Schmidt E D,Guzzo F,Toonen M A,et al. A leucine-rich repeat containing receptor-like kinase marks somatic plant cells competent to form embryos[J]. Development,1997,124(10):2049-2062.
[3]Somleva M N,Schmidt E D L,de Vries S C. Embryogenic cells in Dactylis glomerata L. (Poaceae) explants identified by cell tracking and by SERK expression[J]. Plant Cell Reports,2000,19(7):718-726.
[4]Nolan K E,Irwanto R R,Rose R J. Auxin up-regulates MtSERK1 expression in both Medicago truncatula root-forming and embryogenic cultures[J]. Plant Physiology,2003,133(1):218-230.
[5]Nolan K E,Kurdyukov S,Rose R J. Expression of the SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASE1 (SERK1) gene is associated with developmental change in the life cycle of the model legume Medicago truncatula[J]. Journal of Experimental Botany,2009,60(6):1759-1771.
[6]Hu H,Xiong L,Yang Y. Rice SERK1 gene positively regulates somatic embryogenesis of cultured cell and host defense response against fungal infection[J]. Planta,2005,222(1):107-117.
[7]Singla B,Khurana J P,Khurana P. Characterization of three somatic embryogenesis receptor kinase genes from wheat,Triticum aestivum[J]. Plant Cell Reports,2008,27(5):833-843.
[8]Sharma S K,Millam S,Hein I,et al. Cloning and molecular characterisation of a potato SERK gene transcriptionally induced during initiation of somatic embryogenesis[J]. Planta,2008,228(2):319-330.
[9]Shimada T,Hirabayashi T,Endo T,et al. Isolation and characterization of the somatic embryogenesis receptor-like kinase gene homologue (CitSERK1) from Citrus unshiu Marc.[J]. Scientia Horticulturae,2005,103(2):233-238.
[10]Ge X X,Fan G E,Chai L J,et al. Cloning,molecular characterization and expression analysis of a SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASE gene (CitSERK1-like) in Valencia sweet orange[J]. Acta Physiologiae Plantarum,2010,32(6):1197-1207.
[11]Savona M,Mattioli R,Nigro S,et al. Two SERK genes are markers of pluripotency in Cyclamen persicum Mill[J]. Journal of Experimental Botany,2012,63(1):471-488.
[12]Ma J,He Y,Hu Z,et al. Characterization and expression analysis of AcSERK2,a somatic embryogenesis and stress resistance related gene in pineapple[J]. Gene,2012,500(1):115-123.
[13]Ma J,He Y H,Wu C H,et al. Cloning and molecular characterization of a SERK gene transcriptionally induced during somatic embryogenesis in Ananas comosus cv. Shenwan[J]. Plant Molecular Biology Reporter,2012,30(1):195-203.
[14]Guo W W,Li D L,Duan Y X. Citrus transgenics:current status and prospects[J]. Transgenic Plant Journd,2007,1:202-209.
[15]Hecht V,Vielle-Calzada J P,Hartog M V,et al. The arabidopsis SOMATIC EMBRYOGENESIS RECEPTOR KINASE 1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J]. Plant Physiology,2001,127(3):803-816.
[16]Santos M O,Romano E,Vieira L S,et al. Suppression of SERK gene expression affects fungus tolerance and somatic embryogenesis in transgenic lettuce[J]. Plant Biology,2009,11(1):83-89.
[17]Albrecht C,Russinova E,Hecht V,et al. The Arabidopsis thaliana SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASES1 and 2 control male sporogenesis[J]. The Plant Cell,2005,17(12):3337-3349.
[18]Albertini E,Marconi G,Reale L,et al. SERK and APOSTART:candidate genes for apomixis in Poa pratensis[J]. Plant Physiology,2005,138(4):2185-2199.
[19]Albrecht C,Russinova E,Kemmerling B,et al. Arabidopsis SOMATIC EMBRYOGENESIS RECEPTOR KINASE proteins serve brassinosteroid-dependent and-independent signaling pathways[J]. Plant Physiology,2008,148(1):611-619.贺 容,张生珍,王 超,等. 羊种布氏杆菌3型Omp25基因序列及其表达蛋白生物信息学分析[J]. 江苏农业科学,2016,44(4):25-28.

