一株产L-苹果酸黑曲霉菌株的诱变筛选及发酵培养基优化
刘书彤,石冰冰,谭奕阳,厉成伟,魏彩霞,王德培,3,薛鲜丽,3,*
(1.天津科技大学生物工程学院,天津 300457;2.山东日照金禾博源生化有限公司,山东日照 276800;3.工业发酵微生物教育部重点实验室,天津 300457)
L-苹果酸,又名L-羟基琥珀酸,分子式C4H6O5,为白色结晶或结晶性粉末,易溶于水和乙醇[1],被广泛运用于合成材料、化妆品、饲料添加剂、食品调节剂以及药物合成等领域[2]。尤其是近年来,L-苹果酸的需求量不断上升,在全球的年需求量已经远远超过了20 万吨。利用微生物代谢发酵法生产L-苹果酸已经成为极其高效的生产方法之一,但是目前仍然存在着菌株选择性少、杂酸水平高等问题有待解决[3-4]。其中曲霉属是已知的最好的产L-苹果酸的菌株[5],Battat 等[6]使用黄曲霉菌株Aspergillus flavusKyowa A-114(ATCC 13697)在16 L 的发酵罐中连续发酵192 h 最终产量高达113 g/L,产率为0.59 g/L/h,但黄曲霉在发酵过程中容易产生黄曲霉毒素,不适合应用于食品发酵领域。除此之外,West等[7]在米曲霉AspergillusoryzaeNRRL 3488 中对菌株进行改造并优化发酵后,发酵164 h,生产苹果酸154 g/L,产率为0.94 g/L/h,这是目前已报道的发酵生产L-苹果酸速率最高的菌株。
黑曲霉(Aspergillusniger)被美国FDA 认定为GRAS(Generally Recognized as Safe)菌株[8],且作为工业生产柠檬酸、没食子酸等有机酸及淀粉酶、果胶酶、葡萄糖氧化酶等蛋白酶的优良菌株,其发酵的产品可以被广泛运用于有机肥料、有机饲料以及食品添加剂等。我国是全球柠檬酸生产最大国,2021 年全球产量240 万吨,我国为168 万吨占全球70%,其生产柠檬酸的关键在于具有高效分泌柠檬酸能力的黑曲霉菌株。张鸿飞等[9]以玉米清化液为原料,利用黑曲霉发酵60 h 生产柠檬酸,其产量可达18.33 g/100 mL,具有产酸水平高、产酸速度快、成本低等优势,其极高的碳转化率以及低pH 耐受性使其成为非常有潜力的有机酸生产的细胞工厂。目前,黑曲霉发酵生产L-苹果酸的研究还不成熟,无法进行大规模生产,因此,对黑曲霉菌株进行诱变筛选,并建立利用黑曲霉菌株发酵生产L-苹果酸的发酵体系,对L-苹果酸的工业化生产具有重要现实意义[10-11]。
本研究通过对野生型黑曲霉菌株进行诱变,筛选产L-苹果酸黑曲霉菌株,以菌球生长速度、L-苹果酸产量、残糖量等为指标探究不同培养条件对黑曲霉菌丝生长及L-苹果酸生产的影响,最终确定黑曲霉发酵生产L-苹果酸的最佳培养条件。
1 材料与方法
1.1 材料与仪器
黑曲霉菌株 由本实验室保藏的野生型菌株;黑曲霉菌株CGMCC NO.40550 本研究通过紫外诱变所得,由中国微生物菌种保藏中心保藏;无水葡萄糖、酵母粉、琼脂粉、胰蛋白胨 天津市北方天医试剂公司;硫酸铵、磷酸二氢钾、硫酸镁、氯化钙、氯化钾、七水合硫酸亚铁、五水合硫酸铜、硫酸锰、七水合硫酸锌、氯化钠、氢氧化钠、无水乙醇、甘油(以上试剂均为分析纯)北京市索来宝科技有限公司。
LRH-250A 生化培养箱 韶关市泰宏医疗器械有限公司;WXL-A30002 电子天平 北京赛多利斯仪器系统有限公司;LDZX-50FB 立式压力蒸汽灭菌器 上海申安医疗器械厂;CX23 型光学显微镜OLYMPUS 公司。
1.2 实验方法
1.2.1 培养基的配制 PDA 培养基(1 L):土豆汁、葡萄糖2%、琼脂粉2%。
初始种子培养基(1 L):葡萄糖80 g,10×微量元素100 mL,500 mL 三角瓶装液量 30 mL,115 ℃灭菌20 min。
初始发酵培养基(1 L):葡萄糖180 g,10×微量元素100 mL,CaCO38%,500 mL 三角瓶装液量50 mL,115 ℃灭菌20 min。
1.2.2 紫外诱变及正突变体的筛选方法 以黑曲霉菌株CGMCC NO.10142 为出发菌株,斜面生长6 d的新鲜孢子,无菌ddH2O 清洗并通过Miracloth 过滤收集,经小玻璃珠打散,获得孢子悬液,于30 ℃、180 r/min 下分别孵育2 h 进行吸水膨胀,采用血球计数板计数,稀释到浓度为1×107个/mL。取100 μL孵育后孢子悬液于诱变小皿中进行紫外照射10 min,稀释涂布于初筛培养基平板,进行正突变体的筛选[12-13]。
正突变体的筛选通过平板透明圈法,在PDA 培养基中加入CaCO3,黑曲霉分泌的苹果酸与平板中CaCO3反应从而分解CaCO3形成透明圈[14-16]。同时通过添加放线菌酮的平板进行菌株形态差异筛选,放线菌酮作为一种蛋白合成抑制剂,对霉菌的生长产生一定抑制作用,可以有效提高菌落之间的形态差异[17-18]。取紫外诱变筛选到的正突变体在PDA 斜面上生长6 天的新鲜孢子,用无菌ddH2O 清洗,并通过Miracloth 过滤收集,经小玻璃珠打散,获得孢子悬液,稀释到浓度为1×108个/mL,取100 μL 孢悬液于含有10 μg/mL 放线菌酮的PDA+CaCO3初筛培养基中诱变培养24 h,使用基于菌落形态的筛选策略,最终筛选出了一株L-苹果酸产量最高的菌株。
1.2.3 种子培养基的优化
1.2.3.1 转速对黑曲霉菌球形态的影响 正突变体菌株斜面生长6 d 的新鲜孢子,无菌ddH2O 清洗并通过Miracloth 过滤收集,经小玻璃珠打散,获得孢子悬液,接种到种子培养基中。种子培养过程中转速分别设置300、250、220、180 r/min,种子接种量为1×106个/mL,培养温度37 ℃,种子培养基30 mL,分别培养至48 h 和72 h,菌球形态在40 倍光学显微镜下进行。
1.2.3.2 种子培养基pH 选择 以初始种子培养基为基础,微量元素以及糖浓度相同的情况下,探究初始pH 对黑曲霉孢子萌发及发酵生产L-苹果酸的影响。调整种子培养基pH 分别为3.0、3.7、5.0、6.0,接种量为1×106个/mL,250 r/min,37 ℃,摇床培养24 h。接着补加60 mL 发酵培养基,220 r/min,37 ℃,摇床培养48、72、96 h。每组做三个平行试验,以最终菌丝球形态、菌球数及L-苹果酸产量为参考值,确定种子培养基的最终pH。
1.2.3.3 种子培养基碳源浓度选择 调整初始种子培养基的糖浓度,探究初始糖浓度对黑曲霉发酵生产L-苹果酸的影响。在种子培养基中分别添加60、80、100、120 g/L 的葡萄糖,考察不同碳氮比对L-苹果酸产量的影响。每组做三个平行,以最终菌丝球形态、菌球数及L-苹果酸产量为参考值,确定种子培养基的最终葡萄糖浓度。
1.2.3.4 种子培养基氮源种类选择 调整初始种子培养基的氮源,探究初始氮源种类对黑曲霉发酵生产L-苹果酸的影响。为了保证氮含量相同,在种子培养基中分别添加硫酸铵4.59 g/L、氯化铵3.7 g/L、黄豆饼粉2.97 g/L、酵母浸粉9.9 g/L、蛋白胨6.9 g/L作为有机氮源和无机氮源,分别加入种子培养基中。每组做三个平行试验,以最终菌丝球形态、菌球数及L-苹果酸产量为参考值,确定种子培养基的最佳氮源。
1.2.4 发酵培养基成分选择
1.2.4.1 发酵培养基碳源浓度选择 优化后的种子培养基220 r/min,37 ℃,摇床培养24 h 后,向培养基中补加发酵培养基,发酵培养基与种子培养基体积比为2:1。其中葡萄糖含量分别为140、160、180 g/L,220 r/min,37 ℃,摇床培养72 h,考察发酵培养基中不同糖浓度对L-苹果酸产量的影响,每组做三个平行,测定最后的L-苹果酸产量、菌球数及残糖量,确定发酵培养基的最佳糖浓度。
1.2.4.2 发酵培养基金属离子种类选择 对发酵培养基中金属元素 Mg2+、Cu2+、Zn2+、Mn2+、Fe2+、Fe3+对L-苹果酸合成影响进行试验。菌株在优化后的种子培养基,220 r/min,37 ℃,摇床培养24 h,向培养基中补加发酵培养基。将MgSO4、CuSO4、ZnSO4、MnSO4、Fe2(SO4)3、FeSO4分别以0.05 g/L 添加至发酵培养基中,继续摇床培养72 h。每组做三个平行,测定最后的L-苹果酸产量、菌球数及残糖量,确定发酵培养基的最适金属离子。
1.2.4.3 发酵培养基金属离子浓度选择 将最适金属离子以0.004、0.006、0.010、0.012 g/L 添加至发酵培养基中,220 r/min,37 ℃,摇床培养72 h,考察金属离子浓度对L-苹果酸产量的影响。每组做三个平行,测定最后的L-苹果酸产量、菌球数及残糖量,确定发酵培养基的最适金属离子浓度。
1.2.5 测定指标
1.2.5.1 菌球数的测定 发酵过程中生物量以菌球数多少计算。将发酵液均匀后稀释100 倍,吸取菌球制片,用显微镜进行镜检观察;将发酵液混匀后,稀释100 倍,涡旋混匀,使菌球均匀悬浮后取0.1 mL至载玻片上进行菌球计数,每组计数3 次作为平行。
1.2.5.2 还原糖的测定 还原糖浓度选择DNS 法进行测定[19]。取2 mL 发酵液置于8000 r/min 离心15 min,取上清液稀释120 倍后,向比色管中分别加入发酵液、蒸馏水和DNS 试剂,配制成反应液,煮沸5 min 后,加蒸馏水定容至25 mL。用分光光度计测试540 nm 下的吸光值,根据标准曲线,计算葡萄糖浓度。
1.2.6 L-苹果酸浓度测定
1.2.6.1 发酵液的处理 取发酵液2 mL,8000 r/min离心15 min,取0.1 mL 上清与1.9 mL 的10 mmol/L硫酸溶液进行混合,涡旋混匀;离心过的发酵液弃上清,补加10 mmol/L 硫酸到2 mL 重悬,混匀后静置15 min,重复2~3 次后用10 mmol/L 硫酸溶液将其稀释20 倍。用0.22 μm 的滤膜过滤至液相小瓶,进行HPLC(High Performance Liquid Chromatography)分析。
1.2.6.2 L-苹果酸HPLC 的定量分析 选用HPLC的方法对L-苹果酸定量分析。样品用10 mmol/L 硫酸溶液进行酸化处理,用0.22 μm 的滤膜过滤至液相小瓶,进行HPLC 分析[20]。
检测条件:色谱仪型号Waterse2695,检测器Waters2996;进样量10 μL;流速0.6 mL/min;流动相5 mmol/L 硫酸溶液。
1.2.6.3 标准曲线的建立 利用HPLC 建立L-苹果酸、富马酸、琥珀酸不同浓度的标准曲线,分别配制0.025、0.05、0.1、0.25、0.5、1 g/L 的L-苹果酸标准溶液与琥珀酸标准溶液,2.5、5、10、12.5、25、50、75 mg/L 的富马酸标准溶液进行HPLC 分析,并绘制标准曲线。
1.2.6.4 L-苹果酸浓度计算 发酵液酸化并进行HPLC 分析后,记录L-苹果酸的峰面积为y,代入标曲中计算得出L-苹果酸浓度x。其中标准曲线y=814.31x+20.755,R2=0.9974:
式(1)中:L-苹果酸终浓度以g/L 计。
1.2.6.5 L-苹果酸发酵强度及糖酸转化率分析 以发酵产物的L-苹果酸生产速率来衡量发酵强度,计算公式为:
式(2)中:L-苹果酸终浓度以g/L 计,发酵时间以h 计。
Xi 等[21]认为当葡萄糖完全通过乙醛酸循环途径代谢生产L-苹果酸时,1 mol 葡萄糖转化为1 mol L-苹果酸,反应式如下:
此时糖酸转化率即被利用的葡萄糖的物质的量与发酵产生的L-苹果酸的物质的量之比,是衡量发酵效率的重要指标。
1.3 数据处理
所有实验均有三个平行,显示的所有数据点均代表从三个平行实验中获得的平均值,误差线表示标准偏差,所有实验重复三个独立的重复。数据采用SPSS 20.0 软件进行分析,使用ANOVA 进行方差分析,使用LSD 进行差异性检验,数据结果以“平均值±标准误”表示,P<0.05 表示差异显著,P<0.01 表示差异极显著[22]。依据相应的计算公式,利用Origin 2021 绘制图片,并进行相应的数据分析。
2 结果与分析
2.1 菌株的诱变及筛选结果
紫外诱变后筛选到的正突变体经过传代,孢子悬液点种到加有10 μg/mL 放线菌酮初筛平板上,进行产酸透明圈分析。如图1a 所示,以出发菌株作为对照菌株,对照菌株无透明圈形成,所得到的正突变体菌株能形成明显的透明圈,即为黑曲霉菌株CGMCC NO.40550。待菌株在平板上生长至第4 d,取平板上形成的产酸透明圈1 cm2,溶解于10 mmol/L H2SO4中酸化进行过夜处理,后取上清过膜除菌,用于HPLC 产酸分析。结果如图1b 所示,L-苹果酸和富马酸标准品分别在9.45 min 和14.26 min 出现峰,参照标准品HPLC 结果,对照菌株并无L-苹果酸的峰,而正突变体菌株所形成的透明圈含有富马酸的最大峰,其次是L-苹果酸的峰以及其他有机酸较小的峰。为分析其L-苹果酸的百分比含量,分别制备L-苹果酸、琥珀酸和富马酸的标准曲线(图1c),从结果中可以看出,其浓度跟峰面积呈现很好的线性关系,其中琥珀酸标准曲线为y=583.09x+0.55819(R2=0.9983),L-苹果酸标准曲线为y=814.31x+20.755(R2=0.9974),富马酸标准曲线为y=100.31x+37.83(R2=0.9993)。由标准曲线分析可得,虽然富马酸峰面积最大,但相应的浓度很低。此标准曲线用于本研究中L-苹果酸、琥珀酸和富马酸的定量分析。
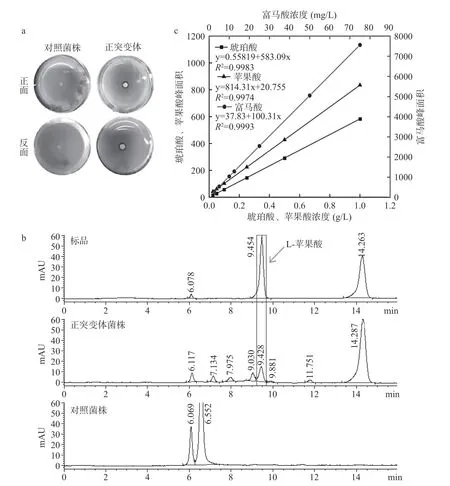
图1 菌株的平板筛选及产酸透明圈HPLC 分析Fig.1 Plate screening and HPLC analysis of acid transparent ring of the strain
2.2 种子培养基成分优化
2.2.1 种子培养基pH 条件优化 种子培养基的不同pH 对黑曲霉L-苹果酸发酵、菌丝球形态以及发酵残糖量具有显著的影响,结果如图2 所示。在pH为5.0、6.0 时发酵24 h,种子培养基中菌球形态明显变大,与之相反,在pH 为3.0、3.7 时发酵24 h 发现,菌球体积较小,属于正常形态(图2a);在种子培养基pH 为3.7 时发酵48~96 h 菌球数最多达到9.8×104个/mL,其次是pH3.0 时菌球数为9.2×104个/mL,而pH6.0 时其菌球数最少,发酵96 h,仅有6.8×104个/mL(图2b)。种子培养基pH 为3.7 时,发酵48、72、96 h 时L-苹果酸的产量均为最高,分别为2.52、4.35、5.28 g/L(图2c),同时其葡萄糖利用率上升(图2d),菌株将葡萄糖分解利用发酵产酸。发酵48 h 时pH3.0 与3.7、pH5.0 与6.0,二者之间的产酸水平相当,但随着发酵时间延长,它们之间的产酸水平形成显著差异,发酵96 h 时pH3.0、pH5.0 和6.0 相应的L-苹果酸的产量依次为4.85、3.23 和3.15 g/L。结果可知,当种子培养基的pH 过高时,菌球生长会受到很大影响,pH 为6.0 时,种子培养基中菌丝球大而少,可见过高的pH 并不利于菌丝球的形成。同时,过大的菌丝球会对其L-苹果酸的生产造成不利影响,降低L-苹果酸的产量。最终确定种子发酵液初始pH 为3.7。
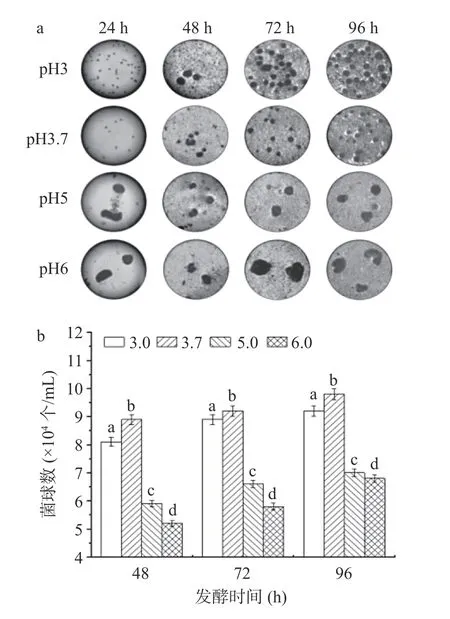
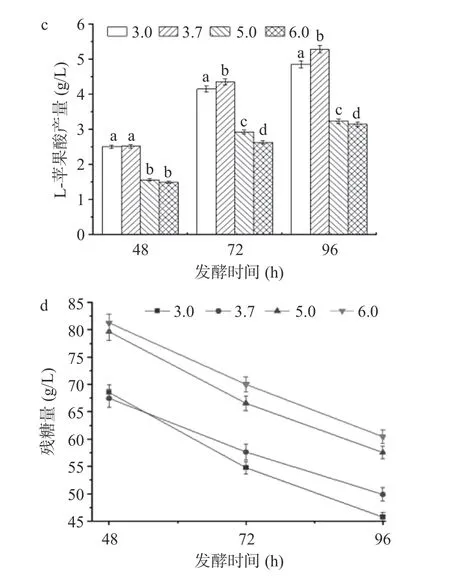
图2 初始pH 对发酵生产L-苹果酸的影响Fig.2 Effects of initial pH on bacterial growth,bacterial volume,L-malic acid production and glucose consumption at different time
2.2.2 种子培养基不同碳源浓度优化 摇瓶发酵结果如图3 所示,以葡萄糖为碳源,其浓度为60 g/L时L-苹果酸产量最高,浓度为80 g/L 时L-苹果酸产量最低,如图3 所示,当种子培养基中葡萄糖浓度为60 g/L 时,其L-苹果酸产量最高为5.01 g/L,依次是糖浓度为80、100、120 g/L 时L-苹果酸产量的1.67、1.36、1.07 倍,差异显著(P<0.05);其中,菌球数在葡萄糖浓度为60 g/L 时最多,达到9.6×104个/mL,分别是葡萄糖浓度为80、100、120 g/L 时菌球数的1.01、0.97、0.91 倍(图3),差异显著(P<0.05)。Hirsch等[23]和Meng 等[24]指出,高浓度的葡萄糖有利于菌丝极化生长,碳源限制导致真菌提前老化,使得菌丝体生长速度变快,加速了其老化,致使其生长状态不佳。故确定种子培养基中葡萄糖浓度为60 g/L 时为最佳初始糖浓度。
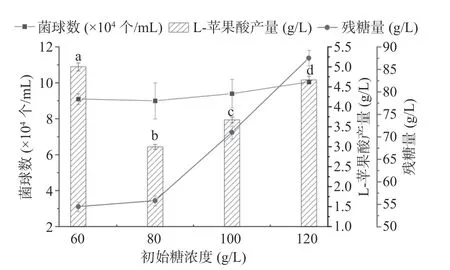
图3 初始碳源浓度对黑曲霉孢子萌发及生产L-苹果酸的影响Fig.3 Effect of initial carbon source concentration on the germination of Aspergillus niger spores and the production of L-malic acid
2.2.3 种子培养基氮源种类优化 种子培养基氮源种类优化结果如图4 所示,它们的菌球数在9.1×104~9.3×104个/mL 范围内,无显著差异性(P>0.05)。以硫酸铵和酵母粉为氮源时,L-苹果酸产量均高于其它氮源。5 种氮源对于L-苹果酸产量的影响先后顺序为硫酸铵>酵母粉>氯化铵>蛋白胨>黄豆饼粉,酵母粉次之,其菌体量较高,但其产酸水平差,L-苹果酸产量为5.22 g/L,推测酵母粉更有利于菌体生长,但不利于其次级代谢;当利用黄豆饼粉作为氮源时,菌体量最低,L-苹果酸产量最低,为3.01 g/L,推测黄豆饼粉不利于菌体生长与L-苹果酸生产,这可能与其分子结构复杂、被利用速度缓慢有关。添加硫酸铵时L-苹果酸产量最高可达9.14 g/L,且残糖量相对较少。Ni 等[25]和Xu 等[26]认为,硫酸铵作为无机氮源,可直接被分解利用,促进菌体生长,且考虑到无机氮源成分简单、利用率高等优点,故确定种子培养基中氮源为硫酸铵时为最适氮源。

图4 初始氮源种类对黑曲霉孢子萌发及生产L-苹果酸的影响Fig.4 Effect of initial nitrogen source concentration on the germination of Aspergillus niger spores and the production of L-malic acid
2.3 发酵培养基优化
2.3.1 发酵转速对黑曲霉菌球形态的影响 黑曲霉是否能形成正常菌球直接关系其发酵产酸的能力,因此本研究探索了不同摇床转速对黑曲霉菌球形成的影响。分别在不同发酵阶段取样在40 倍显微镜下进行镜检观察,结果如图1d 所示,当转速高于250 r/min 时,无法形成规则的菌球,且菌丝较长易发生断裂。转速在180~220 r/min 时,能形成正常的菌球,且转速在220 r/min 时,则能形成实心菌球,菌球形态均匀、大小达到最佳状态(图5)。

图5 不同发酵转速对菌球的影响Fig.5 Effects of different fermentation speeds on bacterial balls
2.3.2 发酵培养基碳源浓度优化 摇瓶发酵结果如图6 所示,发酵培养基葡萄糖浓度为140、160 和180 g/L 时,菌球数在9.85×104~10.1×104个/mL 范围内,无显著差异性(P>0.05)。当发酵培养基中葡萄糖浓度为180 g/L 时,其L-苹果酸产量最高,为12.35 g/L,分别是糖浓度为140、160 g/L 时L-苹果酸产量的1.17、1.04 倍,差异显著(P<0.05);当葡萄糖浓度为180 g/L 时残糖量分别是葡萄糖浓度为140、160 g/L 时L-苹果酸产量的1.25、1.17 倍,差异显著(P<0.05)。考虑到较高的残糖量有利于延长发酵时间后菌体产酸利用,故确定发酵培养基中葡萄糖浓度为180 g/L 时为最佳糖浓度。在优化发酵培养基的过程中发现,发酵培养基中糖浓度对菌体生长并没有较大的影响,提高糖浓度后菌体量并未大幅度改变,由此推测菌体主要在种子培养基中萌发和生长代谢,补加发酵培养基后主要进行产酸代谢。
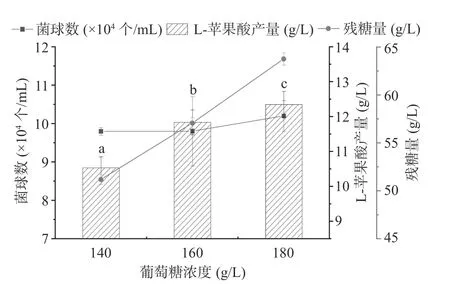
图6 发酵培养基糖浓度对黑曲霉生产L-苹果酸的影响Fig.6 Effect of fermentation medium sugar concentration on the production of L-malic acid by Aspergillus niger
2.3.3 发酵培养添加不同金属离子种类优化 发酵结果由图7 所示,在发酵培养基中添加Cu2+、Zn2+、Mn2+、Mg2+、Fe2+、Fe3+6 种金属离子,对其L-苹果酸产量与菌球数均有较大影响。比较HPLC 检测结果发现,L-苹果酸的产量差异较大(图7a),添加Cu2+离子后,L-苹果酸的产量提高到了13.42g/L,远高于Zn2+、Mn2+离子,分别提高了6.4、2.87 倍,差异显著(P<0.05);添加Mg2+、Fe2+、Fe3+离子后L-苹果酸的产量略有降低,分别为10.02、9.51、8.38 g/L,差异显著(P<0.05)。再对比其菌体量变化发现,添加Zn2+、Mn2+后菌体量变低,添加Cu2+离子后菌球数与L-苹果酸产量均有提高(图7b),推测适量Cu2+离子在该黑曲霉萌发与发酵生产L-苹果酸的代谢途径中起到了激活某种酶的作用,加速了葡萄糖向L-苹果酸的代谢,故而随着其浓度的升高,L-苹果酸产量升高、残糖量下降。
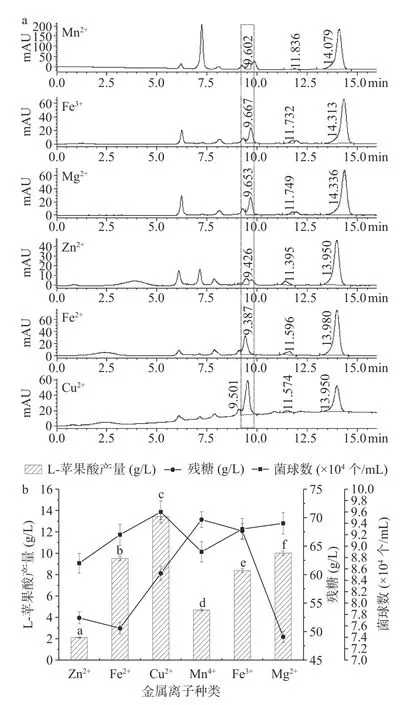
图7 发酵培养基中金属离子种类对黑曲霉发酵生产L-苹果酸的影响Fig.7 Effect of metal ion types in fermentation medium on the production of L-malic acid by Aspergillus niger fermentation
2.3.4 发酵培养基添加金属离子浓度的优化试验摇瓶发酵结果如图8 所示,数据表明,菌球数基本无差异,推测Cu2+离子浓度在0.004~0.012 g/L 范围内对菌球的生长无明显影响;Cu2+离子浓度为0.012 g/L时L-苹果酸的产酸量最高,为14.32 g/L,较浓度为0.004、0.006、0.010 g/L 时提高了1.55、1.47、1.2 倍,差异显著(P<0.05)。同时葡萄糖被分解利用,随着离子浓度升高,其残糖量呈下降趋势。
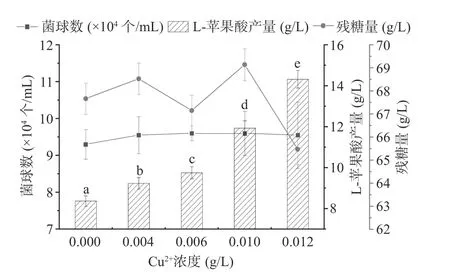
图8 发酵培养基中Cu2+离子浓度对黑曲霉发酵生产L-苹果酸的影响Fig.8 Effect of Cu2+ ion concentration in fermentation medium on the production of L-malic acid by Aspergillus niger fermentation
2.4 优化前后发酵条件和效果比较
对比未优化时的发酵情况(表1),对培养基进行优化后的菌株产酸水平大大提高,发酵72 h 后L-苹果酸的产量较优化前L-苹果酸的产量提高了3.04倍,发酵96 h 后L-苹果酸的产量较优化前L-苹果酸的产量提高了3.44 倍,差异极显著(P<0.01)。在初步优化种子培养基及发酵培养基后,菌球对葡萄糖的利用率更高,达到了13%,较优化前提高了4.3 倍,同时其发酵强度也大大提高,较优化前提高了3 倍左右,可见初步优化培养基对该菌株的发酵生产L-苹果酸起到了很好的作用。

表1 培养基优化前后发酵产酸及其参数分析Table 1 Acid production and parameter analysis of fermentation medium optimized and non-optimized
3 讨论与结论
近年来,微生物发酵产生代谢物的研究越来越多,由于培养基的条件会影响微生物的生长与代谢产物的积累,因此对于发酵培养条件的优化成为了研究的热点。在微生物的发酵实验中,单因素实验可以最直接、有效地反应各个因素对于菌株影响,广泛应用于发酵条件的优化和菌株的特性考察[27-28]。
黑曲霉种子培养基碳源浓度优化时,随着葡萄糖浓度的升高,其L-苹果酸的产量反而下降。说明在高浓度初糖条件下,种子培养会发生“葡萄糖效应”[29],可能产生大量乙酸,从而抑制菌体生长,导致L-苹果酸产量水平降低,故而在进行种子培养时,不宜加入过高的葡萄糖,浓度为60 g/L 时较为适宜;该过程中,硫酸铵为无机氮源,菌体可直接将其分解为氨,更容易被利用,使其快速生长,促使菌体提前进入次级代谢,使L-苹果酸产量达到更高水平。
在发酵培养的过程中,菌体进入次级代谢,开始大量分解并利用葡萄糖,故而葡萄糖的添加量需要较高水平;同时金属离子添加必不可少,分析得出,不同金属离子对菌体的生长萌发和发酵生产有不同的作用[30],例如在发酵培养基中通过添加还原性的金属如亚铁离子可以提高产量,可能与其降低了氧化胁迫效应相关;锰的含量对生物的种群数量以及产物的产量均有较大影响,主要是通过提高丙酮酸羧化酶、丙酮酸激酶、糖代谢过程中部分关键调控中的酶活性以及一些作用于核苷酸的酶的活性[31];镁离子的添加能够激活、提高许多重要酶,如己糖磷酸化酶、柠檬酸脱氢酶、羧化酶的活性,从而影响基质的氧化过程,还可以提高一些菌种对自身所产抗生素的耐受能力[32]。但由于Cu2+离子为重金属离子,Schmitt 等[33]指出Cu2+过量添加处理会抑制黑曲霉的生长和呼吸速率,但Cu2+过量添加处理会抑制黑曲霉的生长和呼吸速率,其超过特定的阈值浓度可直接或间接地影响微生物的生长、代谢和群落组成,故而目前尚未有研究指出其最适添加量。
通过分析总体产酸情况发现,主要副产物为富马酸、琥珀酸,推测该菌株在该发酵条件下主要通过乙醛酸循环途径进行产酸,可通过在乙醛酸循环上对菌株进行改造,加速代谢流向[34],以达到更高的产酸水平。同时,后续可尝试摸索最为合适的Cu2+的最适添加量。已报道的研究中,周洁等[10]利用米曲霉在30 L 发酵罐中发酵生产L-苹果酸时,其96 h 的产酸量为65 g/L,将发酵时间延长至132 h,产酸量可达到105 g/L;吴悦等[35]利用寄生曲霉进行发酵生产L-苹果酸的时间延长至192 h,其产量由23 g/L提高至55 g/L,因此可尝试在后期补料并发酵时间延长至144~216 h,以提高L-苹果酸的产量。
本研究对黑曲霉野生型菌株进行紫外诱变和高浓度放线菌酮迭代筛选,得到菌株CGMCC NO.40550。确定种子培养基中最适葡萄糖浓度为60 g/L、最适氮源为(NH4)2SO44.95 g/L;发酵培养基成分最适葡萄糖和(NH4)2SO4浓度分别为180 和4.95 g/L,CuSO4·5H2O 为其生产L-苹果酸最佳微量元素。总之,经过多次单因素实验的优化发酵培养条件,显著提高了目标菌株的L-苹果酸产量。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

