人参醇溶蛋白提取工艺优化、结构表征及体外抗氧化活性分析
郭 浩,白雪媛,陈 宇,宋文博,刘 那,王思明
(长春中医药大学东北亚中医药研究院,吉林长春 130117)
人参(PanaxginsengC.A.Mey)为五加科植物人参的根及根茎,属于多年生宿根草本植物,是我国传统名贵中药材,被誉为“百草之王”。《神农本草经》记载其具有“补五脏、安精神、定魂魄、止惊悸、除邪气、明目、开心益智、久服延年益寿”等功效[1-3]。人参具有多种活性成分,主要包括人参皂苷类、多糖类、蛋白质类物质,具有抗衰老、抗肿瘤、降血脂[4]、体外抗阿尔兹海默病[5-6]、缓解疲劳[7]、调节免疫功能[8]等多种药理作用,具有着重要的药用价值[9-10]。
人参蛋白是人参有效组分之一,现阶段对人参蛋白的研究主要集中于人参中水溶性蛋白,目前提取人参蛋白的方法主要有硫酸铵沉淀法、有机试剂沉淀法、膜过滤法[11]等,并且已被证明其具有抗氧化、增强免疫、神经保护等药理活性[12]。有研究表明包括木瓜,苦杏仁,白芸豆等中药材在内的多种植物醇溶蛋白目前均已进入较深层次研究,包括提取工艺、结构表征、相关活性等[13-15],而人参醇溶蛋白却鲜有相关文献报道。
因此本文优化了人参醇溶蛋白的最佳提取工艺并对其进行结构表征,探讨了人参醇溶蛋白的体外抗氧化活性研究。为人参蛋白包括人参醇溶蛋白的进一步研究奠定理论基础,对中药材人参在食品、药物开发等方面都具有重要意义。
1 材料与方法
1.1 材料与仪器
人参药材 吉林省抚松县万良镇提供,长春中医药大学药学院王哲副教授鉴定为植物人参(Panax ginsengC.A.Mey)的干燥根茎;无水乙醇 分析纯,天津新通精细化工有限公司;氯化钠、硫酸亚铁 北京化工厂;水杨酸 天津市光复精细化工研究所;过氧化氢 天津新通精细化工有限公司;DPPH、羟基自由基试剂盒、Tris-Tricine-SDS-PAGE 凝胶制备试剂盒 北京索莱宝科技有限公司;BeyoBlueTM考马斯亮蓝超快染色液 上海碧云天生物技术有限公司。
GS-05 粉碎机 北京锟捷玉诚机械设备有限公司;Lynx 6000 离心机 美国Thermo Fisher 公司;S220-K-CN 标准型pH 计、AB135-S 电子天平、ALC-2100-2 电子天平 梅特勒-托利多仪器有限公司;Alpha 3-4 Lscbasic 冷冻干燥仪 美国Labconco公司;超低温冰箱(-80 ℃)SanyoThermo 公司;涡旋混合震荡器 北京大龙仪器有限公司;Infinite 200 Pro 多功能酶标仪 瑞士Tecan 公司;Micro Mhemi 4.2凝胶成像仪 以色列DNR 公司。
1.2 实验方法
1.2.1 人参醇溶蛋白提取、盐析工艺及溶剂的选择分别称取25 g 人参粉,选择无水乙醇,90%,80%,70%,60%,50%乙醇,回流2 h 提取,7000 r/min,25 ℃离心10 min,采用宋丹等[16]的盐析法并修改,对人参醇溶性蛋白进行盐析,取上清按1:1 料液比,与1% NaCl 混合,4 ℃,盐析24 h,7000 r/min,25 ℃离心10 min,弃上清,沉淀冻干后备用。精密天平称取适量人参醇溶性蛋白冻干粉,用相应提取溶剂配制成1 mg/mL 人参蛋白溶液,取等量2×蛋白上样Buffer,混匀后沸水5 min,使蛋白变性后按顺序于Tris-Tricine-SDS-PAGE 凝胶制备试剂盒说明书配制好的凝胶中上样。按BeyoBlueTM考马斯亮蓝超快染色液说明书染色并脱色后于凝胶成像仪中成像。
1.2.2 单因素实验
1.2.2.1 不同提取时间对人参醇溶蛋白得率的影响在提取料液比1:10,提取溶剂为90%乙醇,pH=7条件下进行试验,研究提取时间0.5、1、1.5、2、2.5、3 h 对人参醇溶蛋白得率的影响,待提取完成,按1.2.1 方法盐析蛋白,冻干后计算得率。人参醇溶蛋白得率(%)=人参醇溶蛋冻干粉质量/提取该人参醇溶蛋白粉所用人参质量。
1.2.2.2 不同料液比对人参醇溶蛋白得率的影响在提取时间为2 h,提取溶剂为90%乙醇,pH=7 条件下进行试验,探讨不同提取料液比1:5、1:10、1:15、1:20、1:25 g/mL 对人参醇溶蛋白得率的影响,提取结束后,按1.2.1 方法盐析蛋白,冻干后计算得率。
1.2.2.3 不同pH 对人参醇溶蛋白得率的影响 在提取时间为2 h,提取溶剂为90%乙醇,料液比1:10(g/mL)的条件下进行试验,探讨当pH 分别为1、3、5、7、9 条件时对人参醇溶蛋白得率的影响。按1.2.1 方法盐析蛋白,并在冻干后计算得率。
1.2.3 响应面设计试验 采用Design Expert10.0.3软件进行三因素三水平的Box-Behnken 试验设计[17],根据单因素实验的结果,以提取时间(A)、提取料液比(B)、提取pH(C)为自变量,对人参醇溶蛋白的提取进行工艺优化,表1 为试验因素水平表。

表1 响应面试验的因素与水平Table 1 Factors and levels of response surface experiment
1.2.4 紫外光谱扫描 取适量人参醇溶蛋白样品溶于pH7.0 的90%乙醇中,使人参醇溶蛋白溶液的最终浓度为2 mg/mL。根据Qian 等[18]的方法,使用UV-2550 型紫外可见分光光度计进行扫描,扫描范围为200~600 nm,扫描速度为60 nm/min。
1.2.5 傅立叶变换红外吸收光谱(FTIR)检测 将人参醇溶蛋白冻干粉与干燥的溴化钾1:50 研磨混匀后,在专门的压片机上压制薄片,用Vertex70 型红外光谱仪在400~4000 cm-1范围内扫描[19]。
1.2.6 氨基酸组成成分分析
1.2.6.1 供试品处理 取一定量的人参醇溶蛋白样品,转移至水解管中,加入1 mL、6 mol/L 的盐酸,充入氮气约5 min,密封后放置于Block Heater 干式加热器模块中,110 ℃水解反应24 h。反应完毕后,将游离氨基酸溶液转移至1.5 mL EP 管中,抽真空浓缩至干。
1.2.6.2 混合氨基酸标准品衍生化的处理 取25 µL混合氨基酸标准品溶液,加入12.5 µL 1 mol/L 三乙胺涡旋混合震荡,之后加入12.5 µL、0.1 mol/L 异硫氰酸苯酯(PITC)涡旋混合震荡室温静置1 h,加入100 µL 正己烷剧烈混合震荡后静置10 min,取下层溶液20 µL,加入180 µL 流动相A 溶液,混合后0.22 µm 过滤处理待测试。
1.2.6.3 样品溶液衍生化处理 取适量流动相A 液复溶已冻干样品游离氨基酸,取25 µL 样品氨基酸溶液,加入12.5 µL 1 moL/L 三乙胺涡旋混合震荡,加入12.5 µL 0.1 mol/L 异硫氰酸苯酯(PITC)涡旋混合震荡室温静置1 h,100 µL 正己烷剧烈混合震荡后静置10 min,取下层溶液20 µL 与180 µL 流动相A 溶液混合后0.22 µm 过滤处理等待测试。
1.2.6.4 高效液相色谱条件 A 液为0.05 mol/L 乙酸钠水溶液,B 液为甲醇-乙腈-水溶液(甲醇:乙腈:水)=20:60:20(V:V:V)。流速为:1.0 mL/min;柱温:35 ℃;色谱柱为Aglient AdvanceBio columns洗脱条件见表2。
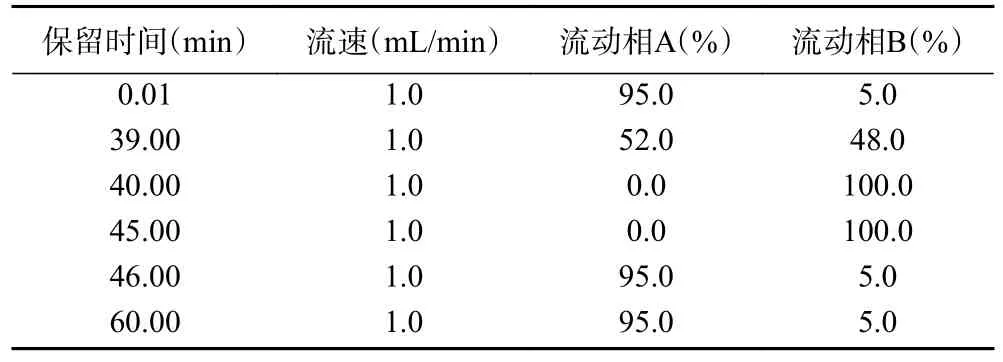
表2 高效液相色谱洗脱条件Table 2 High performance liquid chromatography separation gradients
1.2.7 扫描电子显微镜(SEM)将冻干后人参醇溶蛋白样品均匀撒在贴有导电胶的硅片上,用洗耳球吹掉多余的样品,离子溅射仪进行90 s 喷金处理处理,后放入扫描电子显微镜在5 kV 加速电压下观察100、500、1000 倍三个倍数下拍摄人参醇溶蛋白成像。
1.2.8 人参醇溶蛋白体外抗氧化试验
1.2.8.1 DPPH 自由基清除能力 采用文献[20]方法并进行修改,设计不同pH 条件下人参醇溶蛋白体外抗氧化活性。参考文献[21]报道,取适量人参醇溶蛋白冻干粉,90%乙醇溶解配成1 g/100 mL 的人参醇溶蛋白溶液后调pH=1、3、5、7、9 并取50 µL不同pH样品溶液与200 µL 0.004% DPPH 溶液(无水甲醇溶解)混合反应,在37 ℃下避光反应1 h,12000 r/min离心5 min,于517 nm 波长处测定吸光度A1;用无水甲醇代替DPPH 溶液,测定吸光度A2;用蒸馏水代替样品溶液,测定吸光度A0,计算DPPH 自由基清除率,公式为:清除率(%)=[1-(A1-A2)/A0]×100。
1.2.8.2 羟基自由基清除能力 参考文献[22-23]报道,将50 µL 不同pH 样品溶液与100 µL、9 mmol/L 硫酸亚铁,100 µL、9 mmol/L 水杨酸(无水乙醇溶解)混合,加入100 µL 过氧化氢(8.8 mmol/L),在25 ℃下反应30 min,12000 r/min 离心5 min,于510 nm 波长处测定吸光度A1;用蒸馏水代替过氧化氢,测定吸光度A2;用蒸馏水代替样品溶液,测定吸光度A0,计算羟基自由基清除率,公式为:清除率(%)=[1-(A1-A2)/A0]×100。
1.2.8.3 铁离子还原能力 参考文献[24]报道,将1.0 mL 不同pH 样品溶液与1.0 mL 1%铁氰化钾溶液混合,在50 ℃下反应20 min,冷却至室温后,加1.0 mL 10%三氯乙酸,5000 r/min 离心15 min,取2.5 mL 上清液与0.15 mL 0.1%氯化铁混合,于700 nm 波长处测定吸光度。
1.3 数据处理
每个样品重复测定3 次,取平均值,采用SPSS Statistics 17.0 软件进行方差分析和显著性分析,P<0.05 表示具有显著性差异,使用Graph Pad prism 8.0.2 和Design-Expert 10.0.3 进行数据处理和分析。
2 结果与分析
2.1 人参醇溶蛋白提取溶剂的选择
如图1 所示,人参醇溶蛋白在不同提取溶剂提取条件下,在SDS-PAGE 电泳后呈现出不同分子量蛋白条带,50%、60%、70%、80%体积分数乙醇溶液提取结果猜测可能是因为提取溶剂水分的占比过大,将人参中即溶于水同时又溶于乙醇的两性蛋白提取出来,为了将提取的人参醇溶蛋白进行简单纯化并得到只溶于醇的蛋白,且90%体积分数乙醇溶液与无水乙醇提取所呈现蛋白条带相近,因此本试验选用90%乙醇作为人参醇溶蛋白的提取溶剂。
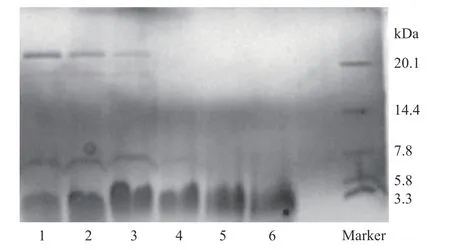
图1 不同提取溶剂提取人参醇溶蛋白的SDS-SPEAG电泳图Fig.1 SDS-SPEAG electrophoresis patterns of ginsenoside soluble proteins extracted with different extraction solvents
2.2 单因素实验结果
2.2.1 提取时间对人参醇溶蛋白得率的影响 提取时间对人参醇溶蛋白得率的影响如图2 所示,由图2 可知,随提取时间的延长,人参醇溶蛋白的得率逐渐升高,当提取时间为2 h 时,得率达到最高,可能是因为人参醇溶蛋白与提取液溶解不够充分所致。继续增加提取时间,人参醇溶蛋白的得率下降,这可能是因为随着提取时间的增加,蛋白变性所导致[25]。经过统计分析,发现提取时间对人参醇溶蛋白得率的影响存在显著性差异(P<0.05),因此选取提取时间1.5、2 和2.5 h 作为进一步响应面试验优化的条件。
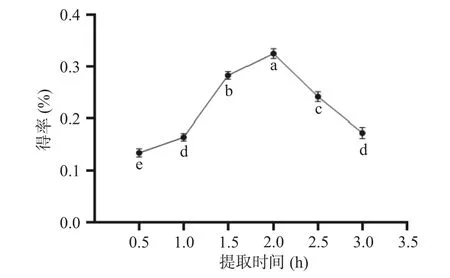
图2 提取时间对人参醇溶蛋白得率的影响Fig.2 Effect of extraction time on the yield of ginseng alcoholsoluble protein
2.2.2 提取料液比对人参醇溶蛋白得率的影响 提取料液比对人参醇溶蛋白得率的影响如图3 所示,由图3 可知,提取料液比1:5~1:10(g/mL)时,人参醇溶蛋白的得率上升,当提取料液比为1:10(g/mL)时,人参醇溶蛋白的得率达到最高,因为随料液比的增加,更多蛋白与提取液充分接触,利于蛋白溶出,提高人参醇溶蛋白得率[26]。当料液比增加至1:25(g/mL)时,人参醇溶蛋白得率下降,可能是随着提取溶剂的增多,人参醇溶蛋白与蛋白水解酶充分接触,部分人参醇溶蛋白被蛋白水解酶水解所致。因为人参醇溶蛋白的得率在料液比1:10 时提取效果最好,继续增加料液比也没有对人参醇溶蛋白得率有显著提高。经过统计分析,发现料液比的变化对人参醇溶蛋白得率有显著性影响(P<0.05),因此选取料液比1:5、1:10 和1:15(g/mL)作为进一步响应面试验优化的条件。
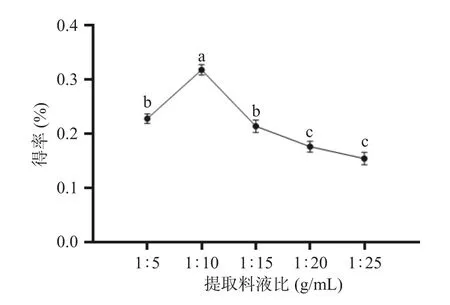
图3 提取料液比对人参醇溶蛋白得率的影响Fig.3 Influence of extraction material-liquid ratio on the yield of ginseng alcohol-soluble protein
2.2.3 提取pH 对得率的影响 提取pH 对人参醇溶蛋白得率的影响如图4 所示,由图4 可知,在pH7 之前,蛋白质提取率随pH 的增加而增加,人参醇溶蛋白的得率在pH7 时升至最高,随后开始下降,这可能与人参醇溶蛋白的等电点相关。经统计分析,发现提取pH 对人参醇溶蛋白得率有显著性影响(P<0.05),因此选取pH5、7、9 作为进一步响应面试验优化的条件。
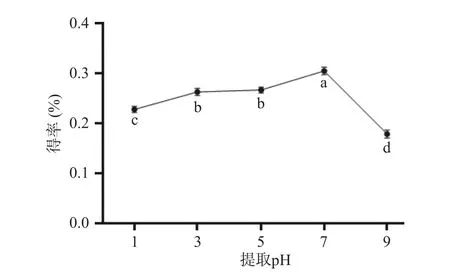
图4 提取pH 对人参醇溶蛋白得率的影响Fig.4 Effect of extraction pH on the yield of ginseng alcoholsoluble protein
2.3 响应面试验结果
2.3.1 响应面试验设计与结果 在Box-Behnken 试验设计原理基础上,设计了三因素三水平的响应面分析试验。根据设计出的试验方案中的不同试验条件进行试验,每组平行做三次,得到的设计方案及结果如表3 所示。
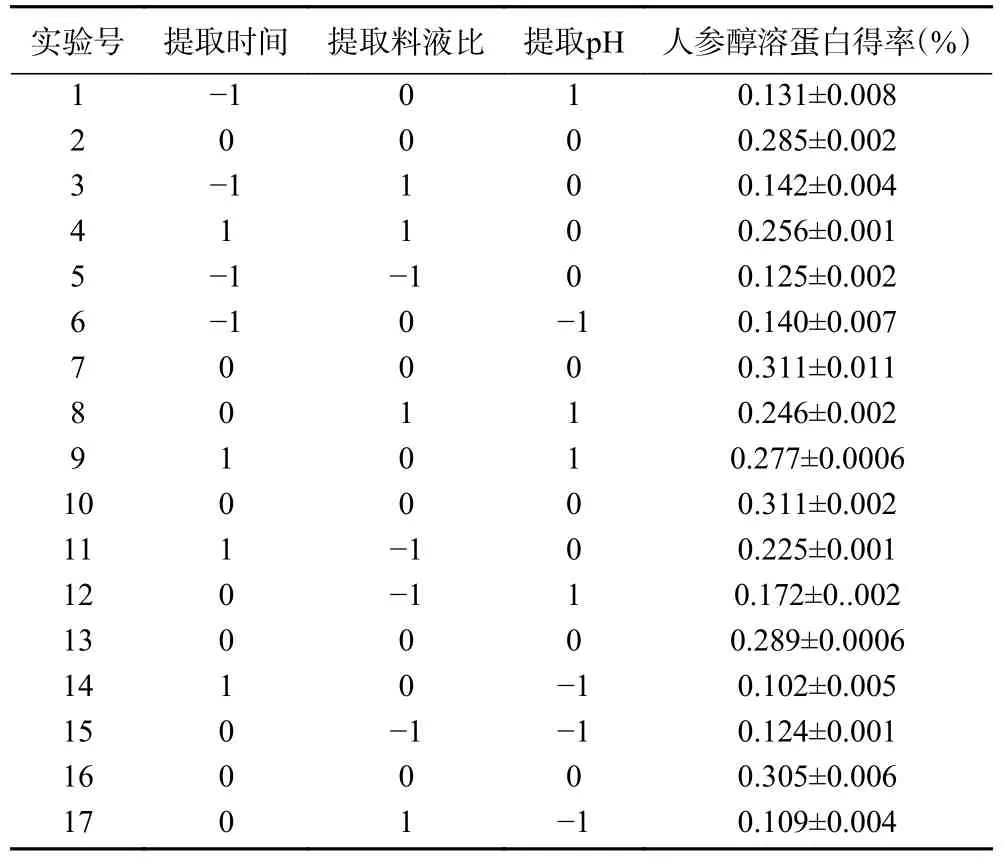
表3 响应面试验BBD 设计与结果Table 3 Response surface test BBD design and results
2.3.2 回归模型的建立及分析 运用Design-Expert 10.0.3 软件,对表3 进行拟合,以人参醇溶蛋白得率作为响应值,得到的二次多项回归方程为:Y=0.30+0.04A+0.013B+0.044C+0.0035AB+0.046AC+0.022BC-0.057A2-0.056B2-0.081C2。响应面分析结果见表4。
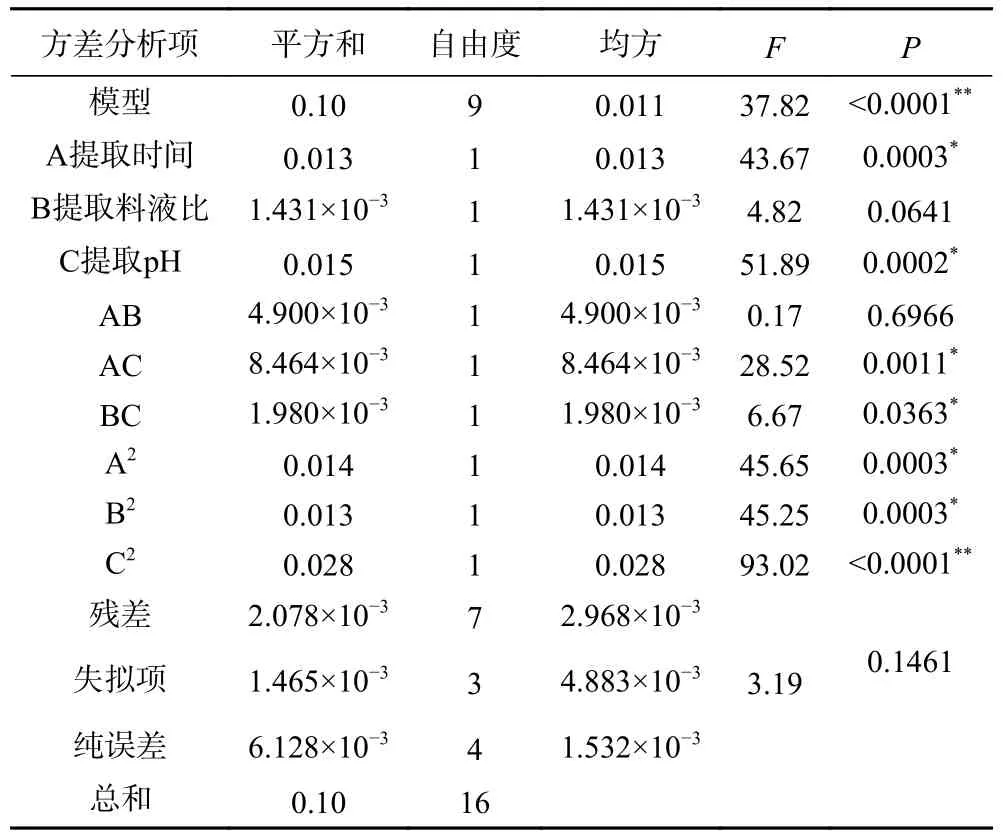
表4 响应面试验方差分析Table 4 Response surface experimental ANOVA
从表5 可以看出,二次项C2对人参醇溶蛋白得率影响极显著,一次项A、C,交互项AC、BC,二次项A2、B2对人参醇溶蛋白得率影响显著,一次项B,交互项AB 对人参醇溶蛋白得率影响不显著,得影响人参醇溶蛋白得率的顺序为提取pH(C)>提取时间(A)>提取料液比(B)。建立的回归模型中P<0.0001,表明回归模型的达到了极显著水平(P<0.01);而失拟项的P为0.1461>0.05,其模型差异不显著,说明模型具有较好的试验稳定性,表明该方程可靠。本研究拟合度为0.9798,反映了本研究的正确性和准确性;R2Adj=0.9539,表示本研究所设计的试验模型可以用来说明95.39%的试验数据,变异系数CV=8.25%,变异系数比较低,表示该模型具有较高的可信度和精确度;此次试验信噪比为14.395>4,表明在精密度试验中该模型精密度良好。综上所述,该模型能较好地反映响应值的变化。
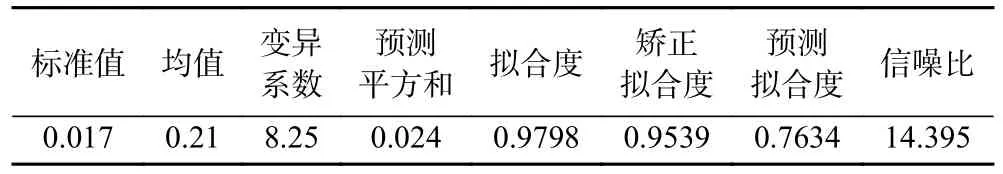
表5 回归模型方差分析Table 5 Regression model analysis of variance
2.3.3 各因素间的交互作用 根据回归方程分析结果,利用DesignExpert 8.0.6 软件进行拟合,做响应面曲面图,进一步直观地确认三因素两两交互作用对蛋白得率的影响[27-28]。
对提取时间(A)、提取料液比(B)、提取pH(C)进行两两交互分析,做不同因素间响应面图见图5~图7。曲面越陡,等高线越密集,则影响越显著,等高线越接近椭圆,两个因素的交互作用越强。
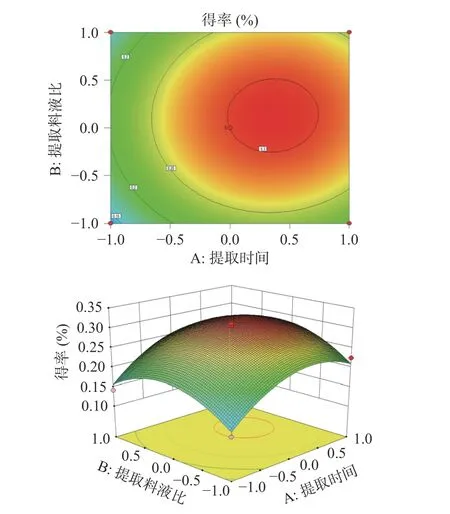
图5 提取时间和提取料液比对人参醇溶蛋白得率的交互影响Fig.5 Interaction effect of extraction time and extraction stock ratio on the yield of ginseng alcohol-soluble protein
由图5 所示,响应面坡度平缓,等高线稀疏,说明提取时间提取料液比的交互作用对人参醇溶蛋白得率的影响较小。
由图6 所示,在固定提取料液比、提取时间的情况下,人参醇溶蛋白得率随着提取pH 的增加先上升后降低;在固定提取料液比、提取pH 的情况下,人参醇溶蛋白得率随着提取时间的增加先上升后降低。响应面坡度陡峭,等高线接近于椭圆形,说明提取时间和提取 pH 的交互作用对人参醇溶蛋白得率的影响显著。
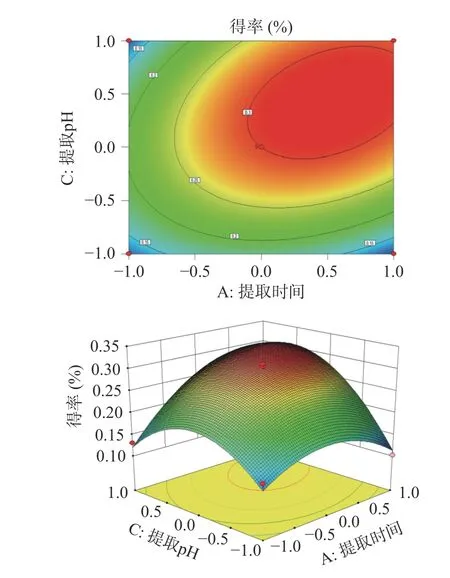
图6 提取时间和提取pH 对人参醇溶蛋白得率的交互影响Fig.6 Interactive effects of extraction time and extraction pH on the yield of ginseng alcohol-soluble protein
由图7 所示,在固定提取时间、提取pH 的情况下,随着提取料液比的增加,人参醇溶蛋白得率呈现升高后降低变化趋势;在固定提取时间、提取料液比的情况下,随着提取时间的增加,人参醇溶蛋白得率呈现升高后降低变化趋势。响应面坡度陡峭,等高线密集,说明提取pH 和提取料液比的交互作用对人参醇溶蛋白得率影响显著。
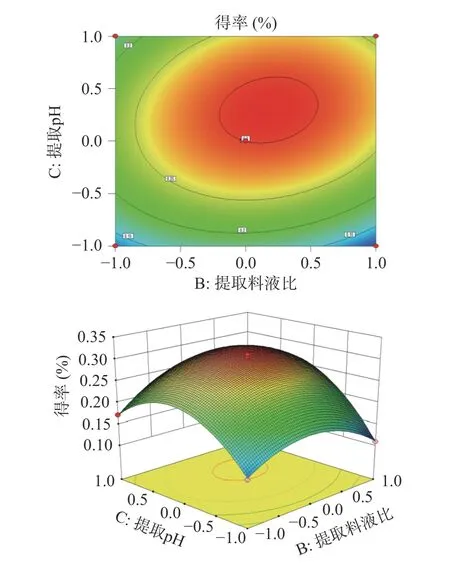
图7 提取料液比和提取pH 对人参醇溶蛋白得率的交互影响Fig.7 Interactive effects of extraction stock ratio and extraction pH on the yield of ginseng alcohol-soluble protein
2.3.4 最佳工艺验证性试验 通过Design Expert 10.0.3 软件预测得到人参醇溶蛋白最佳提取工艺条件为提取时间为2.30 h,提取料液比为1:11.45 g/mL,提取pH7.78 是最优的工艺参数。该方法可以使蛋白得率达到0.322%。结合实际操作条件,将人参醇溶蛋白提取工艺调整为提取时间2 h、提取料液比1:10 g/mL、提取pH7。在此试验的基础上,进行三次工艺验证试验,得到人参醇溶蛋白的提取率为0.319%±0.001%,与预期的预测的0.322%相近,表明该数学模型的优化范围达到了预期目的,且具有可靠性和和重现性。通过该试验模型可以有效的获得更多的人参醇溶蛋白[29]。
2.4 人参醇溶蛋白紫外分析
如图8 所示,经过紫外最大波长扫描,发现人参醇溶蛋白最大紫外吸收波长为224 nm。在280 nm附近也有微弱的吸收峰,说明人参醇溶蛋白含有一定量的酪氨酸[30]。
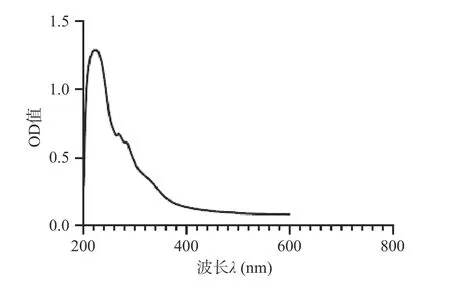
图8 人参醇溶蛋白紫外全波长扫描Fig.8 UV full wavelength scan of ginseng alcohol soluble protein
2.5 傅立叶变换红外吸收光谱(FTIR)检测结果
如图9 所示,人参醇溶蛋白在4000~400 cm-1有很多吸收峰,波数3347 cm-1处出现的宽峰是HO 键伸缩振动引起的典型吸收峰,2923 cm-1出现的峰是由-CH2-反对称伸缩振产生的,1652 cm-1处的吸收峰是由蛋白质酰胺I 带特征基团R-CO-NH2中-C=O-伸缩振动产生的,1516 cm-1处吸收峰是蛋白质伯胺基团中的-NH 面内弯曲振动产生的,1378 cm-1处的吸收峰由蛋白质中游离的COO-对称伸缩振动产生的,1238 cm-1处的吸收峰可能由-C(CH3)3中的C-C 反对称伸缩振动产生的,后面出现的721、575、523 cm-1可能是由-OH 的存在而引起的[31-33]。
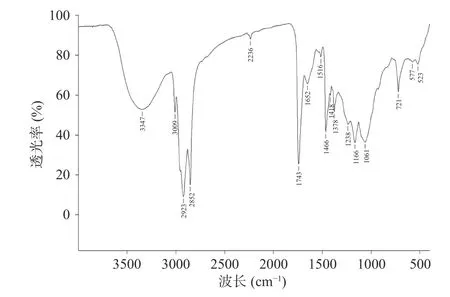
图9 人参醇溶蛋白红外光谱图Fig.9 Infrared spectrum of ginseng alcohol-soluble protein
2.6 氨基酸组成成分分析
2.6.1 氨基酸组成混合标准品及样品液相分析 氨基酸混合标准品经PITC 衍生化处理后,经高效液相色谱分析,得到的原始数据经过Empower 积分标峰,所得的标峰图谱和数据处理积分列表见图10。
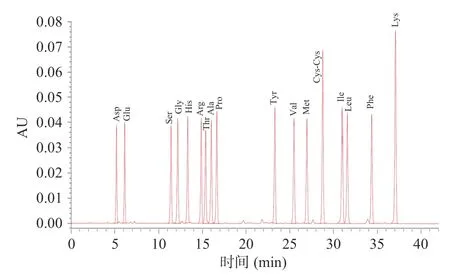
图10 氨基酸标准品液相色谱图Fig.10 Liquid chromatogram of amino acid standards
供试品水解后的游离氨基酸样品经PITC 衍生化处理后,经高效液相色谱分析,得到的原始数据经过Empower 积分标峰,所得的标峰图谱和数据处理积分列表见图11。
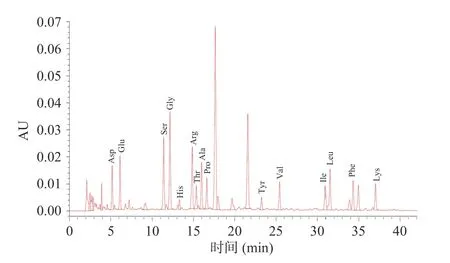
图11 醇溶蛋白氨基酸组成液相色谱图Fig.11 Liquid chromatogram of amino acid composition of alcohol-soluble protein
人参醇溶蛋白的氨基酸的组成成分如表6 所示,其中人参醇溶蛋白氨基酸总量占82.3%,人体必需氨基酸含量占26.46%,药用氨基酸含量占30.51%。人参醇溶蛋白中同时属于人体必需氨基酸和药用氨基酸的LYS、ILE 以及PHE 在促进人体生长发育,增强机体免疫力以及抗病毒等方面有较强功效[34]。这些结果表明,人参醇溶蛋白中所含人体必需氨基酸以及药用氨基酸占比较高,在生物医学以及食品工业方面有较强的开发价值。
2.7 人参醇溶蛋白的扫描电镜分析
如图12 所示,不同倍数扫描电镜下人参醇溶性蛋白结构完整,表面稀疏,具有少数孔隙,蛋白质颗粒呈蜂窝聚集状态,具有稳定有序的网状结构,表面有不规则的脊形凸起,该电镜结果与疏水性蛋白结构一致[35]。

图12 人参醇溶蛋白1000、500、100 倍数下扫描电镜图Fig.12 Scanning electron microscope images of ginseng gliadin at 1000,500 and 100 times
2.8 人参醇溶蛋白不同pH 下体外抗氧化活性能力
2.8.1 不同pH 人参醇溶蛋白对DPPH 自由基的清除能力 图13 显示,在人参醇溶蛋白pH 为1~7 范围内,人参醇溶蛋白对DPPH 基自由基的清除率先下降后上升,当pH=1 时DPPH 基自由基的清除率高达96%,时当pH=5 时清除率最低为21%,而后随着pH 的升高,人参醇溶蛋白对DPPH 自由基的清除率又逐渐升高。与弱碱性条件(pH=9)相比,在较强酸性条件下(pH=1),高静电荷引起的分子内电荷排斥力导致蛋白质分子的肿胀与展开,暴露其疏水基团,从而促进其抗氧化活性[36]。
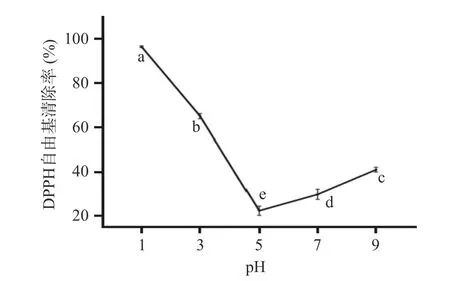
图13 不同pH 人参醇溶蛋白对DPPH 自由基的清除能力Fig.13 Scavenging ability of DPPH free radicals by ginseng alcohol-soluble protein at different pH
2.8.2 羟基自由基清除能力 图14 可以看出,在人参醇溶蛋白pH 为1~7 范围内,人参醇溶蛋白对羟基自由基的清除率逐渐下降,当pH 大于5 时,清除率又逐渐缓慢上升,但变化不显著。当pH=1 时人参醇溶蛋白对羟基自由基的清除率最大,达到79%。这可能是因为随着pH 的增加,人参醇溶蛋白的空间构像发生了改变,产生了不同的抗氧化活性。
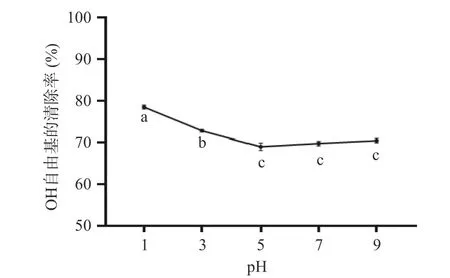
图14 不同pH 人参醇溶蛋白对OH 自由基的清除能力Fig.14 Scavenging ability of OH radicals by ginseng alcoholsoluble protein at different pH
2.8.3 不同pH 人参醇溶蛋白对铁离子的还原能力图15 显示,在人参醇溶蛋白pH 为1~7 范围内,人参醇溶蛋白铁离子的还原能力先迅速下降后逐步上升,当pH 为1 时还原作用最强,高达0.86,当pH大于5 时,换还原力逐渐增加,这可能是碱性pH 使疏水性氨基酸残基增多,提高了人参醇溶蛋白对铁离子的还原力[37]。
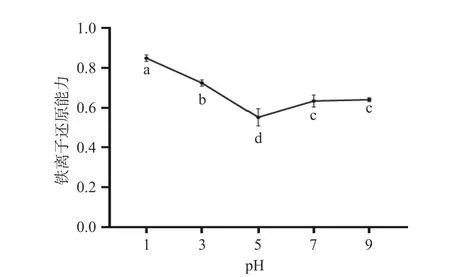
图15 不同pH 人参醇溶蛋白对铁离子的还原能力Fig.15 Reduction ability of ginseng alcohol-soluble protein to iron ions at different pH
3 结论
本研究确定人参中醇溶蛋白最佳提取工艺为,提取时间2 h、料液比1:10 g/mL、提取pH7,此工艺下蛋白得率为0.319%。该蛋白分子量约为3.3 kDa,与疏水性蛋白的表面结构特征一致,氨基酸总量为82.3%。当pH=1 时,其对DPPH 自由基的清除率为96%,对羟基自由基的清除率为79%,对铁离子的还原能力为0.86,本文可为人参醇溶蛋白的开发利用提供数据支持与科学依据,但其发挥抗氧化活性的具体机制尚不明确,需通过体内实验进行深入研究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

