铁皮石斛中性多糖的分离纯化及抗炎作用
林晓亮,谢玲娜,陈梦香,梁 明,梁逸恒,杜志云,*
(1.无限极(中国)有限公司,广东广州 510623;2.广东工业大学生物医药学院,广东广州 510006)
铁皮石斛(DendrobiumofficinaleKimura et Migo)是一种稀有的多年生草本植物,是兰科的第二大属[1]。它的地理分布广泛,包括印度、澳大利亚、美国和日本,在中国广泛分布,主要分布于安徽、浙江和福建等地[2-3]。其茎入药,味甘,性微寒,具有生津养胃,滋阴清热,润肺益肾等功效。现代医学研究表明铁皮石斛具有广泛的药理作用,包括抗癌,抗血管生成,抗炎,抗氧化,抗糖尿病,免疫增强,保肝,抗真菌,抗菌,抗病毒等[4-5]。研究表明,铁皮石斛的主要生物活性化合物是具有保湿、抗氧化、抗衰老和增强免疫作用的铁皮石斛多糖[6-8]。
炎症是一种由感染、组织压力、组织损害或者细胞应激引起的人体自动防御反应[9-10]。正常情况下炎症能消除有害刺激,启动愈合过程并恢复受伤组织的正常功能,对机体有益;但是过度炎症会破坏正常组织的稳态,例如过度炎症引起的炎症因子风暴会造成多器官衰竭,严重时甚至会造成死亡[11]。因此,抑制失调或者过度的炎症对人类的身体健康十分重要。巨噬细胞是先天性免疫和细胞免疫中的重要组成部分,具有吞噬、呈递抗原和分泌细胞因子等重要作用[12-13]。巨噬细胞能参与炎症过程中炎症反应的诱发、维持和消退[12]。脂多糖(Lipopolysaccharide,LPS),又称内毒素(Endotoxin),由类脂A、核心多糖和0-抗原重复序列组成,能够诱导炎症[14]。LPS 诱导巨噬细胞炎症是由细胞膜上的Toll 样受体4(tolllike receptor 4,TLR4)介导的,细胞膜上的TLR4 识别LPS 后,巨噬细胞被激活,并导致一系列的细胞因子和其他炎症因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)和IL-6 等的过度表达[15]。据报道,75%醇沉的铁皮石斛多糖能促进RAW 264.7 细胞的M2极化,显著降低TNF-α、IL-6 和NO 的释放水平,但蔡海兰等和黄杰等[16-17]的研究报道的铁皮石斛纯多糖对RAW 264.7 细胞具有激活作用,能促进TNFα的分泌,这可能与铁皮石斛原料的产地、多糖的分子量与结构相关。童微等[18]的研究发现,分子质量为960 kDa 的铁皮石斛多糖能显著增强RAW 264.7细胞的免疫活性,不同化学修饰对其免疫活性的影响不同。但以上研究未对铁皮石斛多糖进行进一步的结构解析和构效关系研究。
因此,本文对分离得到的铁皮石斛多糖进行结构解析,以巨噬细胞RAW 264.7 为研究对象,探究铁皮石斛分子量、结构与抗炎功效之间的关系,为开发铁皮石斛在抗炎功效上的应用提供依据。
1 材料与方法
1.1 材料与仪器
铁皮石斛原料(昆植1 号)产地为中国云南;小鼠腹腔巨噬细胞RAW 264.7 购于上海ATCC细胞库;DMEM(dulbecco's modified eagle medium)培养基、胎牛血清、青霉素-链霉素双抗 美国Gibco 公司;脂多糖(lipopolysaccharide,LPS)、葡萄糖、半乳糖、阿拉伯糖、木糖、鼠李糖、果糖、甘露糖、肌醇标准品 美国Sigma 公司;氯仿、正丁醇、氢氧化钠、浓硫酸、苯酚、吡啶 天津市大茂化学试剂厂;IL-4 酶联免疫试剂盒(96T)、TNF-α酶联免疫试剂盒(96T)江苏酶免实业有限公司。
RE-2000A 旋转蒸发仪 上海亚索生化仪器厂;ML204T/02 电子分析天平 梅特勒-托利多(中国);H1650 离心机 湖南湘仪离心机仪器有限公司;Sigma Alpha1-2LD 真空冷冻干燥机 美国Sigma公司;ICS-5000 型离子色谱分析系、Dionex Carbo-PacTMPA10 离子交换柱、Aglient 1200 型高效液相色谱仪、CO2培养箱 美国Thermo 公司;UV-3200 紫外-可见分光光度计 岛津企业管理(中国)有限公司;Sunrise 型多功能酶标仪 奥地利Tecan公司。
1.2 实验方法
1.2.1 铁皮石斛多糖的提取与纯化
1.2.1.1 铁皮石斛粗多糖的制备 通过水提醇沉法提取铁皮石斛多糖,称取一定量的晒干铁皮石斛原料,使用加热水提法制备石斛粗多糖,实验条件为:提取料液比1:20、提取温度100 ℃、提取时间1 h、提取次数2 次,最终得到提取液4 L。按照1:4(去离子水:95%乙醇)的比例加入乙醇溶液,醇沉过滤,40 ℃恒温干燥过夜,获得干燥的石斛粗多糖。
1.2.1.2 铁皮石斛纯化多糖的制备 称取铁皮石斛粗多糖1.0 g,溶于30 mL 纯水中,使用DEAE-25 纤维素交换层析柱进行分离。将石斛多糖溶液加入到层析柱中,用纯水洗脱层析柱,控制流速1 mL/min,每120 s 收集1 管洗脱液。在收集终点附近,取样少量的洗脱液,用苯酚硫酸法鉴定收集终点。对洗脱液进行选择性合并,获得不同的铁皮石斛多糖组分,收集获得的石斛多糖溶液浓缩后过Sephadex G-100葡萄糖凝胶柱,控制流速约0.1 mL/min,每管收集1 mL 洗脱液,溶液内多糖含量为0 时证明已到达收集终点。检测已收集的40 管的洗脱液中的多糖含量,并使用酶标仪在波长为490 nm 处检测吸光度,得到洗脱液中多糖的含量情况,并以此数据绘制多糖含量变化色谱图,根据色谱图中多糖物质的洗脱的先后顺序,判断多糖组分的分离效果。对主要出峰部分的洗脱液进行合并,冻干后获得了多糖组分DOP-1。
1.2.1.3 多糖的纯度鉴定 将多糖DOP-1 溶于蒸馏水配制成浓度为1 mg/mL 的溶液,用蒸馏水作参比,在波长范围为190~400 nm 处对其进行紫外光谱扫描。
1.2.2 铁皮石斛多糖的结构鉴定
1.2.2.1 DOP-1 的糖含量测定 利用苯酚硫酸法[19-20]测定样品中的总糖含量,将多糖DOP-1 溶于蒸馏水配制成浓度为0.1 mg/mL 的溶液,吸取1.0 mL,然后分别加入0.5 mL 的6%的苯酚溶液和l mL 的浓硫酸,涡旋充分混合,30 ℃水浴20 min,室温冷却,在490 nm 下测定吸光度。
采用DNS 法[21]测定样品中的还原糖含量,将多糖DOP-1 溶于蒸馏水配制成浓度为0.1 mg/mL 的溶液,吸取1.0 mL,然后分别加入2 mL DNS 溶液,加热15 min,室温冷却,在540 nm 下测定吸光度。
1.2.2.2 铁皮石斛多糖的单糖组成分析 参考于小芳[22]的实验方法,配制浓度为10.0 μg/mL 的各单糖(阿拉伯糖、鼠李糖、木糖、果糖、甘露糖、半乳糖和葡萄糖)标准溶液,然后再配制成5.0 μg/mL 的混合标准溶液。从混合标准溶液中分别取出5、1、0.5、0.1、0.05 mL 溶液,并在每个样品中加入10 μg肌醇作为内标,然后用氮吹仪吹干。标准溶液及石斛多糖在100 ℃下用2 mol/L TFA 被水解6 h。移除过量的TFA 后,用0.3 mL TriSil 试剂(吡啶:六甲基二硅胺烷:三甲基氯硅烷=10:2:1(V:V:V))对多糖水解产物进行硅醚化,反应条件是80 ℃水浴加热1 h,反应完成后用氮气吹干,1 mL 正己烷定容,取0.5 μL 进行气相色谱法分析。气相色谱条件为:色谱柱DB-17(30 m×0.32 mm×0.5 m);检测器为氢火焰离子化检测器;检测器温度280 ℃;柱温190 ℃;进样口温度280 ℃;载气N2;流速1 mL/min。
1.2.2.3 铁皮石斛多糖的分子量测定 基于侯重文等[23]采用高效液相凝胶色谱仪分析多糖的均一性和平均分子量的实验方法,仪器配制了Ultrahydrogel 250 柱子(7.8×300 mm),流动相为0.1 mol/L NaNO3,柱温为30 ℃,流速为0.6 mL/min,进样量为20 μL。将不同分子量的葡聚糖标准品(Mw=70、130、175、300、256 和580 kDa)分别配制成5 mg/mL 溶液,由小分子到大分子依次进样,记录各标准品相应的保留时间,以保留时间为横坐标,以分子量的对数为纵坐标绘制标准曲线,根据标准曲线计算分离获得的多糖的平均分子量。
1.2.2.4 铁皮石斛多糖的红外光谱分析 将KBr 与干燥的多糖样品充分研磨混合后压制成薄片,然后于400~4000 cm-1波长范围进行红外扫描分析[24]。
1.2.2.5 铁皮石斛多糖的核磁分析 将样品溶解在0.55 mL 的D2O 中并用D2O 交换两次。1H NMR,13C NMR 光谱在Bruker 光谱仪上以298 K 的探针温度记录并在400 MHz 下操作。
1.2.3 铁皮石斛多糖DOP-1 的抗炎活性
1.2.3.1 细胞培养 小鼠腹腔巨噬细胞RAW 264.7细胞复苏,使用含有10%胎牛血清和1%青霉素-链霉素的DMEM 培养基,在含有5%二氧化碳的37 ℃恒温培养箱中培养。
1.2.3.2 DOP-1 对细胞增殖的影响 将RAW 264.7细胞以1×103个/mL 的密度接种于96 孔板中,在含有5%二氧化碳的37 ℃恒温培养箱中培养24 h后,弃去上清液,每孔加入含各浓度(1000、500、250、125、25、5 μg/mL)多糖的培养基,培养24 h。避光条件下向96 孔板中每孔加入100 μL 的0.5 mg/mL MTT 溶液,培养箱中孵育4 h。4 h 后吸除MTT溶液,每孔加入150 μL DMSO,震荡10 min,酶标仪中570 nm 检测吸光值。统计分析,计算出多糖对RAW 264.7 细胞存活率的影响。选取对细胞无增殖抑制作用浓度进行实验。
1.2.3.3 DOP-1 对细胞炎症因子表达量的影响 将RAW 264.7 细胞以5×104个/mL 的密度接种于24孔板中,在含有5%二氧化碳的37 ℃恒温培养箱中培养24 h 后,弃去上清液,分别设置为空白组、LPS 组(5 μg/mL LPS)、DOP-1 组(5 μg/mL LPS+(125~500)μg/mL DOP-1 溶液),每组分别加入对应的供试液(或空白培养基)1 mL。培养24 h 后,按照试剂盒说明书操作,测定样品中的NO、TNF-α和IL-1β的含量[25]。
1.3 数据处理
实验结果采用单因素方差分析,各组间差异比较用单因素方差分析(One-Way ANOVA),进行组间两两多重比较,P<0.05 表示差异有统计学意义(*P<0.05,**P<0.01,***P<0.001)。采用Graph Pad软件作图。使用Image J 软件处理染色图片,所有数值均用“均数±标准误差”。
2 结果与分析
2.1 铁皮石斛多糖的提取及纯化
铁皮石斛粗多糖的DEAE-25 纤维素柱洗脱曲线见图1,收集主要洗脱组分,再经过Sephadex G-100 葡萄糖凝胶柱洗脱,获得铁皮石斛中性多糖DOP-1。
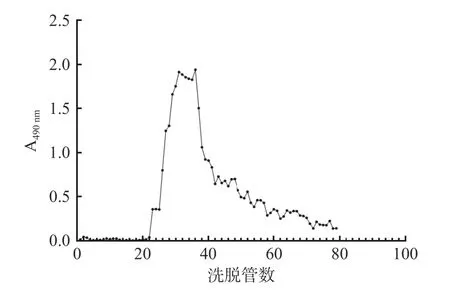
图1 铁皮石斛多糖的DEAE-25 洗脱曲线Fig.1 DEAE-25 elution curve of polysaccharides from Dendrobium officinale
将铁皮石斛多糖DOP-1 在波长范围为190~400 nm 处进行紫外光谱扫描,UV 光谱显示其在260 和280 nm 处没有吸收峰(图2),说明DOP-1 中不存在核酸和蛋白质。
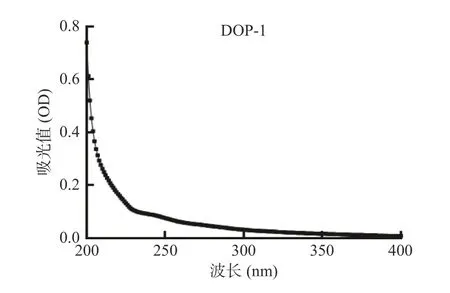
图2 DOP-1 的UV 光谱Fig.2 UV spectrum of DOP-1
2.2 铁皮石斛多糖的结构分析
2.2.1 多糖含量测定 利用苯酚-硫酸法和DNS 法测定DOP-1 的总糖含量和还原糖含量,求得DOP-1的总糖含量为94%,纯度较高,且结果与之前的报道一致[26]。且DOP-1 中不存在还原糖。
2.2.2 多糖分子量测定 使用标准右旋糖酐已知分子量的T 系列标准,得到一个线性标准曲线方程:y=-0.3501x+9.3765,R2=0.9495,x 代表Rt,y 代表lg Mw。采用高效凝胶色谱法对DOP-1 的平均分子量进行分析,结果如图3 所示,根据分子量分布及保留时间(Rt)求铁皮石斛多糖组分的分子量,求得DOP-1 的分子量为59.2 kDa,可能是均一性的多糖。之前的研究报道表明,不同的产地、提取方式、分离纯化方法对铁皮石斛多糖的分子量均有较大影响[27]。
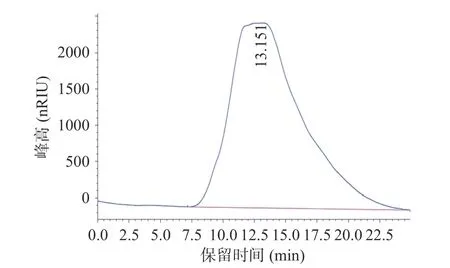
图3 DOP-1 的分子质量分布曲线Fig.3 Molecular mass distribution curves of DOP-1
2.2.3 多糖的单糖组成及含量测定 将铁皮石斛中性多糖DOP-1 进行酸水解,硅醚化反应后,采用气相色谱法进行单糖组分分析,将DOP-1 的气相色谱图与单糖混合标准品的气相色谱图进行比对,根据各单糖标品的出峰时间可以判断出各组分的单糖组成,在根据色谱图上的峰面积大小能够计算出各组分中的单糖构成和摩尔比。DOP-1 单糖组成及摩尔比见表1,单糖组成为鼠李糖、甘露糖、葡萄糖和半乳糖,单糖摩尔比为0.6:9.0:2.7:2.9。根据赵小丹等[28]的报道,铁皮石斛多糖的单糖组成主要为葡萄糖和甘露糖,李镜锐等[26]的报道表明铁皮石斛多糖主要由阿拉伯糖、半乳糖、甘露糖和葡萄糖4 种单糖组成,其中主要的单糖为甘露糖和葡萄糖。以上的研究报道与我们的实验结果较为接近,本实验中DOP-1 的单糖组成为鼠李糖、甘露糖、葡萄糖和半乳糖,其中鼠李糖含量较少,可忽略不计。
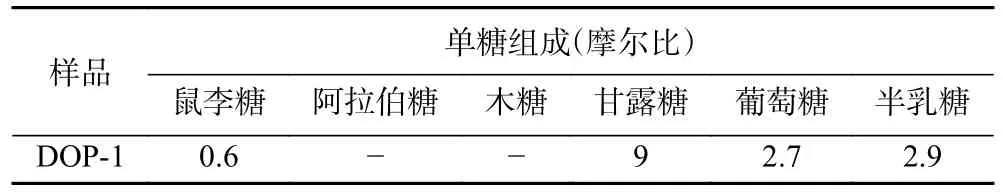
表1 铁皮石斛多糖的单糖组成分析Table 1 Analysis of the monosaccharide composition of Dendrobium officinale polysaccharides
2.2.4 铁皮石斛多糖的红外光谱分析 通过对铁皮石斛多糖DOP-1 进行红外光谱分析,可得DOP-1 的傅里叶红外光谱图如图4 所示,根据文献[29]查询可得,多糖分子中羟基基团的O-H 伸缩振动能够在3400 cm-1左右处出现较大的吸收峰,2900 cm-1附近较强的吸收峰来自于多糖分子-CH2-中的C-H 伸缩振动,说明DOP-1 有多糖的特征官能团;DOP-1 在1732 cm-1处有吸收峰,说明含有-COOH 基团;DOP-1在1641 cm-1处的吸收峰是由-COOR 中的C=O振动引起的;硫酸基基团中的伸缩会在1250 cm-1处有吸收峰,DOP-1 在1250 cm-1处有一定的吸收峰,表明含有硫酸基;DOP-1 在810 cm-1处的吸收峰是D-Man 的结果。
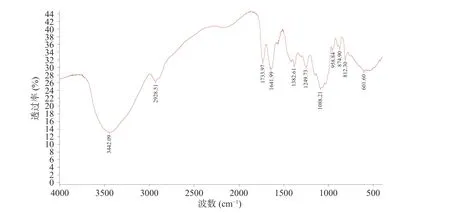
图4 DOP-1 的FT-IR 光谱Fig.4 FT-IR spectrum of DOP-1
2.2.5 多糖的核磁共振分析 多糖的1H 谱中质子信号大部分集中于δ3.0~δ4.0 ppm 的区域,重叠现象严重,但是异头氢质子的信号在δ4.3~δ5.9 ppm 处,因此谱图解析的关键是异头信号。α-糖苷键中C-1处质子的化学位移大于5.0 ppm,而β-糖苷键中C-1处的质子的化学位移小于5.0 ppm。在图5a 中,在δ4.2~δ5.0 ppm 和δ5.0~δ5.5 ppm 处均存在信号,这表明DOP-1 包含α-糖苷键和β-糖苷键。DOP-1的H-1 质子在δ4.2~δ5.5 ppm 内主要含有四种不同类型的异头氢,说明DNP4 主要含有四种不同类型的单糖,这与单糖组成分析的结果接近,其中δ5.32 ppm有主要位移,说明有α-葡萄糖存在,这与红外光谱的结果相符合。
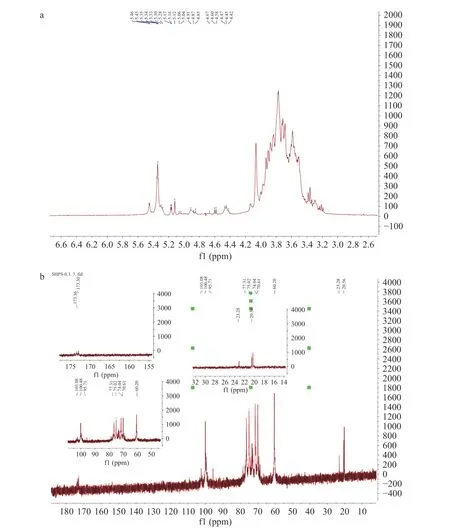
图5 DOP-1 的1H 谱(a)、13C 谱(b)Fig.5 1H spectrum (a),13C spectrum (b) of DOP-1
13C NMR 中化学位移在90~103 ppm 的异头碳是α-型糖苷,化学位移在103~106 ppm 之间的异头碳是β-型糖苷。在图5b 中,在DOP-1 的13CNMR谱中,在低场160~180 ppm 处有微弱信号,说明多糖组分可能含有糖醛酸。根据DOP-1 的13CNMR 谱图,DOP-1 中存在α-糖苷键和β-糖苷键,这与1HNMR分析一致。
DOP-1 的HSQC 谱如图6 所示,H/C 信号在5.34/99.59、4.45/102.51、4.70/100.08、4.91/98.52、91.83/5.17、4.58/95.71 ppm 分别归属对应→4)-α-Glcp-(1→、β-GlcpA-(1→、→4)-β-D-Manp-(1→、→4,6)-α-D-Glcp-(1→、α-reducing-Manp、β-reducing-Manp 糖残基,这与单糖组成结果一致。

图6 DOP-1 的HSQC 谱图Fig.6 HSQC spectrum of DOP-1
2.3 铁皮石斛多糖DOP-1 的抗炎活性
2.3.1 DOP-1 对巨噬细胞存活率的影响 DOP-1 对巨噬细胞RAW 264.7 细胞存活率的影响如图7 所示,在药物浓度小于500 μg/mL 的条件小,DOP-1 对RAW 264.7 细胞没有细胞毒性。

图7 DOP-1 对RAW 264.7 细胞存活率的影响Fig.7 Effect of DOP-1 on the survival rate of RAW 264.7 cells
2.3.2 DOP-1 对RAW264.7 细胞NO、TNF-α和IL-1β表达量的影响 LPS 诱导巨噬细胞炎症模型中,NO 和多种促炎细胞因子的分泌都会显著增加,NO 释放量是衡量炎症反应程度的重要指标,IL-1β和TNF-α是关键的促炎细胞因子。如图8 所示,与空白组相比,LPS 组的NO 相对含量显著升高(P<0.001),DOP-1 处理后细胞NO 的分泌显著减少了,并呈剂量依赖性。如图9 所示,LPS 刺激24 h 显著促进了RAW 264.7 细胞IL-1β的分泌,经125、250、500 μg/mL 的DOP-1 处理后,IL-1β的相对含量显著下降(P<0.01)。如图10 所示,相比于空白组,LPS 组 的TNF-α表达量显著升高了(P<0.001),DOP-1 处理显著降低了细胞TNF-α的表达水平(P<0.001)。
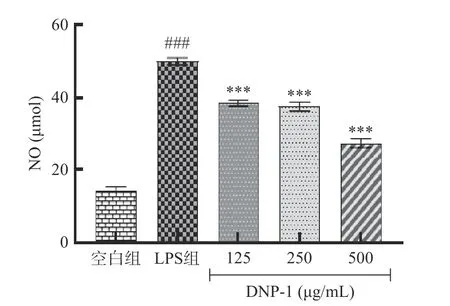
图8 DOP-1 对RAW 264.7 细胞NO 表达量的影响Fig.8 Effect of DOP-1 on NO expression in RAW 264.7 cells
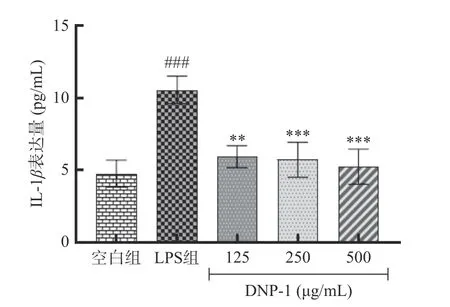
图9 DOP-1 对RAW 264.7 细胞IL-1β 表达量的影响Fig.9 Effect of DOP-1 on IL-1β expression in RAW 264.7 cells
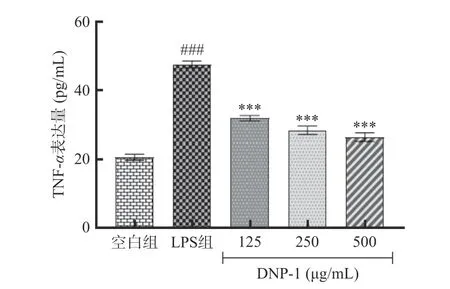
图10 DOP-1 对RAW 264.7 细胞TNF-α 表达量的影响Fig.10 Effect of DOP-1 on the expression of TNF-α in RAW 264.7 cells
由上述实验结果可知,DOP-1 在没有细胞毒性的浓度下,能显著抑制LPS 诱导的巨噬细胞NO、IL-1β和TNF-α的分泌,表明铁皮石斛多糖DOP-1 可以通过下调炎症因子表达量来起到抗炎作用。Xiang 等[30]的研究发现,从厚壳贻贝中提取分离得到的多糖能够通过改善LPS 诱导的RAW 264.7 细胞中TNF-α和IL-6 的过度产生,抑制NF-κB 信号通路的激活,改善DSS 诱导的结肠炎等。因此,推测铁皮石斛多糖可能可以通过抑制炎症细胞因子的信号传导,抑制NF-κB 通路的信号激活,从而抑制炎症反应,具有良好的抗炎功效。
3 结论
本实验通过水提醇沉法从铁皮石斛中提取分离纯化得到组分DOP-1,其中DOP-1 为均一性多糖,理化性质分析表明DOP-1 的糖含量为94%,且不含有糖醛酸和蛋白质。DOP-1 的分子量为59.2 kDa,单糖组成为鼠李糖、甘露糖、葡萄糖和半乳糖,单糖摩尔比为0.6:12.0:6.4:0.4。DOP-1 的红外光谱结果显示,DOP-1 含有多糖的特征官能团,且含有硫酸基团和D-Man。DOP-1 的核磁波谱分析表明DOP-1 含有→4)-α-Glcp-(1→、β-GlcpA-(1→、→4)-β-DManp-(1→、→4,6)-α-D-Glcp-(1→、α-reducing-Manp、β-reducing-Manp 糖残基,这与单糖组成和红外分析的结果一致。体外细胞实验表明,DOP-1 能抑制LPS 诱导的巨噬细胞NO、IL-1β和TNF-α的分泌,具有较好的抗炎功效。不同的产地来源、提取分离方法等因素都会可能对提取得到的铁皮石斛多糖的分子量、单糖组成和结构造成影响,而不同的分子量结构的铁皮石斛多糖,其生物活性往往也存在较大差异。先前对铁皮石斛多糖的研究中发现了铁皮石斛多糖的抗炎功效,但没有进行进一步的构效关系验证。本研究中对分离纯化得到的铁皮石斛多糖DOP-1 进行了结构表征并验证了其对LPS 诱导的炎症的抑制作用。本研究对铁皮石斛多糖的结构及其活性的探讨,可为铁皮石斛多糖在抗炎产品的开发利用提供理论依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

