反复冻融法制备灵芝多糖工艺优化、结构表征及抗氧化活性分析
任洪飞,逄梦玉,隋昕怡,刘 丹,杨飞燕,刘养山,张 景,杜秀菊
(聊城大学生命科学学院,山东聊城 252000)
灵芝(Ganodermalucidum),又称瑞草,据《中国药典》记载,主要有补气安神,止咳平喘的功效[1]。研究表明,灵芝中含有400 多种生物活性化合物,包括多糖、三萜、甾醇、核苷酸、脂肪酸和多肽等[2],是一种极佳的食药同源真菌。多糖是灵芝的主要活性成分之一[3],主要存在于灵芝子实体和菌丝体中[4],具有抗氧化[5]、抗肿瘤[6]、抗衰老[7]、抗菌[8]、抗炎[9]、防治心血管疾病[10]、保肝护肝[11]、保护神经[12]、免疫调节[13]等药理活性及功能。
传统灵芝多糖提取方法主要包括水提法、酶提法[14]、微波辅助提取法、超声波辅助提取法[15]、酸提法、碱提法等[16],但存在提取率低、设备要求高、经济效益低等诸多弊端。改进现有的灵芝多糖提取方法和探究新的提取方法以提高灵芝多糖的提取率、降低提取成本仍然具有重大意义。反复冻融法原理是在反复冻结和解冻过程中,细胞内部的水分形成冰晶刺破细胞壁,使得胞内物质更容易透过细胞壁溶出。该技术条件温和,不会破坏热不稳定性成分,容易实现工业上放大,是一种环境友好且经济的提取方法。目前已用于拐枣多糖[17]、刺麒麟菜多糖[18]、枸杞多糖[19]、油菜花粉多糖[20]和小球藻多糖[21]等多种多糖的提取,均取得了较好的效果。此外,反复冻融法已应用于灵芝孢子粉的破壁[22],但采用反复冻融提取灵芝子实体多糖及其工艺优化鲜有报道。
本研究优化反复冻融法提取灵芝多糖(G.lucidumpolysaccharide freeze-thaw,GLPf)工艺,并利用乙醇对其进行分级(GLPf30、GLPf60、GLPf80)。比较多糖的抗氧化活性并对其进行结构表征,旨在筛选活性较高的多糖组分,为灵芝资源的合理开发奠定理论依据。
1 材料与方法
1.1 材料与仪器
灵芝子实体 购于山东聊城冠县,经聊城大学农学院戴明勋副教授鉴定为赤芝;单糖标准品 美国Sigma 公司;苯酚、铁氰化钾、磷酸氢二钠、磷酸二氢钠 天津市风船化学试剂科技有限公司;浓硫酸 莱阳经济技术开发区精细化工厂;葡萄糖、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵(ABTS)、抗坏血酸(vitamin C,VC)北京索莱宝科技有限公司;无水乙醇 烟台远东精细化工有限公司;三氯化铁、三氯乙酸 国药集团化学试剂有限公司;以上试剂均为分析纯。
xt-200 高速多功能粉碎机 浙江省红太阳机电有限公司;HHS-22-8 电热恒温水浴锅 上海博讯实业有限公司;SHZ-D(Ⅲ)循环水式多用真空泵 河南省予华仪器有限公司;RE-2000B 旋转蒸发仪 上海亚荣生化仪器厂;721 可见分光光度计 上海佑科仪器仪表有限公司;GFL-140 电热鼓风干燥箱天津市莱玻特瑞仪器有限公司;Sorvall Biofuge Stratos 高速冷冻离心机、Nicolet iS50 傅里叶红外光谱仪 Thermo Scientific 公司。
1.2 实验方法
1.2.1 灵芝样品预处理 灵芝子实体预处理参照田淑雨等[23]的方法,略作改动。灵芝子实体60 ℃烘干至恒重,粉碎,过80 目筛。按照1:15(g/mL)的比例加入95%的乙醇,浸泡24 h,重复2 次。滤渣60 ℃烘干后备用。
1.2.2 灵芝多糖的提取工艺 精确称取3.0 g 已处理的灵芝子实体粉末,按照一定的溶胀比加入蒸馏水,充分混匀,置于-27 ℃冰箱中冷冻一定时间后取出,50 ℃水浴解冻10 min,冷却至室温后再次冻结,重复数次后利用热水浸提。
灵芝多糖热水浸提参照田淑雨等[15]的条件,略作改动。选取料液比1:25(g/mL),提取时间2.5 h,提取温度85 ℃。提取液4000 r/min 离心10 min,上清液抽滤2 次后蒸发浓缩至原体积的1/3,加入4 倍体积95%的乙醇,醇沉过夜。醇沉后5000 r/min 离心20 min,弃上清,沉淀冷冻干燥,即为灵芝粗多糖。
1.2.3 反复冻融法单因素实验 以粗多糖提取得率为考察指标,固定溶胀比15:1(mL/g),冻融时间为2 h,冻融次数2 次,对反复冻融过程中的溶胀比、冻融时间和冻融次数三个因素进行单因素实验设计。固定其他冻融条件,分别选取5:1、10:1、15:1、20:1、25:1(mL/g)得溶胀比,1.5、2、2.5、3 和3.5 h得冻融时间,1、2、3、4、5 次得冻融次数,按照1.2.2 的提取条件进行提取,得灵芝粗多糖。多糖提取得率公式计算如下:
式中,m 为灵芝多糖质量(g);M 为灵芝子实体粉末质量(g)。
1.2.4 反复冻融法响应面试验 根据单因素结果,以溶胀比、冻融时间、冻融次数为考察因素,多糖提取得率为考察指标,运用Design-Expert 8.0.5 软件,设计Box-Behnken 试验,采用3 因素3 水平响应面分析试验,各因素水平见表1。

表1 响应面设计因素与水平Table 1 Factors and levels of the response surface methodology
1.2.5 乙醇分级灵芝多糖 乙醇分级灵芝多糖参照张景等[24]的方法,略作改动,具体如下:利用1.2.4 最优条件提取获得灵芝多糖提取液,浓缩后加入95%的乙醇,边加边搅拌均匀,至乙醇浓度达到30%,4 ℃静置4 h 后,离心(5000 r/min,20 min),收集沉淀,透析(3500 Da),冷冻干燥后即得灵芝多糖GLPf30。同样操作,将上清液加95%乙醇至乙醇浓度分别为60%和80%,分别获得灵芝多糖组分GLPf60 和GLPf80。具体流程如图1。
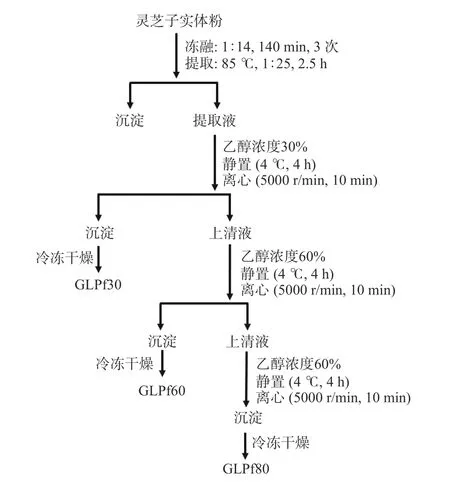
图1 乙醇分级灵芝多糖制备图Fig.1 Preparation diagram of ethanol graded Ganoderma lucidum polysaccharides
1.2.6 多糖和蛋白质含量测定 采用苯酚-硫酸法[25]和DNS(3,5-二硝基水杨酸,3,5-Dinitrosalicylic acid)法[26]测定样品中总糖含量和还原糖,分别根据公式(2)和公式(3)计算含量。多糖含量的计算按公式(4)进行。
式中,C 为根据标曲计算得到的样品总糖质量浓度(mg/mL);V 为样品溶液总体积(mL);M 为粗多糖质量(mg)。
式中,C 为根据标曲计算得到的样品还原糖质量浓度(mg/mL);V 为样品溶液总体积(mL);M 为粗多糖质量(mg)。
蛋白质含量采用考马斯亮蓝法[27]测定,根据公式(5)进行计算。
式中,C 为根据标曲计算得到的样品蛋白质量浓度(mg/mL);V 为样品溶液总体积(mL);M 为粗多糖质量(mg)。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH 自由基清除力测定 参考Wei 等[28]的方法,略作改动。取1 mL 不同浓度样品液(62.5、125、250、500、1000、1500 µg/mL),加入1 mL 0.2 mmol/L 的DPPH 无水乙醇溶液,混匀后避光反应30 min,测定517 nm 处吸光值,记作Ai;分别将Ai中的DPPH 溶液、样品溶液换成无水乙醇,同样方法测得吸光值,分别记作Aj和A0。DPPH 自由基清除率计算公式如下:
1.2.7.2 羟自由基清除力测定 参照Bulu 等[29]的方法,略作改动。将1 mL 30%的H2O2溶液(4 mmol/L)、1 mL 不同浓度样品液、1 mL FeSO4溶液(4 mmol/L)、1 mL 水杨酸无水乙醇溶液(4 mmol/mL)混匀,37 ℃避光反应30 min,离心(4000 r/min,10 min),取上清液,测定510 nm 处吸光值,记作Ai。分别以无水乙醇代替Ai中的水杨酸无水乙醇溶液,以超纯水代替Ai中的样品液,其余步骤同Ai,测得吸光值,分别记作Aj和A0。以VC为阳性对照。羟自由基清除率公式如下:
1.2.7.3 总还原力测定 总还原力测定方法参照田淑雨等[30],略作改动。将1 mL 不同浓度样品液与2 mL 1%的铁氰化钾溶液、2 mL 0.2 mol/L pH=6.6的PBS 缓冲液混合均匀,50 ℃恒温20 min。再加入2 mL 10%的三氯乙酸溶液,混匀,3000 r/min 离心10 min。取2.5 mL 上清液、2.5 mL 超纯水和1 mL 0.1%的三氯化铁溶液混匀,静置10 min,测700 nm 处吸光值。
1.2.7.4 ABTS+自由基清除力测定 ABTS 溶液配制及清除力测定参照刘养山等[31]的方法,略作改动。将50 μL 样品液与150 μL ABTS 溶液混合均匀,避光5 min 测定734 nm 吸光值,记作Ai。以PBS 缓冲液分别替代Ai中的ABTS 溶液和样品液,测得吸光值分别记作Aj和A0。以VC为阳性对照。ABTS+自由基清除率计算公式如下:
1.2.8 多糖结构表征
1.2.8.1 傅里叶红外光谱分析 利用傅里叶红外光谱对五种单糖的特征性官能团进行分析,参照Xu等[5]的方法,略作改动。取1 mg 多糖样品混入100 mg KBr 粉末研磨均匀,压片,扫描范围为4000~400 cm-1,累积扫描32 次。
1.2.8.2 单糖组分分析 采用高效离子交换色谱(HPAEC)法进行检测,参照Li 等[32]的方法,略作改动。称取样品2 mg 加入10 mL 3 mol/L 三氟乙酸,120 ℃水解6 h,冷却减压蒸干,加3 mL 甲醇蒸干,稀释100 倍,过0.22 μm 的微孔滤膜。利用CarboPac PA20 阴离子交换分析柱,以2 mmol/mL 的NaOH溶液洗脱,流速0.45 mL/min;柱温30 ℃;进样量25 μL。
1.3 数据处理
实验数据运用 Excel 2021 整理,用SPSS Statistics 19、Origin 2021 进行数据分析及绘图,每个实验设置三个平行,结果以均值±标准差表示,不同字母(a~d)表示数据之间有显著差异(P<0.05)。
2 结果与分析
2.1 单因素实验结果
由图2a 可知,随着溶胀比的增加,多糖提取得率呈现先升高后降低的趋势,在15:1(mL/g)时提取得率达到最高,之后下降,然后略有上升(图2a)。可能原因是随着溶胀比的增大,在一定时间内无法形成足够的冰晶刺破细胞壁,阻碍了多糖的溶出。所以选取溶胀比为15:1(mL/g)进行后续响应面试验。
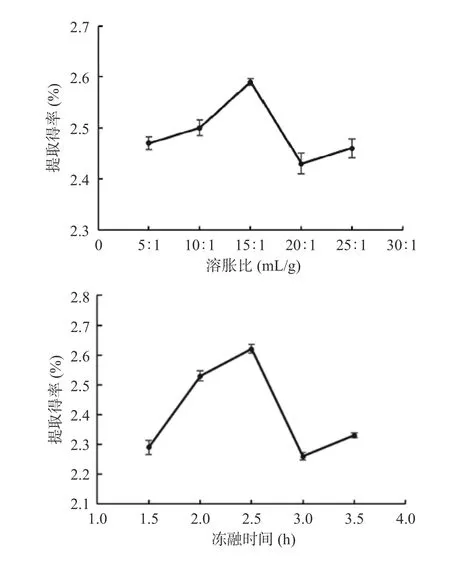
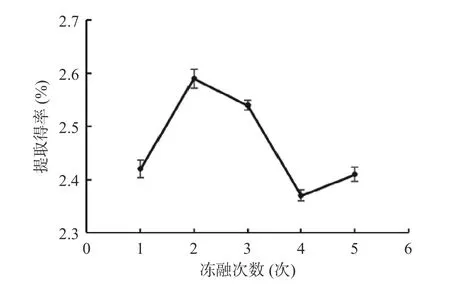
图2 不同因素对灵芝多糖提取得率的影响Fig.2 Influence of different factors on Ganoderma lucidum polysaccharide extraction yield
随着冻融时间的增加,多糖提取得率呈现先升高后降低的趋势,在2.5 h 时提取得率达到最大(图2b)。分析其原因可能是随着冻融时间的增加,细胞内水结晶度升高,更容易刺破细胞壁,多糖释放的阻力减小。但时间过长导致分子热运动长时间处于抑制状态,多糖难以溶出[32]。所以选取2.5 h 进行后续试验。
随着冻融次数的增加,多糖提取得率呈现先升高后降低的趋势,在冻融2 次时提取得率达到最高(图2c)。分析其原因可能是随着冻融次数的增加,细胞破壁更加充分,提取得率提高。冻融次数过多导致机械强度过大,使得多糖结构变化,提取得率降低[33]。所以冻融次数2 次进行后续试验。
2.2 响应面试验结果
Box-Behnken 试验方案及结果见表2。响应面分析的回归方程为:Y=2.64-0.012A+0.033B+0.12C-0.10A2-0.050B2-0.090C2+0.057AB-0.0075AC-0.063BC。
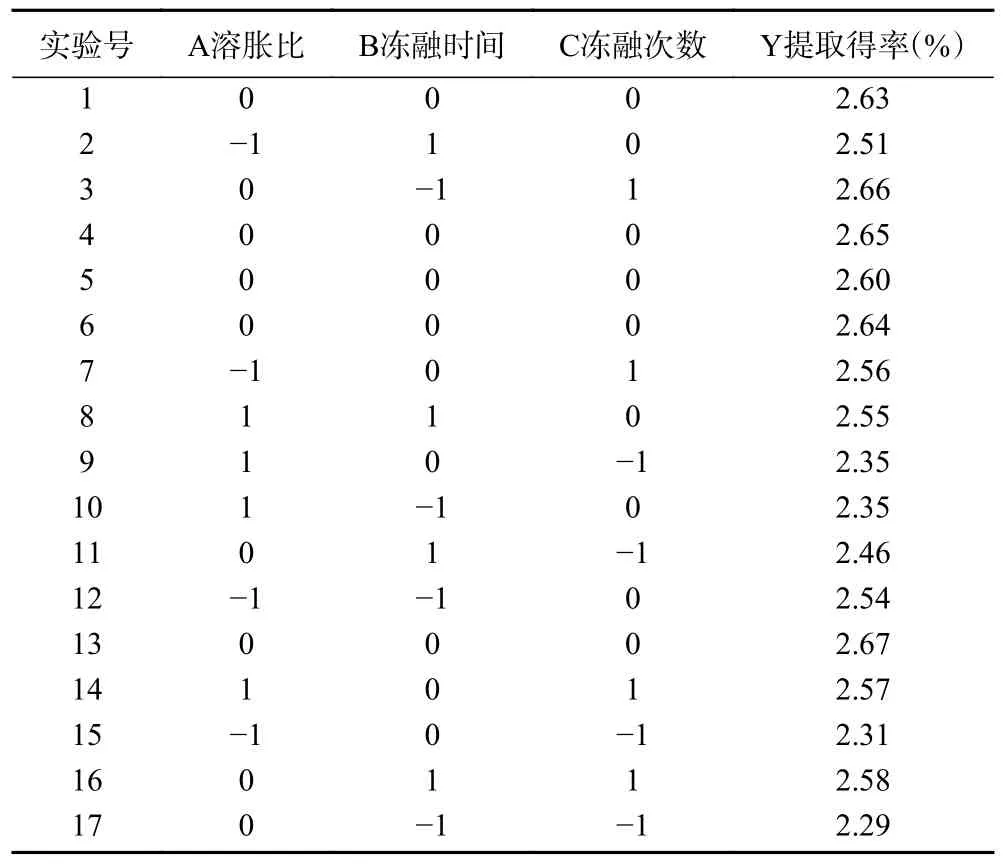
表2 响应面试验设计及结果Table 2 Designs and results of Box-Behnken test
根据表3 可知,响应面模型P<0.01,表示该模型极其显著;失拟项P>0.05,不显著。R2=0.9671,表明该模型拟合度较好;R2Adj=0.9247,表明该模型能够解释92.47%的响应值变化。C.V.<10%,表明实验可信度和精确度较高;精密度>4 为合理[34],模型精密度为13.633,符合精密度要求。
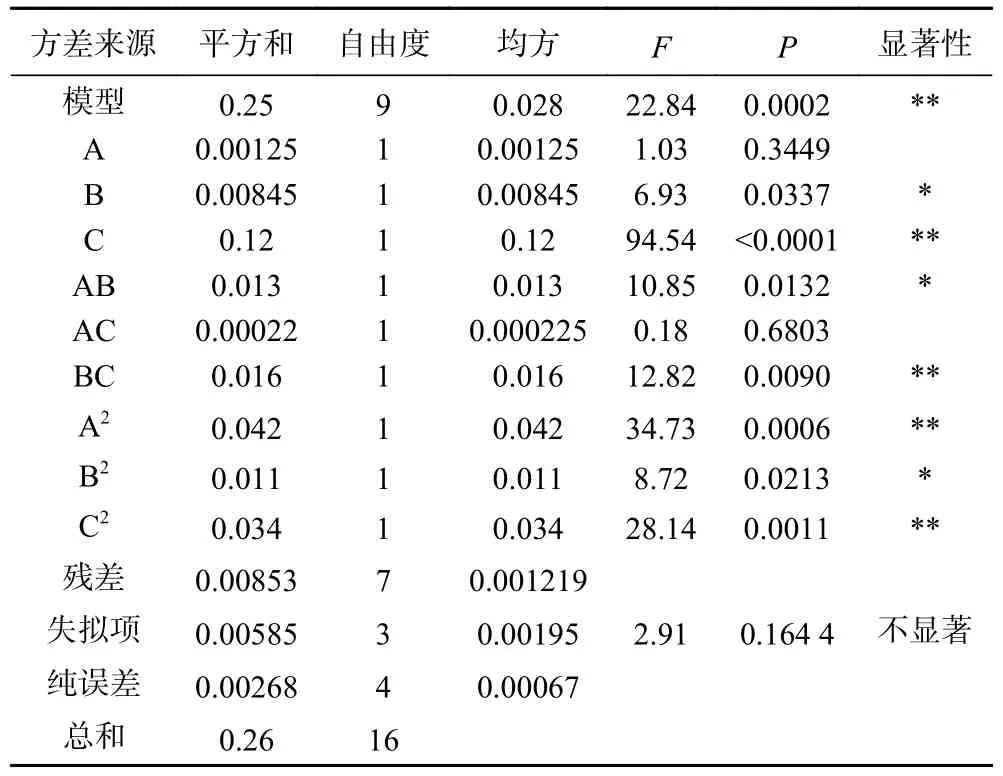
表3 响应面结果方差分析Table 3 Analysis of variance of response surface results
响应面及等高线图如图3 所示。响应面曲线越陡,交互作用越强;陡峭程度越低,交互作用越弱。等高线越趋于椭圆形,因素间的交互作用越强,越趋于圆形,交互作用较弱。由图3 可以看出:BC 的交互作用对响应值的影响最强,AB 次之,AC 最弱。
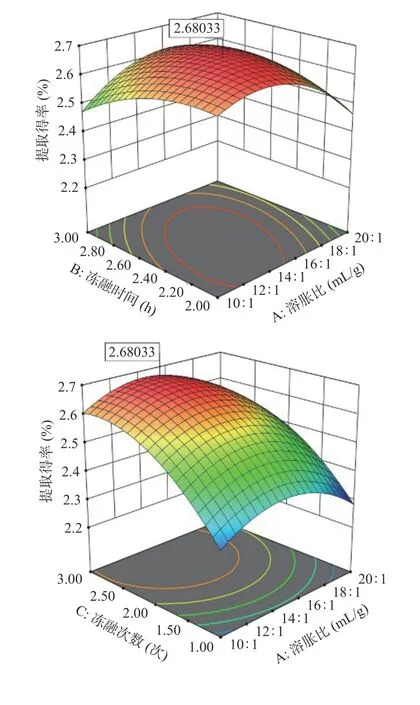
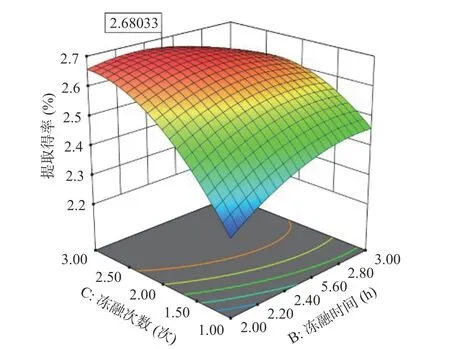
图3 不同因素交互作用对灵芝多糖(GLPf)提取得率的影响Fig.3 Effect of different factor interactions on GLPf extraction yield
响应面试验预测条件为:溶胀比14.21:1(mL/g)、冻融时间2.38 h、冻融次数2.75 次,预测提取得率为2.68%;对预测条件稍作调整进行验证,提取条件为:溶胀比14:1(mL/g)、冻融时间140 min、冻融次数3 次,多糖实际提取得率为2.71%±0.035%,与预测值误差1.2%。
2.3 灵芝多糖抗氧化活性结果
5 种灵芝多糖清除DPPH 自由基试验结果如图4(a)和表4 所示。利用不同浓度的样品进行测定,每种多糖对于DPPH 自由基清除能力均具有浓度依赖性,浓度越高清除能力越强。根据DPPH 自由基清除力的EC50值可知,清除能力大小排序为:GLPf30>GLPw>GLPf>GLPf80>GLPf60。GLPw 与GLPf 的DPPH 自由基清除能力接近,GLPf60 与GLPf80 的DPPH 自由基清除能力相对较弱,30%乙醇分级组分GLPf30 相较于其他4 种多糖具有较强的DPPH 自由基清除能力。
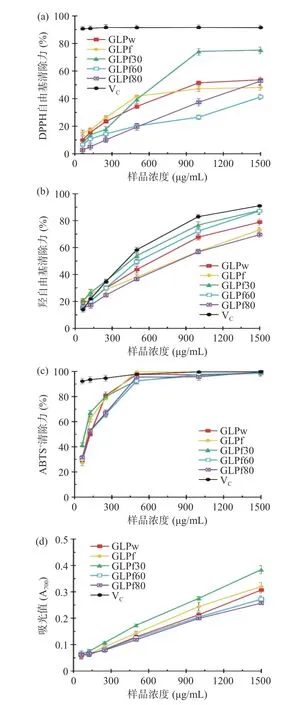
图4 5 种灵芝多糖抗氧化活性Fig.4 Antioxidant activity of 5 polysaccharides from Ganoderma lucidum

表4 不同多糖抗氧化活性EC50 值(mg/mL)Table 4 EC50 values of antioxidant activity of different polysaccharides from Ganoderma lucidum (mg/mL)
5 种灵芝多糖清除羟自由基能力如图4(b)和表4 所示。每种多糖对于羟自由基清除能力均具有浓度依赖性,浓度越高清除能力越强。清除能力大小排序为:GLPf30>GLPf60>GLPw>GLPf>GLPf80。GLPw 与GLPf 的羟自由基清除力相近,GLPf80 的清除力最弱,GLPf60 清除力略低于GLPf30,30%乙醇分级组分GLPf30 相较于其他4 种多糖具有较高的羟自由基清除能力。
以VC为阳性对照,5 种灵芝多糖清除ABTS+自由基能力如图4(c)和表4 所示。每种多糖对于ABTS+自由基清除能力均具有浓度依赖性,浓度越高清除能力越强。ABTS+自由基清除力大小排序为:GLPf30>GLPf>GLPw>GLPf60≈GLPf80。5 种多糖均表现出了较强的ABTS+自由基清除能力,GLPf30甚至高于阳性对照VC。
5 种灵芝多糖总还原力如图4(d)和表4 所示。利用不同浓度的样品进行测定,每种多糖总还原力均具有浓度依赖性,浓度越高清除能力越强。GLPf30的总还原力最强(RP0.5AU=3.32),反复冻融提取所得的多糖GLPf 总还原力(RP0.5AU=4.84)略强于热水浸提多糖GLPw(RP0.5AU=5.94)。
2.4 傅里叶红外光谱分析
傅里叶红外光谱法是根据不同波数吸收峰鉴定多糖分子中原子或官能团振动情况的方法,5 种多糖的红外光谱结果如图5 所示。各多糖的红外吸收峰大致相似,而峰面积有较大差异,具体分析如下:
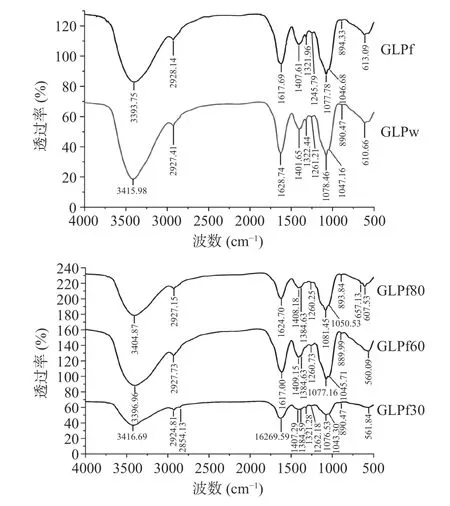
图5 5 种灵芝多糖傅里叶红外光谱图Fig.5 FT-IR of five Ganoderma lucidum polysaccharides
首先对水提灵芝多糖GLPw 和冻融灵芝多糖GLPf 进行分析。2 种多糖在3415.98 和3393.75 cm-1处存在较宽的吸收峰,为O-H 键伸缩振动引起,表明多糖中含有羟基[35];2927 cm-1左右存在的较窄的吸收峰为C-H 键振动峰,表明多糖中含有-CH、-CH2、-CH3[36];在1600 cm-1左右的吸收峰是是由于多糖结合水引起或C=O 的伸缩振动峰[37];1401.65 和1407.61 cm-1处的吸收峰是糖醛酸中的-COOH 伸缩振动峰,暗示多糖中含有糖醛酸[38],这与单糖组成结果相吻合;1322.44 和1321.96 cm-1为C-H 的振动峰[5];1261.21 和1245.79 cm-1为S=O 振动峰,表明多糖中有硫酸盐的存在[39];GLPw 中1078.46、1047.16 cm-1和GLPf 中1077.78、1046.68 cm-1均为吡喃环中的糖苷键伸缩振动引起的[40];890.47 和894.33 cm-1为典型的β糖苷键吸收峰[41];610.66 和613.09 cm-1有吸收峰,说明多糖中含有吡喃糖骨架[14]。
对乙醇分级所得3 种多糖(GLPf30、GLPf60、GLPf80)进行分析。3416.69、3396.96、3416.69 cm-1处的吸收峰为羟基吸收峰;2924.81、2927.73、2927.15 cm-1处为C-H 键振动峰;1600 cm-1左右的吸收峰是是由于多糖结合水引起或C=O 的伸缩振动峰;1407.29、1409.15、1408.18 cm-1处的吸收峰暗示多糖中有糖醛酸的存在,与单糖组成结果相互佐证;1384.59(GLPf30)、1321.28(GLPf30)、1384.63(GLPf60)、1384.63(GLPf80)cm-1为C-H 的振动峰;1262.18、1260.73、1260.25 cm-1为S=O 振 动峰;1076.53、1043.30、1077.16、1045.71、1081.45、1050.53 cm-1均为吡喃环糖苷键伸缩振动引起;890.47、889.99、893.84 cm-1为β糖苷键吸收峰;3 种多糖在500~900 cm-1均有吸收峰,说明多糖中含有吡喃糖骨架[36]。
综上所述,5 种多糖均是以吡喃糖为骨架的酸性多糖,且均含有β构象。5 种多糖的红外吸收峰在4000~500 cm-1范围内非常相似,表明反复冻融和乙醇分级不会影响灵芝多糖的主要结构。
2.5 灵芝多糖理化性质和单糖组分分析
灵芝粗多糖中糖含量及蛋白含量如表5 所示,总糖、还原糖及蛋白含量标准曲线如图6 所示。相较于热水浸提法提取所得的灵芝多糖,反复冻融法所得的多糖中还原糖含量较低,蛋白含量也较低。有研究表明反复冻融法可用于多糖的脱蛋白[42],为本研究结果提供了佐证。经乙醇分级后所得三个组分中,GLPf30 质量占比偏低,GLPf60 与GLPf80 占比相近。利用不同浓度的乙醇分级最终得到的各组分质量占比有所不同,田淑雨等[30]利用乙醇分级得到GLP40、GLP60 和GLP80 的质量占比分别为45%、29%、26%。不同组分的物理性状也有所差异,五种多糖均以棕色为主,GLPf30 冻干后为片状,而其余四种组分均为块状。
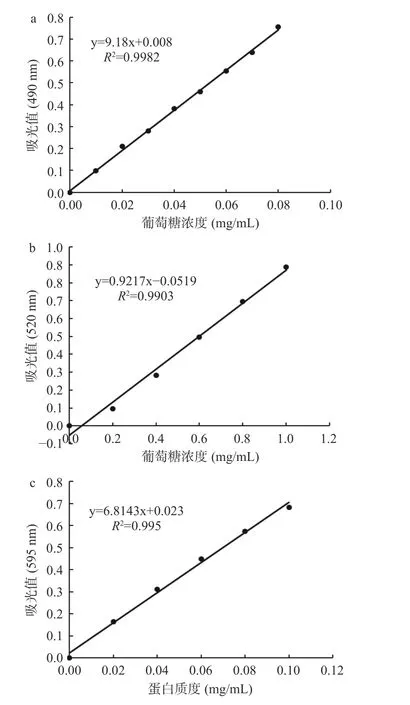
图6 总糖(a)、还原糖(b)及蛋白质(c)的标准曲线图Fig.6 Standard curves for total sugars (a),reducing sugars (b)and proteins (c)
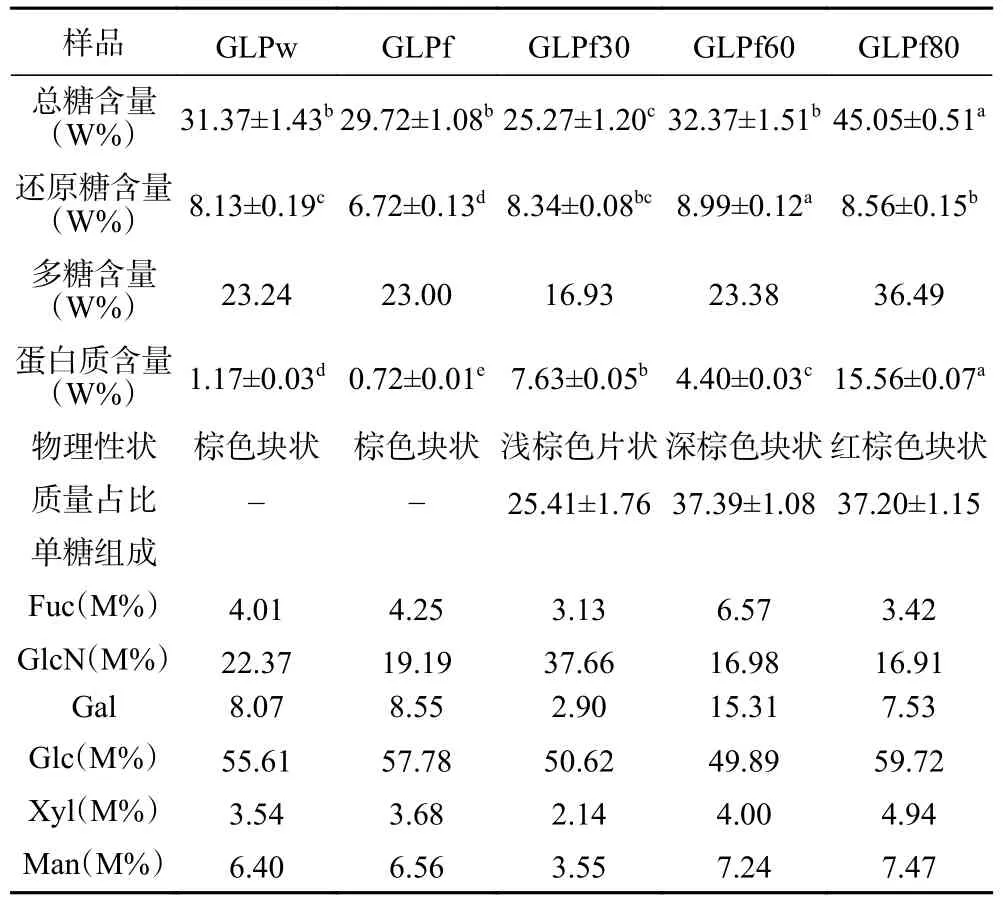
表5 灵芝多糖的理化性质与单糖组成Table 5 Analysis of polysaccharide content and monosaccharide composition
5 种多糖的HPAEC 结果如图7 及表5 所示。5 种多糖均由岩藻糖(Fuc)、氨基葡萄糖(GlcN)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)六种单糖组成,且均含有少量的葡萄糖醛酸(GlcA);GLPw、GLPf、GLPf30、GLPf60、GLPf80 摩尔比分别为2.70:15.06:5.43:37.44:2.38:4.31,3.04:13.72:6.11:41.31:2.63:4.69,1.73:20.79:1.60:27.95:1.18:1.96,5.32:13.74:12.39:40.38:3.24:5.86,2.85:14.08:6.27:49.71:4.11:6.22。不同提取方法以及乙醇分级后获得多单糖组成种类相同,但摩尔比有较大差异。
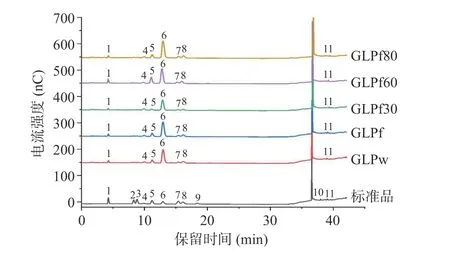
图7 5 种灵芝多糖的高效阴离子色谱图Fig.7 High performance anion exchange chromatography of 5 polysaccharides from Ganoderma lucidum
3 讨论与结论
本研究表明反复冻融法提取灵芝多糖(GLPf)比传统的水提得率(2.36%)提高了14.8%,且冻融多糖(GLPf)的抗氧化活性高于水提多糖(GLPw),此方法可以提高灵芝多糖的提取得率及抗氧化活性。杨静等[17]利用反复冻融与回流技术相结合提取拐枣多糖,最终拐枣中多糖的含量为1.68%;陈玉芳等[18]利用冷冻法提取刺麒麟菜多糖,多糖得率达到53.98%,硫酸酯基含量23.76%;温梓辰等[19]利用反复冻融提取枸杞多糖,多糖融出率可达到15.651%。以上研究均表明反复冻融是一种有效的多糖提取方法,与本研究结论相吻合。
采用乙醇分级法,由GLPf 成功分离获得3 种灵芝多糖,GLPf30 的抗氧化能力明显高于其他两种多糖(GLPf60 和GLPf80)及其前体物GLPf,是一种具有抗氧化活性潜力的多糖组分,值得进一步深入研究。王宣东[43]利用乙醇分级得到3 种金耳多糖,发现TAP30 的抗氧化能力最强;常雪飞等[44]利用乙醇分级获得3 种辣木叶多糖,发现80%乙醇分级组分MP-3 具有较强的抗氧化能力;景永帅等[45]利用乙醇对北沙参多糖进行分级,发现50%乙醇分级所得多糖抗氧化性较强;吴杨洋等[46]分级得到四种蛹虫草多糖,发现CMP60 的还原力和DPPH 自由基清除率均为最高,CMP80 的羟自由基的清除率最高。本研究再次表明,乙醇分级法对于筛选灵芝多糖的抗氧化活性部位是一个有效的方法。
HPAEC 和FT-IR 结果表明,GLPf30 与其他4 种多糖的单糖组分相似,但其摩尔比、理化性质有明显不同,尤其是GLPf30 的氨基葡萄糖(GlcN)占比为最高(达到37.66%)。推测这大概就是GLPf30的抗氧化活性明显优于其他组分的物质基础。
后续将对GLPf30 进一步纯化,对其一级结构和空间结构进行深度解析,并对其构效关系做进一步的研究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

