牛血红蛋白肽的酶解工艺优化及其亚铁螯合物结构、稳定性研究
祝超智,温耀涵,许 龙,张秋会,王兴辉,赵改名,*,韩广星
(1.河南农业大学食品科学技术学院,河南郑州 450002;2.临沂综合实验站,山东临沂 273300)
牛血液作为畜禽屠宰加工过程中主要的副产物之一,占肉牛总体重的5.0%~6.0%,其蛋白质含量高达17%~20%,且氨基酸组成平衡,是蛋白质的优质来源[1]。牛血主要由血浆(约65%)和血细胞(约35%)2 个部分组成,其营养成分较为丰富,尤其是蛋白质含量较高,牛血中蛋白质大多存在于红细胞内,且主要为血红蛋白,是制备生物活性肽的良好原料[2]。目前,许多研究对动物血液进行了有效利用,主要将其加工成食品,如血豆腐、血肠等,或提取血浆蛋白添加到饲料中,能够改善体内肠道菌群,提高动物免疫力[3]。但对于牛血红蛋白却一直未得到充分的利用,由于牛血有较重的血腥味、其适口性及在体内消化吸收能力较差,且屠宰时原料血液涉及到收集保存困难和环境污染等问题,牛血液的综合利用严重受限[4]。作为新型铁补充剂,多肽亚铁螯合物已被证实可以显著提高铁的稳定性、吸收性和生物利用度[5-6]。很多研究从植物蛋白中提取多肽与铁结合制备螯合物,如大麦,燕麦,绿豆等[5,7-8]。近年来从动物源蛋白中提取的生物活性肽作为新型的金属离子螯合剂,已经引起了人们的重视。Sun 等[9]从南极磷虾中分离鉴定得到的新型肽,与亚铁螯合后消化稳定性更好。石景等[10]以鸡血为原料,制备的鸡血球肽铁螯合物稳定性高,耐消化能力强。李紫玉等[11]采用分步酶解方式提取牛血红蛋白中的活性肽,为血液中蛋白资源的开发与加工利用提供技术参考。因此,为提高牛血副产物的利用率和产品附加值,进一步研究开发牛血红蛋白中的营养物质很有必要[12]。
本研究以牛血为原料,在单酶探究结果的基础上,采用双酶分步酶解牛血红蛋白,经脱色处理后制备牛血红蛋白肽(Bovine Hemoglobin Peptide,BHP),进一步制备其亚铁螯合物,并对牛血红蛋白肽铁螯合物(Bovine Hemoglobin Peptide Iron Chelate,BHPFe)进行结构表征和体外稳定性分析。
1 材料与方法
1.1 材料与仪器
西门塔尔杂交牛新鲜牛血 河南恒都食品有限公司,于4 ℃条件下冷藏运输至实验室,样品前处理后收集血红细胞储存于-18 ℃;柠檬酸三钠、氯化亚铁 均购自国药集团;碱性蛋白酶(2×105U/g)、胃蛋白酶(2.5×105U/g)、胰蛋白酶(2.5×105U/g)均购自北京索莱宝试剂有限公司;中性蛋白酶(5×104U/g)、复合蛋白酶(1.5×105U/g)、风味蛋白酶(酶活力5×104U/g)、木瓜蛋白酶(酶活力6.0×105U/g)均购自丹麦诺维信试剂公司。
pHS-3C pH 计 上海仪电科学仪器股份有限公司;UV2600 型紫外可见分光光度计 岛津企业管理(中国)有限公司;TEN-SORⅡ 型傅里叶红外光谱仪 布鲁克科技有限公司;Q600 热分析仪 TA Instruments-Waters LLC 公司;ZEISS Gemini 300 扫描电镜 德国蔡司集团;Biochrom 氨基酸分析仪英国百康有限公司。
1.2 实验方法
1.2.1 蛋白酶的选择 选取市面上常用的七种商业蛋白酶(表1),分别按照每种蛋白酶适宜的酶解条件进行酶解试验,其余酶解条件固定相同的参数对牛血红蛋白溶液进行酶解,以酶解液的水解度、多肽含量和Fe2+螯合能力为评价指标,选取最适酶解的蛋白酶种类。根据国标GB/T 28715-2012《饲料添加剂酸性、中性蛋白酶活力的测定》和SB/T 10317-1999《蛋白酶活力测定法》的方法测定蛋白酶实际酶活力[13-14]。七种蛋白酶所制定的酶解条件及经测定得到的实际酶活力见表1。

表1 不同蛋白酶种类酶解条件及实际酶活Table 1 Enzymolysis conditions and actual enzyme activities of different proteases
1.2.2 酶解工艺 新鲜牛血→柠檬酸三钠抗凝过滤→4000 r/min 离心10 min 收集牛血细胞→生理盐水洗涤3 次→加去离子水使细胞溶胀→高速分散器6000 r/min 机械破壁20 min→4000 r/min 离心10 min去杂→取上清液→加胃蛋白酶酶解→调节pH 灭酶→加碱性蛋白酶酶解→沸水浴中灭酶10 min→冷却至室温→8000 r/min 离心10 min→取上清液→羧甲基淀粉脱色[15]→5000 r/min 离心10 min→取上清液→过0.22 μm 微孔滤膜→经冷冻干燥即得牛血红蛋白肽。
1.2.3 单因素实验 根据蛋白酶筛选结果,且由于胃蛋白酶酶解条件的限制性,因此固定胃蛋白酶的酶解条件(pH 为2,温度37 ℃,添加量2000 U/g,时间2 h)为第一步酶解蛋白酶,选取碱性蛋白酶为二次酶解蛋白酶,以水解度、多肽含量和亚铁螯合活性为评价指标,探究制备牛血红蛋白肽的最佳酶解工艺。具体单因素实验设计如下。
1.2.3.1 料液比对酶解效果的影响 经胃蛋白酶初步酶解后,在酶解pH 为9.5,酶解温度50 ℃,酶添加量6000 U/g,酶解时间3 h 的条件下制备牛血红蛋白肽,设置料液比分别为1:1、1:2、1:3、1:4、1:5,探究料液比对双酶酶解制备牛血红蛋白肽的影响。
1.2.3.2 酶解pH 对酶解效果的影响 经胃蛋白酶初步酶解后,在料液比为1:4,酶解温度50 ℃,酶添加量6000 U/g,酶解时间3 h 的条件下制备牛血红蛋白肽,设置酶解pH 分别为8.5、9、9.5、10、10.5,探究酶解pH 对双酶酶解制备牛血红蛋白肽的影响。
1.2.3.3 酶添加量对酶解效果的影响 经胃蛋白酶初步酶解后,在料液比为1:4,酶解pH 为9.5,酶解温度50 ℃,酶解时间3 h 的条件下制备牛血红蛋白肽,设置酶添加量分别为2000、4000、6000、8000、10000 U/g,探究酶添加量对双酶酶解制备牛血红蛋白肽的影响。
1.2.3.4 酶解温度对酶解效果的影响 经胃蛋白酶初步酶解后,在料液比为1:4,酶解pH 为9.5,酶添加量6000 U/g,酶解时间3 h 的条件下制备牛血红蛋白肽,设置酶解温度分别为40、45、50、55、60 ℃,探究酶解温度对双酶酶解制备牛血红蛋白肽的影响。
1.2.3.5 酶解时间对酶解效果的影响 经胃蛋白酶初步酶解后,在料液比为1:4,酶解pH 为9.5,酶解温度50 ℃,酶添加量6000 U/g 的条件下制备牛血红蛋白肽,设置酶解时间分别为1、2、3、4、5 h,探究酶解时间对双酶酶解制备牛血红蛋白肽的影响。
1.2.4 酶解工艺优化 根据单因素结果,选取酶pH、酶添加量、酶解温度为自变量,设计三因素三水平响应面优化试验,试验因素与水平见表2。

表2 响应面试验优化因素与水平Table 2 Optimization factors and levels of response surface experiments
1.2.5 水解度的测定 参照孙如男[16]的方法,水解度(Degree of hydrolysis,DH)为酶解液中氨基酸态氮含量与样品总氮含量的比值,即:
式中:V1,样品消耗的氢氧化钠的体积,mL;V2,空白消耗的氢氧化钠的体积,mL;Va,样品消耗标准滴定液的体积,mL;Vb,空白消耗的体积,mL;V,量取酶解液的体积,mL;Vc,吸取消化液的体积,mL。
1.2.6 Fe2+螯合能力的测定 参照Lin 等[17]的方法,以去离子水代替酶解液做总铁对照,以水代替亚铁盐氯化亚铁做空白对照。将螯合反应生成的络合物在562 nm 处检测其吸光度。Fe2+螯合能力计算公式:
式中:A0,总铁对照吸光度;A1,样品吸光度;A2,空白对照吸光度。
1.2.7 多肽含量的测定 参照吴慧琳等[18]的方法,以牛血清白蛋白为标准品制作标准曲线y=0.00128x+0.02163,R2=0.999。将处理后样品于540 nm 下测定吸光度,代入标准曲线,即可求得样品溶液中的多肽含量。
1.2.8 肽铁螯合物的制备 称取适量牛血红蛋白肽于试管中,加去离子水,将其配制成浓度为3%的多肽溶液,加抗坏血酸,然后按3:1 比例加入氯化亚铁,30 ℃条件下下反应30 min。将反应后的溶液3800 r/min 离心10 min,去除沉淀,上清液用6 倍体积的无水乙醇醇沉处理12 h,10000×g 离心10 min后取沉淀,用无水乙醇反复洗涤滤渣,去除多肽及盐等杂质,真空冷冻干燥后得牛血红蛋白肽铁螯合物成品[6]。
1.2.9 牛血红蛋白肽铁螯合物结构表征
1.2.9.1 紫外光谱 分别取BHP 及BHP-Fe 配制成1 mg/mL 的溶液,稀释至合适梯度之后过0.22 μm微孔滤膜。在200~500 nm 范围内进行的全波段扫描[19]。
1.2.9.2 红外光谱 分别取BHP 及BHP-Fe 样品2 mg 左右,加入干燥后的KBr 充分研磨,用压模器将混合粉末样品压制成薄圆片,用红外光谱仪进行测试,扫描范围为4000~500 cm-1[20]。
1.2.9.3 X 射线衍射分析 取牛血红蛋白多肽及多肽亚铁螯合物冻干样制样,XRD 的测试条件为:管电压40 kV,管电流40 mA,扫描速度15°/min,扫描角度5°~90°。
1.2.9.4 扫描电镜观察 取少量BHP 及BHP-Fe 样品粘到导电胶上,使用溅射镀膜仪进行喷金处理。分别于200 倍、1000 倍扫描电镜下观察样品形貌[21]。
1.2.9.5 氨基酸组成 参考GB 5009.124-2016《食品中氨基酸的测定》采用全自动氨基酸分析仪对样品进行氨基酸测定[22]。
1.2.10 热稳定性分析 取BHP 及BHP-Fe 样品5 mg 放入铝坩埚中,以空坩埚为空白参照,保护气体为N2,加热速率为10 ℃/min,温度测试范围为20~600 ℃[23]。
1.2.11 体外模拟消化稳定性 参考Brodkorb 等[24]的体外模拟消化方法,制备模拟胃液(Simulated gastric fluid,SGF)和模拟肠液(Simulated intestinal fluid,SIF)待用,同时以硫酸亚铁和乳酸亚铁作为对照进行模拟胃肠道消化,步骤如下:
胃消化阶段:将三种铁补充剂配制成1%溶液置于10 mL 容量瓶中,混合均匀移至消化管中,将消化仪温度调至37 ℃预热20 min,加入8 mL 预热后的SGF,用1 mol/L 的HCl 调pH 至3.0,加入2000 U/mL 胃蛋白酶,和5 μL 的CaCl2(0.3 mol/L),加去离子水至总体积20 mL,于37 ℃下恒温孵育2 h,反应结束后在100 ℃下沸水浴10 min 灭酶终止反应。
肠消化阶段:将模拟胃消化液中加入16 mL SIF,用1 mol/L 的NaOH 调pH 至7.0,加入100 U/mL胰蛋白酶和10 mmol/L 猪胆汁盐3 mL,再加40 μL的CaCl2(0.3 mol/L),加去离子水至总体积为20 mL,于37 ℃下恒温孵育2 h,反应结束后同样进行上述灭酶处理。
将上述胃和肠消化液分别于0、30、60、90、120 min 取1 mL 反应液进行灭酶处理,加入6 倍体积无水乙醇静置沉淀2 h,8000 r/min 离心15 min 后取上清测定游离铁含量[25]。亚铁离子保留率公式如下:
式中:m1—样品的亚铁离子含量(μg);m2—螯合态的亚铁离子含量(μg);V0—测定时所取溶液体积(mL);V—溶液总体积(mL)。
1.3 数据处理
使用SPSS 24.0 进行单因素方差分析和显著性分析,软件Design-Expert V8.0.6 中的Box-Behnken模块设计响应面试验和Origin 2022 软件进行作图。
2 结果与分析
2.1 蛋白酶筛选结果
以七种蛋白酶分别酶解牛血红蛋白,其水解度、多肽含量和Fe2+螯合能力如图1。由七种蛋白酶酶解结果可得,在相同酶解条件下,胃蛋白酶和碱性蛋白酶两者水解度、多肽含量和亚铁离子螯合率均高于其他五种蛋白酶,且处于较高水平,水解度最高的是胃蛋白酶为25.63%,其次是碱性蛋白酶,水解度为21.07%。然而,相同的酶添加量下,碱性蛋白酶酶解液的Fe2+螯合能力为83.93%,多肽含量为14.59 mg/mL,均高于胃蛋白酶,且存在显著性差异(P<0.05)。由于制备多肽的首要评价指标为水解度,在高水平的水解度下多肽含量也会增加,从而Fe2+螯合能力也会随之发生改变。然而,单酶水解法存在水解程度不彻底,产物活性低等问题,影响螯合效果,通过对单酶酶解结果探究,发现制备的肽铁螯合物螯合效果不佳,但过度水解又会导致多肽含量减少,因此,酶解试验采用双酶分步酶解方式,选取胃蛋白酶为初步酶解蛋白酶,在保持合适的水解效率下,以碱性蛋白酶为二次酶解蛋白酶,制备多肽含量和Fe2+螯合能力较高的牛血红蛋白肽,并探究碱性蛋白酶二次酶解最佳酶解条件。
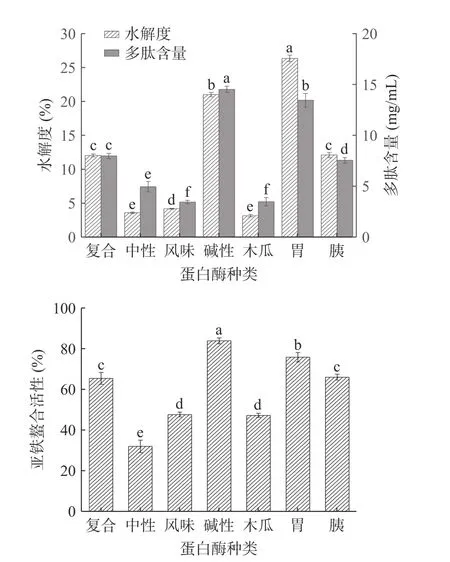
图1 不同蛋白酶种类对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.1 Effects of different protease types on the degree of hydrolysis,polypeptide content and Fe2+ chelating ability of bovine hemoglobin
2.2 单因素实验结果
2.2.1 料液比对酶解效果的影响 由图2 可知,料液比为1:1 时,多肽含量最高为15.84 mg/mL,料液比为1:5 时,水解度最高为48.93%。随着料液比的增加,牛血红蛋白的水解度显著提高(P<0.05),多肽含量显著降低(P<0.05),说明体系中多肽被过分水解生成了大量游离氨基酸,同时疏水性氨基酸可能更多地暴露在多肽表面,对多肽螯合亚铁形成一定阻力,从而导致其亚铁结合能力显著下降[26]。水解度和多肽含量呈相反趋势,由于水分含量较少血红蛋白无法完全释放,从而导致水解度较低,而水分含量较高又会使多肽降解为氨基酸,使多肽含量减少,不利于高含量多肽的制备。此外,随着料液比的增加,牛血红蛋白酶解物的亚铁结合能力先缓慢升高后显著下降(P<0.05)。因此,综合考虑,选择料液比1:3 用于后续试验,且不再对该因素进行优化。
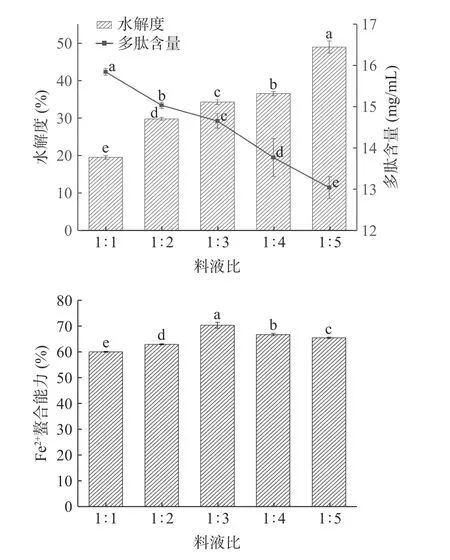
图2 料液比对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.2 Effects of solid-liquid ratio on the degree of hydrolysis,peptide content and Fe2+ chelating ability of bovine hemoglobin
2.2.2 酶解pH 对酶解效果的影响 pH 是影响酶解效果的重要影响因素之一,其变化会直接使蛋白酶分子结构的空间构象发生改变,以及影响酶与底物的结合状态及螯合物的内部解离,从而影响酶解反应速率与酶解液亚铁螯合能力[16]。由图3 可知,不同pH 下牛血红蛋白酶解液的水解度变化趋势逐渐升高,主要是因为碱性蛋白酶的碱性作用越来越强。同时,随着反应体系pH 的增大,牛血红蛋白酶解物的Fe2+螯合能力逐渐升高后趋于平稳。当pH 为10.5 时水解度达到最高值为26.39%。当pH 为9.5 时多肽含量最高为15.04 mg/mL,Fe2+螯合能力为67.87%。因此选择pH 为9.5 进行后续试验。
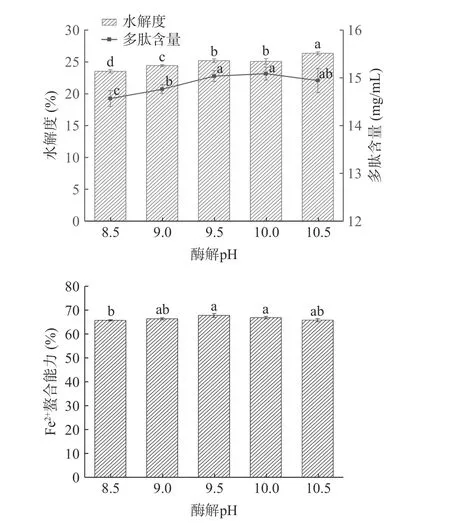
图3 pH 对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.3 Effects of pH on the degree of hydrolysis of bovine hemoglobin,peptide content and Fe2+ chelating ability
2.2.3 酶添加量对酶解效果的影响 酶添加量是酶解工艺中的重要的影响因素之一。如图4 所示,碱性蛋白酶添加量不断增加,酶解物的Fe2+螯合能力大体上处于平稳趋势,加酶量为6000 U/g 和8000 U/g时,其Fe2+螯合能力显著高于其他水平(P<0.05),达到69.23%。由图4 可知,当碱性蛋白酶添加量为10000 U/g 时,水解度最高为26.81%,然而在添加量为6000 U/g 时,多肽含量达到最大值14.27 mg/mL,Fe2+螯合能力为68.02%。随着加酶量的增加,牛血红蛋白的水解度不断提高后趋于平稳,但多肽含量显著降低,说明加酶量大于6000 U/g 后,多肽被过度水解,游离氨基酸含量增加[27]。由于加酶量大于6000 U/g 时,多肽含量降低。综合考虑,选取6000 U/g的酶添加量用于后续试验。

图4 酶添加量对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.4 Effects of enzyme supplemental levels on the degree of hydrolysis of bovine hemoglobin,polypeptide content and Fe2+ chelating ability
2.2.4 酶解温度对酶解效果的影响 由图5 可知,温度在45~60 ℃时,水解度和多肽含量随温度增加而明显降低。45 ℃时多肽含量达到最高为14.99 mg/mL,Fe2+螯合能力为68.46%,40 ℃时水解度最高为33.59% 与45 ℃时水解度无显著性差异(P>0.05)。在 50 ℃之后,水解度却显著降低,这是由于温度的升高,使得酶的活力增大;而超过一定温度时,酶发生热变性,结构被逐渐破坏,活力下降,从而水解度降低,导致螯合率下降[28]。根据结果,选择 45 ℃作为酶解的最佳温度。
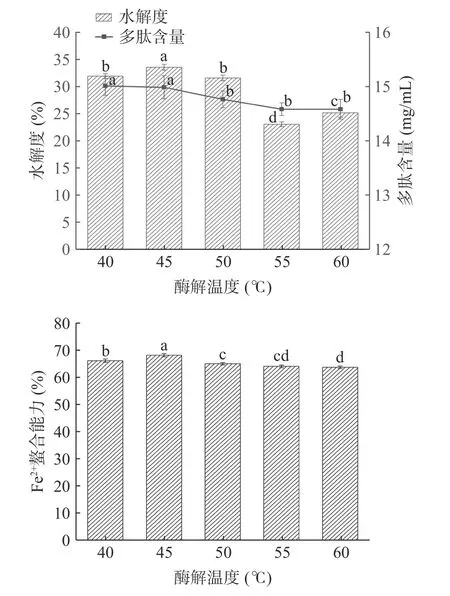
图5 酶解温度对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.5 Effects of enzymatic hydrolysis temperature on degree of hydrolysis of bovine hemoglobin,polypeptide content and Fe2+ chelating ability
2.2.5 酶解时间对酶解效果的影响 牛血红蛋白酶解液的水解度和多肽含量如图6 所示,随酶解时间的延长,两者均呈先显著增长后趋于平稳,由于酶解产物随着酶解时间增加不断产生,因而酶解反应会受到一定的抑制;随着时间的延长,水解度整体呈现先增加后逐渐降低的趋势,多肽含量呈现逐渐降低的趋势,2 h 时,水解度最高为35.76%,多肽含量最高为15.13 mg/mL,其中酶解2 h 和3 h 时的酶解物Fe2+螯合能力显著增高。由于时间和效率问题,后续试验选取酶解时间为2 h 且不在对该因素进行优化。
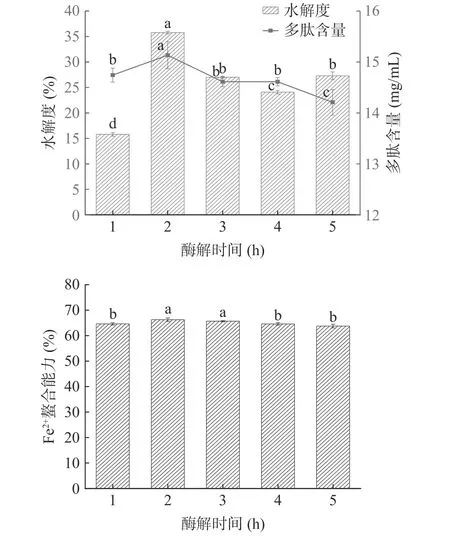
图6 时间对牛血红蛋白水解度、多肽含量和Fe2+螯合能力的影响Fig.6 Effects of time on degree of hydrolysis,peptide content and Fe2+ chelating ability of bovine hemoglobin
2.3 响应面试验结果及方差分析
2.3.1 响应面优化试验结果 根据螯合反应的单因素实验结果,通过Design-Expert.V8.0.6.1 响应面软件对酶解pH,酶解温度(℃),酶添加量(U/g)进行三因素三水平响应面工艺优化,以水解度和Fe2+螯合能力为响应值,试验结果见表3。
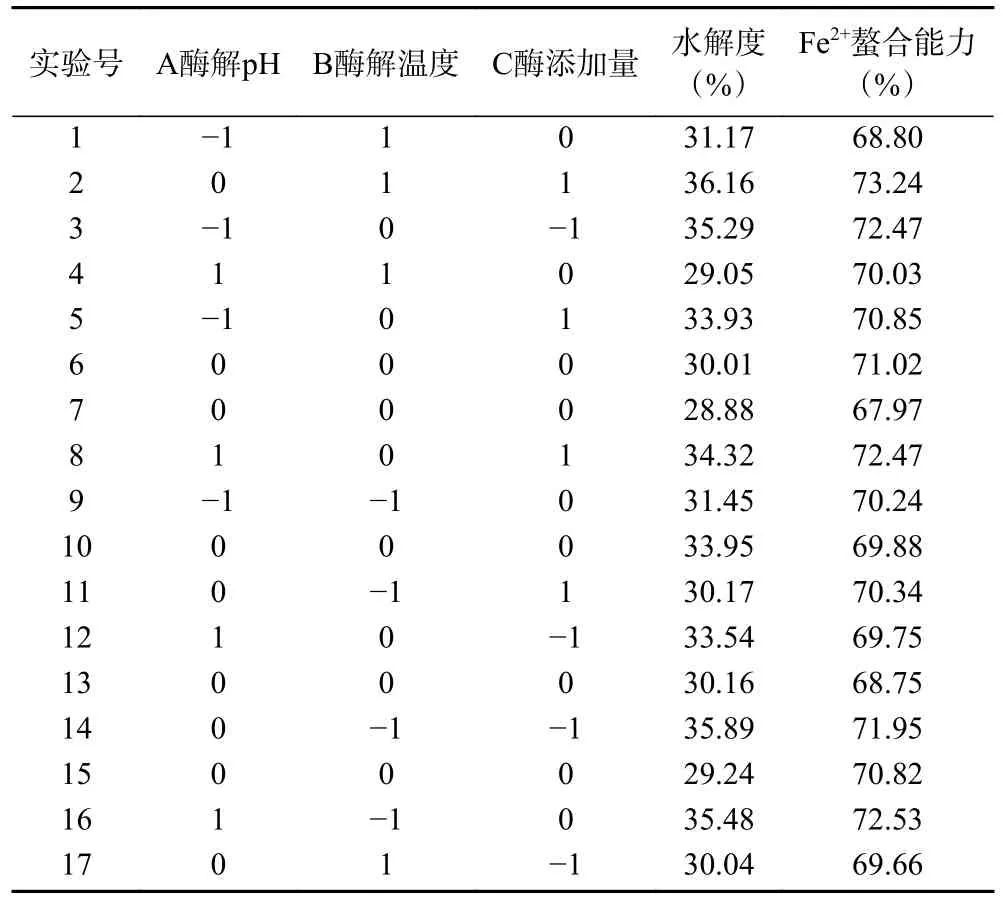
表3 响应面试验设计结果Table 3 Response surface experimental design results
2.3.2 水解度结果及方差分析 由表4 方差分析结果可知,以水解度为因变量时,构建的回归模型极显著P=0.0008<0.01,模型校正后的R²Adj=0.8880,说明该水解度模型能够解释88.8%的响应值变化,且拟合性较高。失拟项的P=0.2198>0.05,失拟不显著,表明试验误差较小,可以真实反映响应面的拟合,进一步证明该模型能够用于牛血红蛋白酶解工艺的优化。经逐步回归分析,得到多元二次方程式为:Y1=35.43+1.05A+0.69B-0.99C+0.93AB-1.31AC-0.83BC-2.30A2-2.66B2-1.74C2,F值表示各因素对水解度影响程度大小,通过表4 中3 个自变量的F值大小结果,可以推断出各因素对水解度的影响程度高低为:酶解pH>酶添加量>酶解温度。
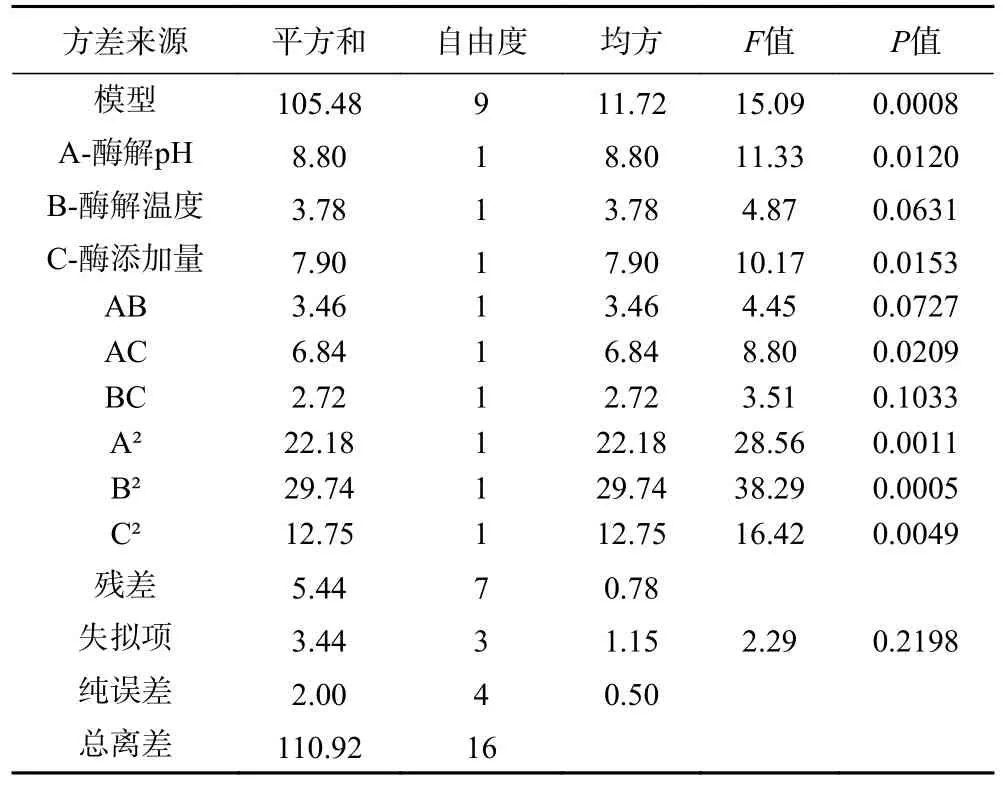
表4 水解度方差分析结果Table 4 Hydrolysis degree variance analysis results
各因素的交互作用对水解度的影响如图7 所示。响应面的陡峭程度反映了各因素之间交互作用对水解度的影响,利用Design-Expert 绘制目标函数水解度的三维表面响应图与等高线图,并用于评估三个自变量(酶解pH(A)、酶解温度(B)、酶添加量(C))与水解度之间的相互作用关系[29]。由图7 可知,各因素交互三维图在选定范围内均有最高点,表明酶解条件的选取合理。与其它项相比,AC 的交互作用存在显著性影响(P<0.05),而AB 和BC 之间的交互作用对水解度影响不显著(P>0.05),说明其与水解度交互相关性小[30]。
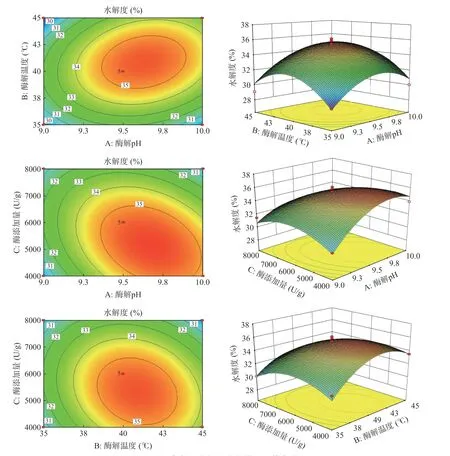
图7 酶解条件对水解度响应曲面和等高线图Fig.7 Response surface and contour diagram of hydrolysis degree under enzymatic hydrolysis conditions
2.3.3 Fe2+螯合能力结果及方差分析 由表5 方差分析结果可知,当Fe2+螯合能力为因变量时,构建的回归模型极显著P=0.0003<0.01,模型校正后的R²Adj=0.9637,说明该Fe2+螯合能力模型能够解释96.37%的响应值变化,且拟合性较高。失拟项的P=0.5891>0.05,失拟不显著,表明试验误差较小,可以真实反映响应面的拟合,进一步证明该模型能够用于牛血红蛋白酶解工艺的优化。多元二次方程式为:Y2=72.53+0.55A+0.59B+0.65C-0.22AB-0.087AC-0.12BC-1.43A2-1.47B2-1.13C2。F值表示各因素对Fe2+螯合能力影响程度大小,通过上表中3 个自变量的F值大小可以推断出各因素对水解度的影响程度高低为:酶添加量>酶解温度>酶解pH。
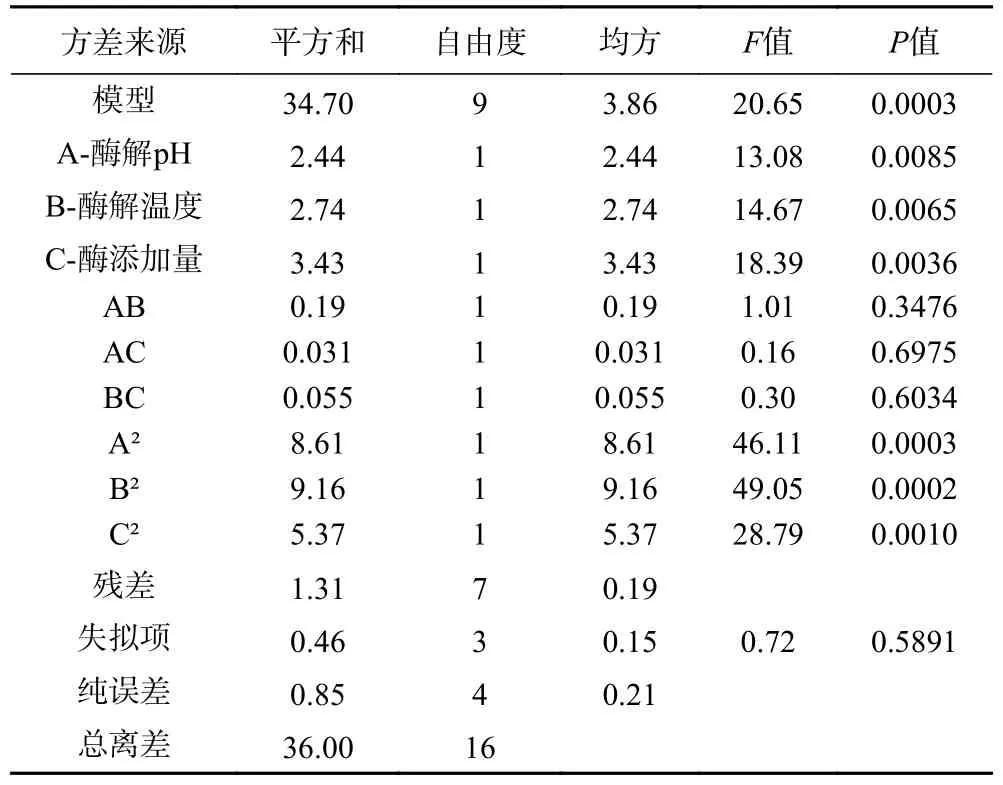
表5 Fe2+螯合能力方差分析结果Table 5 Results of variance analysis of Fe2+ chelating ability
如图8 所示,反映了三个因素中一个独立变量在其中心点保持不变时,其他两个因素的交互作用对Fe2+螯合能力的影响[29]。其中,酶解pH(A)、酶解温度(B)、酶添加量(C)三因素三维图均是凸面,且都有最高点,表明模型适用于BHP 的酶解条件优化。酶解pH、酶解温度和酶添加量三因素对Fe2+螯合能力均存在显著性影响(P<0.05),而三因素两两之间的交互作用对Fe2+螯合能力影响不显著(P>0.05),响应曲面较为平缓,等高线图接近于圆形,表明Fe2+螯合能力与其相关性相对较小。但各因素二次项对Fe2+螯合能力有极显著影响(P<0.01),与方差分析结果一致[30]。
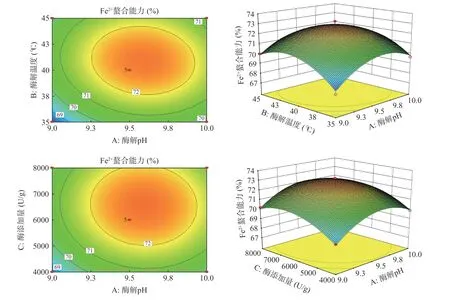

图8 酶解条件对Fe2+螯合能力响应曲面和等高线图Fig.8 Response surface and contour diagram of enzymatic hydrolysis conditions to ferrous chelation rate
2.3.4 响应面优化试验结果 该部分对牛血红蛋白酶解过程中三种影响较大的酶解因素进行了研究,运用响应曲面法对酶解pH、酶解温度和酶添加量进行优化,得出结论如下:
水解度(Y1)与酶解pH(A)、酶解温度(B)和酶添加量(C)之间的二次多项回归方程为:Y1=35.43+1.05A+0.69B-0.99C-1.31AC-2.30A2-2.66B2-1.74C2,最优酶解工艺为:酶解pH9.7,酶解温度41 ℃,酶添加量5169 U/g,水解度预测值35.86%。
Fe2+螯合能力(Y2)与酶解pH(A)、酶解温度(B)和酶添加量(C)之间的二次多项回归方程为:Y2=72.53+0.55A+0.59B+0.65C-1.43A2-1.47B2-1.13C2。最优酶解工艺为:酶解pH10,酶解温度41 ℃,酶添加量6579 U/g,Fe2+螯合能力预测值71.98%。
根据试验目标和实际可操作性,为达到水解度和Fe2+螯合能力最高的要求,三因素的最终酶解条件为:酶解pH9.8,酶解温度41 ℃,酶添加量5900 U/g。通过验证试验可得,在酶解pH9.8,酶解温度41 ℃,酶添加量5900 U/g,料液比1:3,酶解时间2 h 的条件下,牛血红蛋白的水解度为35.07%,Fe2+螯合能力为72.11%,在回归方程预期值误差范围内,表明此条件下,该模型可用的预测牛血红蛋白酶解工艺,为实际操作奠定了理论基础。
2.4 牛血红蛋白肽铁螯合物
2.4.1 紫外光谱分析 紫外扫描结果见图9,BHPFe 和BHP 相比有明显的差异偏移,BHP 在225 和278 nm 处有较大吸收峰,发生螯合反应后,BHP-Fe的特征吸收峰在231 nm 处,红移了6 nm,且BHPFe 的吸收强度高于BHP,然而278 nm 处的吸收峰消失,可能是由于酪氨酸、色氨酸和苯丙氨酸在与亚铁离子螯合反应过程中的电荷发生迁移。研究表明,多肽与金属离子螯合后,吸收峰的位置变化与C=O,COOH,–OH 和-NH2这些发色基团和助色基团的手性变化有关[31]。
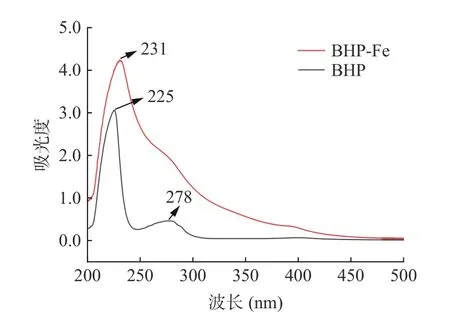
图9 BHP 和BHP-Fe 的紫外光谱图Fig.9 UV spectra of BHP and BHP-Fe
2.4.2 红外光谱分析 BHP 和BHP-Fe 的红外光谱图如图10 所示,BHP 极有可能是通过多肽链中的氨基残基和羧基与亚铁离子相互作用。在1541.8 cm-1和1393.3 cm-1处观察到的BHP 的吸收峰对应于酰胺I 和酰胺II 的振动。虽然酰胺I 和酰胺II 的条带没有变化,但在与亚铁离子结合时,吸收峰的强度较弱。在BHP-Fe 红外光谱图中显示,在1039.5 cm-1和1163.4 cm-1处出现了两个明显的吸收峰,这很可能是由于C-O-Fe 配位键的形成[32]。1400 cm-1附近为吸收峰。BHP 在1393.3 cm-1处的吸收峰与亚铁离子螯合后蓝移至1381.3 cm-1,可能是由于氨基酸残基侧链基团-COO-伸缩振动引起的[33]。BHPFe 在3272.4 cm-1处的吸收峰对应于N-H 的拉伸振动,O-H 移至3315.63 cm-1,Fe-N 键取代了N-H,表明N-H 参与了螯合反应。1642.6 cm-1处的吸收峰对应酰胺I(C-O)的振动,螯合后位移至1647.1 cm-1,表明C-O 基团参与了螯合,可能是由于碳基氧的非键自由电子对与亚铁离子螯合[34]。此外,1541.8 cm-1对应的酰胺II(N-H 和C-N)的吸收带移至1588.1 cm-1,主要是由于N-H 变形和肽键的C-N 拉伸引起的[6,17]。综上,BHP 与亚铁离子的螯合位点主要对应于羧基氧原子和氨基氮原子。
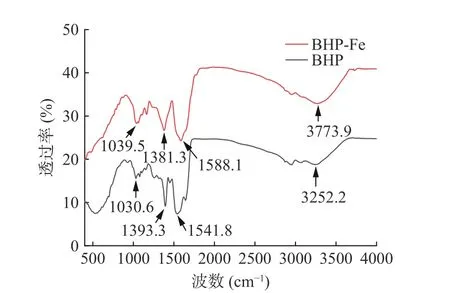
图10 BHP 和BHP-Fe 的红外光谱图Fig.10 Infrared spectra of BHP and BHP-Fe
2.4.3 X 射线衍射分析 如图11 所示,BHP 在衍射角为21.15°处出现了宽大的特征衍射峰,在31.66°和45.55°两处出现较为狭窄的衍射峰,说明BHP 是呈弥散状态,且不规则的非晶体结构。而发生螯合反应之后,BHP-Fe 仅在衍射角度26.20°有一处最大特征衍射峰,分子结晶度发生变化,可能是亚铁离子与BHP 之间的结合是通过离子键和配位键形式与多肽发生作用生成了新物质[35]。而亚铁离子在反应体系中呈高度分散状态,经螯合生成了新的晶体结构,表明BHP-Fe 是具有不同于多肽形态的新晶型结构。
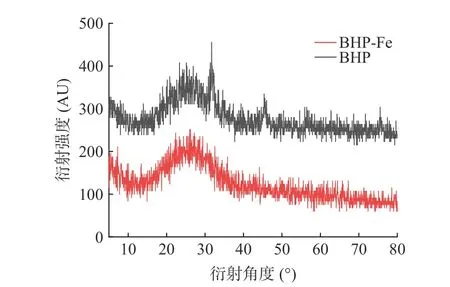
图11 BHP 和BHP-Fe 的X 射线衍射图Fig.11 X-ray diffraction of BHP and BHP-Fe
2.4.4 扫描电镜分析 图12 分别是BHP 在200、1000 倍扫描电镜下的微观结构,BHP 为粒径大小不同的不规则碎片状结构,表面较为光滑。多肽与亚铁离子结合后,如图12 所示,螯合物的粒径变小,呈断裂块状或小颗粒状存在且有更细小碎片附着,表面较粗糙。二者的微观形态存在明显差异,可推测BHP 与亚铁离子主要通过离子键和配位键相互作用形成了螯合物,这与红外光谱分析得到BHP 通过羧基氧及氨基氮与亚铁离子发生结合,及XRD 分析得到的BHP 与亚铁之间并不是简单的物理混合的结论相一致,且二者之间存在部分吸附作用。这种适度的相互作用力,一方面有助于提高亚铁在消化道中的稳定性;另一方面,螯合物借助肽转运系统进入肠细胞后,在肠细胞液的作用下易释放亚铁离子,从而促进铁的吸收利用。

图12 BHP 和BHP-Fe 的微观结构Fig.12 Microstructure of BHP and BHp-Fe
2.4.5 氨基酸组成分析 分别对BHP 和BHP-Fe 进行氨基酸组分分析,结果如表6 所示。研究表明多肽的金属离子结合能力与氨基酸组成密切相关,其中天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸等含有特殊侧链基团,如羧基、氨基、胍基和咪唑基已被证实对金属离子具有高亲和性,多肽的金属离子结合能力也与这些氨基酸的含量呈正相关性[36]。由于BHP 为混合物,螯合前后氨基酸含量的变化与含有上述氨基酸的多肽与亚铁离子结合生成螯合物的变化有关,因此。BHP 在螯合前后的氨基酸组成及含量如表6 所示,BHP 富含天冬氨酸(66.42 mg/g)、谷氨酸(54.19 mg/g)和赖氨酸(60.92 mg/g)。对比BHP,BHP-Fe 中天冬氨酸(85.29 mg/g)、谷氨酸(92.95 mg/g)、赖氨酸(65.16 mg/g)的含量均有所提高。其中,天冬氨酸和谷氨酸因自身具有环状结构,其侧链羧基可能为多肽和亚铁的螯合提供结合位点,从而形成稳定的螯合物,与红外光谱分析图谱的结果相吻合[16]。相关研究表明,含有羟基及巯基侧链的半胱氨酸在金属螯合中起关键作用,BHP 在螯合前后,其半胱氨酸的含量从0.63 mg/g 提升到了0.66 mg/g,说明半胱氨酸可能也参与了亚铁的螯合[25]。

表6 氨基酸组成分析Table 6 Analysis of amino acid composition
2.5 热重分析
不同温度环境下的热解速率可以反映两者的化学结构变化和螯合前后物质的熔点变化。如图13所示,BHP 和BHP-Fe 在初始升温从室温至100 ℃阶段都发生了不同程度的重量损失,这主要是因为样品中水分蒸发,BHP-Fe 相较于BHP 的损失幅度较大,说明两者含水量存在一定差异。热重分析(Thermogravimetry Analysis,TGA)图显示,BHP 在140 ℃时开始有机分解,且降解过程中非共价键会发生裂解。热失重曲线(Differential thermogravimetric curve,DTG)图显示,BHP 在301 ℃时达到最大分解速率,而BHP-Fe 在403 ℃时达到最大分解速率,但质量损失率小于BHP,说明在300 ℃以上较高温度范围的条件下,BHP-Fe 热稳定性更高。而在0~300 ℃的较低温度下,BHP-Fe 没有BHP 耐热。
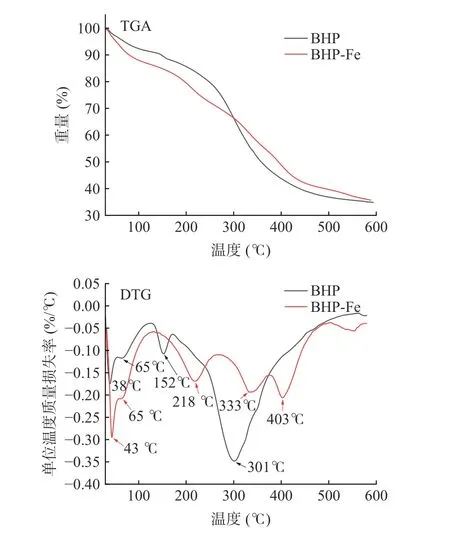
图13 BHP 和BHP-Fe 的热重曲线和热重损失曲线图Fig.13 TG curves and TG loss curves of BHP and BHP-Fe
2.6 体外模拟消化稳定性分析
三种铁补充剂在模拟胃液消化中的铁保留率情况如图14 所示,以硫酸亚铁、乳酸亚铁作对照。随着胃消化时间的延长,三种铁补充剂中的铁保留率呈不断下降趋势。0 到120 min 时,BHP-Fe 铁保留率从87.62%显著下降至48.34%(P<0.05);硫酸亚铁在0 到60 min 的过程中,铁保留率从80.15%显著下降至38.93%(P<0.05);60 到120 min,铁保留率无显著性变化(P>0.05);乳酸亚铁的铁保留率同样呈显著下降趋势,但其整体铁保留率高于硫酸亚铁。这可能由于在高浓度酸性体系中,H+与Fe2+竞争与多肽的结合位点,铁补充剂中的亚铁离子释放出来变成游离铁,从而导致BHP-Fe 的铁保留率下降。然而在胃蛋白酶的作用下肽分子构象发生改变,由于螯合物中的多肽可能被再次水解,导致BHP 与亚铁结合能力变弱,亚铁离子易从螯合物中解离出来使其稳定性变差[37]。
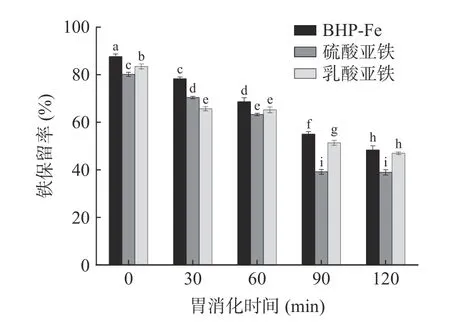
图14 模拟胃消化时间对不同铁补充剂稳定性影响Fig.14 Effects of simulated gastric digestion time on stability of different iron supplements
如图15 所示,随肠消化时间的延长,螯合物的铁保留率的变化逐渐下降后呈平稳趋势,最终维持在一定水平。0 到30 min 时,BHP-Fe 的铁保留率从92.91%到93.36%,无显著性变化。从60 至120 min,其铁保留率先显著下降(P<0.05)后趋于平稳,2 h 后螯合物的铁保留率依然维持在80.27%的水平,说明BHP-Fe 在模拟肠消化过程中具有良好的稳定性,对消化酶有一定耐受性,具有促进铁在小肠处吸收利用的潜能[38]。从0 到120 min,硫酸亚铁和乳酸亚铁的在肠液环境下的铁保留率水平均低于BHP-Fe,且两者在肠消化时间中对其铁保留率的整体影响不大,在90 到120 min,无显著性变化,最终2 h 时的铁保留率维持在68.78%~70.73%,稳定性水平低于螯合物。综上可推测,BHP-Fe 从胃液的酸性环境进入到肠液的碱性环境中,肠液体系的碱性条件下也有利于螯合反应发生,此时体系中游离的多肽和游离铁重新发生螯合,因而整体铁保留率提高。所以,经长时间消化后,BHP-Fe 在肠液中仍能维持在较高水平的铁保留率,且其稳定性高于硫酸亚铁和乳酸亚铁[21,37]。
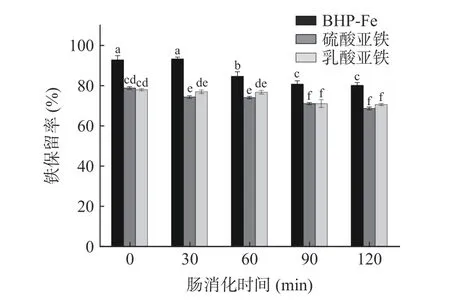
图15 模拟肠消化时间对不同铁补充剂稳定性影响Fig.15 Effect of simulated intestinal digestion time on stability of different iron supplements
3 结论
本文通过七种商业蛋白酶筛选试验,得到胃蛋白酶和碱性蛋白酶分步酶解牛血红蛋白的最适方式,单因素结合响应面优化得到牛血红蛋白肽最佳工艺。在此条件下,牛血红蛋白水解度和牛血红蛋白肽的Fe2+螯合能力最高,与亚铁螯合之后所制备的牛血红蛋白肽铁螯合物具有潜在的应用价值。分析了牛血红蛋白肽亚铁螯合物的结构及消化稳定性,结果表明BHP-Fe 在胃肠环境中具有良好的消化耐受性,相较于普通的补铁剂稳定性更高。因此,本研究结果牛血红蛋白肽铁螯合物可作为食源性新型补铁剂。此外,肽铁螯合物的生物活性受多种因素影响,是各种条件综合的结果。因此,后续还需研究阐明具体的螯合作用机制,进一步探究其在体内的吸收利用情况,以期提高铁在体内的生物利用度。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

