胃腺癌患者血浆脂肪酸组分变化及其对临床分期的预测效能
吴生为,丁潇东,毛伟征
1 南京医科大学青岛临床医学院,山东青岛 266071;2 青岛市市立医院普外科
中国每年新增胃癌患者47.9万例,几乎占了全球胃癌新增病例的一半[1]。胃癌中胃腺癌占比高达95%以上,胃腺癌患者的生存时间及预后与临床分期密切相关。早期胃腺癌患者通过胃腺癌根治术可以获得较好的预后,但是多数患者早期症状不明显,确诊时已处于中晚期,而这类患者手术治疗后的5年生存率低于30%[2]。因此,早期发现并且准确评估胃腺癌分期,对于制定最佳治疗方案及患者预后有直接影响。目前,临床上确定胃腺癌分期以病理检查结果为金标准,虽然其可以准确诊断患者病情,但是因为病理检查具有一定的侵入性、创伤性,部分患者的接受度不高。研究表明,肿瘤细胞生长、增殖、分化和转移均与脂质代谢密切相关[3]。脂肪酸是脂质的重要组成部分,参与了肿瘤细胞的信号传导,其异常表达与乳腺癌、卵巢癌、结直肠癌和膀胱癌等肿瘤的发生发展密切相关[4-6]。但是,胃腺癌患者血浆脂肪酸谱是否已经发生改变及其是否可以预测患者的临床分期鲜见报道。2023年1月—8月,本研究比较了不同临床分期胃腺癌患者的血浆脂肪酸组分,为患者术前确定临床分期提供依据。现报告如下。
1 资料与方法
1.1 临床资料 纳入标准:①行开放或微创胃腺癌根治性切除手术;②术后经病理检查确诊为胃腺癌;③临床资料完整。排除标准:①合并严重的心脑血管疾病、肝肾功能障碍、甲状腺功能亢进、糖尿病、艾滋病等;②术中联合其他脏器切除;③术前行放化疗、免疫治疗及脂肪乳营养支持治疗。④术前影像学检查显示存在肝、肺等远处转移。选择同期青岛市市立医院收治并符合上述标准的胃腺癌患者40例,根据第8版美国癌症联合会(AJCC)的临床病理分期标准,分为早期组(Ⅰ、Ⅱ期)21例、中晚期组(Ⅲ、Ⅳ期)19例。早期组男16例、女性5例,年龄(66.95 ± 9.48)岁,BMI(24.13 ± 3.84)kg/m2,吸烟3例;中晚期组男13例、女性6例,年龄(66.21 ± 10.92)岁,BMI(22.26 ±2.65)kg/m2,吸烟6例。两组上述资料均具有可比性(P均>0.05)。本研究通过青岛市市立医院伦理委员会批准(2023临审字第180号),患者及家属均签署知情同意书。
1.2 血浆脂肪酸占比检测 采用气相色谱法。两组均在术前留取静脉血5 mL,3 000 g/min离心15 min,保存血浆。氯仿/甲醇(1∶ 1v/v)浸提血浆中的脂质,与硫酸甲醇3 mL、甲苯1 mL混合,70 ℃条件下保持2 h,生成脂肪酸甲酯。正己烷萃取,使用Sep-Pak硅胶柱过滤。氮吹仪除去溶剂,重新溶解在正己烷中。使用配备Agilent DB-23色谱柱(60 m,0.25 mm ×0.25 μm)的气相色谱系统,检测血浆中各类脂肪酸占总脂肪酸的百分比。样品进口温度为260 ℃,N2、H2压力分别为50、75 kPa;温度程序:140 ℃、0~2 min,140~160 ℃、2~3 min,160 ℃、3~8 min,160~180 ℃、8~9 min,180 ℃、9~21 min,180~200 ℃、21~22 min,200 ℃、22~30 min,200~205 ℃、30~30.25 min,205 ℃、30.25~41.25 min。
1.3 统计学方法 采用SPSS26.0统计软件。计量资料采用S-W法检验正态性,呈正态分布以±s表示,两组间比较采用Student-t检验;非正态分布以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验。绘制两组间比较有差异的血浆脂肪酸单独及联合预测患者临床分期的ROC曲线,计算曲线下面积(AUC),分析其预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组血浆脂肪酸占比比较 按照长短来分:早期组血浆短链脂肪酸(SCFA)、中链脂肪酸(MCFA)、长链脂肪酸(LCFA)占比分别为0.13%(0.04%,0.53 %)、1.66%(0.16%, 2.41%)、96.93%(92.20%, 99.66%),中晚期组分别为0.49%(0.14%, 0.91%)、1.88%(0.24%, 3.52%)、95.64%(93.72%, 98.51%),两组比较差异均无统计学意义(P均>0.05)。按照结构来分:两组血浆饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)及PUFA中的Ω-3多不饱和脂肪酸(Ω-3PUFA)、Ω-6多不饱和脂肪酸(Ω-6PUFA)占比比较差异均无统计学意义(P均>0.05);中晚期组血浆SFA中的棕榈酸(PA,C16: 0)占比高于早期组,Ω-3PUFA的α-亚麻酸(ALA,C18: 3n3)占比低于早期组(P均<0.05);两组其他血浆脂肪酸占比比较差异均无统计学意义(P均>0.05)。见表1。
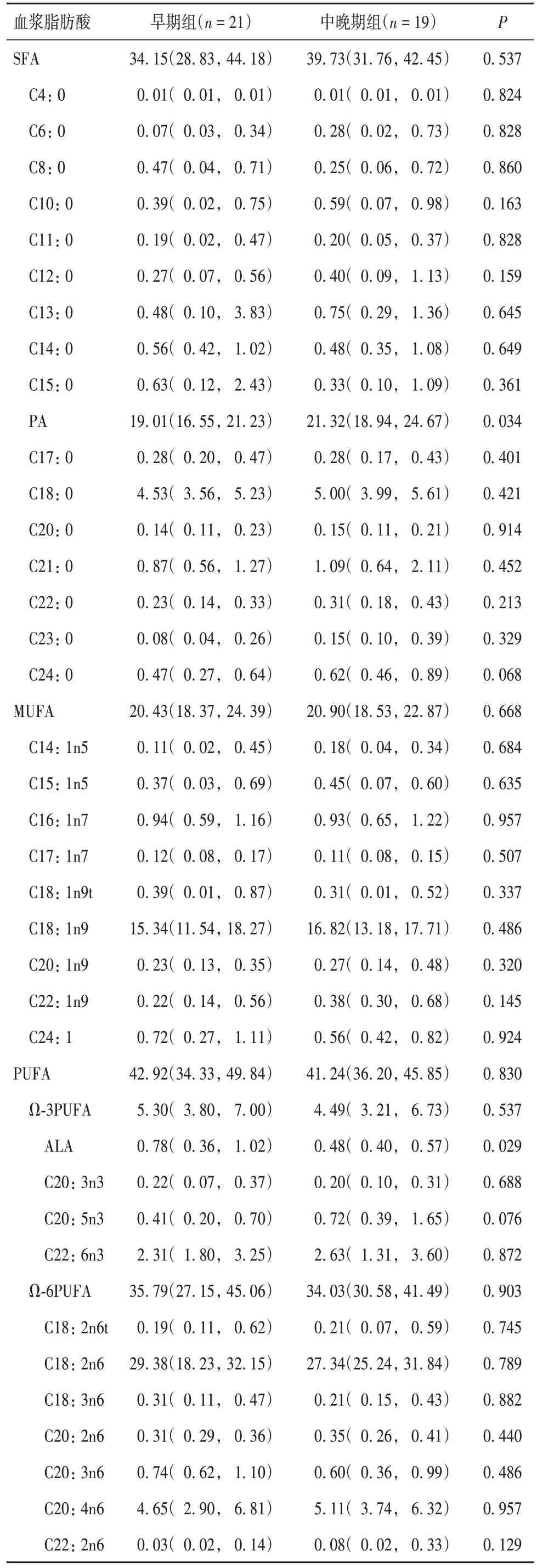
表1 两组血浆脂肪酸占比比较[%,M(P25,P75)]
2.2 血浆PA、ALA单独及联合对胃腺癌分期的预测价值 血浆PA、ALA单独及联合预测胃腺癌分期的AUC及95%CI分别为0.697(0.534~0.860)、0.703(0.528~0.878)、0.797(0.657~0.937),敏感度分别为58.0%、66.7%、63.2%,特异度分别为76.0%、84.2%、90.5%。见表2及图1 ~ 3。
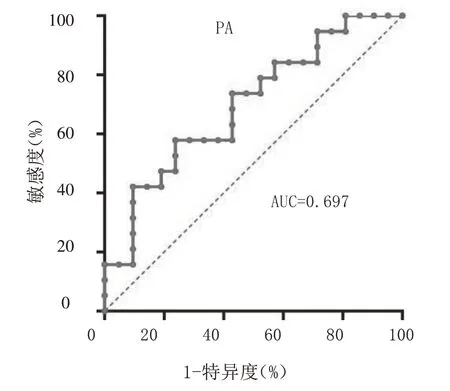
图1 血浆PA预测胃腺癌患者临床分期的ROC曲线
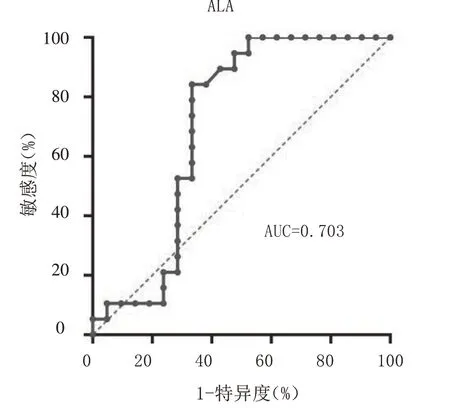
图2 血浆ALA预测胃腺癌患者临床分期的ROC曲线
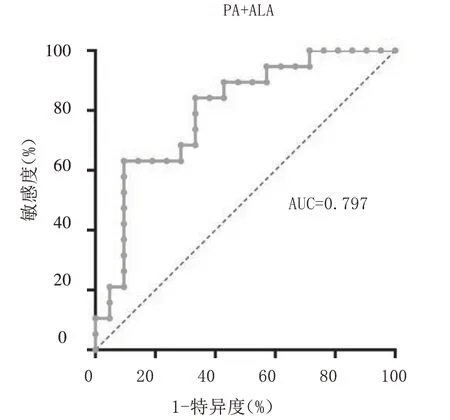
图3 血浆PA和ALA联合预测胃腺癌患者临床分期的ROC曲线
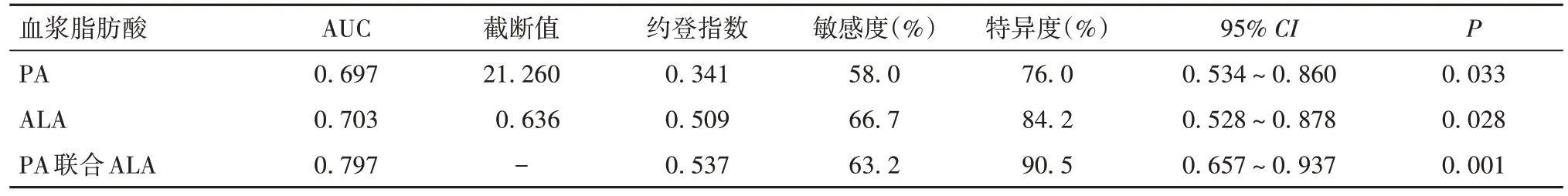
表2 胃腺癌患者血浆中PA和ALA的ROC 曲线分析结果
3 讨论
肿瘤转移及侵袭是中晚期胃腺癌患者预后不良的关键因素,脂质代谢参与了细胞膜合成、能量稳定以及细胞信号传导等过程,血浆中脂肪酸的代谢异常会为肿瘤细胞提供有利于其生存的肿瘤微环境,也是肿瘤发生发展的主要特征之一[3]。为了探究血浆脂肪酸代谢组学与胃腺癌临床病理分期的关系,本研究采用气相色谱法对40例胃腺癌患者的血浆脂肪酸占比进行分析;结果显示,中晚期胃腺癌患者较早期患者的血浆PA占比升高、ALA占比降低,并且二者联合检测有助于临床分期的预测,可以用于指导术前临床分期,进而选择治疗方案。
PA是人体血液中的一种主要SFA,也是高脂饮食中的主要脂肪酸。研究显示,PA可以为肿瘤细胞提供能量,并参与调节促进肿瘤进展的细胞内信号分子,从而促进肿瘤细胞增殖和转移[7]。PA可以通过CD36依赖性方式促进黑色素瘤、口腔癌和乳腺癌转移,还可以通过激活STAT3信号通路促进前列腺癌细胞增殖[8]。最近的一项研究显示,PA还可以受到代谢酶酰基辅酶 A氧化酶1(ACOX1)去磷酸化诱导发生重编程,促进β-连环蛋白棕榈酰化和稳定激活β-连环蛋白信号传导,从而促进结直肠癌的进展[9]。动物实验显示,外源性PA可以由脂肪酸的细胞表面受体CD36介导,通过Akt蛋白磷酸化,促进腹膜种植胃腺癌小鼠的转移[10]。这与本研究观察到的中晚期胃腺癌患者血浆PA占比升高的结果相符。另外,该研究还发现,同样是SFA的硬脂酸具有潜在抑制胃腺癌转移的生物学效应,这表明不同SFA的生物学功能也会存在差异[10]。因此,通过气相色谱法分析每种脂肪酸在胃腺癌中的代谢组学特征是非常有必要的。但是也有研究发现,PA在胃腺癌组织中表达下调,并且高浓度PA可特异性抑制AGS、SGC-7901和MGC-803胃腺癌细胞增殖、侵袭和转移[11]。因此,PA对于不同肿瘤细胞的影响目前是有争议的,需要更多大样本实验明确其作用。
ALA作为人体的必需脂肪酸,主要存在于绿叶蔬菜的叶绿体中,同时也是Ω-3PUFA家族的母体脂肪酸,可以转化为其他具有生物活性的物质,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),这些脂质代谢物可以生成炎症特化促消退介质(SPMs),从而影响肿瘤微环境[12]。一项针对胃腺癌病变进展的长期前瞻性随访研究发现,ALA与胃腺癌早期上皮内瘤变和胃腺癌总体风险呈负相关关系,尤其是与肠化生进展的负相关系数较高[13]。本研究结果显示,中晚期胃腺癌患者血浆脂肪酸中ALA占比下降。ALA可以通过脂质过氧化、增加肿瘤细胞中活性氧的产生以及线粒体功能障碍等方式,抑制肿瘤细胞生长和诱导其凋亡[14]。在肿瘤微环境中,ALA等Ω-3PUFA的减少有助于肿瘤细胞从铁死亡(一种与氧化脂质相关的铁依赖性和非凋亡形式的细胞死亡形式)中逃逸[15]。因此,过量摄入Ω-3PUFA可能是一种选择性辅助抗肿瘤方式。
综上所述,中晚期胃腺癌患者血浆PA占比高于早期患者、ALA占比低于早期患者,二者联合检测有助于胃腺癌患者术前判断临床分期。但本研究只针对代谢组学中的脂肪酸进行了差异比较,未全面考虑其他代谢通路,后续还需对其他代谢通路进行全面研究。

