消皮素B在人主动脉夹层组织中的表达变化及对主动脉平滑肌细胞焦亡、炎症反应的影响
沈小艳,谢孝平,李博文,王志维
武汉大学人民医院心血管外科,武汉 430060
主动脉夹层是一种十分危急的主动脉疾病,在未得到及时治疗的情况下病死率极高。目前,主动脉夹层的治疗方法主要是开放手术和介入治疗,但由于手术难度大、治疗时机晚、病损区域常累及内脏动脉,手术成功率和术后存活率均较低[1]。因此,深入研究主动脉夹层发生的病理生理机制,寻找相关治疗靶点对于改善患者预后具有重要意义。细胞焦亡是新发现的一种细胞程序性死亡方式,消皮素(GSDM)蛋白家族成员可以通过介导细胞焦亡、释放炎症因子、调节炎症反应等机制,参与多种炎症疾病的发生发展[2-3]。消皮素B(GSDMB)是GSDM蛋白家族成员之一,在细胞焦亡和炎症反应中同样发挥重要作用。研究表明,GSDMB蛋白与半胱氨酸蛋白酶4(Caspase-4)结合可增强Caspase-4的活性,促进消皮素D(GSDMD)裂解为N-消皮素D(N-GSDMD),而GSDMD和N-GSDMD相关信号通路可直接参与细胞焦亡的调控,在非典型细胞焦亡过程中发挥关键作用[4]。目前,关于GSDMB在主动脉夹层组织中的表达变化,以及GSDMB沉默或过表达对人主动脉平滑肌细胞(HASMCs)焦亡和炎症反应的影响鲜见报道,为此我们于2023年5月—11月进行了如下研究。
1 资料与方法
1.1 临床资料 纳入标准:①经主动脉计算机断层扫描血管造影(CTA)检查提示急性斯坦福A型主动脉夹层;②拟行升主动脉置换术。排除合并遗传性胸主动脉疾病者,如马凡综合征、洛伊—迪茨综合征及先天性结缔组织发育不全综合征等。选择2017年1月—2020年12月武汉大学人民医院收治并符合上述标准的主动脉夹层患者8例,男6例、女2例,年龄(55.2 ± 6.5)岁,术中收集其主动脉夹层组织8例份。选择捐献心脏的脑死亡患者8例,主动脉CTA检查提示主动脉无病变,男6例、女2例,年龄(51.6 ± 5.8)岁,收集其主动脉组织8例份作为正常对照组织。主动脉夹层患者与捐献者性别构成比、年龄均具有可比性(P均>0.05)。本研究已经通过武汉大学人民医院人类研究伦理委员会批准(WDRY2020-K230),患者及捐献者家属均签署知情同意书。
1.2 实验材料 细胞:HASMCs购自武汉普诺赛生命科技有限公司。主要试剂:DMEM高糖培养基、胎牛血清均购自美国Gibco公司,LipofectamineTM3000试剂购自美国Thermo Fisher公司,细胞焦亡相关指标(GSDMB、Caspase-4、GSDMD、N-GSDMD)、基质金属蛋白酶9(MMP-9)、基质金属蛋白酶2(MMP-2)和内参GAPDH一抗购自武汉三鹰生物技术有限公司,炎症因子白细胞介素18(IL-18)、白细胞介素1β(IL-1β)ELISA试剂盒均购自泉州乐达启博生物科技有限公司,实时荧光定量PCR试剂盒购自武汉塞维尔生物有限公司;NC-siRNA和GSDMB-siRNA均由上海生工有限公司合成,空白载体质粒和GSDMB过表达质粒均购自武汉淼灵生物有限公司。
1.3 主动脉夹层组织与正常对照组织GSDMB蛋白检测 采用Western blotting法。取主动脉夹层组织和正常对照组织,使用组织匀浆机在低温条件下进行研磨,在4 ℃条件下高速离心,分离出蛋白质上清液。将提取的蛋白与上样缓冲液按照1∶ 4的比例混合,100 ℃加热10 min使蛋白变性。将蛋白样本加载到聚丙烯酰胺凝胶(SDS-PAGE)上,依次进行电泳浓缩和分离,将蛋白从凝胶转移到聚偏二氟乙烯(PVDF)膜上。加入5%脱脂牛奶封闭2 h,加入GSDMB及内参GAPDH一抗孵育过夜,加入使用HRP标记的二抗,孵育1 h。加入ECL化学发光剂进行显影,Image J软件分析条带灰度值,计算GSDMB蛋白相对表达量。
1.4 GSDMB基因沉默对HASMCs焦亡和炎症反应的影响观察
1.4.1 细胞培养、分组及转染 将HASMCs置于37 ℃、5% CO2细胞培养箱中,使用含有10%胎牛血清、1%双抗的高糖DMEM培养基进行培养。待HASMCs处于对数生长期时,分为NC-siRNA组、脂多糖(LPS)组、GSDMB-siRNA组、GSDMB-siRNA+LPS组。LPS组和GSDMB-siRNA+LPS组加入1 μg/mL LPS作用24 h,NC-siRNA组、GSDMB-siRNA组、GSDMB-siRNA+LPS组分别使用LipofectamineTM3000试剂转染NC-siRNA、GSDMB-siRNA、NC-siRNA,转染48 h后收集细胞进行后续实验。
1.4.2 细胞GSDMB、Caspase-4、GSDMD、N-GSDMD、MMP-9、MMP-2蛋白检测 采用Western blotting法。收集处理后的各组细胞,加入RIPA缓冲液裂解10 min,使用BCA试剂盒测定总蛋白浓度,加入上样缓冲液混合并高温变性。以GAPDH为内参,参照“1.3”检测并计算目的蛋白相对表达量。
1.4.3 细胞焦亡情况观察 采用流式细胞术。收集处理后的各组细胞,预冷的PBS洗涤后离心,加入Binding Buffer 100 μL 进行重悬。加入PI 5 μL,室温避光孵育20 min。加入PBS 400 μL混匀,上流式细胞仪检测细胞焦亡率。
1.4.4 细胞上清液IL-18、IL-1β检测 采用ELISA法。收集处理后的各组细胞上清,1 000 r/min离心20 min。在预先包被IL-18和IL-1β捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,温浴60 min并彻底洗涤。底物TMB温浴15 min显色,TMB在过氧化物酶的催化下转化为蓝色,并在酸的作用下最终变为黄色。使用酶标仪检测450 nm波长下的光密度(OD)值,计算IL-18、IL-1β水平。
1.5 GSDMB基因过表达对HASMCs焦亡和炎症反应的影响观察
1.5.1 细胞培养、分组及转染 将HASMCs置于37 ℃、5% CO2细胞培养箱中,使用含有10%胎牛血清、1%双抗的高糖DMEM培养基进行培养。待HASMCs处于对数生长期时,分为空载质粒组、LPS作用组、GSDMB过表达组、GSDMB过表达+LPS组。LPS作用组和GSDMB过表达+LPS组加入1 μg/mL LPS作用24 h,空载质粒组、GSDMB过表达组、GSDMB过表达+LPS组分别使用LipofectamineTM3000转染试剂转染空载质粒、GSDMB过表达质粒、GSDMB过表达质粒,转染48 h后收集细胞进行后续实验。
1.5.2 细胞GSDMB、Caspase-4、GSDMD、N-GSDMD、MMP-9、MMP-2蛋白检测 参照“1.4.2”采用Western blotting法检测各目的蛋白相对表达量。
1.5.3 细胞焦亡检测 参照“1.4.3”采用流式细胞术检测细胞焦亡率。
1.5.4 细胞上清液IL-18、IL-1β检测 参照“1.4.4”采用ELISA法检测细胞上清液IL-18、IL-1β水平。
1.6 统计学方法 采用Graphpad9.0统计软件。计量资料采用S-W法检验正态性,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 主动脉夹层组织与正常对照组织GSDMB蛋白表达比较 主动脉夹层组织与正常对照组织GSDMB蛋白相对表达量分别为0.88 ± 0.16、0.62 ± 0.15,二者比较P<0.05。
2.2 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组焦亡相关指标比较 见表1。
表1 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组焦亡相关指标比较(± s)

表1 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组焦亡相关指标比较(± s)
注:与NC-siRNA组比较,*P<0.05;与LPS组比较,#P<0.05;与GSDMB-siRNA组比较,△P<0.05。
组别NC-siRNA组LPS组GSDMB-siRNA组GSDMB-siRNA+LPS组细胞焦亡率(%)11.17 ± 1.35 63.07 ± 4.27*11.73 ± 1.73#41.27 ± 2.22*#△GSDMB 0.73 ± 0.12 1.17 ± 0.10*0.34 ± 0.05*#0.78 ± 0.10#△Caspase-4 0.59 ± 0.03 1.06 ± 0.06*0.68 ± 0.15#0.88 ± 0.03*#△GSDMD 0.59 ± 0.03 1.06 ± 0.08*0.67 ± 0.14#0.90 ± 0.02*#△N-GSDMD 0.69 ± 0.17 1.14 ± 0.14*0.75 ± 0.19#0.85 ± 0.08*#
2.3 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组炎症反应相关指标比较见表2。
表2 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组炎症反应相关指标比较(± s)
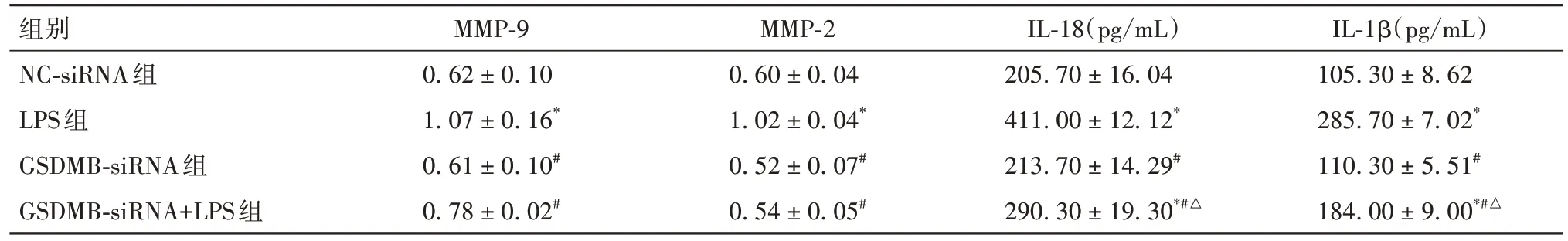
表2 NC-siRNA组、LPS组、GSDMB-siRNA组和GSDMB-siRNA+LPS组炎症反应相关指标比较(± s)
注:与NC-siRNA组比较,*P<0.05;与LPS组比较,#P<0.05;与GSDMB-siRNA组比较,△P<0.05。
组别NC-siRNA组LPS组GSDMB-siRNA组GSDMB-siRNA+LPS组IL-1β(pg/mL)105.30 ± 8.62 285.70 ± 7.02*110.30 ± 5.51#184.00 ± 9.00*#△MMP-9 0.62 ± 0.10 1.07 ± 0.16*0.61 ± 0.10#0.78 ± 0.02#MMP-2 0.60 ± 0.04 1.02 ± 0.04*0.52 ± 0.07#0.54 ± 0.05#IL-18(pg/mL)205.70 ± 16.04 411.00 ± 12.12*213.70 ± 14.29#290.30 ± 19.30*#△
2.4 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组焦亡相关指标比较 见表3。
表3 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组焦亡相关指标比较(± s)
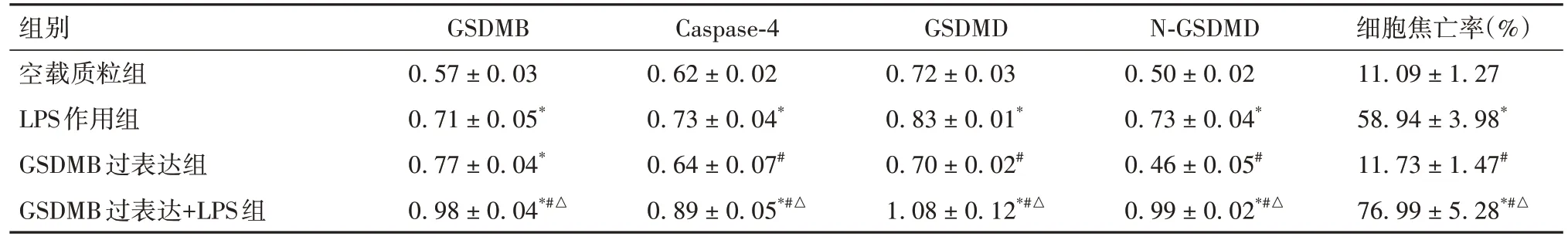
表3 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组焦亡相关指标比较(± s)
注:与空载质粒组比较,*P<0.05;与LPS作用组比较,#P<0.05;与GSDMB过表达组比较,△P<0.05。
组别空载质粒组LPS作用组GSDMB过表达组GSDMB过表达+LPS组细胞焦亡率(%)11.09 ± 1.27 58.94 ± 3.98*11.73 ± 1.47#76.99 ± 5.28*#△GSDMB 0.57 ± 0.03 0.71 ± 0.05*0.77 ± 0.04*0.98 ± 0.04*#△Caspase-4 0.62 ± 0.02 0.73 ± 0.04*0.64 ± 0.07#0.89 ± 0.05*#△GSDMD 0.72 ± 0.03 0.83 ± 0.01*0.70 ± 0.02#1.08 ± 0.12*#△N-GSDMD 0.50 ± 0.02 0.73 ± 0.04*0.46 ± 0.05#0.99 ± 0.02*#△
2.5 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组炎症相关指标比较 见表4。
表4 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组炎症反应相关指标比较(± s)
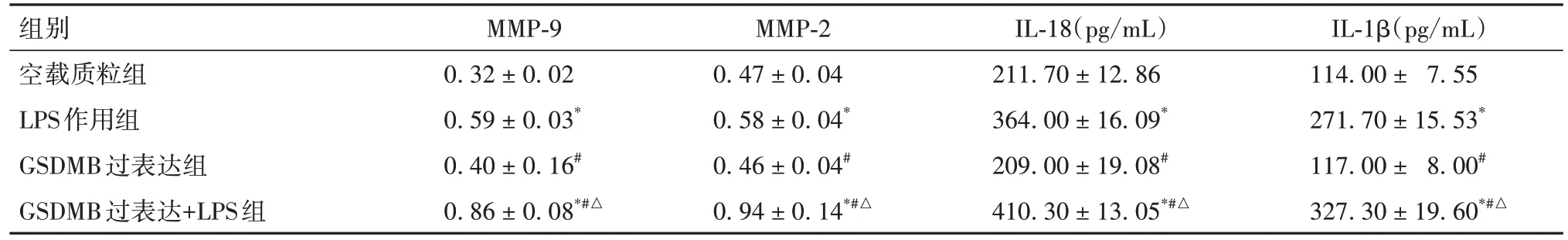
表4 空载质粒组、LPS作用组、GSDMB过表达组和GSDMB过表达+LPS组炎症反应相关指标比较(± s)
注:与空载质粒组比较,*P<0.05;与LPS作用组比较,#P<0.05;与GSDMB过表达组比较,△P<0.05。
组别空载质粒组LPS作用组GSDMB过表达组GSDMB过表达+LPS组IL-1β(pg/mL)114.00 ± 7.55 271.70 ± 15.53*117.00 ± 8.00#327.30 ± 19.60*#△MMP-9 0.32 ± 0.02 0.59 ± 0.03*0.40 ± 0.16#0.86 ± 0.08*#△MMP-2 0.47 ± 0.04 0.58 ± 0.04*0.46 ± 0.04#0.94 ± 0.14*#△IL-18(pg/mL)211.70 ± 12.86 364.00 ± 16.09*209.00 ± 19.08#410.30 ± 13.05*#△
3 讨论
主动脉夹层是一种致命性大血管疾病,其发病机制非常复杂,主动脉中层退行性变是其主要病理特征,表现为血管平滑肌细胞丢失,炎症细胞浸润和细胞外基质降解等[5]。当血管平滑肌细胞受到损伤、氧化应激及炎症因子等刺激时,会激活凋亡、坏死性凋亡和焦亡等多种相关信号通路。血管平滑肌细胞焦亡是主动脉夹层的重要发病机制之一,脂联素通过靶向上调miR-133a基因而抑制细胞焦亡和表型转换,从而减轻主动脉夹层形成,其机制与抑制细胞焦亡经典信号通路NLRP3/Caspase-1/GSDMD及炎症因子释放有关[6]。GSDMD通过激活血管平滑肌细胞内质网应激C/EBP同源蛋白(CHOP)信号通路,促进鸟氨酸脱羧酶 1 (ODC1)表达及提高腐胺水平,进一步加剧平滑肌细胞炎症反应[7]。但是,GSDM家族成员GSDMB与主动脉夹层及血管平滑肌细胞的关系鲜见报道。
GSDMB是一种GSDM蛋白,是细胞焦亡的关键效应分子之一,具有调节免疫应答和炎症反应等功能[8]。GSDMB的独特之处在于其可以被特定的病原体感染,或被细胞内的应激反应所激活。一旦被激活,GSDMB能促进细胞膜破裂,导致细胞内容物泄露,包括促炎症细胞因子。因此,GSDMB异常表达或活化可能导致过度炎症反应,进而加剧疾病的严重程度[9-10]。本研究结果显示,主动脉夹层组织GSDMB蛋白相对表达量高于正常对照组织;HASMCs经LPS作用后GSDMB、Caspase-4、GSDMD、N-GSDMD蛋白相对表达量及细胞焦亡率均升高,提示成功使用LPS构建HASMCs焦亡模型;该模型转染GSDMB-siRNA后上述指标降低,转染GSDMB过表达质粒后上述指标升高,提示敲低GSDMB表达可抑制LPS诱导的HASMCs焦亡,而过表达GSDMB会加重LPS诱导的HASMCs焦亡。
研究显示,GSDMB还可以通过激活Caspase-4,释放IL-18和IL-1β等炎症因子,从而加重炎症反应[11]。本研究结果显示,HASMCs经LPS作用后MMP-9、MMP-2蛋白相对表达量及细胞上清液IL-18、IL-1β水平均升高,提示LPS可刺激HASMCs分泌炎症因子;该模型转染GSDMB-siRNA后上述指标降低,转染GSDMB过表达质粒后上述指标升高,提示敲低GSDMB表达可抑制LPS诱导的HASMCs炎症因子释放,过表达GSDMB表达可促进LPS诱导的HASMCs炎症因子释放。研究发现,炎症因子IL-18、IL-1β均能促进MMP-9、MMP-2分泌,而MMP-9、MMP-2可通过降解细胞外基质,促进主动脉壁弹性纤维破裂,从而加速主动脉夹层的形成[12-13]。研究显示,A型主动脉夹层患者血清IL-1β水平升高,可通过促进MMP-9表达,增加主动脉夹层破裂的发生风险[14]。此外,IL-1β可通过促进胸主动脉夹层小鼠组织MMP-2和MMP-9表达,改变其主动脉壁功能,在胸主动脉夹层的形成中发挥关键作用[15]。因此,我们猜想GSDMB除了参与调控细胞焦亡以外,其释放的炎症因子可能进一步影响HASMCs分泌MMP-2和MMP-9。但是本研究中GSDMB-siRNA组仅GSDMB蛋白相对表达量低于NC-siRNA组,GSDMB过表达组仅GSDMB蛋白相对表达量高于空载质粒组,其他焦亡及炎症相关指标没有明显改变,提示GSDMB沉默或过表达并不会诱导正常HASMCs发生焦亡或炎症反应。这可能与在未受到LPS作用时GSDMB的N端结构域被C端结构域抑制,无法形成孔道有关[10]。
综上所述,人主动脉夹层组织GSDMB表达升高;GSDMB不会影响正常HASMCs的焦亡和炎症反应,但会通过Caspase-4介导的非经典途径正向调控LPS诱导的HASMCs细胞焦亡和炎症反应。因此,GSDMB是调控HASMCs焦亡和炎症反应非经典途径的关键分子,为主动脉夹层的治疗提供了新靶点。

