阿达木单抗还原肽指纹图谱鉴别方法的建立与验证
武 刚,刘 冰,陈全姚,倪永波,郭璐韵,梅玉婷,于传飞,王 兰(中国食品药品检定研究院单克隆抗体产品室,卫生部生物技术产品检定及标准化重点实验室,国家药品监督管理局生物制品质量研究与评价重点实验室,北京 069;重庆市食品药品检验检测研究院生物制品室;烟台大学药学院;共同第一作者;通讯作者,E-mail:wanglan@nifdc.org.cn)
阿达木单抗是采用中国仓鼠卵巢细胞系表达制备的首个重组全人源化抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的单克隆抗体,其通过与TNF-α特异性结合,阻止TNF-α与细胞表面TNF-α受体结合,从而有效抑制TNF-α诱导的多种病理效应[1,2]。阿达木单抗首先是由艾伯维公司研发并于2002年在美国批准上市,商品名为“修美乐(Humira)”,2010年获批进入中国,陆续获批的适应证包括类风湿性关节炎、强直性脊柱炎、银屑病、克罗恩病等多种自身免疫性疾病[3-5]。自2012年开始,阿达木单抗修美乐连续近10年位居全球药品销售额榜首,2021年年销售额突破200亿美元,展现了巨大的市场潜力。目前,美国和欧盟已有10余家公司的阿达木单抗生物类似药上市,国内也已有7家公司的生物类似药获批上市,同时国内还有20余家公司正处于研发阶段[6-9]。
肽指纹图谱是蛋白质表征、结构鉴定和功能研究的基本方法之一。还原肽图是将蛋白质进行变性还原后利用特异性的酶(蛋白水解)或化学裂解,得到一系列的短肽片段,然后对其进行分离、检测和鉴定。如果供试品与参考品以同样的前处理方式制备,酶解后的指纹图谱一致,那么二者被认为是相同的。肽图分析已成为验证单克隆抗体及其他重组蛋白生物制品一级结构完整性及正确性最有效的方法之一[10-12]。肽图分析方法对氨基酸序列的变化非常敏感,氨基酸一级序列的变化或氨基酸的翻译后修饰会导致肽指纹图谱发生变化,可以检测到治疗性单抗中单个氨基酸残基修饰或突变的细微变化,如丝氨酸变为精氨酸[13],肽图鉴别也是考察产品批间一致性及稳定性的重要手段,已成为单抗制品常用的质控放行方法之一,对产品的质量控制有非常重要的意义[9,14,15]。
治疗性单克隆抗体的互补决定区(complementarity determining region,CDR)是决定抗体特异性和亲和力的关键部位,不同抗体的CDR序列不同[16,17],酶切后产生相应肽段的色谱保留行为也不同,从而得到抗体的特征肽段色谱图,达到鉴别抗体的目的。单抗常含有多种翻译后修饰(post-translational modification,PTM),这些PTMs可能发生在抗体生产、纯化和储存的任何阶段[18,19]。位于抗体互补决定区(CDR)的残基的PTM可能会对抗体与目标抗原的结合产生不利影响,进而影响抗体活性及临床疗效。蛋氨酸和色氨酸侧链的氧化,已被证明会导致构象变化[20,21],影响抗体与Fc受体和抗原的结合[22,23],并影响mAb的稳定性和半衰期[21,24]。因此,选择CDR作为肽图鉴别监测的特征肽段是一种常见策略,对单克隆抗体在药物开发、生产和储存过程中的质量控制尤为重要。
本研究首先采用液质联用技术对所建立的阿达木单抗还原肽指纹图谱方法的氨基酸序列覆盖率进行了考察,并对全部CDR肽段进行了鉴别,在此基础上建立了阿达木单抗液相色谱肽指纹图谱鉴别方法,按照《中国药典》2020年版四部通则9101药品质量标准分析方法验证指导原则,对该方法进行了专属性、精密度、耐用性等验证,并考察了样品的储存稳定性,为企业建立抗体肽指纹图谱鉴别分析方法提供参考。
1 材料与方法
1.1 单抗及主要试剂
阿达木单抗、贝伐珠单抗和利妥昔单抗为中国食品药品检定研究院单克隆抗体产品室留样。胰蛋白酶(Trypsin)购自美国Promega公司,胞内蛋白酶(Lys-C)购自日本Wako公司;二硫苏糖醇(DTT)、碘乙酰胺(IAM)购自美国Sigma Aldrich公司;8 mol/L盐酸胍溶液、1 mol/L Tris-HCl溶液(pH 8.0)、ESI阳离子校准液、甲酸(质谱级)、乙腈(质谱级)、水(质谱级)购自美国Thermo Fisher公司。
1.2 仪器设备
配有紫外检测器(UV)的Vanquish Flex超高效液相色谱仪、Q Exactive Plus超高分辨质谱仪购自美国Thermo Fisher公司;真空离心浓缩仪购自英国Genevac公司;金属浴购自德国Eppendorf公司。
1.3 高分辨质谱测定氨基酸序列覆盖率及CDR特征肽段的确证(Trypsin酶切)
1.3.1 样品处理 取蛋白800 μg于离心管中,采用真空离心浓缩仪将样品干燥至透明状,加蛋白变性液40 μL(由8 mol/L盐酸胍1 mL、1 mol/L Tris-HCl pH8.0溶液50 μL和1 mol/L DTT溶液10 μL混合制成),充分涡旋震荡混匀,37 ℃孵育30 min,冷却至室温,加入1 mol/L IAM溶液1 μL,室温避光反应30 min,加入50 mmol/L Tris-HCl pH8.0溶液760 μL,涡旋混匀。取上述溶液100 μL至新离心管中,加0.5 mg/mL Trypsin溶液5 μL,37 ℃孵育4 h,加入甲酸3 μL终止酶解,13 000 r/min离心5 min,取上清液待测。
1.3.2 液相色谱参数 柱温60 ℃,样品盘温度8 ℃,紫外检测波长214 nm,进样量10 μL。流动相:A相为0.1%甲酸水溶液,B相为0.1%甲酸乙腈溶液,梯度洗脱(0~5 min,2%流动相B;5~120 min,2%→35%流动相B;120.1~128 min,35%→100%流动相B;128.1~135 min,2%流动相B),流速0.3 mL/min,色谱柱为Waters ACQUITY UPLC Peptide CSH C18(2.1 mm×150 mm,1.7 μm)。
1.3.3 高分辨质谱参数 采用ESI离子源,正离子模式,数据依赖型扫描,一级扫描范围m/z为200~2 000,分辨率为70 000,AGC target 3×e6;二级分辨率为17 500,AGC target 1×e5;Top 10,First Mass:m/z120,四级杆隔离窗口m/z1.8,碎裂能量NCE 28。3~120 min液相六通阀切入质谱采集,其他时间六通阀切入废液。
1.3.4 肽指纹图谱鉴别方法覆盖率分析及CDR特征肽段确证 使用Thermo BiopharmaFinder3.2软件处理质谱数据,分析建立方法的氨基酸序列覆盖率,并确证全部CDR肽段。结合肽指纹图谱各个肽段的UV强度、分离度、共流出等信息,确定所建立液相方法鉴别分析的特征肽段与参比肽段。
1.4 液相色谱法肽指纹图谱鉴别的方法学验证
1.4.1 专属性分析 将阿达木单抗、贝伐珠单抗和利妥昔单抗分别按1.3.1项下方法进行制备,以水作为空白对照同样品处理,所得溶液按1.3.2和1.3.3项下色谱及质谱参数条件进行分析。
1.4.2 精密度分析 将同一样品溶液连续进样5次,以特征肽段/参比肽段的相对保留时间(relative retention time,RRT)及相对峰面积(relative peak area,RPA)的相对标准偏差(relative standard deviation,RSD)考察仪器精密度。由同一实验人员于不同时间制备样品以及两名实验人员于同一时间分别制备样品,每份样品溶液各进样1次,以特征肽段的RRT及RPA的RSD考察中间精密度。
1.4.3 耐用性分析 分别考察多个维度的方法耐用性,包括酶:蛋白质量比、酶切时间、酶解后样品稳定性、色谱柱耐用性。
以不同酶∶蛋白质量比(1∶35,1∶40,1∶45)加入Trypsin,混匀后37 ℃孵育4 h后终止,即得不同酶解比例的样品溶液。以特征肽段的RRT及RPA的RSD考察方法耐用性。
以酶∶蛋白质量比为1∶40加入Trypsin,37 ℃孵育不同时间(3.5,4,4.5 h),终止,即得不同酶解时间的样品溶液。以特征肽段的RRT及RPA的RSD考察方法耐用性。
将制备的样品溶液于8 ℃样品盘中放置0,12,24 h各进样1次;将制备的样品溶液储存于-20 ℃,于0,3,7 d溶解后各进样1次。以特征肽段的RRT及RPA的RSD评价酶解后样品稳定性。
分别采用不同品牌、型号、柱长和孔径等的7种色谱柱对样品溶液进行分析,通过比较特征肽段色谱行为考察色谱柱的适用性。色谱柱信息见表1。

表1 色谱柱的型号及规格Table 1 Information of chromatographic columns
1.5 高分辨质谱测定氨基酸序列覆盖率、CDR特征肽段确证及方法学验证(Lys-C酶切)
以0.5 mg/mL胞内蛋白酶(Lys-C)代替Trypsin溶液,其他按1.3项方法进行样品制备和检测,并按照1.4项开展方法学验证。
2 结果
2.1 高分辨质谱测定氨基酸序列覆盖率及CDR肽段确证结果(Trypsin酶切)
2.1.1 氨基酸序列覆盖率结果 采用Thermo BiopharmaFinder3.2软件对阿达木单抗质谱数据进行分析,总离子流见图1,采用99%高置信水平卡值,重链(heavy chain,HC)覆盖率为96.0%,轻链(light chain,LC)覆盖率为98.6%,全部CDR肽段均得到确证,未确证的短肽均为亲水性肽段,在色谱柱上无保留,前3 min流入废液,未进入质谱。HC、LC覆盖率良好(≥95.0%),满足鉴别需求。
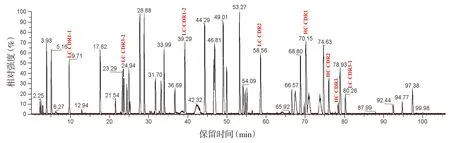
注:HC.重链;LC.轻链;CDR.互补决定区。图1 阿达木单抗总离子流图Figure 1 Total ion chromatogram of adalimumab
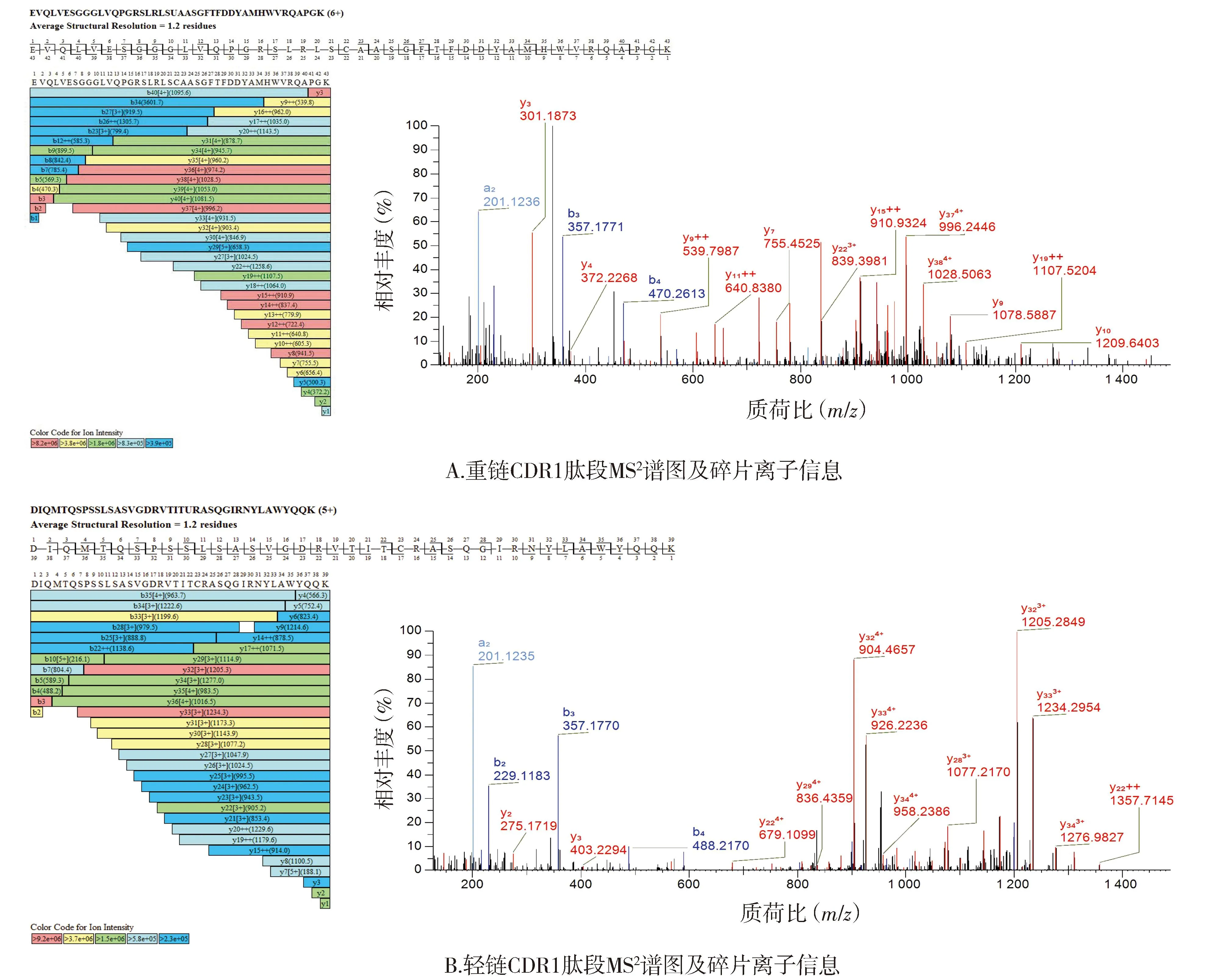
2.1.2 CDR肽段确证结果 HC和LC的全部CDR肽段均得到鉴定。各CDR肽段及离子化信息结果见表2,各肽段实测相对分子质量与理论值偏差≤±5×10-6,其中下划线部分为CDR序列,CDR对应肽段一级质谱图见图2。通过MS2高能量碎裂获得二级碎片b/y离子信息(见图3,以重链CDR1和轻链CDR2为例),确证了各肽段的序列。
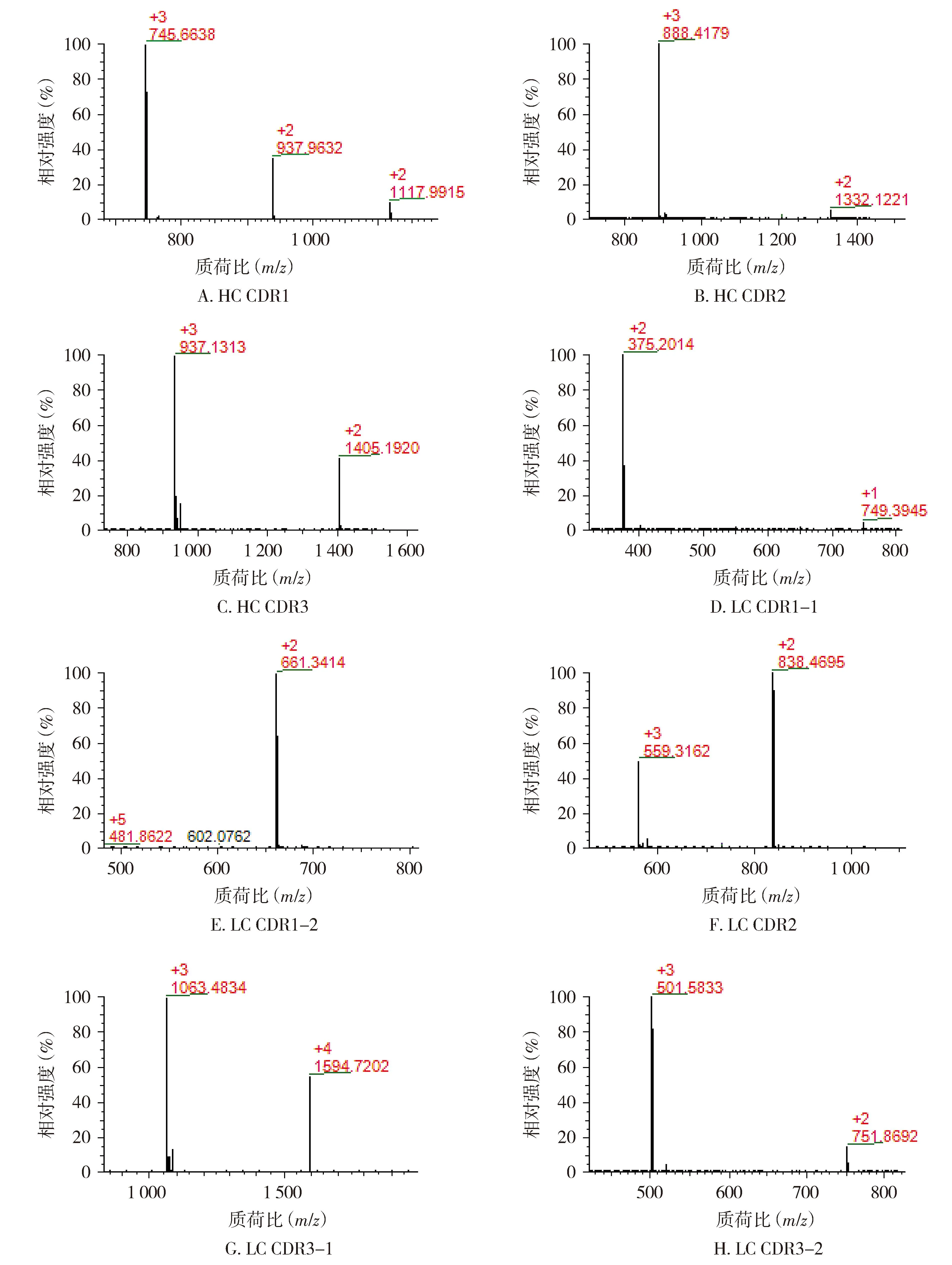
注:+1,+2,+3,+4代表电荷数。图2 阿达木单抗CDR对应肽段一级质谱图Figure 2 First mass spectrum of CDR peptides of adalimumab
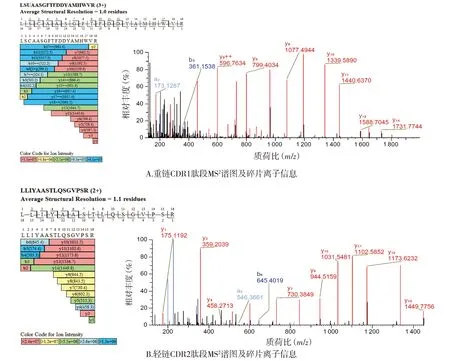
注:b/y代表碎片离子类型;数字代表碎片离子质荷比。图3 阿达木单抗CDR对应肽段MS2谱图Figure 3 MS2 spectra of CDR peptides of adalimumab
2.1.3 特征肽段的确认 根据质谱鉴定出CDR肽段峰的保留时间确定特征肽段。阿达木单抗LC的CDR1和CDR3序列内存在Trypsin酶切位点,酶切后CDR位于2个肽段,分别标记为CDR1-1、CDR1-2及CDR3-1、CDR3-2。经解析,HC-CDR1和LC-CDR1-2在出峰位置处存在共流出峰,其中HC-CDR1与共流出峰强度相当,而LC-CDR1-2与其共流出峰相比强度仅约为2%。因此,最终鉴别用特征肽段选取HC的CDR1、CDR2、CDR3以及LC的CDR1-1、CDR2、CDR3-1、CDR3-2作为特征肽段,同时选定保留时间约为97 min的肽段(Fc段保守氨基酸序列152-214)作为参比肽段。
2.2 液相色谱法肽指纹图谱鉴别的方法学验证结果
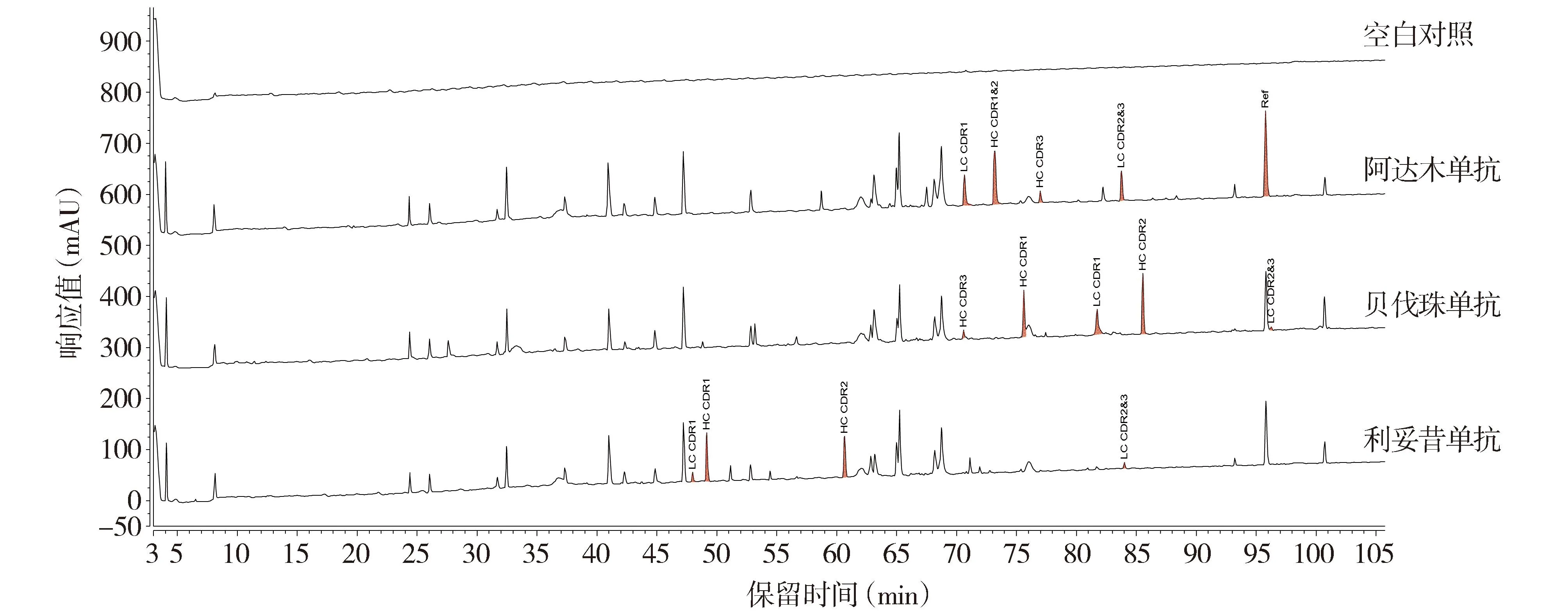
2.2.1 专属性分析结果 空白对照在样品出峰时间内无干扰峰;阿达木单抗、贝伐珠单抗和利妥昔单抗据质谱数据分析,鉴定出各自的CDR肽段(见图4)。该方法可对阿达木单抗进行有效的鉴别。
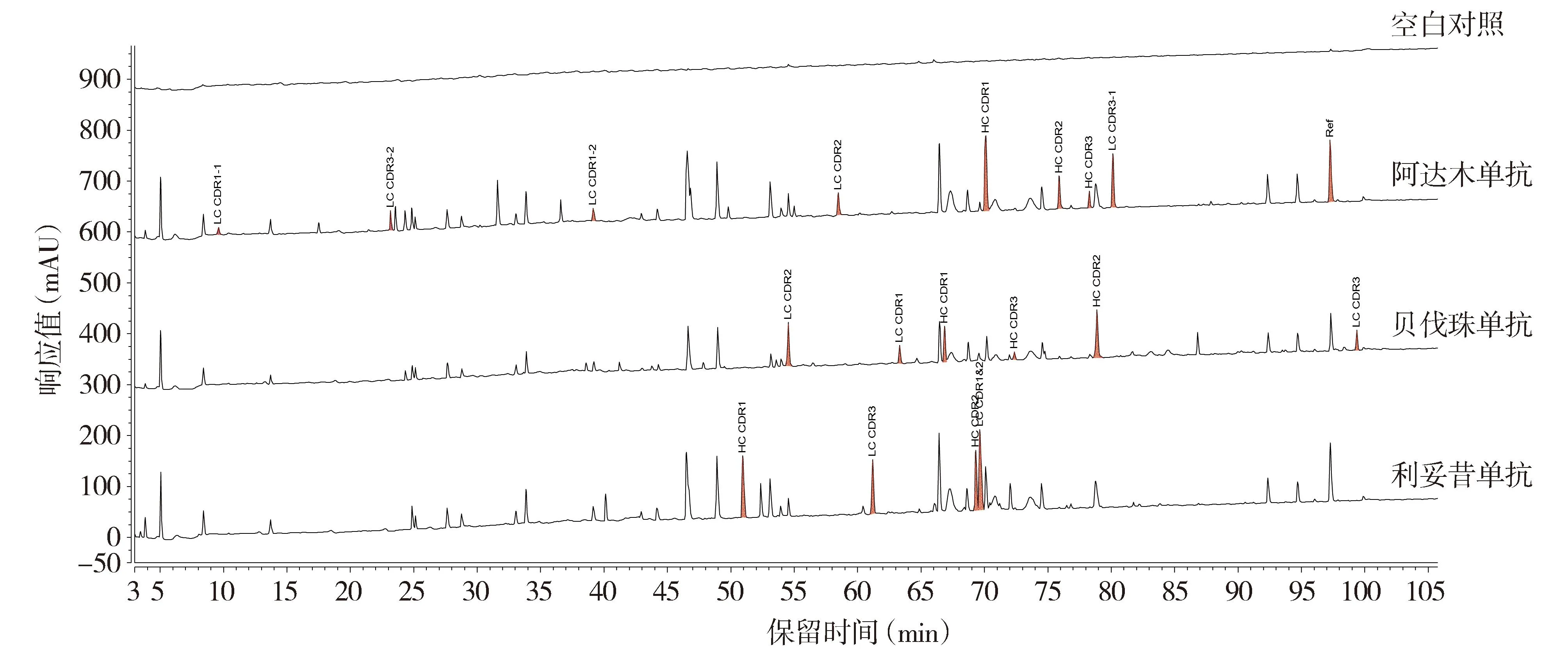
注:HC.重链;LC.轻链;CDR.互补决定区;红色区域代表CDR肽段色谱峰。图4 专属性UV肽谱图Figure 4 The UV peptide mapping chromatograms for specificity
2.2.2 精密度分析结果 连续5次进样测定各特征肽段的RRT的RSD在0.008%~1.097%之间,RPA的RSD在1.212%~7.951%之间(见表3,4),中间精密度考察特征肽段RRT的RSD在0.010%~0.985%之间,RPA的RSD在2.306%~10.939%之间(见图5,表5,6),表明该方法精密度良好。
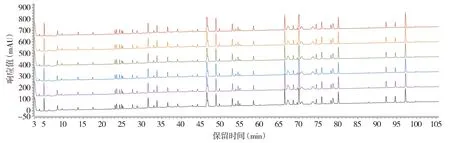
注:6条不同颜色的谱图代表6次重复实验的色谱图。图5 中间精密度色谱图Figure 5 Chromatograms for intermediate precision tests
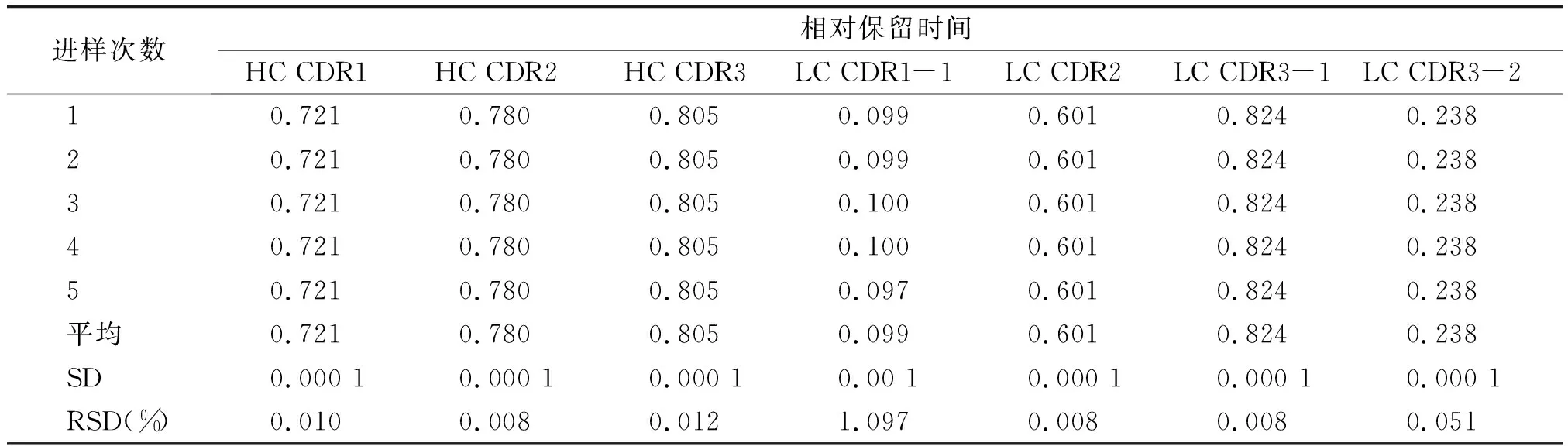
表3 仪器精密度考察结果Table 3 Results of instrument precision tests

表4 仪器精密度考察结果Table 4 Results of instrument precision tests
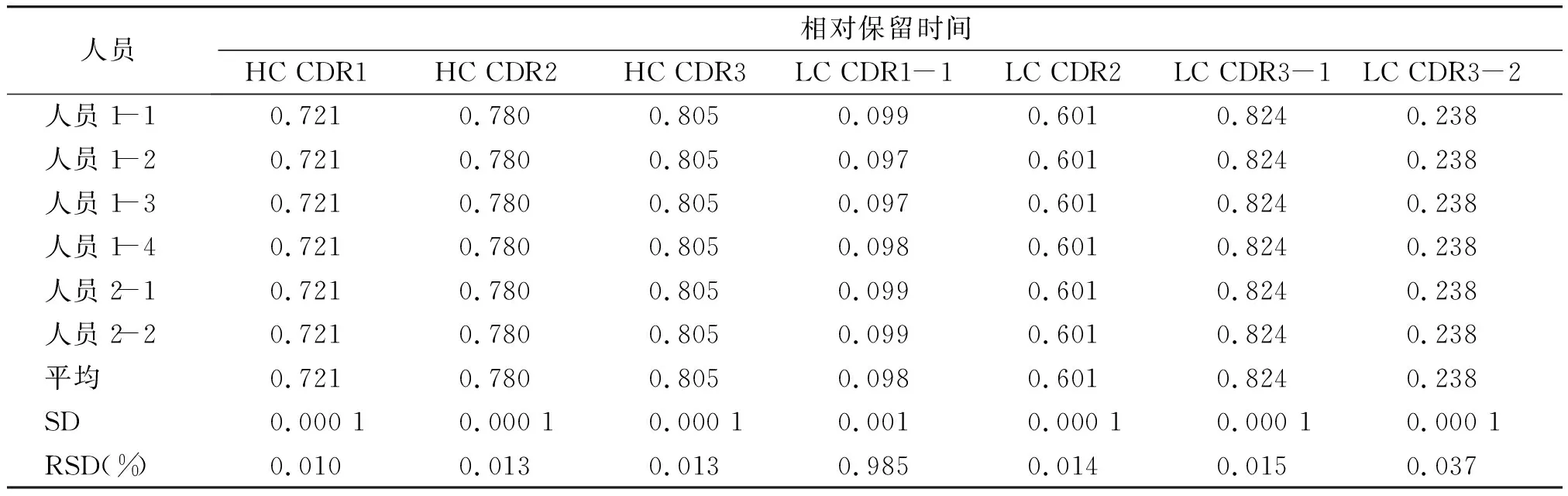
表5 中间精密度考察结果Table 5 Results of intermediate precision tests
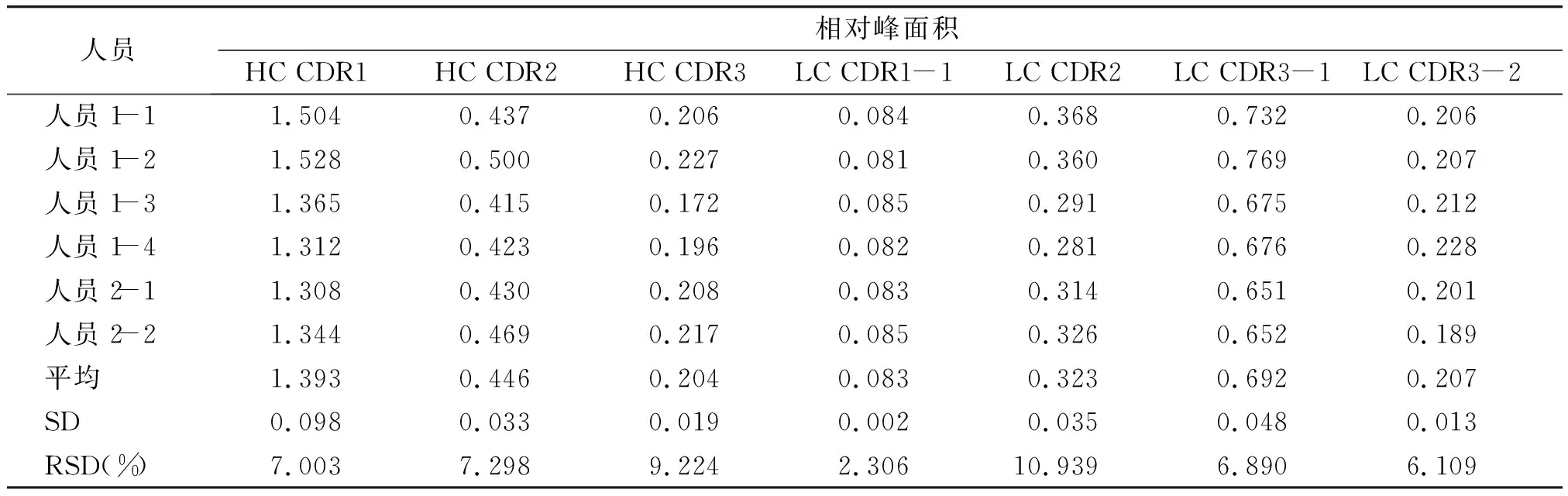
表6 中间精密度考察结果Table 6 Results of intermediate precision tests
2.2.3 耐用性分析结果 实验结果表明,Trypsin酶切比例为1∶35~1∶45,特征肽段RRT的RSD在0.003%~0.870%之间,RPA的RSD在1.299%~14.584%之间;酶切时间在3.5~4.5 h内变化时,特征肽段RRT的RSD在0.031%~1.066%之间,RPA的RSD在2.518%~4.380%之间,耐用性良好(见表7,8)。
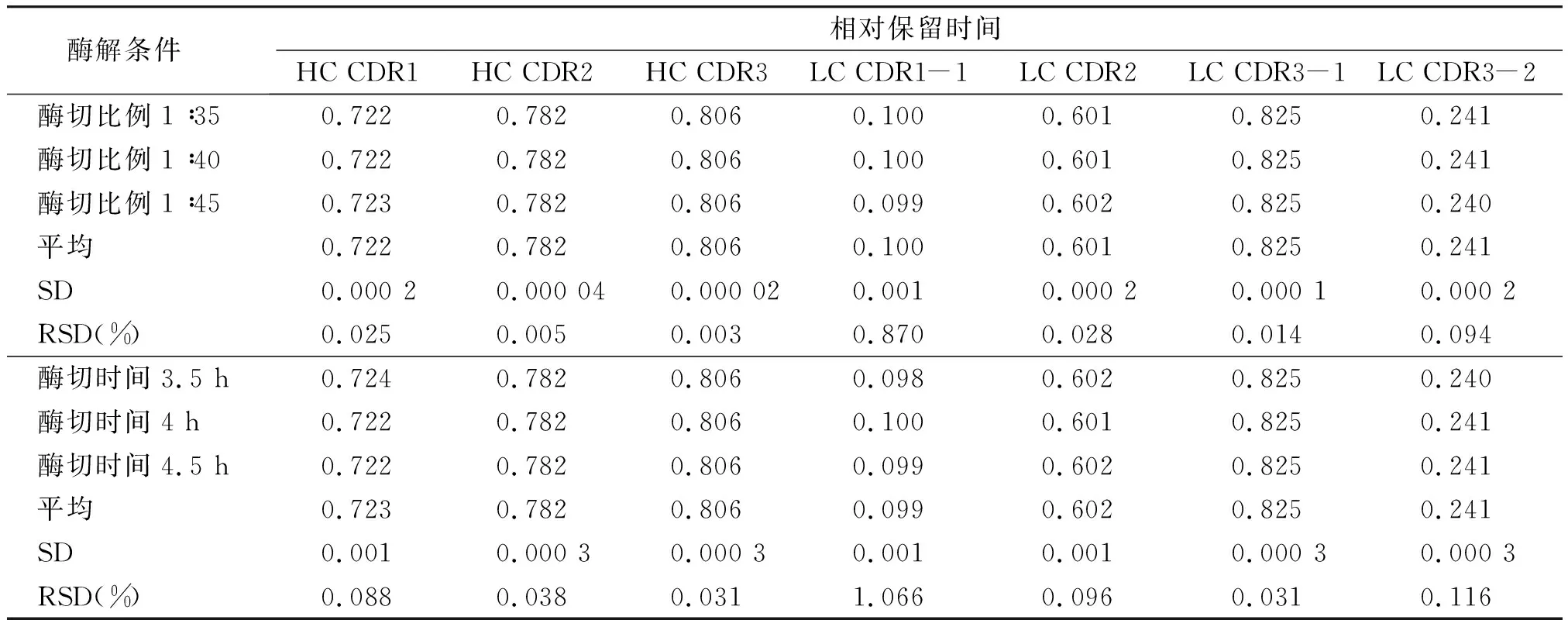
表7 耐用性考察结果Table 7 Results of durability tests
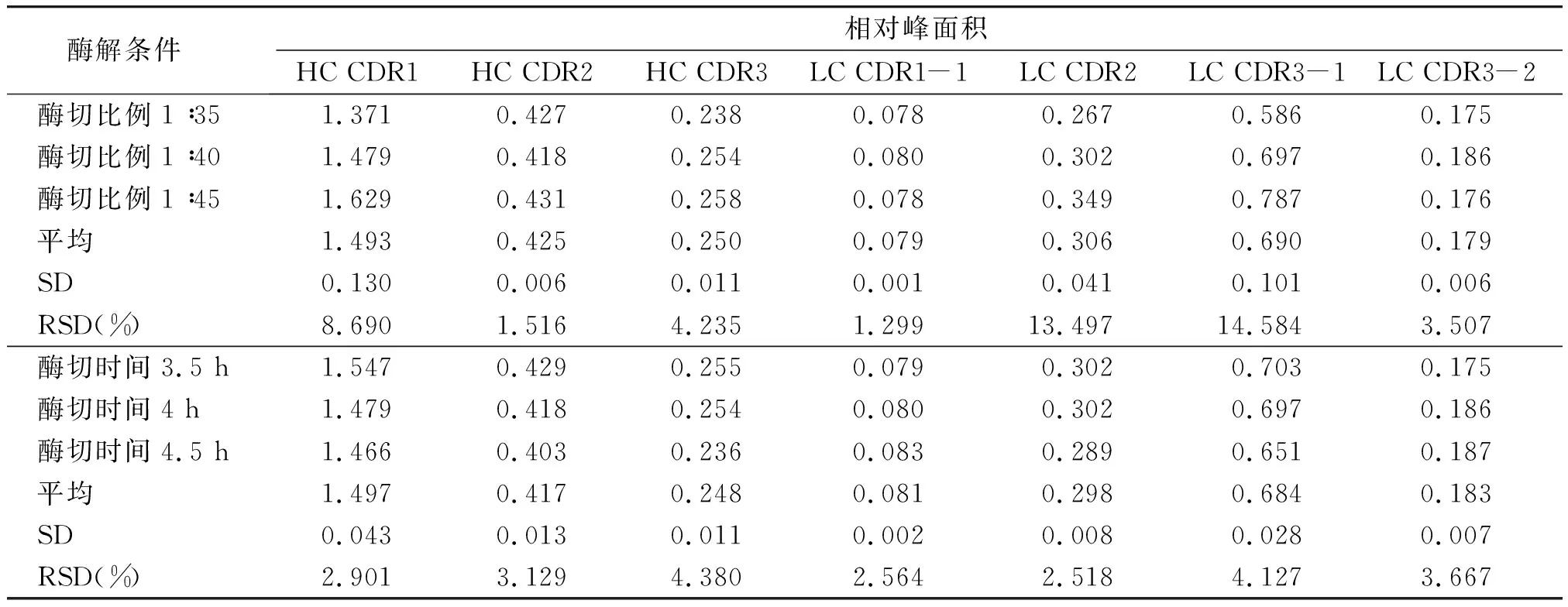
表8 耐用性考察结果Table 8 Results of durability tests
酶解后样品稳定性结果表明,样品溶液在8 ℃放置24 h以及-20 ℃放置7 d的稳定性良好(见表9,10)。
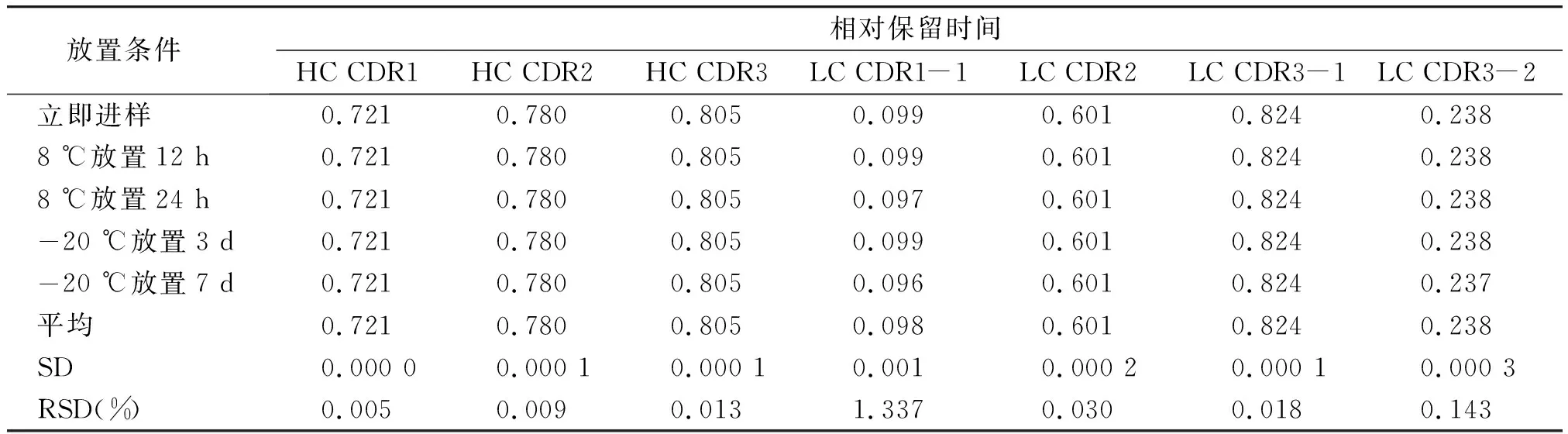
表9 酶解后样品稳定性考察结果Table 9 Results of stability tests of sample solution
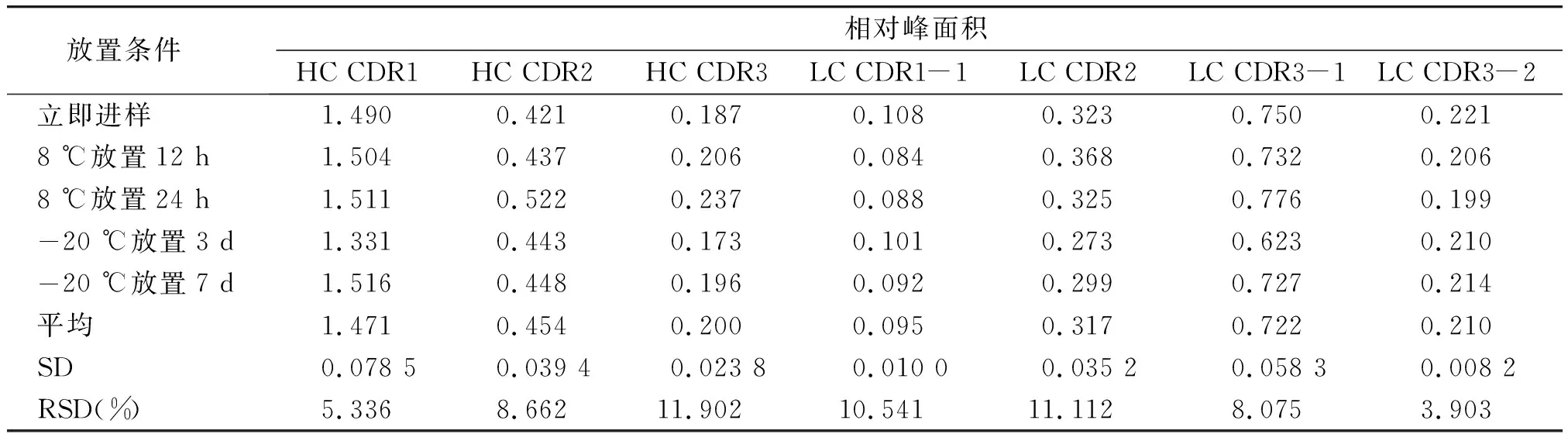
表10 酶解后样品稳定性考察结果Table 10 Results of stability tests of sample solution
对7根不同色谱柱采集的质谱数据进行分析,以99%高置信水平卡值,除色谱柱7的重链外,肽段覆盖率均在95%以上,根据质谱鉴定结果,均在对应的UV谱图中标记出CDR特征峰(见图6)。色谱柱1~4为Waters CSH系列色谱柱,对阿达木单抗各肽段保留行为基本一致,其中色谱柱3分离效果稍好,如重链CDR1与其共流出峰有分开趋势但仍未完全分离;色谱柱4为长100 mm的短柱,肽段保留时间整体前移,但对同一肽段的分离效果却不完全相同,如鉴定到的轻链CDR1-2与其共流出峰分开,保留时间约为36 min,因强度较低未能在UV谱图上标出对应的色谱峰;而鉴定到的重链CDR3与其后面的峰由基线分离变为共洗脱峰。色谱柱5~6为Waters BEH系列色谱柱,二者孔径不同,相比而言,130 Å比300 Å分离效果好,如重链CDR2和CDR3在130 Å色谱柱上可以达到基线分离,而在300 Å色谱柱上被同时洗脱下来。与Waters CSH系列色谱柱相比,鉴定出的轻链CDR1-2被分在2个肽段即ASQGIR和NYLAWYQQKPGKAPK,保留时间约为3 min和47 min,分别标记为CDR1-2′和CDR1-3′;其他特征肽段洗脱顺序大致相同,但峰形整体增宽且峰强度偏低,原因是CSH为表面带正电的BEH(亚乙基桥杂化)颗粒,可以改善低离子强度流动相中的上样能力和峰不对称性。色谱柱7为Agilent色谱柱,其对各肽段保留行为与Waters BEH系列色谱柱类似,但重链CDR2未鉴定到(见图6)。
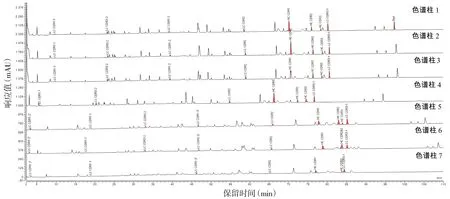
注:红色区域代表CDR肽段色谱峰。图6 不同色谱柱分析CDR肽段的色谱图Figure 6 The chromatograms of CDR peptide by different columns
2.3 高分辨质谱测定氨基酸序列覆盖率、CDR特征肽段确证及方法学验证结果(Lys-C酶切)
2.3.1 氨基酸序列覆盖率及CDR确证结果 采用Thermo BiopharmaFinder3.2软件对阿达木单抗质谱数据进行分析,总离子流图见图7,HC覆盖率为95.1%,LC覆盖率为96.7%,HC、LC覆盖率良好(≥95.0%)。全部CDR肽段均得到确证,对应肽段及离子化信息结果见表11、一级质谱图见图8,通过MS2高能量碎裂获得二级碎片b/y离子信息(见图9,以重链CDR1和轻链CDR1为例),成功确证各CDR肽段。
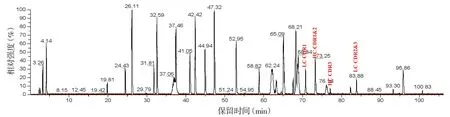
注:HC.重链;LC.轻链;CDR.互补决定区;数字代表保留时间。图7 阿达木单抗CDR对应肽段总离子流图(Lys-C酶切)Figure 7 Total ion chromatograms of adalimumab (digested by Lys-C)
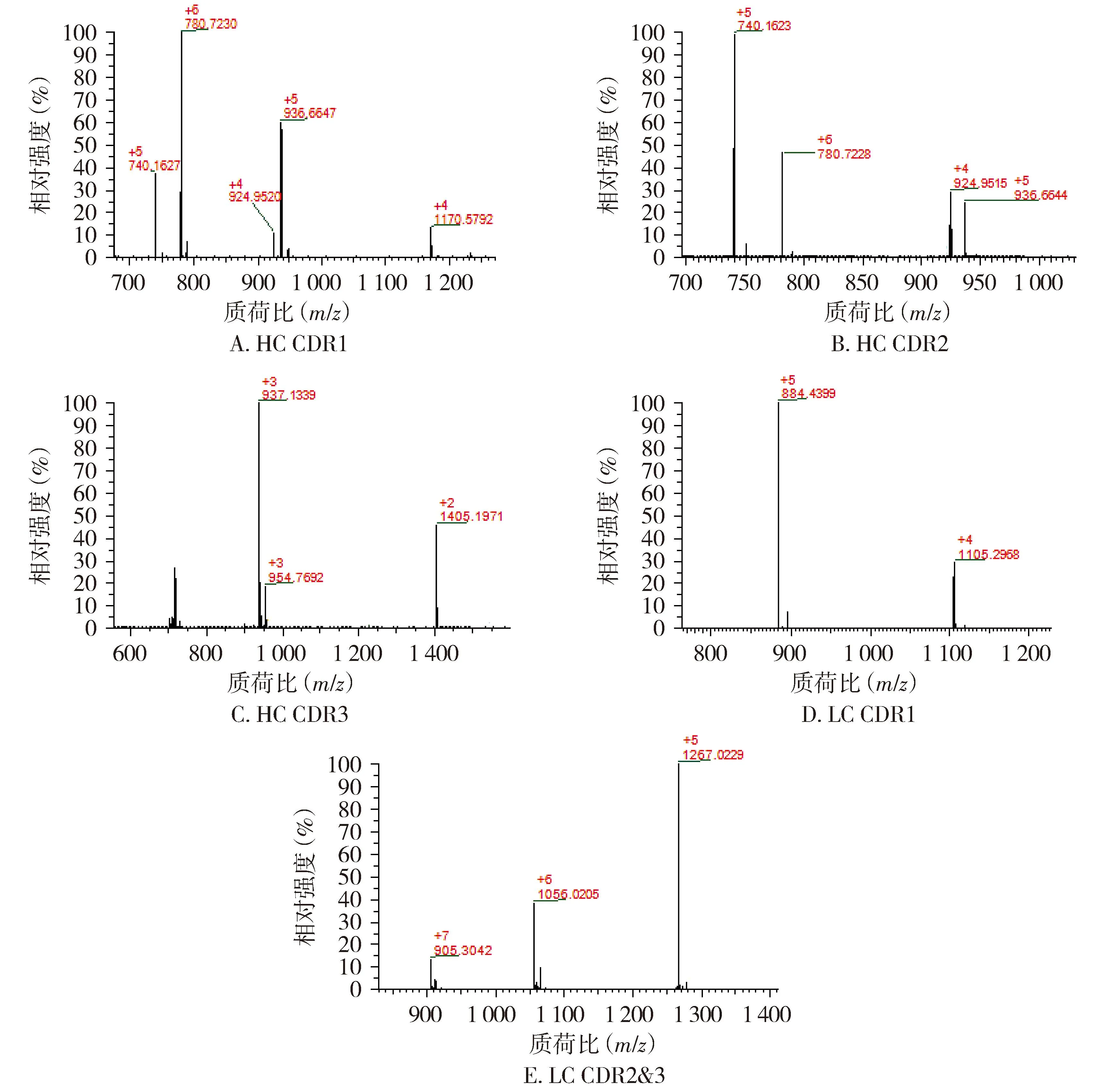
注:图中+2,+3,+4,+5,+6,+7代表电荷数;数字代表质荷比。图8 阿达木单抗CDR对应肽段一级质谱图(Lys-C酶切)Figure 8 Mass spectrum of CDR peptides of adalimumab (digested by Lys-C)
注:b/y代表碎片离子类型;数字代表碎片离子质荷比。图9 阿达木单抗CDR对应肽段MS2谱图(Lys-C酶切)Figure 9 MS2 spectra of CDR peptides of adalimumab (digested by Lys-C)

表11 阿达木单抗CDR对应Lys-C酶切肽段及离子化信息Table 11 Related CDR peptides and ionization information of adalimumab digested by Lys-C
2.3.2 CDR肽段确证结果及鉴定用特征肽段的确定 阿达木单抗LC的CDR2和CDR3位于同一肽段,HC的CDR1和CDR2在色谱图中体现为共流出峰,且二者强度相当。因此,选择HC的CDR1&2、CDR3以及LC的CDR1、CDR2&3肽段作为特征肽段,同时选定保留时间约为95 min的峰(Fc段保守氨基酸序列152-214)作为参比峰。
2.3.3 液相色谱法肽指纹图谱鉴别的方法学验证结果 空白对照在样品出峰时间内无干扰峰(见图10A),且可与其他单抗进行鉴别(见图10B-D)。5次连续进样测定特征肽段RRT的RSD在0.010%~0.017%之间,RPA的RSD在1.617%~6.570%之间;中间精密度考察特征肽段RRT的RSD在0.070%~0.129%之间,RPA的RSD在3.730%~18.280%之间。结果表明,该方法精密度良好。耐用性考察结果表明,Trypsin酶切比例在1∶30~1∶50内变化时,特征肽段RRT的RSD在0.010%~0.038%之间,RPA的RSD在7.576%~16.593%之间;酶切时间在3~5 h内变化时,特征肽段RRT的RSD在0.014%~0.027%之间,RPA的RSD在9.254%~10.999%之间,耐用性良好。酶解后样品溶液在8 ℃放置24 h以及-20 ℃放置7 d的稳定性良好。
注:HC.重链;LC.轻链;CDR.互补决定区;红色区域代表CDR肽段色谱峰。图10 专属性UV肽谱图 (Lys-C酶切)Figure 10 The UV peptide mapping chromatograms for specificity (digested by Lys-C)
3 讨论
单克隆抗体类药物是目前最常见的蛋白质类药物之一,肽指纹图谱鉴别是蛋白质类药物质量控制的重要手段之一。通过反相色谱分析蛋白质酶解后的肽段能够获取蛋白质的大量信息,再通过比较供试品蛋白与参比品蛋白的肽指纹图谱进而判断蛋白表达的准确性,该方法对于蛋白质类药物特性鉴别具有重要意义,现已成为鉴别质控分析常用方法之一。相比于非还原肽图,还原肽图将链内、链间二硫键打开,酶切得到的肽段(如含二硫键的肽段)相对更小,利于保持可溶状态、离子化,便于MS表征分析及检测,用于质控放行的肽图鉴别方法一般使用还原肽指纹图谱,因此,本研究选择还原肽图方法对阿达木单抗进行鉴别。
CDR氨基酸序列是不同单克隆抗体的特异性序列,单抗肽图鉴别方法常选取CDR肽段作为特征肽段进行鉴别以达到质控目的。单抗轻重链各含有3个CDR,酶切后一般产生≥6个含CDR的肽段,但并非所有的CDR肽段峰都适合作为特征峰,如有的CDR肽段虽可由质谱确证,但在UV谱图上色谱峰强度较低或不可见;有的CDR肽段亲水性较强在反相色谱柱上保留较弱,导致保留时间变异较大。本研究中的全部CDR肽段均得到确证,结合质谱鉴定结果以及UV谱图情况,分别选择7个CDR肽段(Trypsin酶切)和4个CDR肽段(Lys-C酶切)作为特征肽段用于肽指纹图谱鉴别。特征肽段应基于对分子特性充分了解,对分析方法充分验证的基础上进行规定,合理设定特征肽段是鉴别方法优劣的关键。同时,如在方法开发时遇到谱图中一些峰的洗脱顺序、峰强度、目视分离度、峰数目和峰形无论如何优化条件(液相色谱仪、色谱柱、流动相、柱温、流速等)均无法稳定重现,则可以考虑在结果判定中合理设置可变区段。肽图一致性判定标准通常要求计算供试品与参比品的特征峰与参比峰的保留时间/相对保留时间、面积/相对峰面积、峰高/相对峰高,规定供试品与参比品相应参数的差值/比值范围来进行判断,且供试品的总洗脱概况(如峰保留时间、峰形和峰高等)应与参比品色谱图一致,本研究采用相对保留时间及相对峰面积作为考察指标对建立的阿达木单抗肽指纹图谱液相鉴别法开展了方法学验证,以此评价该方法的可行性。
肽图样品处理过程中涉及蛋白变性、二硫键还原、烷基化封闭、酶切等步骤,由于变性、还原剂等会影响蛋白酶的活性,常选用脱盐后酶切的操作流程,可以使样品处理方法具有较好的重现性。脱盐方法较多,如透析袋、超滤管、SEC脱盐柱、液相在线脱盐等,但存在成本高、时间长、依赖回收率稳定性等缺陷。由于Trypsin、Lys-C对较低浓度的变性剂具有一定的耐受性,本研究尝试通过稀释的方式建立了非脱盐前处理方法,结果显示蛋白酶可充分对样品进行酶解,且蛋白回收率稳定性较好。因此,为避免方法重现性不稳定、形成批间差异,应在方法学开发阶段充分验证样品处理方法的精密度及耐用性。
本研究采用以甲酸作为流动相离子对试剂的反相体系进行分析,甲酸和三氟乙酸是肽图分析方法的流动相中常用的离子对试剂,三氟乙酸相较于甲酸具有更强的色谱保留,同时还具有改善峰型、降低UV基线噪音等作用,但在质谱上表现出显著的离子抑制效应,长期使用会污染仪器,降低仪器效能[25]。肽图分析通常是在基于质谱鉴别的基础上建立液相方法,如何选择离子对试剂,需权衡利弊后来确定。本研究耐用性考察发现不同的反相色谱柱对各肽段选择性、保留强弱、分离效果以及峰强度等具有一定差异,这不仅与肽段的大小、电荷及疏水性有关,还与色谱柱固定相特性,如颗粒类型、孔径等有关,因此,在方法开发过程中可以通过筛选色谱柱对肽段分离方法进行优化,以获取更高的分离度和回收率。
Trypsin能识别赖氨酸K和精氨酸R,单抗酶解后得到较多的肽段,可实现较好的全序列覆盖,CDR肽段数量多便于合理选定特征肽段,是肽指纹图谱鉴别方法开发最常用的蛋白酶。Trypsin法存在小肽段较多,易形成共流出峰,叠加操作人员差异、色谱柱差异、液相色谱仪工况、批次日间差异等可能导致色谱图存在细微或显著差异,不利于一致性判定。Lys-C酶只识别赖氨酸K,单抗酶解后肽段总量较少,CDR分布的肽段较少,不利于特征肽段的选定。但使用该酶建立的鉴别方法谱图批间差异较小、一致性更好,越来越多的进口及国产上市单抗品种选用Lys-C酶法用于QC放行鉴别。本研究分别采用Trypsin和Lys-C两种酶进行酶切,通过方法学验证,均可达到预期的鉴别目的。除Trypsin、Lys-C外的特异性的蛋白酶也可使用,如AspN、Glu-C等。
本实验分别应用Trypsin、Lys-C对阿达木单抗进行前处理,利用高分辨液质联用系统对CDR区肽段进行了表征确证,以表征结果为基础选取部分适宜的CDR肽段作为鉴别用特征肽段建立液相肽指纹图谱鉴别方法并按照2020年版《中国药典》(通则9101分析方法验证指导原则)完成方法学验证。所建立的肽指纹图谱鉴别分析方法具有良好的专属性、精密度和耐用性,可用于阿达木单抗的质量控制及批检验放行,对众多国产阿达木生物类似药的质量属性评价和控制具有参考价值,同时也可为其他重组蛋白生物制品的肽指纹图谱鉴别方法开发提供参考。

