CeO2纳米酶对环磷酰胺所致斑秃小鼠毛发生长的影响
彭欣欣,张 莹,潘昱帆,刘慧慧,王思宇,韩齐心,牛旭平(山西医科大学第九临床医学院皮肤科,太原 03000;山西医科大学附属太原市中心医院皮肤科;通讯作者,E-mail:nnxxpp978@sina.com)
斑秃(alopecia areata,AA)是一种常见的慢性自身免疫性疾病,可导致非瘢痕性脱发,临床特征为突发的局限性斑块状脱发,可以发生在身体的任何部位。AA持续发展可导致毛发全部脱落,称为全秃,严重者头皮、眉毛、腋毛、阴毛及全身毳毛脱落,称为普秃[1]。AA终生发病风险为2%,给患者的心理和生活造成十分严重的影响[2]。斑秃的发病机制尚未明确,主要与遗传、环境、免疫、氧化应激和情绪因素有关[3,4],其中,毛囊免疫豁免权丧失是导致斑秃的关键因素[5]。目前,斑秃的治疗包括皮质类固醇、外用米诺地尔、蒽林、环孢素、光化学疗法、接触性免疫疗法和靶向免疫治疗[6]。然而,实现完全缓解而不复发仍然具有挑战性。所以,寻找AA有效的治疗靶点和新的治疗方案是目前研究的重要方向。
CeO2纳米酶可以模拟一些天然酶的催化活性,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶、氧化酶、磷酸酶等[7]。CeO2纳米酶可利用其SOD酶活性清除细胞内ROS,从而防止细胞受到氧化应激损伤[8]。目前,CeO2纳米酶在雄激素性脱发、银屑病、视网膜变性、神经系统疾病、缺血、心脏疾病、糖尿病、胃肠道炎、肝脏疾病和癌症等疾病中都展现了较好的治疗效果[9,10]。目前,斑秃还没有能实现完全缓解而不复发的治疗方法,因此,本课题组采用单次腹腔内注射环磷酰胺构建AA小鼠模型[11],探讨CeO2纳米酶对AA小鼠的作用及其效果。
1 材料和方法
1.1 实验动物
7周龄雌性C57BL/6J小鼠30只,SPF级,体质量(20±2)g,购于山西医科大学实验动物中心,实验动物生产许可证号SCXK(晋)2019-0004。
1.2 主要试剂与仪器
环磷酰胺注射液购自德国Baxter Oncology GabH;异氟烷购自河北一品制药股份有限公司;ICAM-1及ELAM-1试剂盒购自睿信生物科技;MDA及SOD试剂盒购自南京建成生物工程研究所;DNM-9602酶标仪为北京普朗新技术有限公司产品;Optima XE超速离心机购于美国Beckman公司。透射电子显微镜购于美国FEI公司。
1.3 CeO2纳米酶制备方法
将108.6 mg硝酸铈[0.25 mmol的Ce(NO3)3·6H2O]溶解在10 mL的去离子水中,得到硝酸铈水溶液。同时,131.2 mg 6-氨基己酸(1 mmol,AHA)和5 μL盐酸(37%)在磁性搅拌下溶于1 mL去离子水中。然后,将硝酸铈的水溶液迅速在空气中加热到95 ℃,加入已配制完成的AHA和盐酸混合溶液。反应持续6 h,将所得的溶液降至室温,用丙酮清洗3次,除去过量的反应物,即可获得CeO2纳米酶。为了研究CeO2纳米酶结构,将样品溶在水中滴在超薄碳网上并烘干,进行透射电子显微镜的测试。
1.4 模型制备及分组
7周龄C57BL/6J小鼠随机分为3组,分别为空白组、模型组和CeO2纳米酶组,每组10只。吸入适量异氟烷后,使用动物专用刮毛刀将背部毛发剃除2 cm×3 cm区域,随后剃毛区域涂抹适量脱毛膏。此时,小鼠背部毛发呈粉红色,从而诱导小鼠背部毛囊从休止期进入生长期。剃毛后第9天,空白组小鼠给予腹腔内单次注射等剂量的生理盐水,模型组和CeO2纳米酶组小鼠均单次腹腔内注射环磷酰胺注射液[11]。定时拍照观察毛发生长及脱落情况,对新生毛发状况进行打分。评分标准:无毛生长为0分;浅毛生长满脱毛区为1分;新生毛长度及密度约为未脱毛区的一半为2分;新生毛长与未脱毛区无差别为3分[12]。
1.5 HE染色观察小鼠斑秃处毛发组织病理改变
实验完成后,通过颈椎脱臼处死所有小鼠,用剃毛刀将小鼠背部毛发脱干净,取小鼠背部治疗后的皮肤组织进行包埋、脱水及HE染色,观察镜检下组织病理学特点及显微镜下每个视野的毛囊计数。
1.6 ELISA检测小鼠血清ICAM-1及ELAM-1含量
实验第28天,通过尾静脉取血,6 000g离心10 min,取血清,使用ELISA法检测小鼠血清中ICAM-1及ELAM-1含量水平,均严格按照相应试剂盒说明操作,最后使用酶标仪测定450 nm处吸光度值,并根据绘制的标准曲线计算各样品中待测指标含量水平。
1.7 小鼠皮肤组织中MDA及SOD含量检测
取小鼠背部治疗后的皮肤组织,用玻璃研磨机和PBS彻底研磨得到匀浆,6 000g离心10 min,取上清,按照试剂盒说明书检测秃发区皮肤组织中MDA及SOD含量。
1.8 统计学分析
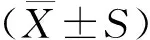
2 结果
2.1 CeO2纳米酶表征
透射电子显微镜(transmission electron microscopy, TEM)下观察CeO2纳米酶形态,结果观察到制备所得的CeO2纳米酶形貌规整、分散均匀、尺寸均一(见图1)。

图1 CeO2纳米酶表征Figure 1 Characterization of CeO2 nanoenzymes
2.2 小鼠秃发区毛发生长情况及评分
模型组背部秃毛区毛发很短,颜色灰白;空白组背部剃毛区毛发较模型组长,毛发致密,CeO2纳米酶组背部秃发区毛发致密,毛色乌黑光泽(见图2)。模型组小鼠秃发区毛发生长评分明显低于空白组(P<0.05);CeO2纳米酶组小鼠秃发区域毛发生长评分均明显高于模型组(P<0.05,见图3)。

图2 小鼠秃发区毛发生长情况Figure 2 Hair growth in the bald area of mice

注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。图3 各组小鼠秃发区毛发评分Figure 3 Hair scores in the bald area of mice in each group
2.3 小鼠秃发区病理组织学改变
镜检可见模型组表皮增厚,毛囊数量减少;空白组表皮较薄,毛囊处于生长期;CeO2纳米酶组毛囊数量明显增加且处于生长期(见图4)。模型组小鼠背部皮肤组织HE单位视野下的毛囊数量低于空白组(P<0.05);CeO2纳米酶组单位视野毛囊数量显著高于模型组(P<0.05,见图5)。

图4 秃发区皮肤组织病理学 (×10)Figure 4 Skin histopathology in bald area (×10)
2.4 小鼠血清ICAM-1及ELAM-1水平
模型组血清中ICAM-1水平较空白组升高(P<0.05),CeO2纳米酶组血清中水平低于模型组(P<0.05,见图6)。模型组血清中ELIAM1水平较空白组升高(P<0.05),CeO2纳米酶组血清中水平低于模型组(P<0.05,见图6)。

注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。图6 CeO2纳米酶小鼠血清中ICAM-1和ELAM-1含量的影响Figure 6 Effect of CeO2 nanoenzyme on serum contents of ICAM-1 and ELAM-1 in mice
2.5 小鼠秃发区皮肤组织中MDA及SOD含量
模型组皮肤组织中MDA含量较空白组升高(P<0.05),CeO2纳米酶组MDA含量较模型组降低(P<0.05,见图7)。模型组皮肤组织中SOD含量较空白组降低(P<0.05),CeO2纳米酶组SOD含量较模型组升高(P<0.05,见图7)。

注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。图7 CeO2纳米酶对小鼠皮肤组织中MDA和SOD含量的影响Figure 7 Effect of CeO2 nanoenzyme on MDA and SOD contents in mouse skin
3 讨论
AA作为一种自身免疫性炎症性脱发,严重影响了患者的生活治疗,目前缺乏有效预防及治愈AA的方法,多种针对免疫细胞的疗法用于治疗AA,但是效果具有个体差异[3,13]。氧化应激作为AA发病机制之一,为AA的治疗提供新的治疗靶点。
CeO2纳米酶具有SOD样活性,可保护细胞免受氧化应激的损伤,拥有强大的抗氧化能力,这种抗氧化能力源于CeO2纳米酶表面的双氧化态Ce3+和Ce4+,其中Ce3+负责消除O2·和·OH,而Ce4+根除H2O2[14,15]。由于CeO2纳米酶良好的抗氧化还原和储氧能力,CeO2纳米酶被广泛应用于各种与氧化应激相关的疾病。但是目前在皮肤相关疾病中应用较少。Yuan等[10]的实验结果表明,氧化铈纳米酶外用于雄激素脱发小鼠模型可以通过有效地改善毛囊周围环境氧化应激水平,对毛囊周围微血管系统的新生也有较好促进作用,从而加速毛囊由休止期进入生长期,快速诱导毛发生长,且比传统治疗药物米诺地尔效果显著。故本研究将CeO2纳米酶应用于斑秃小鼠模型,观察其治疗效果。结果发现,与空白组相比,模型组皮肤组织中MDA含量升高及SOD含量下降,经过CeO2纳米酶治疗后,CeO2纳米酶组皮肤组织中MDA含量降低及SOD含量升高。提示,CeO2纳米酶可以通过清除过量的活性氧积累,有效地调控皮肤中氧化应激,减轻氧化损伤,从而促进毛发生长,与上述文献研究结论一致。
综上所述,本研究表明CeO2纳米酶可以通过抗氧化应激清除活性氧从而促进AA小鼠模型毛发生长,达到治疗的目的,CeO2纳米酶可能成为治疗AA的新型药物的研究方向。但本研究存在以下局限性:首先,本研究通过腹腔内注射环磷酰胺构建斑秃小鼠模型,其发病机制与人类斑秃并非完全吻合;其次,本研究仅在动物模型层面考察了CeO2纳米酶治疗AA的可能作用,并未在细胞层面进一步研究深入揭示CeO2纳米酶发挥作用的具体分子机制。因此,在后续研究中,需要进一步构建更符合人类斑秃的动物模型并在细胞和分子层面论证CeO2纳米酶治疗AA的具体机制,并深入探究CeO2纳米酶治疗AA的优势和不足。

