青年首发抑郁症患者继发精神病性症状的危险因素
毛俊雄,马 琦,,彭朕磊,贾麒钰,徐秋爽,罗 晓,张丽丽,伊琦忠(新疆精神(心理)疾病临床医学研究中心,新疆医科大学第一附属医院心理医学中心,乌鲁木齐 80054;新疆医科大学临床医学研究院,新疆代谢性疾病重点实验室;新疆医科大学第一附属医院创伤骨科;共同第一作者;通讯作者,E-mail:qizhongyi@6.com)
近年来,重度抑郁症(major depression disorder,MDD)的发病率显著增加,一项大规模的流行性病学调查研究显示,中国MDD患者终身患病率为3.4%[1]。当MDD伴有精神病性症状时,被称为伴有精神病性重度抑郁症(psychotic major depression,PMD)[2]。据统计,我国PMD患者约占MDD患者的9.2%[3],其病程及转归与MDD患者也有较大差异[4,5]。研究表明,PMD患者自杀风险及复发率更高,治疗难度更大[6]。PMD的发生与多种因素密切相关,遭受过童年不良事件(如性虐待、躯体虐待及忽视等)的患者更有可能伴有精神病性症状[6,7]。严重的焦虑抑郁情绪可能更容易诱发精神病性症状[8]。此外,血脂[9]及甲状腺激素水平[10]的异常也可能影响PMD的发展,并在一项针对中年人群的研究中得到证实[11]。据报道,不同年龄段PMD患者的临床表现存在差异,Sikich[12]的研究表明,在年轻人群中幻觉更为常见,提示不同年龄的PMD患者可能具有不同的危险因素。
近年来,MDD发病人群趋于年轻化,青年PMD患者逐年增加。鉴于PMD的高危害,制定降低青年PMD发生率的有效措施迫在眉睫,其关键在于找寻MDD向PMD转变的关键危险因素。然而年龄与代谢指标之间存在较大的关联性,因此相同的指标在不同年龄段中的结果可能存在差异。本研究搜集了青年抑郁患者的一般资料及血糖、血脂、甲状腺功能、泌乳素(PRL)和25-羟基维生素D[25(OH)D]水平,探寻青年首发PMD患者的相关危险因素,为PMD的早期预防提供理论基础,为制定新的PMD预防和治疗策略提供参考。
1 对象和方法
1.1 对象
研究对象来自2021—2022年新疆医科大学第一附属医院心理医学中心,由2名副主任医师以上职称的精神科医生根据《精神障碍诊断与统计手册(第5版)》(Diagnostic and Statistical Manual of Mental Disorders, DSM-5,5th Edition)对患者进行独立诊断,诊断为MDD。本研究经新疆医科大学第一附属医院伦理委员会批准(批准文号:20201106-08),所有入组患者均签署知情同意书。
1.2 纳入与排除标准
纳入标准:①符合DSM-5中MDD诊断标准;②年龄18~45岁;③汉密尔顿抑郁量表(Hamilton depression scale, HAMD-17)≥24分;④入院前未经过药物治疗;⑤无精神活性物质滥用史;⑥无严重躯体疾病;⑦长期生活于新疆维吾尔自治区北部。
排除标准:①伴有其他精神疾病;②有头部外伤史;③妊娠期、哺乳期、生理期。
1.3 分组
对符合纳入及排除标准的患者进行为期1年的随访,根据其是否继发精神病性症状,分为伴有精神病性症状的重度抑郁症组(PMD组,n=46)和不伴有精神病性症状的重度抑郁症组(MDD组,n=186)。
1.4 基本信息的采集
收集所有参与者初次入院时的性别、年龄、种族、教育背景、体质量指数(BMI)和婚姻状况。
1.5 量表评分
在2名具有副主任医师及以上职称的精神科医生的指导下对患者进行HAMD-17及汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)的评分,当HAMD-17总分≥24时,则认为患者为重度抑郁;当HAMA总分≥14时,提示患者重度焦虑。两量表经过反复测量,评估结果的组内相关系数大于0.8。
1.6 血液指标检测
所有患者初次入院当天禁食,次日上午8∶00—9∶00采集肘静脉血3~4 mL,2 h内由新疆医科大学第一附属医院临床检验中心检测。检测指标包括血糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)、血清总甲状腺素(TT4)、血清游离甲状腺素(FT4)、促甲状腺激素(TSH)、泌乳素(PRL)和25-羟基维生素D(25(OH)D)等。
1.7 联合指标的构建
在单因素的基础上采用Logistic回归分析筛选出PMD的独立危险因素,将所有的独立危险因素作为预测变量,以PMD作为因变量建立Logistic回归模型,将该模型的预测值作为本研究中的联合指标并进行ROC曲线绘制。
1.8 统计学分析
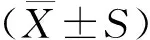
2 结果
2.1 两组间一般人口学资料比较
PMD组未婚人数占比高于MDD组(P<0.05),两组间年龄、BMI、性别、民族及文化程度的差异均不具有统计学意义(P>0.05,见表1)。

表1 两组患者的一般人口学资料比较Table 1 Comparison of general demographic data between the two groups
2.2 两组间临床量表和血液常规代谢指标比较
与MDD组相比,PMD组HAMD-17得分、血清TC、LDL-C及TSH水平升高,HDL-C及25(OH)D水平降低,差异均有统计学意义(P<0.05,见表2)。

表2 两组间临床量表及血液常规代谢指标比较Table 2 Comparison of clinical scales and metabolic indexes between the two groups
2.3 各指标与精神病性症状之间的关联性分析
婚姻状况(已婚)(r=-0.208)、HDL-C(r=-0.258)及25(OH)D水平(r=-0.276)与精神病性症状呈负相关(P<0.01);HAMD-17得分(r=0.345)、TC(r=0.148)、LDL-C(r=0.162)及TSH水平(r=0.134)与精神病性症状呈正相关(P<0.05,见表3)。此外,本研究还表明婚姻状况(已婚)与TC(r=0.223)、LDL-C水平(r=0.221)呈正相关,25(OH)D水平与HAMD-17评分(r=-0.245)及TSH水平(r=-0.157)呈负相关,TC与HDL-C(r=0.224)及LDL-C水平(r=0.916)呈正相关(P<0.05,见表3)。

表3 各指标和精神病性症状之间的Spearman相关性分析 (r值)Table 3 Spearman correlation analysis between each index and psychotic symptoms (r value)
2.4 MDD患者精神病性症状的独立危险因素分析
相关性分析提示各因素之间可能相互影响,为了降低其对结果的干扰,本研究将上述指标纳入多因素Logistic回归分析,结果显示未婚、HAMD-17、TC及低25(OH)D水平为MDD患者精神病性症状的独立危险因素,HDL-C为MDD患者精神病性症状的保护因素(P<0.05,见表4)。

表4 多因素Logistic回归分析Table 4 Multinomial Logistics regression analysis
2.5 ROC曲线分析结果
为了进一步验证上述危险因素与PMD之间的关系并寻找最佳临界阈值,本研究使用Prims9软件绘制ROC曲线。ROC图以其曲线下面积(AUC)反应相关因素对MDD患者继发精神病性症状的预测能力,结果见图1。HAMD-17量表得分的最佳阈值为30.5分(AUC=0.748,95%CI:0.663~0.834),敏感性为0.587,特异性为0.812。TC的最佳阈值为4.155 mmol/L(AUC=0.607,95%CI:0.514~0.699),敏感性为0.609,特异性为0.627。HDL的最佳阈值为1.105 mmol/L(AUC=0.687,95%CI:0.591~0.783),敏感性为0.790,特异性为0.543。25(OH)D水平的最佳阈值为29.725 nmol/L(AUC=0.700;95%CI:0.620~0.779),敏感性为0.473,特异性为0.848。HAMD-17、TC、HDL、25(OH)D及婚姻状况组成的联合指标的AUC为0.887(P<0.001,95%CI:0.835~0.940),敏感性为0.783,特异性为0.844。

注:婚姻状况、HAMD-17得分、TC、HDL-C、25(OH)D及联合指标的AUC分别为0.624,0.748,0.607,0.687,0.700,0.887。图1 各指标预测青年首发MDD患者继发精神病性症状的ROC曲线分析结果Figure 1 ROC curve analysis of each index in prediction of secondary psychotic symptoms in young patients with first-episode MDD
3 讨论
已有的研究表明PMD患者发病年龄呈年轻化趋势、预后更差、复发率及自杀风险更高[3,4],鉴于青年PMD临床表现的特殊性及危害性,早期预测青年MDD患者精神病性症状引起广大学者的重视,因此探寻与青年PMD患者相关的危险因素十分重要。本研究的结果表明,PMD的发生与多种因素相关,具体而言,未婚的MDD患者更有可能继发精神病性症状,与MDD组相比,PMD组HAMD-17量表评分、血清TC、LDL-C及TSH水平升高,与精神病性症状呈正相关;血清HDL-C及25(OH)D水平降低,与精神病性症状呈负相关。多因素Logistic回归分析结果提示,未婚、HAMD-17评分、TC、低HDL-C及低25(OH)D水平是MDD患者精神病性症状的独立危险因素。ROC曲线结果表明所有独立危险因素组成的联合指标能够很好地预测MDD患者继发精神病性症状的可能(AUC=0.887)。
在临床实践中,PMD与精神分裂症(schizophrenia,SC)均存在异常的精神症状,提示两者之间可能存在共同的发病机制。研究表明,婚姻状况可能与精神病性症状之间存在关联,与MDD相比,PMD患者未婚占比升高,提示未婚可能是PMD发病的一个潜在因素[3]。本研究结果显示,在青年人群中,未婚MDD患者出现精神病症状概率更高,经Logistic回归分析,未婚可能是PMD的一个独立危险因素,与既往结果相同[13]。最近发表在Lancet Psychiatry杂志上的一项荟萃分析指出,家庭干预可以降低SC患者的复发率,提示良好的家庭环境可能是PMD的保护因素[14]。因此,未婚患者PMD患病率较高可能与缺乏伴侣的陪伴和支持有关。此外,多项研究证实,在MDD的发作期间,病情的严重程度可能与精神病性症状相关[2,15]。在本研究中,PMD患者HAMD-17量表得分高于MDD患者,与既往结果保持一致[11]。
血脂代谢异常与众多精神疾病密切相关,既往研究表明血脂水平可能也是PMD的危险因素[8]。在本研究中,与MDD相比,PMD患者TC、LDC-C水平升高,HDL-C水平降低,多因素Logistic回归分析结果表明,高TC水平及低HDL-C水平是PMD的独立危险因素,与Wang等[8]的研究相吻合。然而,既往关于血脂与精神疾病的研究结果与此并不一致,Misiak等[16]的一项荟萃分析表明,在首发精神疾病患者中,血清TC水平降低。流行病学报告显示,血脂水平随年龄的增加而升高,在Misiak等[16]的研究中,并未对研究对象的年龄加以限制,而本研究中入组患者均为青年人群,因此结果的差异可能由样本的异质性所致。然而血脂水平与精神病性症状之间的生理学机制暂不明确,有待后续深入研究。
研究表明,SC患者往往伴随着25(OH)D水平的降低[17-19],因此25(OH)D水平与PMD可能也存在关联,然而在既往研究中并无相关文献报道。25(OH)D是人体内反映维生素D(VD)含量的主要指标,VD作为一种脂溶性维生素,可介导免疫反应,调节体内钙、磷吸收[20,21]。研究表明,光照对人体VD的产生具有重要作用[22,23],而不同纬度光照时间的差异可能导致人体内25(OH)D水平的不同[24]。为了控制纬度变量,本研究中的所有参与者均长期生活在新疆维吾尔自治区北部,结果显示,PMD患者的25(OH)D水平低于MDD患者,并且是精神病性症状的独立危险因素。精神病性症状的发生可能与炎症密切相关[25],作为一种先天性免疫调节剂,VD可以与不同的免疫细胞表面受体相互作用[20],其活性产物可以调节单核细胞中的Toll样受体(TLR)2和TLR4从而减轻炎症反应[21]。此外,多巴胺假说认为,精神分裂症精神病性症状的出现是大脑中多巴胺功能亢进和边缘区投射功能异常的结果[26]。大鼠实验表明,VD缺乏可能会改变早期发育过程中大脑中的多巴胺系统[27],而VD补充通过改善TH基因(多巴胺合成限速酶)的表达来保护多巴胺神经元[28]。因此,25(OH)D可能通过上述途径参与PMD的发生。
既往在临床诊疗过程中,抗抑郁药物(如舍曲林、草酸艾司西酞普兰等)联合抗精神病性药物(喹硫平、奥氮平等)是PMD的传统治疗手段[2]。然而,有研究提示,精神分裂症患者辅以他汀类药物(降脂药)能够改善其精神症状[29],VD的辅助治疗能够通过调控神经生长因子水平及氧化应激状态从而降低精神分裂症患者PANSS量表评分[30],提示他汀类药物及补充VD可能有助于PMD患者的治疗。本研究结果表明,血脂及25(OH)D的异常可能与MDD患者精神病性症状的发生密切相关,与Shen等[29]及喻灏等[30]的研究结果相吻合。
本研究的局限性在于以下几点。首先,研究的样本量较小,可能会在一定程度上影响统计效果,在进一步的研究中,需要扩大样本量以获得更可靠的结果;其次,不同季节导致阳光照射时间不同,可能会影响25(OH)D水平,在该研究中,由于样本量的限制,未对患者入院的季节进行严格分类。
综上所述,本研究表明未婚、HAMD-17评分、高TC水平、低HDL-C及低25(OH)D水平是PMD的独立危险因素,血脂及25(OH)D水平可作为预测青年MDD患者继发精神病性症状的的生物标志物,为青年PMD患者的治疗提供新启示。此外,所有独立危险因素的联合指标有助于预测MDD患者精神病性症状的发生(AUC=0.887),提示在MDD的早期阶段应给予关注,以降低MDD向PMD转变的风险。

