脂氧素A4对Ⅱ型肺泡上皮细胞-间质转化的抑制作用及其机制
王贵佐,杨淑梅,刘 璐(陕西省人民医院呼吸与危重症一科,西安 710068;通讯作者,E-mail:liulu290@126.com)
肺纤维化(pulmonary fibrosis, PF)是一种慢性间质性肺疾病,以肺泡上皮损伤、成纤维细胞活化、细胞外基质(extracellular matrix,ECM)沉积和组织结构破坏为特征[1]。该病好发于老年人,发病机制尚未完全明确,目前缺乏有效治疗药物,预后差[2]。肺泡上皮细胞(alveolar epithelial cell, AEC)向间质转化(epithelial-mesenchymal transition, EMT)被认为在肺纤维化过程中发挥重要作用[3]。AEC包括Ⅰ型肺泡上皮细胞(alveolar epithelial type Ⅰ cell, ATⅠ)和Ⅱ型肺泡上皮细胞(ATⅡ)。其中,ATⅡ占AEC的60%,占所有肺细胞的10%~15%,覆盖约4%的肺泡表面[4]。除了可合成、分泌表面活性物质,ATⅡ还具有参与免疫反应以及转分化等多种功能,在肺发育和损伤修复过程中发挥重要作用[5]。近年来研究发现,ATⅡ不仅可分化为ATⅠ[6],还可向间质细胞转变,是肺纤维化过程中肌成纤维细胞的部分来源[7]。因此,揭示ATⅡ发生EMT的机制可为寻求预防和/或治疗肺纤维化提供干预新靶点。
转化生长因子β1(transforming growth factor, TGF-β1)可诱导肌成纤维细胞转分化、EMT以及ECM沉积,在多种器官纤维化过程发挥重要调节作用[8-10]。研究表明TGF-β1可通过激活经典Smad和非经典信号通路介导肌成纤维细胞激活、ECM沉积,最终诱导肺纤维化[11]。核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)是TGF-β1下游非经典信号通路关键分子之一,可调节包括抗氧化、解毒酶等相关基因表达[12],在维持细胞内稳态、氧化还原平衡反应方面发挥重要作用[13-15]。研究发现,Nrf2下调可诱导EMT以及肺纤维化[16]。脂氧素A4(lipoxin A4, LXA4)是花生四烯酸的代谢产物,通过与细胞膜上的LXA4受体结合发挥作用[17]。激活LXA4受体可减轻机械通气诱导的EMT和肺纤维化[18];LXA4稳定类似物BML-111可抑制TGF-β1诱导的肺成纤维细胞活化,减轻博来霉素诱导的肺纤维化[19]。但LXA4通过何种机制减轻肺纤维化,还需进一步研究。本研究通过评估LXA4是否可抑制ATⅡ间质转化,探讨其机制是否与LXA4上调Nrf2表达相关,为肺纤维化临床防治策略提供理论基础和实验依据。
1 材料与方法
1.1 主要试剂
TGF-β1粉剂(纯度≥98%)购于美国PeproTech公司,LXA4酊剂(纯度≥95%)购于美国Cayman Chemical公司,DMEM高糖培养基粉剂购于美国Gibco公司,胎牛血清购于中国浙江天杭生物科技股份有限公司,RIPA裂解液购自于中国上海碧云天公司,化学发光液购自于美国Milipore公司,大鼠抗人E钙黏蛋白(E-cadherin)单克隆抗体、小鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)单克隆抗体、兔抗人Nrf2多克隆抗体、小鼠抗人β-actin单克隆抗体均购于美国Merck公司,HRP标记羊抗兔及小鼠二抗购于美国Sigma-Aldrich公司,LipofectamineTM2000购于美国Invitrogen公司。
1.2 细胞培养、分组及干预
人肺腺癌A549细胞作为腺癌中的肺泡基底上皮细胞,具有AT Ⅱ的生物学特性,已作为AT Ⅱ的体外模型广泛应用。人肺腺癌A549细胞购于中国科学院典型培养物保藏委员会上海细胞库。将A549细胞培养于含有10%胎牛血清和100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖培养基中,在37 ℃ 5% CO2培养箱内培养,取对数生长期的细胞进行实验。
将A549细胞分为对照组、TGF-β1组、空质粒+TGF-β1组、pcDNA3.1-Nrf2+TGF-β1组、LXA4+TGF-β1组。TGF-β1组以5 ng/mL TGF-β1干预A549细胞48 h;空质粒+TGF-β1组和pcDNA3.1-Nrf2+TGF-β1组A549细胞先分别转染空质粒和Nrf2过表达质粒,再以5 ng/mL TGF-β1干预48 h;LXA4+TGF-β1组A549细胞先用100 nmol/L LXA4预处理6 h再给予5 ng/mL TGF-β1干预48 h。
1.3 免疫荧光染色检测细胞E-cadherin、α-SMA表达
A549细胞消化后接种于预先放置有载玻片的6孔板中,移液管吸除培养液后PBS洗3次,4%多聚甲醛溶液固定15 min,0.1% Triton X-100作用20 min,用含10%血清的封闭液封闭25 min,加入E-cadherin(1∶200)、α-SMA抗体(1∶400),湿盒内4 ℃孵育24 h,加入荧光二抗,室温下避光孵育1 h,封片,荧光显微镜观察E-cadherin和α-SMA表达。
1.4 转染质粒过表达Nrf2
调整A549细胞密度至1×106个/mL,取2 mL接种于6孔板,将细胞分为空质粒组、pcDNA3.1-Nrf2组,采用LipofectamineTM2000将浓度为0.5 μg/μL的空质粒或Nrf2过表达质粒分别转染细胞48 h。
1.5 免疫印迹法检测细胞Nrf2蛋白水平
免疫印迹法检测E-cadherin、α-SMA、Nrf2蛋白水平,β-actin作为内参。使用RIPA裂解液提取总蛋白,测定蛋白浓度后按体积4∶1加入上样缓冲液,100 ℃水浴变性。SDS-PAGE分离蛋白样,采用湿转法将凝胶上的蛋白转至PVDF膜。使用封闭液充分封闭,与一抗(大鼠抗人E-cadherin单克隆抗体、小鼠抗人α-SMA单克隆抗体、兔抗人Nrf2多克隆抗体,稀释度均为1∶1 000;小鼠抗人β-actin单克隆抗体,稀释度1∶5 000)孵育,4 ℃过夜,洗膜后与HRP标记羊抗兔及小鼠二抗(稀释度1∶10 000)室温孵育2 h,再次洗膜后进行化学发光。
1.6 统计学分析
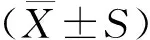
2 结果
2.1 TGF-β1诱导AT Ⅱ发生EMT
倒置显微镜下观察细胞形态,与对照组相比,TGF-β1组部分细胞失去原有的“鹅卵石”样形态,呈现出更加拉伸或伸长的纺锤形,这也是上皮细胞发生EMT的典型改变(见图1A)。与对照组相比,TGF-β1组细胞间充质标志物(α-SMA)蛋白表达水平较对照组升高(P<0.01),而上皮标志物(E-cadherin)的表达较对照组降低(P<0.05,见图1B)。免疫荧光结果与免疫印迹结果一致,即TGF-β1组A549细胞α-SMA水平上调、E-cadherin水平下调(见图1C)。
注:红箭头所指绿色荧光信号为α-SMA,黄箭头所指绿色荧光信号为E-cadherin,白箭头所指蓝色荧光信号为细胞核。C.免疫荧光染色检测细胞α-SMA和E-cadherin表达图1 TGF-β1诱导A549细胞发生EMTFigure 1 TGF-β1 exposure induces EMT in A549 cells
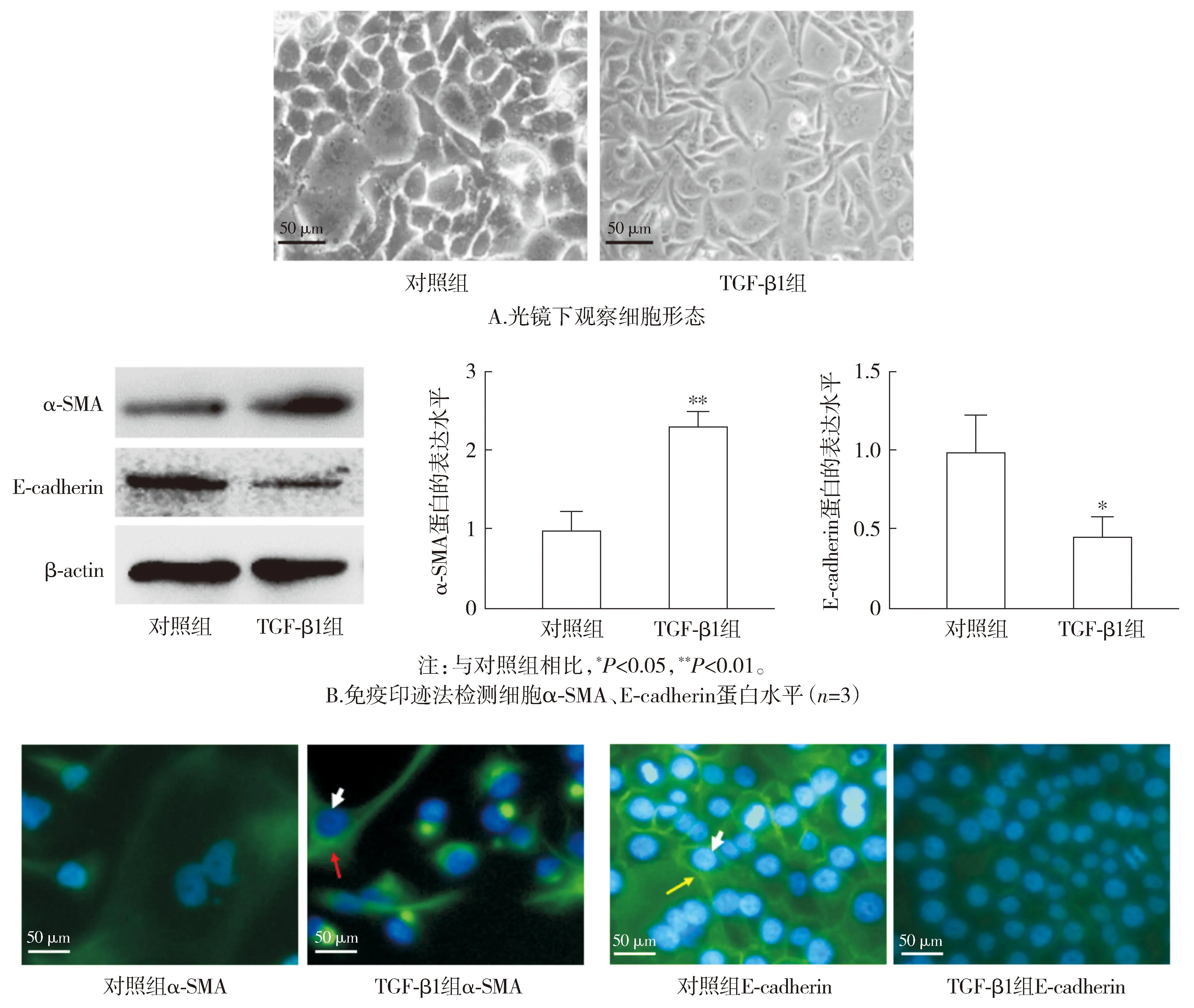
2.2 Nrf2介导TGF-β1诱导的AT Ⅱ发生EMT
与对照组相比,TGF-β1组A549细胞Nrf2蛋白水平下调(P<0.05,见图2A),pcDNA3.1-Nrf2组细胞Nrf2蛋白水平增加(P<0.05,见图2B)。与TGF-β1组相比,pcDNA3.1-Nrf2+TGF-β1组A549细胞α-SMA蛋白水平降低(P<0.01),E-cadherin蛋白水平升高(P<0.05,见图2C)。免疫荧光结果与免疫印迹结果一致(见图2D)。
注:红箭头所指绿色荧光信号为α-SMA,黄箭头所指绿色荧光信号为E-Cadherin,白箭头所指蓝色荧光信号为细胞核。D.免疫荧光染色检测细胞α-SMA和E-cadherin表达图2 Nrf2介导TGF-β1诱导A549细胞发生EMT作用 (n=3)Figure 2 Nrf2 mediates TGF-β1-induced EMT in A549 cells (n=3)
2.3 LXA4通过激活Nrf2抑制TGF-β1诱导的AT Ⅱ发生EMT
与对照组相比,TGF-β1组A549细胞α-SMA蛋白水平升高(P<0.01),E-cadherin及Nrf2蛋白水平降低(P<0.05);与TGF-β1组相比,LXA4+TGF-β1组A549细胞α-SMA蛋白水平降低,E-cadherin及Nrf2蛋白水平升高(P<0.05,见图3A)。免疫荧光结果与免疫印迹结果一致(见图3B)。

注:红箭头所指绿色荧光信号为α-SMA,黄箭头所指绿色荧光信号为E-cadherin,白箭头所指蓝色荧光信号为细胞核。B.免疫荧光染色检测细胞α-SMA和E-cadherin表达图3 LXA4通过上调Nrf2抑制TGF-β1诱导的A549细胞发生EMTFigure 3 LXA4 inhibits TGF-β1-induced EMT in A549 cells by upregulation of Nrf2
3 讨论
肺纤维化以ECM的过度产生和聚集,以及肺组织结构的异常重构为特征[20]。目前尚无有效措施治愈或逆转肺纤维化的进展,免疫抑制剂(如环磷酰胺)和皮质类固醇(如地塞米松)已被用于治疗特发性肺纤维化急性加重,旨在减轻症状和炎症反应,但因疗效有限以及不容忽视的不良反应限制了它们的临床应用[21,22]。抗纤维化药物尼达尼布和吡非尼酮虽可延缓肺纤维化进展[23,24],但却不能治愈肺纤维化。目前,肺移植是终末期肺纤维化患者最终选择的治疗手段,但存在手术费用高、肺供体稀缺和远期生存率差等客观问题。因此,本研究以在肺纤维化中发挥重要作用的AT Ⅱ为研究对象,探讨EMT的潜在机制,旨在为肺纤维化临床干预提供靶点。
ACE失去顶端-基底极性和细胞间黏附性(两者为上皮细胞的特征),并获得间充质细胞的分子及生理特性,具备胶原蛋白合成及收缩能力,即EMT参与肺纤维化的发生发展过程[25]。肺纤维化患者和动物模型中均可检测到ACE向间质转化;在肺纤维化中约有1/3的成纤维细胞是经EMT形成[26],因此探讨ACE发生间质转化的潜在机制、寻求干预靶点,具有重要临床意义。目前研究认为,Nrf2在包括肺纤维化在内的多种以氧化应激和炎症反应为潜在病理机制的器官系统疾病中发挥保护作用[27-29]。激活Nrf2可分别抑制肝细胞及肾小管上皮细胞发生间质转化,减轻小鼠肝纤维化、肾间质纤维化严重程度[30-32],但上调/激活Nrf2是否也可抑制ACE发生间质转化,进而延缓/减轻肺纤维化严重程度,尚无相关报道。本研究结果显示,TGF-β1可通过抑制Nrf2诱导A549细胞发生间质转化,而预先过表达Nrf2可抑制TGF-β1诱导EMT的作用,提示Nrf2在肺纤维化EMT中发挥重要作用。这与Zhang等[16]研究结果一致,即TGF-β1可通过下调Nrf2诱导大鼠AT Ⅱ和A549细胞发生间质转化。
LXA4在炎症后的组织修复调节中发挥重要作用,特别是在肺、肾脏和皮肤纤维化中[33-35]。LXA4稳定类似物BML-111可抑制乳腺癌细胞[36]、子宫内膜上皮细胞[37]以及肝癌细胞[38]发生EMT。在大脑皮质星形胶质细胞[39]、视网膜色素上皮细胞[40]、心肌细胞[41]等多种非ACE中,LXA4可激活Nrf2信号通路。此外,LXA4还可降低肺纤维化模型肺组织中TGF-β水平,并表现出抗纤维化作用[33]。但LXA4的抗肺纤维化作用是否与其抑制ACE向间质转化,及其潜在机制尚未明确。本研究在此基础上深入探索,结果显示,在A549细胞中,LXA4可抑制TGF-β1诱导的Nrf2下调及EMT作用。
综上所述,LXA4通过上调Nrf2表达,抑制AT Ⅱ发生EMT,为肺纤维化临床治疗提供新的思路。但本研究仅进行体外实验,不能完全反映体内的真实情况,还须体内实验进一步证实。另外,除了上调Nrf2外,可能还有其他机制介导LXA4抑制AT Ⅱ间质转化、改善肺纤维化的作用。这有待我们在下一步研究中,验证LXA4稳定类似物在肺纤维化动物模型中的作用及分子机制;并进一步探索是否存在其他潜在作用机制及其之间的相互关系。

