L-3-正丁苯酞对实验性自身免疫性脑脊髓炎的作用及其机制
韩红霞,张晋欣(山西省心血管病医院重症医学科神经重症病区,太原 030024;通讯作者,E-mail:zhangjinxin558@126.com)
多发性硬化症(multiple sclerosis, MS)是一种器官特异性的慢性炎症性疾病,其特征是中枢神经系统(central nervous system, CNS)的脱髓鞘和轴突破坏[1]。MS的发病机制复杂,主要包括淋巴细胞和单核细胞穿透血脑屏障浸润中枢,导致胶质细胞的激活,最终引发髓鞘损伤和CNS白质丢失[2]。由于MS的病因尚未完全明确,因此人们仍在探索MS疾病进展的有效治疗方法[3]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE),由神经抗原特异性T细胞诱导[4],已被公认为是研究治疗MS的潜在药物疗效及探讨MS分子机制广泛使用的动物模型[5]。
L-3-正丁基酞(L-3-n-butylphthalide, NBP)最初提取于芹菜籽,是治疗急性缺血性中风的有效药物[6]。越来越多的证据表明,NBP可以重建血流,减轻血脑屏障损伤[7],减轻脑出血模型大鼠的炎症反应和脑水肿[8],减少梗死病变,预防神经损伤,但其在MS中的潜在治疗机制尚未完全阐明。
小G蛋白RhoA属于Ras同源基因家族,其下游效应蛋白是Rho依赖性激酶(Rho-dependent kinase, ROCK),在星形胶质细胞和神经元中普遍表达,并通过与其下游受体结合来调控肌凝、肌动蛋白等参与调控细胞骨架的形成,对胶质细胞和神经元细胞的发育成熟、髓鞘形成、突触的可塑性等发挥至关重要的作用[9,10]。研究发现,抑制RhoA/ROCK信号通路可以调节巨噬细胞/小胶质细胞的极化,从而减弱脉络膜新生血管[11]。此外,研究表明抑制RhoA/ROCK信号通路可有效减轻缺血性卒中诱导的神经炎症[12],提示RhoA/ROCK信号通路与神经炎症有密切的相关性。而RhoA/ROCK信号通路在EAE中作用机制尚未有研究报道。因此,本研究从抑制免疫炎症的角度观察NBP对EAE模型小鼠的影响,探讨其作用机制是否与RhoA/ROCK信号通路介导有关。
1 材料和方法
1.1 实验动物
SPF级C57BL/6雌性小鼠32只,10周龄,体质量(20±2)g,购自北京维通利华实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2021-0006。饲养在山西医科大学实验动物中心的屏障环境中(实验动物使用许可证号:SYXK(晋)2019-0007),SPF条件下饲养,12 h光照/12 h黑暗循环,标准喂食自由食物和水。实验操作符合山西医科大学实验动物福利伦理(SYDL2023061)。
1.2 试剂及仪器
NBP(批号:6606-49-5)购自石药集团恩必普药业有限公司,髓鞘少突胶质细胞糖蛋白肽片段35-55(MOG35-55)(批号:149635-73-4)、弗氏完全佐剂(complete Freund′s adjuvant,CFA)(批号:S6322)、Total RNA Extraction Kit(批号:RTN350)、real time-PCR试剂盒(批号:QR0200)均购自美国Sigma公司,IL-10(批号:RX-G203075M)、IL-1β(批号:RX-G203063M)、IL-6(批号:RX-G203049M)和IL-18(批号:RX203064M)酶联免疫吸附试验(ELISA)检测试剂盒均购自睿信生物科技有限公司,TNF-α、TNFR1、IL-1β及内参β-actin引物由华大基因科技有限公司合成,RhoA(批号:ab54835)、ROCKⅠ(批号:ab134181)、ROCKⅡ(批号:ab125025)和β-actin抗体(批号:ab8226)均购自美国abcam公司。
组织切片扫描系统(型号:Scanscope-cs)购自美国Aperio公司,荧光定量PCR仪(型号:Step one plus)购自美国ABI公司,垂直电泳系统(型号:Mana-TROTEAN)购自美国Bio公司等。
1.3 方法
1.3.1 EAE模型构建及分组 32只C57BL/6雌性小鼠随机分为:对照组(control组)、EAE组、NBP低剂量组(L-NBP)和NBP高剂量组(H-NBP),每组8只。EAE造模方法参考之前的研究[13],使用生理盐水将MOG35-55多肽稀释至5 g/L,然后加入等体积的CFA,混匀后加入一定体积的再灭活结核分枝杆菌,轻轻吹打混匀,形成4 g/L的结核杆菌H37Ra油包水乳剂。在小鼠脊柱两侧选取4点皮下注射0.1 mL MOG35-55水乳剂。除对照组以外,其余各组小鼠均皮下注射MOG35-55多肽油包水乳剂进行造模,对照组皮下注射等体积的生理盐水。
1.3.2 NBP体内给药 根据中国患者的NBP临床剂量(25~50 mg/d),结合体表面积转换法(小鼠换算系数0.002 6),按小鼠剂量=人剂量[mg/(kg·d)]×70 kg×0.002 6/0.02 kg,计算得小鼠的NBP使用剂量为3.25~6.5 mg/(kg·d)。以该剂量作为理论参考,本研究选择NBP低剂量3.25 mg/(kg·d),高剂量6.5 mg/(kg·d)。对照组和EAE组给予等体积生理盐水,均采用腹腔注射给药,连续28 d。
1.3.3 EAE病情评分 从免疫当日开始,每7 d对各组小鼠进行称重,并采用Weaver评分法进行评分[14],由1名对治疗组不知情的观察者进行神经功能观察评估。评分标准:总分为0~5分。尾巴的得分为0~2分,四肢的得分为0~3分。尾部的评分定义为:0分,正常;1分,部分瘫痪;2分,完全瘫痪。四肢分别评估如下:0分,正常;1分,步态改变或虚弱;2分,瘫痪;3分,完全瘫痪的肢体。
1.3.4 取材及标本处理 各组小鼠体内给药后28 d取材。①取血清:眼眶静脉丛取血于1.5 mL离心管中,室温静置30 min,1 200 r/min离心10 min,收集血清。②脊髓组织病理取材:0.6%戊巴比妥钠麻醉小鼠后,使用生理盐水进行心脏灌注,再使用4%多聚甲醛进行固定,断头取脊髓组织,置于多聚甲醛中固定24 h,石蜡包埋后进行切片,分别进行苏木精和伊红(HE),劳克坚牢蓝(Luxol fast blue, LFB)染色。
1.3.5 HE染色及病理评分 对脊髓组织进行HE染色,以评估炎症浸润情况。HE染色后,采用组织切片扫描系统进行观察。组织病理学评分标准如下[5]:0分,正常;1分,轻度炎症,少量炎症细胞浸润;2分,中度炎症,组织血管周围出现炎症浸润;3分,严重炎症,血管周围出现炎症细胞袖带样浸润;4分,大量炎症,血管周围炎症细胞袖带样延伸至邻近组织。
1.3.6 LFB染色及病理评分 取各组小鼠脊髓,石蜡包埋脊髓组织,切片、二甲苯梯度水合,蒸馏水清洗,浸入0.1% LFB溶液,60 ℃密封浸染8~16 h;蒸馏水清洗,加入95%酒精,0.05%碳酸锂水溶液分色10 s以上,在70%酒精中继续分色直到能看清灰、白色能分清晰为止。组织切片扫描系统观察组织病理变化并进行评分。LFB评分标准[15]:0分,无脱髓鞘;1分,罕见脱髓鞘;2分,少数脱髓鞘;3分,大面积脱髓鞘。
1.3.7 ELISA检测小鼠血清的炎性因子 眼眶静脉丛采血法取小鼠静脉血,离心后取血清,根据ELISA试剂说明书检测各小鼠血清中IL-10、IL-1β、IL-6和IL-18的水平。
1.3.8 real-time PCR检测脊髓组织炎症相关因子的mRNA表达 提取各组脊髓组织总RNA,根据逆转录试剂盒合成cDNA,TNF-α、TNFR1、IL-1β及内参β-actin的引物由华大基因科技有限公司合成,引物序列见表1。依据real time-PCR试剂盒扩增条件,在荧光定量PCR仪上进行扩增。扩增结束后,采用2-ΔΔCt法计算各基因的RNA相对表达量。
1.3.9 Western blot法测定脊髓组织RhoA/ROCK信号通路相关蛋白表达水平 NBP体内给药28 d,取小鼠脊髓,液氮速冻后,-80 ℃保存。使用RIPA裂解液提取蛋白,BCA法测蛋白浓度。10% SDS-PAGE电泳分离蛋白,转膜至PDVF膜。5%脱脂奶粉封闭1.5 h,按照抗体说明书加入一定稀释比例的一抗[RhoA(1∶2 000)、ROCKⅠ(1∶1 000)、ROCKⅡ(1∶1 000)及β-actin(1∶5 000)],4 ℃摇床过夜;次日,PBST洗3次,加入辣根过氧化物酶标记兔抗鼠IgG二抗(1∶5 000),室温孵育1 h,PBST洗涤3次;最后,用3-氨基-9-乙基咔唑(3-amino-9-ethylcarbazole,AEC)显色试剂盒进行显色。用Image J分析蛋白条带灰度值,以RhoA、ROCKⅠ及ROCKⅡ与内参蛋白β-actin灰度比值计算其相对表达量。
1.4 统计学分析
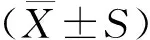
2 结果
2.1 各组小鼠体质量变化情况
与对照组相比,EAE组小鼠体质量从免疫后第2周开始下降(P<0.01);与EAE组比较,L-NBP组和H-NBP组小鼠体质量从免疫第2周开始增加(P<0.05);与L-NBP组比较,H-NBP组小鼠体质量在免疫后第4周增加明显,差异有统计学意义(P<0.05,见图1)。
注:与对照组比较,**P<0.001,***P<0.001,****P<0.000 1;与EAE组比较,#P<0.05,##P<0.01,###P<0.001;与L-NBP组比较,△P<0.05。图1 各组小鼠免疫后体质量变化情况Figure 1 Changes of body weight of mice after the immunization in each group
2.2 各组小鼠神经功能障碍评分结果
对照组神经功能评分每时点均为0分;与对照组相比,EAE组小鼠的神经功能评分降低(P<0.000 1)。与EAE组相比,L-NBP组和H-NBP组小鼠的神经功能障碍评分均降低(P<0.05),发病潜伏期均延长(P<0.05),发病高峰期均延迟(P<0.05)。与L-NBP组相比,H-NBP组小鼠的神经功能障碍评分降低(P<0.05),发病潜伏期延长(P<0.01),发病高峰期延迟(P<0.01,见图2)。

注:与对照组比较,****P<0.000 1;与EAE组比较,##P<0.01,###P<0.001,####P<0.000 1;与L-NBP组比较,△P<0.05,△△P<0.01。图2 NBP对EAE小鼠的神经功能障碍的影响Figure2 Effect of NBP on neurological dysfunction in EAE mice
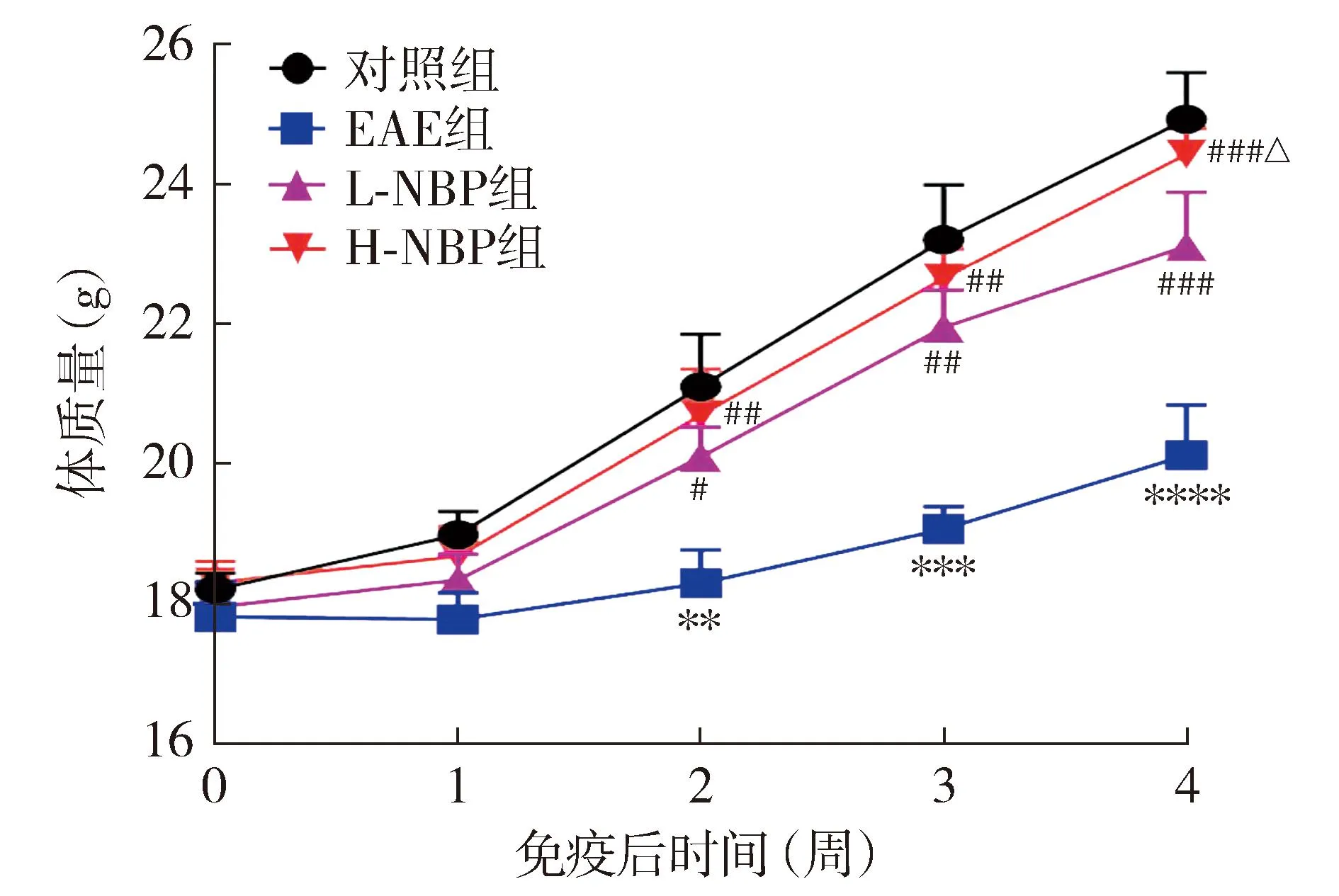
2.3 各组小鼠脊髓组织HE染色结果
HE染色结果显示:与对照组相比,EAE组小鼠脊髓组织血管周围有大量炎症细胞浸润,脊髓组织组织病理学评分升高(P<0.000 1);与EAE组相比,L-NBP组和H-NBP组炎症细胞浸润减少,组织病理学评分均降低(P<0.05);与L-NBP组相比,H-NBP组炎症细胞浸润减少,组织病理学评分降低(P<0.05,见图3)。
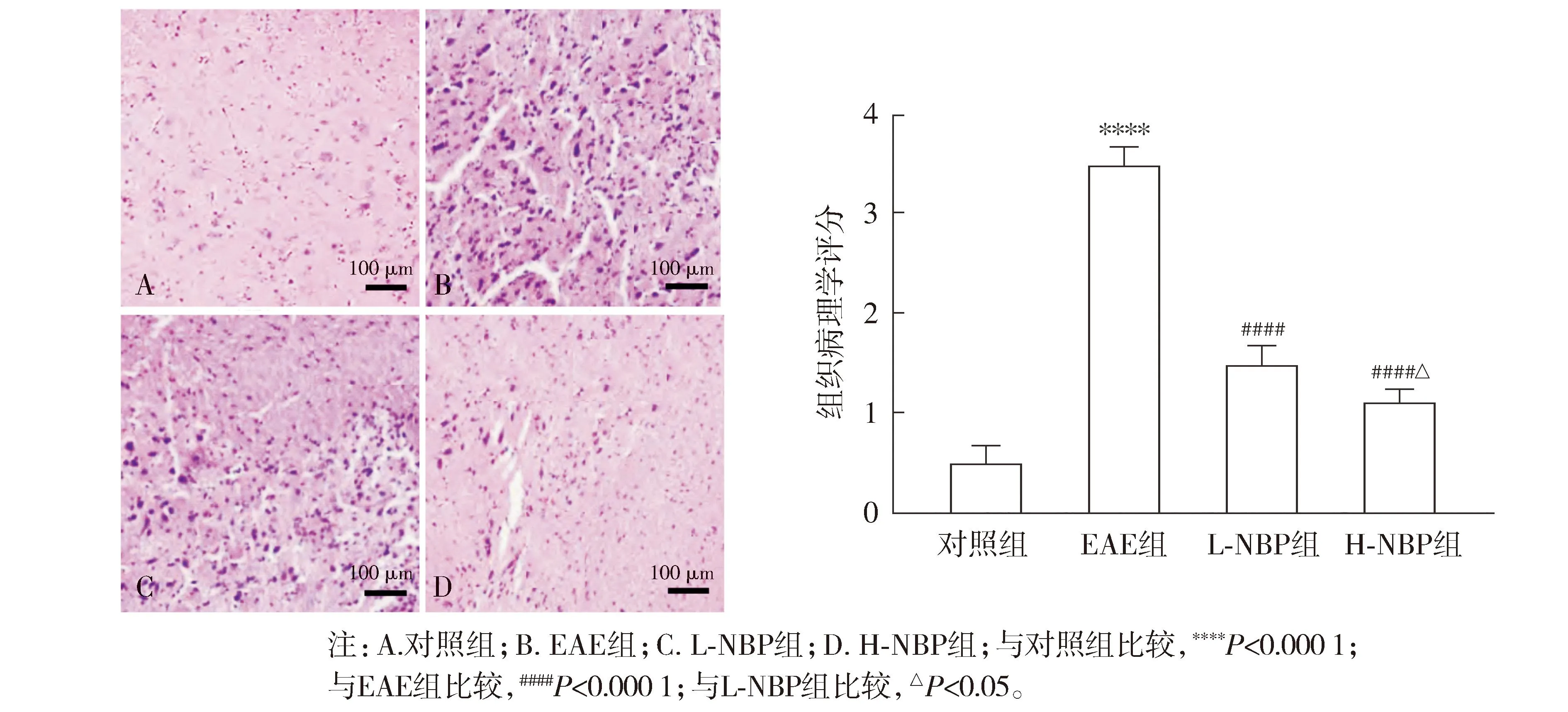
图3 各组小鼠脊髓组织HE染色结果 (×200)Figure 3 HE staining results of spinal cord tissue of mice in each group (×200)
2.4 各组小鼠脊髓组织LFB染色结果
LFB染色结果显示:与对照组比较,EAE组出现明显的脱髓鞘及空泡改变,LFB评分增高(P<0.000 1);与EAE组相比,L-NBP组和H-NBP组小鼠的脱髓鞘及空泡化程度降低,LFB评分均降低(P<0.05);与L-NBP组相比,H-NBP组小鼠的脱髓鞘及空泡化程度进一步降低,LFB评分降低(P<0.05,见图4)。
图4 LFB染色观察NBP对小鼠脊髓组织的影响 (×200)Figure 4 Effect of NBP on spinal cord of mice observed by LFB staining (×200)
2.5 各组小鼠外周血IL-10、IL-1β、IL-6和IL-18表达变化
与对照组相比,EAE组小鼠外周血IL-10含量降低(P<0.000 1),IL-18、IL-6和IL-1β含量增加(P<0.001);与EAE组相比,L-NBP组和H-NBP组小鼠外周血IL-10含量增加,IL-18、IL-1β和IL-6含量均降低(P<0.05);与L-NBP组相比,H-NBP组小鼠外周血IL-10含量增加,IL-18、IL-1β和IL-6含量降低(P<0.05,见图5)。
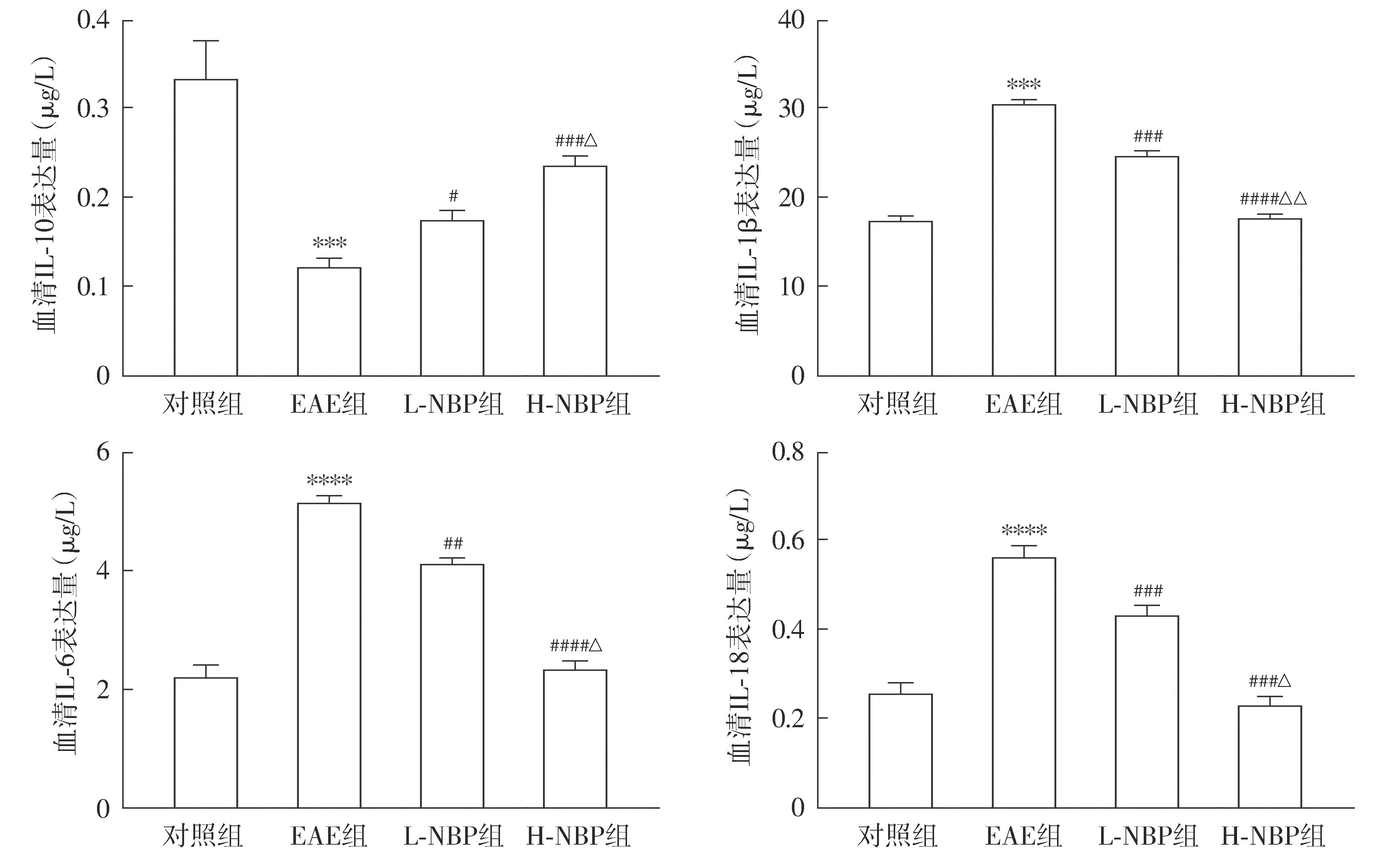
注:与对照组比较,***P<0.001,****P<0.000 1;与EAE组比较,##P<0.01,###P<0.001,####P<0.000 1;与L-NBP组比较,△P<0.05,△△P<0.01。图5 NBP对EAE小鼠中血清IL-10、IL-1β、IL-6及IL-18的影响Figure 5 Effect of NBP on serum levels of IL-10, IL-1β, IL-6 and IL-18 in EAE mice
2.6 各组小鼠脊髓组织中炎症因子相关基因的mRNA表达变化
real time-PCR结果显示,与对照组相比,EAE组炎性细胞因子TNF-α、TNF受体1(TNFR1)及IL-1β mRNA表达升高(P<0.05);与EAE组相比,L-NBP组和H-NBP组TNF-α、TNFR1及IL-1β mRNA表达降低(P<0.05);与L-NBP组相比,H-NBP组TNF-α、TNFR1及IL-1β mRNA表达降低(P<0.05,见图6)。
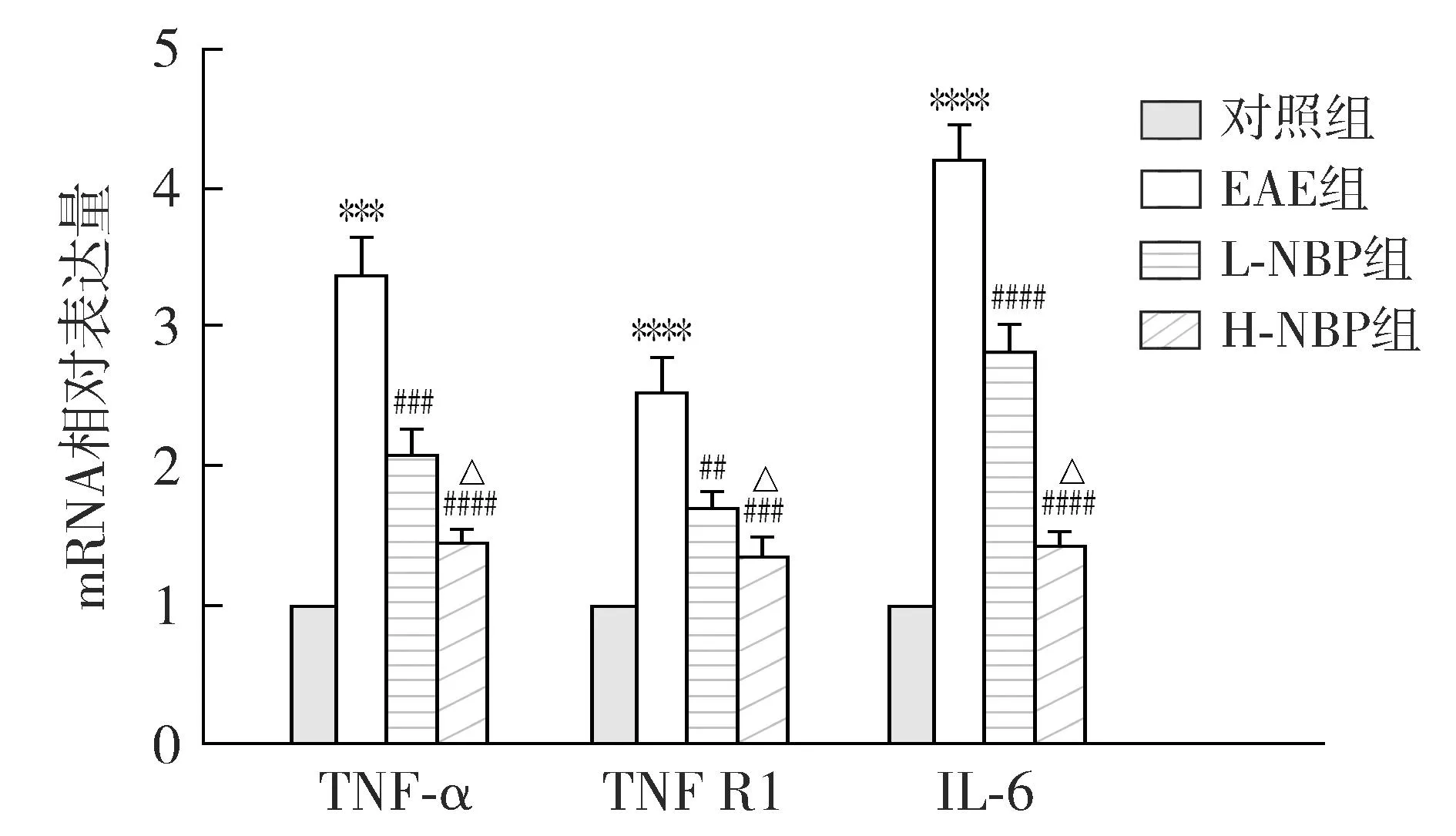
注:与对照组比较,***P<0.001,****P<0.000 1;与EAE组比较,##P<0.01,###P<0.001,####P<0.000 1;与L-NBP组比较,△P<0.05,△△P<0.01。图6 NBP对EAE小鼠TNF-α、TNFR1和IL-1β mRNA表达的影响Figure 6 Effect of NBP on mRNA expressions of TNF-α, TNFR1 and IL-1β in EAE mice
2.7 各组小鼠脊髓组织RhoA/ROCK信号通路各蛋白的表达变化
与对照组相比,EAE组RhoA、ROCKⅠ以及ROCKⅡ蛋白表达增高(P<0.05);与EAE组相比,L-NBP组和H-NBP组RhoA、ROCKⅠ以及ROCKⅡ蛋白表达均降低(P<0.05);与L-NBP组相比,H-NBP组ROCKⅠ表达差异无统计学意义,RhoA和ROCKⅡ蛋白表达降低(P<0.05,见图7)。
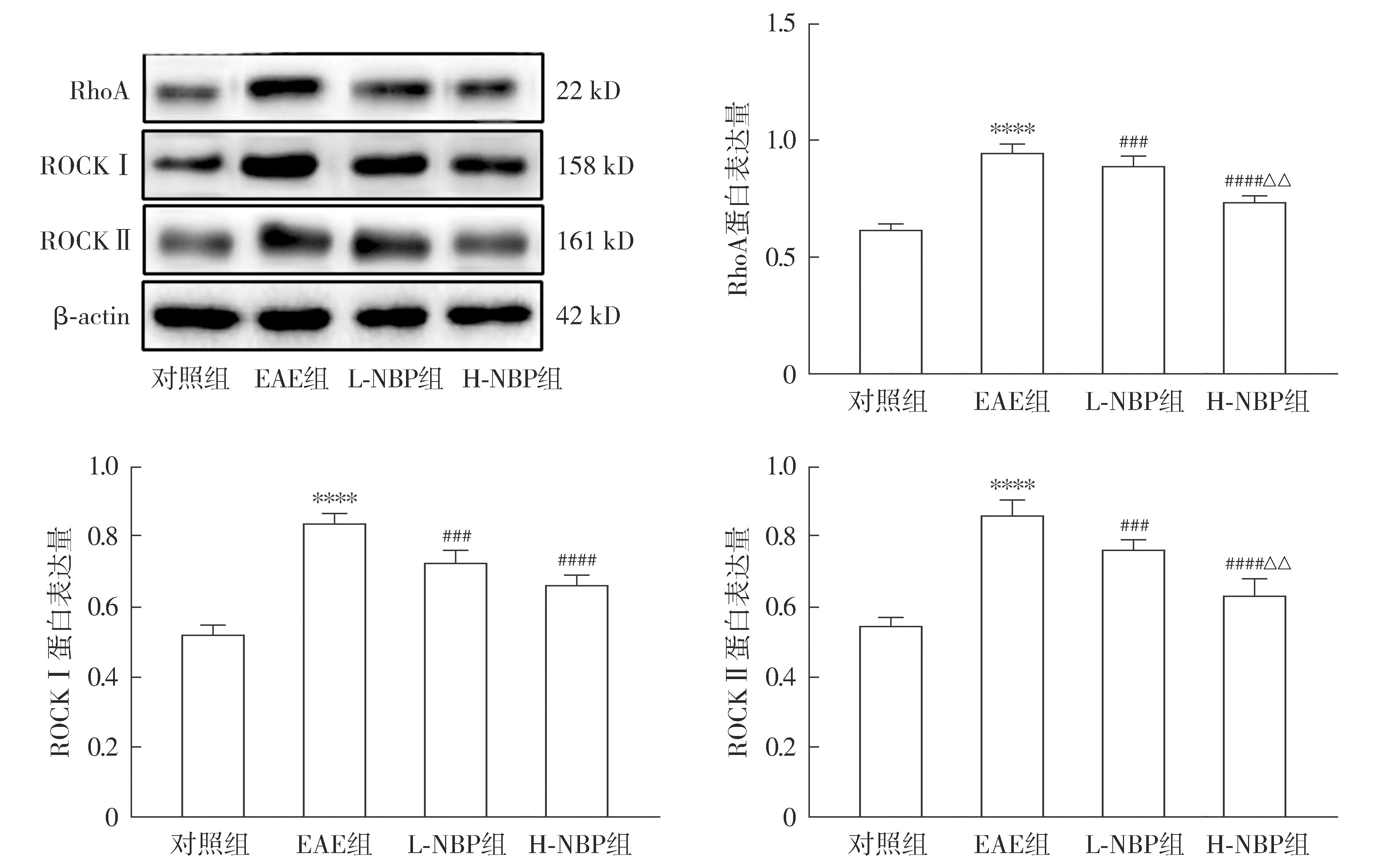
注:与对照组比较,****P<0.000 1;与EAE组比较,###P<0.001,####P<0.000 1;与L-NBP组比较,△△P<0.01。图7 NBP对EAE小鼠脊髓组织RhoA、ROCKⅠ和ROCKⅡ蛋白表达的影响Figure 7 Effect of NBP on the expression of RhoA, ROCKⅠ and ROCKⅡ proteins in spinal cord of EAE mice
3 讨论
MS是一种自身免疫性疾病,研究者致力于探索免疫系统异常对疾病发生和发展的影响[2]。研究表明,T细胞、B细胞、巨噬细胞等免疫细胞在MS中起着重要的作用[16]。另外,神经系统炎症反应也是MS主要特征之一[17]。研究者发现神经炎症会导致神经元及神经胶质细胞损伤和髓鞘破坏[18,19],对微血管也有影响[20],相关的炎症介质加速了MS疾病进展。目前关于MS的治疗主要包括免疫调节治疗、疾病修饰治疗、康复治疗和对症治疗等[21,22]。
研究发现,NBP对缺血性卒中具有显著的神经保护作用[23]。此外,NBP对神经退行性疾病的治疗作用已经超过了对中风的作用,包括阿尔茨海默病(AD)[24,25]、血管性痴呆(VaD)[26]、帕金森病(PD)[27]和肌萎缩性侧索硬化症(ALS)等。然而,NBP对MS治疗作用的研究尚未见报道。所以本实验研究NBP对EAE的抑制炎症作用,结果表明,NBP能够显著改善EAE小鼠的临床症状和病理变化。首先,NBP改善了EAE小鼠的神经功能症状。通过HE染色结果观察到,在EAE小鼠中,脊髓组织出现了大量的炎症细胞浸润,且组织病理学评分明显升高;而与EAE组相比,NBP组炎症细胞浸润和组织病理学评分均显著降低。这表明NBP具有抗炎作用,能够减少炎症细胞的浸润,改善脊髓组织的病理变化。其次,通过LFB染色结果观察到,在EAE小鼠中,出现了明显的脱髓鞘和空泡化,而NBP组脱髓鞘和空泡化现象明显减少。这说明NBP能够改善EAE小鼠的脱髓鞘情况,可能有助于保护神经纤维,来改善EAE的严重程度。进一步的实验结果显示,与对照组相比,EAE组小鼠的外周血中IL-10含量降低,而IL-18、IL-1β和TNF-β含量增加;而与EAE组相比,NBP组IL-10含量增加,IL-18、IL-1β和TNF-β含量降低。这表明NBP可能通过调节炎症介质的表达,改善炎症状态。此外,通过real time-PCR分析发现,在EAE小鼠的脊髓组织中,炎性细胞因子TNF-α和IL-1β以及TNFR1的表达明显升高,而NBP组这些炎症因子的表达水平下降。这进一步证实了NBP具有抗炎作用,对EAE具有重要的保护作用。上述结果说明NBP可通过抑制神经炎症来实现神经保护作用,与NBP能减轻神经炎症[28]的报道相一致。
RhoA/ROCK通路蛋白是缺血性卒中病理过程中神经炎症的重要调节因子[12]。研究表明,RhoA/ROCK通路的上调在促进神经炎症和介导脑损伤中具有重要作用[29]。抑制RhoA/ROCK通路可以减少促炎因子IL-6、IL-1β和TNF-α等的释放,促进神经元的恢复[30]。本研究结果显示,EAE小鼠的脊髓组织中RhoA、ROCKⅠ和ROCKⅡ蛋白的表达升高,说明其神经炎症可能是通过上调RhoA/ROCK通路来实现的;而经NBP干预后RhoA、ROCKⅠ和ROCKⅡ蛋白表达下降。表明NBP可能通过抑制RhoA/ROCK信号通路的激活,发挥其保护作用。
综上所述,NBP通过抑制炎症细胞浸润和炎症因子的表达,改善脱髓鞘,调节免疫介质的平衡,通过抑制RhoA/ROCK信号通路的激活,发挥其对EAE小鼠的保护作用。这些结果的发现为MS的治疗提供了更为全面的理论支持。但本研究也存在一定的局限性:①没有评估NBP的不良反应;②缺乏阳性对照组,样本量偏小;③未使用RhoA/ROCK通路的抑制剂来确定NBP治疗EAE的确切机制。因此,还需要更多的研究进一步揭示NBP/RhoA/ROCK与抑制神经炎症之间的确切关系。

