沉默lncRNA XIST对阿霉素诱导的扩张型心肌病的影响及其机制
薛松妍,薛 强,王方圆,周 倩,姜 铭,马 静(空军军医大学第一附属医院中医科,西安 7003;空军军医大学第一附属医院心内科;通讯作者,E-mail:jingma@fmmu.edu.cn)
扩张型心肌病(dilated cardiomyopathy,DCM)是一种非缺血性心肌病,具有结构性和功能性心肌异常,主要特征表现为心脏左心室扩张,并伴有左心室或双心室收缩功能障碍,而由于心肌功能紊乱,DCM也是导致心脏衰竭或猝死的主要诱因之一[1,2],DCM预后较差,5年存活率约为50%,10年存活率为25%[3]。数十年的研究结果揭示了DCM的发病存在多种因素,主要包括基因突变、感染、炎症、自身免疫疾病、接触毒素和内分泌紊乱等[4]。在DCM的病理发展过程中,心肌细胞逐渐发生各种变化,导致心肌功能和形态受损,进而导致心室扩张时收缩性能下降[5]。心肌细胞凋亡和纤维化是导致DCM发展的两个主要过程,而胶原蛋白和其他细胞外基质(extracellular matrices,ECM)蛋白在ECM中的积累,以及心肌细胞的凋亡导致了心肌纤维化,这些过程导致了左心室扩张和僵硬,心室被拉伸,最终诱发心脏功能障碍[6]。
长链非编码RNA(long non-coding RNAs,lncRNAs)是指一类长度大于200个核苷酸的RNA,研究表明lncRNA MALAT1[7]、lncRNA CARL[8]和lncRNA H19[9]等lncRNAs与DCM的心肌纤维化和心肌细胞凋亡过程有关。X-无活性特异性转录物(X-inactive specific transcript,XIST)是一种与癌细胞凋亡和肺等组织纤维化密切相关的lncRNA[10],有研究发现XIST促进心肌肥厚的病理发展[11]以及心肌缺血再灌注后心肌细胞的凋亡进程[12]。目前,大鼠腹腔注射阿霉素是DCM动物研究层面主流的造模方法,研究显示,阿霉素诱导后大鼠出现明显的心肌肥大、纤维增生和细胞凋亡等心肌损伤症状[13,14]。本研究旨在探究XIST对阿霉素诱导的DCM大鼠心肌纤维化和心肌细胞凋亡的影响,以及其涉及的调控机制,以期为DCM的临床检验和治疗提供新的靶标。
1 材料与方法
1.1 材料
1.1.1 实验试剂和仪器 苏木素伊红(HE)染色试剂盒(C0105S)和TUNEL细胞凋亡检测试剂盒(绿色荧光,C1086)购自上海碧云天生物技术有限公司,改良Masson三色染色试剂盒(G1346)购自北京索莱宝科技有限公司。LipofectamineTM2000转染试剂(11668030)和LipofectamineTM3000转染试剂(L3000001)均购自美国Invitrogen公司。双荧光素酶报告基因检测试剂盒(E1910)购自美国Promega公司。一抗PDGFC(ab93899)、α-SMA(ab5694)、collagen Ⅰ(ab138492)、TGF-β1(ab215715)和GAPDH(ab8245)均购自美国Abcam公司。VividE9彩色超声影像系统购自美国GE公司。
1.1.2 实验细胞和动物 大鼠心肌细胞(H9c2细胞系,GNR 5)和DMEM完全培养液(含10% FBS,MD02)均购自中国科学院细胞库。7~8周龄SPF级雄性SD大鼠(260~320 g)购自陕西中医药大学[生产许可证:SCXK(陕)2021-001],大鼠屏障环境饲养条件:温度24~26 ℃,湿度50%~60%,12 h循环照明。
1.2 方法
1.2.1 DCM大鼠建模和分组转染处理 参考文献[15]所述方法建立阿霉素诱导的扩张型心肌病大鼠模型,采用0.9%氯化钠配制1 mg/mL的阿霉素溶液,大鼠腹腔注射剂量为2.5 mg/kg的阿霉素溶液,每周1次,共注射6周。末次注射阿霉素溶液2周后对造模大鼠行超声检查,以左室射血分数(left ventricular ejection fraction,LVEF)<30%判定造模成功[14]。本研究中共有37只大鼠DCM建模成功,随机选择30只分为模型组、sh-NC组和sh-XIST组,每组10只;另取10只健康SD大鼠为对照组。建模成功后,sh-NC组和sh-XIST组大鼠分别给予尾静脉注射sh-NC和sh-XIST,每周1次,共持续4周;对照组和模型组大鼠同期给予尾静脉注射等量0.9%氯化钠溶液。末次处理48 h后,采集样本进行各项指标检测。
1.2.2 大鼠心脏功能指数检测 末次处理48 h后,采用VividE9彩色超声影像系统(探头6S-D,2.7~8.0 MHz)检测各组大鼠心脏功能指数左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)和LVEF。
1.2.3 HE染色检测大鼠心肌组织病理学变化 各组大鼠采用3%戊巴比妥钠腹腔注射麻醉后处死,开腔取心脏组织,生理盐水冲洗干净后,部分-80 ℃冻存待测,另一部分采用4%多聚甲醛固定处理,采用常规方法制作4 μm石蜡切片染色备用。按照HE染色试剂盒所述染色方法,切片经过二甲苯脱蜡和无水乙醇分级水化处理,加入苏木素染色液染色10 min,蒸馏水洗片后再加入伊红染色液染色1 min,乙醇分级脱水后用二甲苯透明处理,然后中性树胶封片,显微镜下观察并拍照。
1.2.4 Masson三色染色检测大鼠心肌组织病理学变化 取各组大鼠制备好的石蜡切片,按照改良Masson三色染色试剂盒所述染色方法,切片经过媒染液浸染,然后依次天青石蓝染液、苏木素染液、分化液、丽春红品红染液、磷钼酸以及苯胺蓝染液染色处理后,无水乙醇脱水和二甲苯透明,然后中性树胶封片,显微镜下观察并拍照。
1.2.5 DCM细胞模型构建和分组转染处理 参考文献[16]所述,采用大鼠心肌细胞H9c2细胞系构建DCM细胞模型。H9c2细胞采用DMEM培养基(含10% FBS,青霉素100 U/mL,链霉素100 U/mL)培养,5% CO2和37 ℃培养箱中培养。H9c2细胞常规培养,取对数期细胞转接至6孔板,加入阿霉素溶液(终浓度3 μmol/L)处理24 h后进行转染。按照实验设计,取未经阿霉素处理的H9c2细胞作为对照组,而将阿霉素处理后的H9c2细胞分为模型组、sh-NC组、sh-XIST组、sh-XIST+miR-NC组和sh-XIST+miR-149-5p inhibitor组,其中sh-NC组和sh-XIST组细胞采用LipofectamineTM2000分别转染sh-NC和sh-XIST,sh-XIST+miR-NC组细胞共转染sh-XIST和miR-NC,sh-XIST+miR-149-5p inhibitor组细胞共转染sh-XIST和miR-149-5p inhibitor。转染完成后,继续常规培养,48 h后收集各组细胞待测。
1.2.6 双荧光素酶报告试验分析XIST、miR-149-5p和PDGFC的靶向关系 采用ENCORI/starBase软件分析XIST与miR-149-5p结合位点情况,TargetScanHuman软件分析miR-149-5p和PDGFC结合位点情况。构建野生型WT-XIST、突变型MUT-XIST、野生型WT-PDGFC 3′UTR和突变型MUT-PDGFC 3′UTR具有miR-149-5p结合位点的荧光素酶报告质粒。采用LipofectamineTM3000转染试剂将WT-XIST、MUT-XIST、WT-PDGFC 3′UTR和MUT-PDGFC 3′UTR与mimics-NC或miR-149-5p mimics共转染至靶细胞,转染48 h后,按照双荧光素酶报告基因检测试剂盒说明方法检测荧光素酶活性。
1.2.7 TUNEL和流式细胞术检测大鼠心肌细胞凋亡水平 采用TUNEL染色法检测大鼠心肌组织心肌细胞凋亡水平。取各组大鼠制备好的石蜡切片,按照一步法TUNEL细胞凋亡检测试剂盒所述检测方法,切片经过二甲苯脱蜡和梯度浓度乙醇分级水化后,滴加20 μg/mL不含DNase的蛋白酶K作用20 min,PBS洗片,再加入50 μL的TUNEL检测液,于37 ℃避光孵育1 h,PBS洗片后采用抗荧光淬灭封片液封片,于荧光显微镜下观察,并使用Image J软件进行定量分析。
采用流式细胞术检测大鼠心肌细胞H9c2细胞凋亡水平。转染完成培养48 h后,3 000 r/min离心5 min收集H9c2细胞,预冷的PBS溶液重悬细胞,3 000 r/min离心5 min,去除上清,加入195 μL结合液轻柔重悬细胞,再依次加入5 μL的Annexin Ⅴ-FITC和10 μL的PI染液,轻柔混匀室温下避光孵育15 min,然后流式细胞仪上机检测细胞凋亡率。
1.2.8 RT-qPCR分析XIST、miR-149-5p和PDGFC表达水平 分别取各组大鼠于-80 ℃冻存的心肌组织,剪成小块于冰上充分匀浆,另收集各组H9c2细胞,采用TRIzol试剂分离提取心肌组织和H9c2细胞的总RNA。以总RNA为模板反转录获得cDNA,然后再进行RT-qPCR反应,程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,40个循环。采用2-ΔΔCt分析基因相对表达量,GAPDH作为XIST和PDGFC内部对照,U6作为miR-149-5p的内部对照。XIST引物序列,F:5′-CGGGTCTCTTCAAGGACATTTAGCC-3′,R:5′-GCACCAATACAGAGGAATGGAGGG-3′;miR-149-5p引物序列,F:5′-GGCTCTGGCTCCGTGTCTT-3′,R:5′-CAGTGCAGGGTCCGAGGTATT-3′;PDGFC引物序列,F:5′-GCCAA-AGAACGGGGACTCG-3′,R:5′-AGTGACAACTCT-CTCATGCCG-3′。
1.2.9 Western blot分析PDGFC、α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平 分别取各组大鼠于-80 ℃冻存的心肌组织,剪成小块于冰上充分匀浆,另收集各组H9c2细胞,分别加入RIPA裂解液充分反应后离心收集提取总蛋白,BCA法进行定量分析。采用12% SDS-PAGE电泳分离蛋白,然后转移至PVDF膜,再经5%脱脂牛奶封闭处理2 h。TBST溶液洗膜,加入一抗PDGFC(1∶1 000)、α-SMA(1∶1 000)、collagen Ⅰ(1∶1 000)、TGF-β1(1∶1 000)和GAPDH(1∶1 000),4 ℃下过夜孵育。再加入二抗辣根过氧化物酶标记的IgG(1∶1000),室温下孵育处理2 h,TBST溶液洗膜,ECL超敏发光液处理,曝光后凝胶系统成像拍照,采用Image J软件进行蛋白条带灰度值分析,GAPDH作为内部对照。
1.3 统计学分析
2 结果
2.1 DCM大鼠心脏功能指标和病理学变化
与对照组比较,模型组大鼠LVESD和LVEDD指标均升高(P<0.05),LVEF指标降低(P<0.05,见表1和图1);心肌细胞排列紊乱,出现细胞坏死和肥大,细胞间质增宽,出现大量胶原沉积和纤维组织增生(见图2)。与sh-NC组比较,sh-XIST组大鼠LVESD和LVEDD指标均降低(P<0.05),LVEF指标升高(P<0.05,见表1和图1);心肌细胞排列恢复有序,无明显坏死细胞,胶原沉积和纤维化明显减少(见图2)。
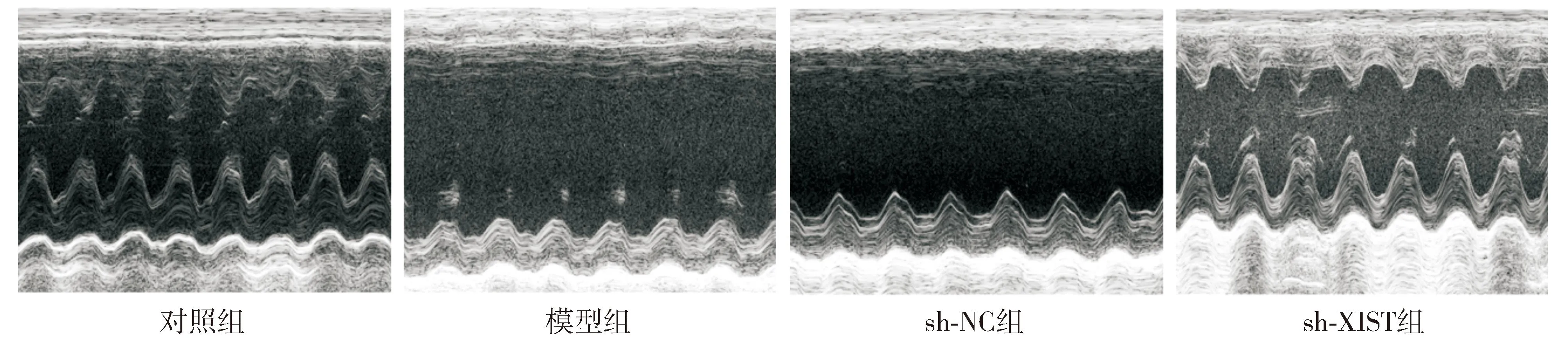
图1 各组大鼠心脏功能超声检测图Figure 1 The cardiac function of rats in each group detected by ultrasound

表1 各组大鼠心功能指标比较结果Table 1 Comparison of cardiac function indexes between groups
2.2 DCM大鼠心肌组织纤维化和心肌细胞凋亡变化
与对照组比较,模型组大鼠心肌组织中α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平以及TUNEL阳性细胞率均升高(P<0.05);与sh-NC组比较,sh-XIST组大鼠心肌组织中α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平以及TUNEL阳性细胞率均降低(P<0.05,见图3,4)。

图3 DCM大鼠心肌组织心肌细胞凋亡水平变化Figure 3 Changes of apoptosis of cardiomyocytes in myocardium of DCM rats
2.3 沉默XIST表达对DCM大鼠心肌组织中XIST、miR-149-5p和PDGFC水平的影响
与对照组比较,模型组大鼠心肌组织中XIST表达水平及PDGFC的mRNA和蛋白表达水平均升高(P<0.01),miR-149-5p表达水平降低(P<0.01,见图5)。与sh-NC组比较,sh-XIST组大鼠心肌组织中XIST表达水平及PDGFC的mRNA和蛋白表达水平均降低(P<0.01),miR-149-5p表达水平升高(P<0.01,见图5)。
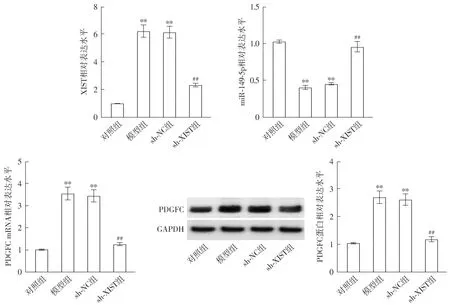
注:与对照组比较,**P<0.01;与sh-NC组比较,##P<0.01。图5 沉默XIST表达对DCM大鼠心肌组织XIST、miR-149-5p和PDGFC水平的影响Figure 5 Effects of silencing XIST expression on levels of XIST, miR-149-5p and PDGFC in myocardial tissue of DCM rats
2.4 XIST、miR-149-5p和PDGFC之间的靶向关系
ENCORI/starBase软件和TargetScanHuman软件分析结果显示,miR-149-5p与XIST和PDGFC之间均存在结合位点(见图6A)。双荧光素酶报告实验结果显示,与mimics-NC比较,转染miR-149-5p mimics的WT-XIST或WT-PDGFC 3′UTR荧光素酶活性降低(P<0.05,见图6B),进一步验证了miR-149-5p与XIST或PDGFC之间的靶向关系。

注:与mimics-NC比较,*P<0.05。B.双荧光素酶报告试验分析XIST、miR-149-5p和PDGFC之间的靶向关系图6 XIST、miR-149-5p和PDGFC之间的靶向关系分析Figure 6 Targeting relationship analysis between XIST, miR-149-5p and PDGFC
2.5 沉默XIST表达对心肌细胞凋亡的影响
与对照组比较,模型组H9c2细胞凋亡率升高(P<0.05);与sh-NC组比较,sh-XIST组H9c2细胞凋亡率降低(P<0.05);与sh-XIST+miR-NC组比较,sh-XIST+miR-149-5p inhibitor组H9c2细胞凋亡率升高(P<0.05,见图7)。
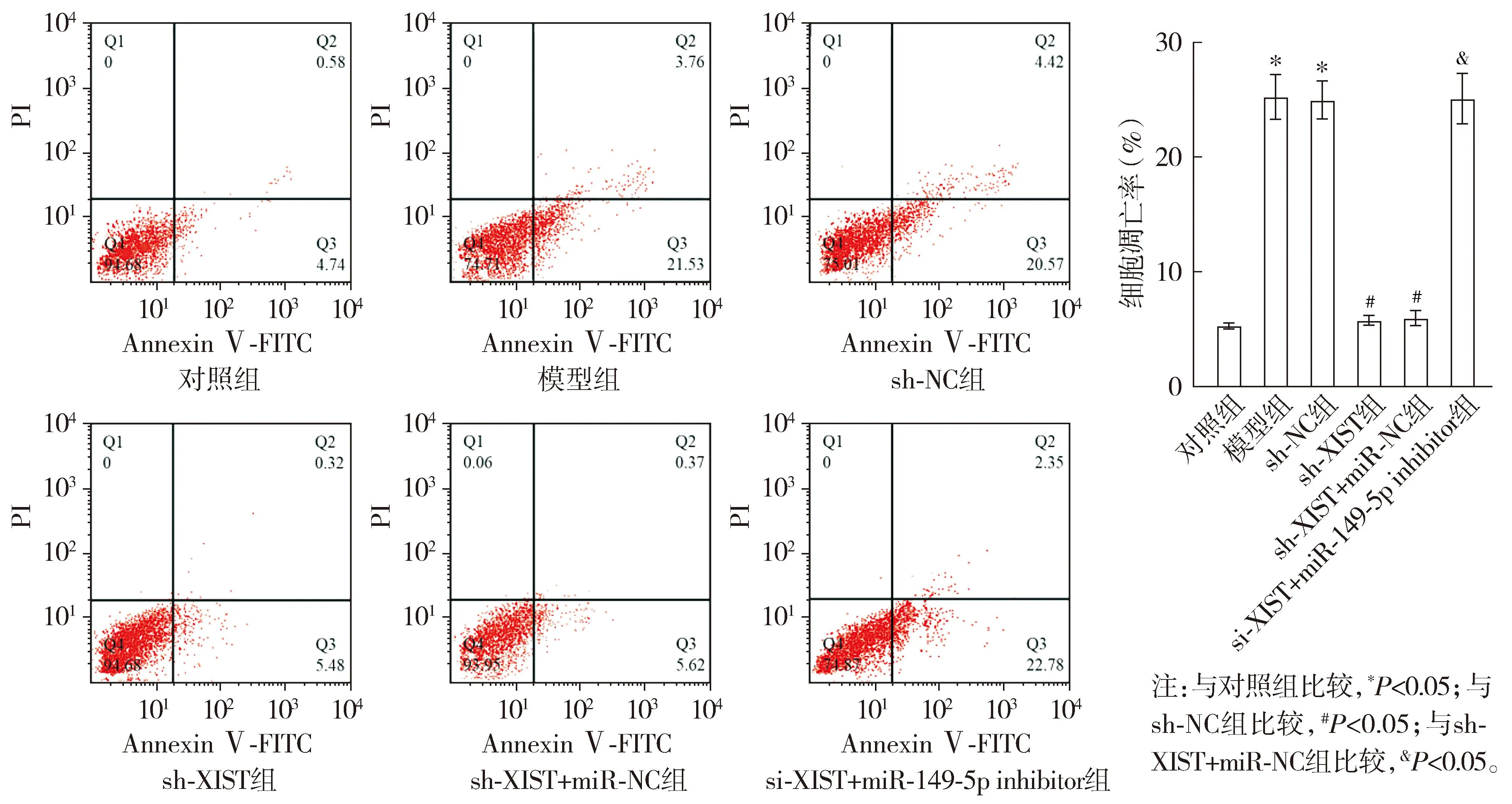
图7 流式细胞术检测沉默XIST表达对H9c2细胞凋亡的影响Figure 7 Effect of silencing XIST on apoptosis of H9c2 cells detected by flow cytometry
2.6 沉默XIST表达和抑制miR-149-5p表达对心肌细胞纤维化蛋白标志物和PDGFC表达水平的影响
转染后,与对照组比较,模型组H9c2细胞中XIST、PDGFC mRNA和蛋白以及α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平均升高(P<0.05,见图8,9),miR-149-5p表达水平降低(P<0.05,见图9)。与sh-NC组比较,sh-XIST组H9c2细胞中XIST、PDGFC mRNA和蛋白以及α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平均降低(P<0.05,见图8,9),miR-149-5p表达水平升高(P<0.05,见图9)。与sh-XIST+miR-NC组比较,sh-XIST+miR-149-5p inhibitor组H9c2细胞中PDGFC mRNA和蛋白以及α-SMA、collagen Ⅰ和TGF-β1蛋白表达水平均升高(P<0.05,见图8,9),miR-149-5p表达水平降低(P<0.05,见图9)。

注:与对照组比较,*P<0.05,**P<0.01;与sh-NC组比较,#P<0.05,##P<0.01;与sh-XIST+miR-NC组比较,&P<0.05,&&P<0.01。图8 沉默XIST和抑制miR-149-5p对H9c2细胞中α-SMA、collagen Ⅰ和TGF-β1蛋白表达的影响Figure 8 Effects of silencing XIST and inhibiting miR-149-5p on protein expressions of α-SMA, collagen Ⅰ and TGF-β1 in H9c2 cells
3 讨论
扩张型心肌病(DCM)是指心肌在没有如高血压和瓣膜疾病等异常负荷的情况下,以左心室扩张和收缩功能障碍为主要特征的一类非缺血性心肌病[17]。DCM的发病率和死亡率都很高,可能导致心脏停止跳动和持续性心力衰竭[18]。临床上通常采用超声心动图检测结果对DCM做最初的判定,一般同时识别心室扩张和收缩功能障碍[19]。本研究通过阿霉素诱导构建DCM大鼠模型,结果显示DCM大鼠心脏功能指标LVESD和LVEDD水平均升高,LVEF水平降低,表明DCM大鼠模型构建成功。
近年来,越来越多的研究表明,lncRNAs与心血管疾病的发生和调控密切相关,主要涉及对心肌细胞肥大、凋亡、自噬和再生,以及心肌组织纤维化和重构等生理功能的调控[20]。DCM的主要病理特征为心肌细胞肥大和凋亡、心肌纤维化、损伤以及产生的心室重构。由于心脏受到超负荷压力,导致心脏成纤维细胞异常增殖,细胞外基质蛋白大量分泌和沉积,最终导致心肌组织弹性变差以及心室病理性重塑,发生心室扩张和收缩功能障碍。Cui等[21]研究发现,lncRNA CFRL通过调节miR-3113-5p/CTGF和miR-3473d/FN1轴加重心脏纤维化;Tao等[22]发现在心脏成纤维细胞中外源性过表达lncRNA GAS5,导致心脏成纤维细胞的增殖受到抑制;Chen等[23]研究显示,lncRNA XIST通过miR-330-3p/S100B通路抑制小鼠心肌肥厚过程中的纤维化反应。本研究从动物和细胞水平探究XIST对DCM中纤维化的影响,结果显示DCM大鼠心脏组织和H9c2细胞中XIST高表达,沉默XIST表达后,DCM大鼠心脏组织纤维化程度降低,细胞外基质胶原沉积减少,且心脏组织和H9c2细胞中α-SMA、collagen Ⅰ和TGF-β1蛋白水平也均显著下降。而α-SMA、collagen Ⅰ和TGF-β1作为心血管疾病中组织纤维化的生物标志物已被广泛证明[24]。因此,推测沉默XIST可能有助于缓解DCM大鼠心肌组织纤维化发展。
心肌细胞凋亡与心脏发育及其相关疾病的发生密切相关[25]。DCM发生中,由于心肌损伤产生的炎症因子和氧自由基积累,导致机体内心肌细胞凋亡机制启动,通过一系列调控反应诱导心肌细胞凋亡,最终导致心肌收缩功能障碍[26]。现有的研究已发现部分lncRNA在诱导/抑制心肌凋亡中发挥作用,Chen等[27]发现H9c2细胞中lncRNA MIAT通过激活NF-κB信号通路促进心肌细胞凋亡;Zhou等[28]研究发现XIST在心肌梗死后细胞中高表达,过表达XIST可抑制心肌梗死小鼠心脏细胞增殖,并促进细胞凋亡;Xiao等[29]研究结果显示,XIST通过miR-101/TLR2轴调控苯肾上腺素诱导的心肌细胞肥厚,过表达XIST可以促进心肌细胞凋亡引发心衰。本研究中,无论是在大鼠心肌组织还是心肌细胞系H9c2细胞中,沉默表达XIST后,心肌细胞凋亡水平均降低,这表明XIST是促进细胞凋亡的功能角色,这与目前所报道的XIST在心肌细胞凋亡中的功能一致。
本研究中,通过靶向关系分析发现miR-149-5p与lncRNA XIST和血小板源性生长因子C(platelet-derived growth factor C,PDGFC)均存在结合位点,预示三者间存在某种调控关系。Liu等[30]研究发现敲低XIST可通过促进miR-149-5p表达而降低DNMT3A表达水平,进而抑制软骨细胞凋亡和细胞外基质蛋白降解;研究发现肝纤维化模型小鼠的肝脏中miR-149-5p低表达,而过表达miR-149-5p可以有效抑制肝纤维化[31]。PDGFC可以通过自分泌的方式刺激成纤维细胞的增殖,在纤维化、新生血管、动脉粥样硬化和再狭窄中具有重要意义[32]。本研究发现DCM大鼠心肌组织或阿霉素诱导的H9c2细胞中XIST和PDGFC高表达,而miR-149-5p低表达;沉默XIST表达后,miR-149-5p表达水平升高,而PDGFC表达水平降低,同时心肌细胞凋亡和心肌组织纤维化水平均降低,结合生信分析结果,可以预测XIST是否是通过调控miR-149-5p和PDGFC的表达而对DCM大鼠心肌组织纤维化和心肌细胞凋亡产生影响。
综上所述,DCM大鼠心肌组织或阿霉素诱导的H9c2细胞中XIST和PDGFC高表达,miR-149-5p低表达;沉默XIST表达后,DCM大鼠心肌组织纤维化水平和心肌细胞凋亡水平均降低。表明,沉默XIST可能通过上调miR-149-5p表达和抑制PDGFC表达,进而抑制阿霉素诱导的DCM大鼠心肌纤维化和心肌细胞凋亡水平,从而改善DCM的发展。

