离子色谱法测定别嘌醇中吗啉残留
赵晓亚,郑文惠,耿一楠,刘晓,常艳,丁俊飞(华润双鹤药业股份有限公司,北京 101111)
别嘌醇(allopurinol),化学名为1H-吡唑并[3,4-d]嘧啶-4-醇,是临床上治疗痛风的常用药物[1]。此外,研究表明别嘌醇对肾病也有良好的治疗效果[2],还可作为肿瘤溶解综合征低危患者和血尿酸正常的中危患者的首选初始药物[3]。别嘌醇治疗痛风的主要药用原理是别嘌醇及其代谢产物氧嘌呤醇通过抑制黄嘌呤氧化酶的活性,使尿酸生成减少[4]。目前,别嘌醇常用的工业化合成路线如图1所示[5-6]。其中,别嘌醇合成工艺中的重要起始物料吗啉,在后续反应中可通过精制去除。由于别嘌醇常采用“一锅法”合成路线,即生成5-氨基-1-H-吡唑-4-甲酰胺半硫酸盐[5],合成路线较短,有残留吗啉的风险,因此需严格控制吗啉残留量。参考致癌效力数据库(CPDB)提供的1547种化合物结构[7],吗啉结构与1,4二氧己环结构类似,具有潜在警示结构。因此,按照潜在致突变性杂质的要求制定吗啉限度为1.8 µg·g-1[8]。

图1 别嘌醇原料药的工艺路线Fig 1 Process route of allopurinol API
目前,别嘌醇及其制剂的杂质相关研究内容较多[9-10],但尚未发现对别嘌醇中吗啉进行检测的标准[11-13]或文献。吗啉检测通常采用气相色谱法[14-15]、离子色谱法[16]、液相色谱法[17]等分析方法,其中,离子色谱法具有简便、快速、灵敏度高,以及对强碱溶液的强耐受性等优点。本研究基于离子色谱法测定别嘌醇中的痕量吗啉,该法灵敏度高、专属性好、准确度高,不仅能够较好地满足别嘌醇中吗啉的质量控制要求,为别嘌醇质量标准的提升提供了科学依据,同时也为其他化合物中吗啉的检测提供了参考方法。
1 材料
1.1 仪器
ICS5000型离子色谱仪(美国赛默飞世尔科技公司);Mettler ToledoXP205 电子分析天平(十万分之一,梅特勒-托利多国际有限公司);CS12阳离子色谱柱(250 mm×4.0 mm,美国赛默飞世尔科技公司);Dionex OnGuard Ⅱ H固相萃取小柱(美国戴安公司)。
1.2 试药
吗啉对照品(色谱级,批号:5002D30W,含量:99.6%,Alfa Aesar化学有限公司);别嘌醇原料药[批号:4019Ⅱ181101,含量:99.4%;批号:4019Ⅱ181102,含量:99.5%;批号:4019Ⅱ181103,含量:98.9%,华润双鹤药业(商丘)有限责任公司];甲烷磺酸(分析纯,北京伊诺凯科技有限公司);氢氧化锂(分析纯,中国医药集团有限公司)。
2 方法与结果
2.1 色谱条件
采用IonPac CS12(250 mm×4.0 mm)阳离子色谱柱为分析柱,IonPac CG12(50 mm×4.0 mm)为保护柱;以8 mmol·L-1甲烷磺酸溶液为淋洗液A,40 mmol·L-1甲烷磺酸溶液为淋洗液B,梯度洗脱程序见表1;流速:1.0 mL·min-1;进样量:500 μL;抑制器:CERS 300(4 mm);抑制电流为161 mA;柱温为30℃。

表1 梯度洗脱程序Tab 1 Gradient elution procedure
2.2 溶液配制
2.2.1 稀释剂 取 0.01 mol·L-1氢氧化锂溶液,用H型固相萃取小柱滤过,即得。
2.2.2 供试品溶液 精密称取别嘌醇40 mg置10 mL量瓶中,加约3/4量瓶体积稀释剂,置90℃加热1 h溶解,放冷,用稀释剂稀释至刻度,摇匀,冰箱放置1 h后,用0.45 µm聚醚砜滤膜滤过,即得。
2.2.3 对照品储备液 精密称取吗啉36 mg,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,移取1 mL,置100 mL量瓶中,用水稀释至刻度,再移取1 mL,置50 mL量瓶中,用水稀释至刻度,摇匀,即得。
2.2.4 对照品溶液 精密移取对照品储备液1 mL置10 mL量瓶中,加稀释剂稀释至刻度,摇匀,即得。
2.3 专属性与系统适用性试验
分别取稀释剂、对照品溶液和供试品溶液各500 μL,进样分析,记录色谱图见图2。结果显示,稀释剂和别嘌醇均不干扰吗啉检测,吗啉的保留时间为16.840 min,该色谱条件下与相邻杂质峰最小分离度为1.5;连续6针对照品溶液色谱图中吗啉峰面积RSD为1.5%,供试品溶液前后两针对照品溶液色谱图中吗啉峰面积RD为3.7%。结果表明该方法专属性与系统适用性良好。
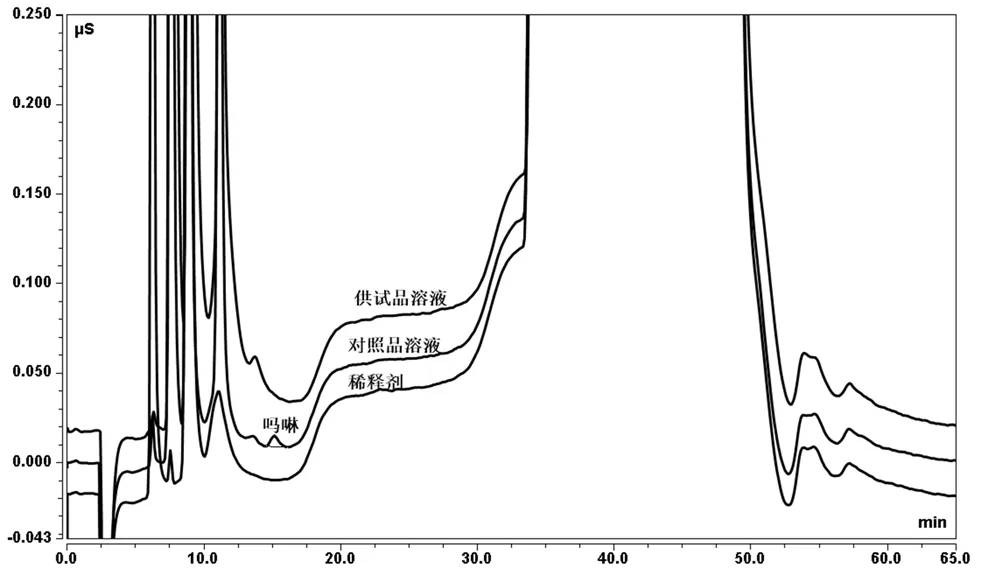
图2 稀释剂、对照品溶液及供试品溶液离子色谱图Fig 2 Ion chromatograms of diluent,standard solution and sample solution
2.4 检测限(LOD)和定量限(LOQ)
取吗啉对照品储备液,用稀释剂逐级稀释合适的倍数后进行测试,以信噪比(S/N)约为10时的进样浓度为其定量限,继续稀释,以S/N约为3时的进样浓度为其检测限。结果显示吗啉的定量限质量浓度为1.487 ng·mL-1,相当于供试品质量浓度0.37 μg·g-1,检测限质量浓度为0.5558 ng·mL-1,相当于供试品质量浓度0.14 μg·g-1。
2.5 线性关系考察
取对照品储备液,分别稀释制成含吗啉0.001 487~0.014 87 μg·mL-1的系列溶液,分别精密量取线性溶液各500 μL,注入离子色谱仪,记录峰面积。以质量浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标,进行线性回归。结果显示吗啉线性回归方程为:Y=1.107X-0.0004,r=0.9991,Y轴截距占100%响应值的百分比为5.2%。吗啉在0.001 487~0.014 87 μg·mL-1内与峰面积线性关系良好。
2.6 加样回收试验
精密称取别嘌醇(4019Ⅱ181103批次)40 mg,平行10份,分别置10 mL量瓶中,按照3个浓度准确加入对照品储备液,加稀释剂至3/4量瓶体积,置90℃加热1 h,溶解,放冷,用稀释剂稀释至刻度,摇匀,冰箱放置1 h后,用0.45 µm聚醚砜滤膜滤过,作为50%、100%、150%浓度水平的加样回收试验溶液,每个浓度水平平行配制3份,进样测定。结果回收率均在89.99%~118.00%,RSD均小于9.0%,所建立的方法的回收率较好(见表2)。

表2 加样回收试验Tab 2 Recoveries
2.7 重复性考察
取“2.6”项下100%水平回收率溶液作为加标供试品溶液,注入离子色谱仪,分别测定6份加标供试品溶液中吗啉的含量。结果表明6份重复性溶液中吗啉含量均值为1.8 μg·g-1,RSD为12.3%。表明本方法具有良好的重复性。
2.8 稳定性考察
对照品溶液在室温下放置46.5 h,各时间点峰面积与0 h峰面积的变化值均在0.0%~3.8%,表明对照品溶液在46.5 h内稳定。加标供试品溶液在室温下放置38 h后,各时间点峰面积与0 h峰面积的变化值均在1.2%~3.8%内,表明加标供试品溶液在38 h内稳定。
2.9 耐用性试验
取100%水平回收率溶液作为加标供试品溶液,分别用不同色谱柱、不同流速0.9~1.1 mL·min-1、不同日期以及不同实验员操作,其他条件不变,测定加标供试品溶液中吗啉的含量。结果表明,与原条件结果比较,RD在0.0%~10.5%。因此,色谱条件发生微小变化不影响吗啉的检测,耐用性良好。
2.10 样品中吗啉含量测定
分别取4019Ⅱ181101、4019Ⅱ181102、4019Ⅱ-181103批次别嘌醇原料药配制供试品溶液,按外标法以峰面积计算吗啉的含量。结果显示,3批别嘌醇供试品中均未检出吗啉。
3 讨论
3.1 检测方法选择
目前,吗啉检测通常以气相色谱法为主,采用溶液直接进样,结合氢火焰离子化检测器[14-15]。但文献报道基于气相色谱法检测吗啉检出限最低为2.01 μg·mL-1[14],灵敏度较低。离子色谱法[18-20]具有简便、快速、灵敏度高,以及对强碱溶液的强耐受性等优点。张于等[16]曾采用离子色谱-间接紫外检测法对实验室合成的吗啉样品进行分析,且检测限小于0.45 ng·mL-1。本研究直接选用离子色谱-电导检测器法对别嘌醇中痕量吗啉进行检测,无需结合紫外检测器,检测限低,结果准确可靠。
3.2 溶剂选择
2020年版《中国药典》载明别嘌醇在0.1 mol·L-1氢氧化钠或氢氧化钾溶液中易溶[8],但钠离子和钾离子在该色谱柱体系下,与吗啉分离较差。经筛选,发现采用0.01 mol·L-1氢氧化锂,以H型固相萃取小柱滤过后的溶液为溶剂时,别嘌醇能够溶解完全,且锂离子和吗啉的分离得到了极大改善。本研究最终选用0.01 mol·L-1氢氧化锂为溶剂。该溶剂的合理选择和处理方法,为本方法开发成功的关键性因素。
3.3 淋洗液条件优化
本研究对淋洗液的浓度和梯度分别进行了考察。结果表明采用8 mmol·L-1甲烷磺酸溶液为淋洗液,等度洗脱,运行时间为180 min时,样品中的所有杂质才能完全洗脱。但以8 mmol·L-1和40 mmol·L-1甲烷磺酸溶液为淋洗液进行梯度洗脱时,45 min内能将样品中所有的杂质完全洗脱,且65 min内可完全平衡回初始梯度,极大地节省了检测时间。
3.4 小结
本文采用离子色谱法实现了别嘌醇中吗啉进行有效的控制,按照潜在致突变性杂质的要求制定吗啉限度为1.8 µg·g-1[8],方法学考察结果表明,在此试验条件下,吗啉在0.001 487~0.014 87 μg·mL-1与峰面积线性关系良好,检测限为0.5558 ng·mL-1,专属性强、灵敏度高,可有效避免样品假阴性,满足杂质定量检测要求,可作为别嘌醇中痕量吗啉的质量控制方法,同时也可以作为其他化合物中吗啉含量测定的参考方法。

