STAT3在阿尔茨海默病小鼠认知障碍发生发展中的作用及机制研究
王珏,陈佩弦,何玲,孙逸(中国药科大学药学院,南京 211198)
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性神经退行性疾病,是老年痴呆症的主要病因,其临床特征是以记忆力减退为常见症状的进行性认知障碍[1]。《世界阿尔茨海默病报告》指出,目前全球范围内的AD患者约有5000万名,预计到2060年,将增长到1.38亿[2]。AD的两个主要组织病理学标志物是细胞内的神经原纤维缠结(neurofibrillary tangles,NFTs)和细胞外的β-淀粉样蛋白斑块沉积(β-amyloid protein plaque,SP),分别由过度磷酸化的Tau(microtubule-associated protein tau,Tau)蛋白和β-淀粉样蛋白(β-amyloid,Aβ)组成[3]。但是,基于清除Aβ或降低过度磷酸化的Tau蛋白的药物开发策略屡次失败[4]。
随着实验技术的提高,在对Aβ假说进行修正和深入研究的同时,新的致病假说也不断被提出,其中颅内神经炎症已经被确定为AD的关键驱动因素[5]。流行病学研究显示,使用非甾体抗炎药可预防或减缓AD的进程[6]。AD患者脑组织和脑脊液中包含多种促炎介质,脑内淀粉样斑块周围激活的胶质细胞增多[7]。近期的研究发现,信号传导及转录激活因子3(signal transducers and activators of transcription,STAT3)是炎症信号的重要调节因子[8]。AD模型病理过程和AD患者脑中也检测到了活化形式的STAT3上调[9]。STAT3表达上升伴随着小胶质细胞的活化和星形胶质细胞的激活和增殖,这些反应加剧了脑内的神经炎症,使脑内的病理环境进一步恶化,形成恶性循环,导致患者的认知和学习能力进一步降低[8]。STAT3的抑制或许可以成为改善AD症状的新途径。
氯硝柳胺(nicolsamide,NIC)是WHO批准的首选灭螺药,已在临床应用50余年[10],主要通过影响细胞线粒体、溶酶体以及乳酸脱氢酶等多种细胞酶的活性,参与细胞的氧化磷酸化,引起细胞凋亡和自噬性死亡[11-12]。氯硝柳胺是公认的STAT3抑制剂,可抑制巨噬细胞诱导的炎症反应,在治疗肿瘤、细菌病毒感染、糖尿病、心血管系统疾病、神经退行性疾病等方面具有潜在的应用效果[13]。因此,本研究拟以氯硝柳胺为工具药,探讨STAT3在AD小鼠认知障碍发生发展中的作用和机制。
1 材料
旷场实验视频分析系统、新物体识别视频分析系统、Y迷宫、穿梭实验视频分析系统(北京众实迪创科技有限公司);Morris水迷宫(上海吉量软件科技有限公司);ANY-maze动物行为分析系统(美国Stoelting公司);脑立体定位仪及适配器、动物颅骨钻(成都泰盟科技);微量注射泵(保定兰格恒流泵);分析天平(上海舜宇恒平科学仪器);涡旋混合器(海门市其林贝尔仪器制造);KD-160型电子秤(TANITA公司);手持组织匀浆器(宁波新芝生物科技);台式高速冷冻离心机(长沙湘仪);恒温孵箱(德国Heraeus);酶标仪(深圳雷杜生命科学);恒温磁力搅拌器(江苏省金坛市荣华仪器);PHS-25 pH计(上海仪电科学仪器);掌上离心机(大龙兴创实验仪器);Mini-PROTEAN Tetra手灌胶系统、Mini-PROTEAN Tetra电泳和转印系统(Bio-Rad);全自动化学发光成像分析系统(上海天能);水平摇床(海门市其林贝尔仪器);切片扫描仪(滨松);冰冻切片机(Leica)。
β-淀粉样蛋白1-42(Aβ1-42)粉末(Sigma-Aldrich);单克隆抗体Aβ、Tau和P-Tau(Ser396)(Santa Cruz),PSD95、β-actin、白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α(Proteintech),STAT3、P-STAT3(Tyr705)、HRP标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG抗体(Proteintech);SOD、MDA检测试剂盒(南京建成);GSH试剂盒(Boxbio);ECL试剂盒(上海雅酶);HE染色试剂盒(Solarbio)。氯硝柳胺(MedChemExpress,批号:15718)。
2 方法
2.1 实验动物及分组
8周龄SPF级C57BL/6J雄性小鼠,体重22~25 g [上海必凯科翼生物科技股份有限公司,许可证号:SCXK(沪)2018-0006]。饲料和垫料来自中国药科大学江宁校区药学动物实验中心,温度22~25℃,相对湿度50%~70%,自然光线,自由饮水和进食。小鼠先适应性喂养7 d,再进行后续具体实验。
36只C57BL/6J雄性小鼠按体重随机分为3组,每组12只,分别为模型组(model)、氯硝柳胺给药组[NIC,25 mg/(kg·d)[14]]、对照组(control)。模型组和给药组在适应性饲养结束后进行双侧海马注射Aβ溶液,对照组注射相同体积的生理盐水。给药组灌胃给予氯硝柳胺溶液(溶媒为1%DMSO、4%聚乙二醇、95%生理盐水),剂量为25 mg/(kg·d)[14],持续7 d,对照组和模型组灌胃相同体积的溶媒。
2.2 小鼠AD模型的建立
2.2.1 Aβ1-42溶液的配制 将冻存的Aβ1-42粉末从冰箱中取出,梯度升温至室温,加入适量生理盐水溶解并超声10 min,使其终浓度为82 pmol·μL-1,37℃孵育7 d。之后分装老化好的Aβ1-42寡聚体,于-20℃冰箱中冻存备用。
2.2.2 小鼠双侧海马脑立体定位注射Aβ剪除小鼠后眼角到两耳间的毛发,使用75%乙醇消毒表皮后剪开头皮暴露颅骨,棉签蘸取少量30%过氧化氢溶液擦拭创面,使得颅骨缝清晰可见。定位坐标由小鼠脑立体定位图谱确定,使用小动物颅骨钻钻穿颅骨;将打孔后的小鼠于脑立体定位仪上固定,微量进样器与小鼠颅骨钻孔平面垂直,缓慢匀速进针。使用自动进样泵缓慢匀速推入5 μL生理盐水或Aβ1-42溶液。结束注射后留针90 s,再缓慢完成出针;注射完成后,缝合头皮,消毒创口。
2.3 行为学实验方法
2.3.1 旷场实验 将小鼠活动区域(50 cm×50 cm×40 cm的敞口箱体)划分为中央区域和四周区域,将小鼠置于旷场装置中央,记录5 min内小鼠自由探索活动轨迹,评价指标为活动距离和中央区停留时间。
2.3.2 新物体识别实验 实验分为适应日、训练日和测试日。第1日为适应日,将小鼠放入未放置物体的敞口箱中令其自由活动10 min以减少环境压力。第2日为训练日,在敞口箱内放置两个相同物体,置入小鼠令其探索5 min。第3日为测试日,与第2日过程相同,只是将其中一个物体替换成不同的物体。记录测试日小鼠对两个物体的探索时间,即对旧物体探索时间(familiar)和对新物体探索时间(novel),可由此计算偏好指数=novel/(familiar+novel),评价小鼠对新物体的好奇程度,大于0.5则视为小鼠更乐于探索新物体。
2.3.3 Morris水迷宫实验 Morris水迷宫实验周期为6 d,分为空间记忆采集实验和空间搜索实验。空间记忆采集实验:每只小鼠依次从四个入水点背对池壁置入水池,每次时间为90 s,全程录像并记录游泳轨迹;若小鼠成功站上台面超过10 s则自动停止采集,并将第一次碰到台面的时间记为潜伏期。如在90 s内未成功登上台面10 s,则需人为牵引小鼠至平台并使其在平台逗留30 s,此时潜伏期记为90 s。平台低于水面1 cm为不可见平台。空间探索实验:第6日撤去平台,选取目标象限对角象限的入水点将小鼠置于水中,每只小鼠均需完成90 s的游泳并全程记录轨迹。
2.4 Western blot实验
将从小鼠海马和皮层获得的组织放在含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液中。按照试剂盒说明书从新鲜组织中提取细胞蛋白质和核蛋白。蛋白样品用SDS-PAGE凝胶分离,转移到PVDF膜上。用封闭液在室温下封闭3 h,并与单克隆抗体Aβ1-42,Tau和P-Tau(Ser396),PSD95,β-actin,IL-1β,TNF-α,STAT3,P-STAT3(Tyr705)孵育过夜,然后将膜与HRP的山羊抗兔抗体和抗小鼠IgG抗体分别在室温下孵育60 min。使用ECL试剂盒曝光蛋白质条带,并使用化学发光检测系统扫描。通过灰度分析(ImageJ软件)定量相对蛋白表达水平,并使用β-actin灰度进行归一化分析。
2.5 血清SOD、GSH和MDA水平检测
每只小鼠眼眶取血,置于1.5 mL离心管中,室温条件静置30 min后,3000 r·min-1离心 10 min获得血清,根据相应试剂盒操作说明书分别测定SOD、MDA和GSH含量。
2.6 苏木精-伊红染色法(HE染色)
新鲜取材,经固定、石蜡包埋,切片5 μm。苏木素染液染色2~20 min,蒸馏水洗去浮色。分化液分化10~60 s,纯水滴加或浸洗2次,每次3~5 min。置伊红染液60 s,倾去多余染色液后快速脱水。经透明和封片后用扫描仪观察。
2.7 数据分析
Western blot结果采用ImageJ软件进行灰度值分析,所有实验数据经GraphPad Prism 7.0软件分析后以平均值±标准误(Mean±SEM)表示,进行单因素方差分析和多重比较检验,P<0.05为差异有统计学意义。统计结果采用GraphPad Prism 7.0软件绘图。
3 结果
3.1 抑制STAT3改善AD小鼠认知功能障碍
3.1.1 抑制STAT3对AD小鼠自发活动和探索能力的影响 如图1所示,与对照组相比,模型组小鼠的总活动距离无显著性差异(P>0.05),但中央区停留时间显著减少(P<0.001),表明小鼠呈现明显的焦虑情绪,且空间探索欲望能力显著降低。与模型组相比,氯硝柳胺给药组小鼠的中央区停留时间显著增加(P<0.01)。以上研究表明抑制STAT3可以显著改善AD小鼠的焦虑症状,提高其空间探索能力。
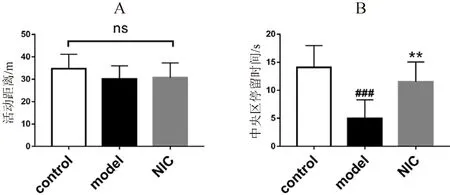
图1 抑制STAT3对旷场实验中AD小鼠的自发活动和探索能力的影响Fig 1 Effect of STAT3 inhibition on spontaneous activity and exploratory ability of mice with Alzheimer’s disease in open field experiment
3.1.2 抑制STAT3对新物体识别实验中识别记忆能力的影响 如图2A所示,与对照组相比,模型组小鼠对旧物体的探索时间显著增多(P<0.01),对新物体的探索时间显著减少(P<0.01)。同时如图 2B所示,模型组小鼠对新物体的识别指数显著降低(P<0.01),表明AD模型小鼠存在物体识别记忆能力缺陷。与模型组相比,氯硝柳胺给药组小鼠的新物体识别指数显著增高(P<0.01),以上研究表明抑制STAT3可以显著改善AD小鼠的物体识别和记忆能力。

图2 抑制STAT3对新物体识别实验中识别记忆能力的影响Fig 2 Effect of STAT3 inhibition on recognition and memory ability in New object recognition experiment
3.1.3 抑制STAT3对小鼠空间学习记忆能力的影响 Morris水迷宫的第1~5日为不可见平台训练期。如图3A所示,在共计5 d的定位航行实验中,各组小鼠游泳速度无显著差异(P>0.05),说明各组小鼠的视力和游泳能力基本一致。图3B结果显示,定位航行1~5 d各组小鼠逃避潜伏期随着训练时间的增加而呈现不同程度的缩短。与同时期对照组小鼠相比,模型组小鼠潜伏期显著升高(P<0.01),而氯硝柳胺给药组小鼠的逃避潜伏期相对于模型组显著降低(P<0.01),说明模型组小鼠存在明显的空间学习记忆障碍,且与STAT3的激活相关,抑制STAT3后可在一定程度上改善AD小鼠的空间学习记忆障碍。
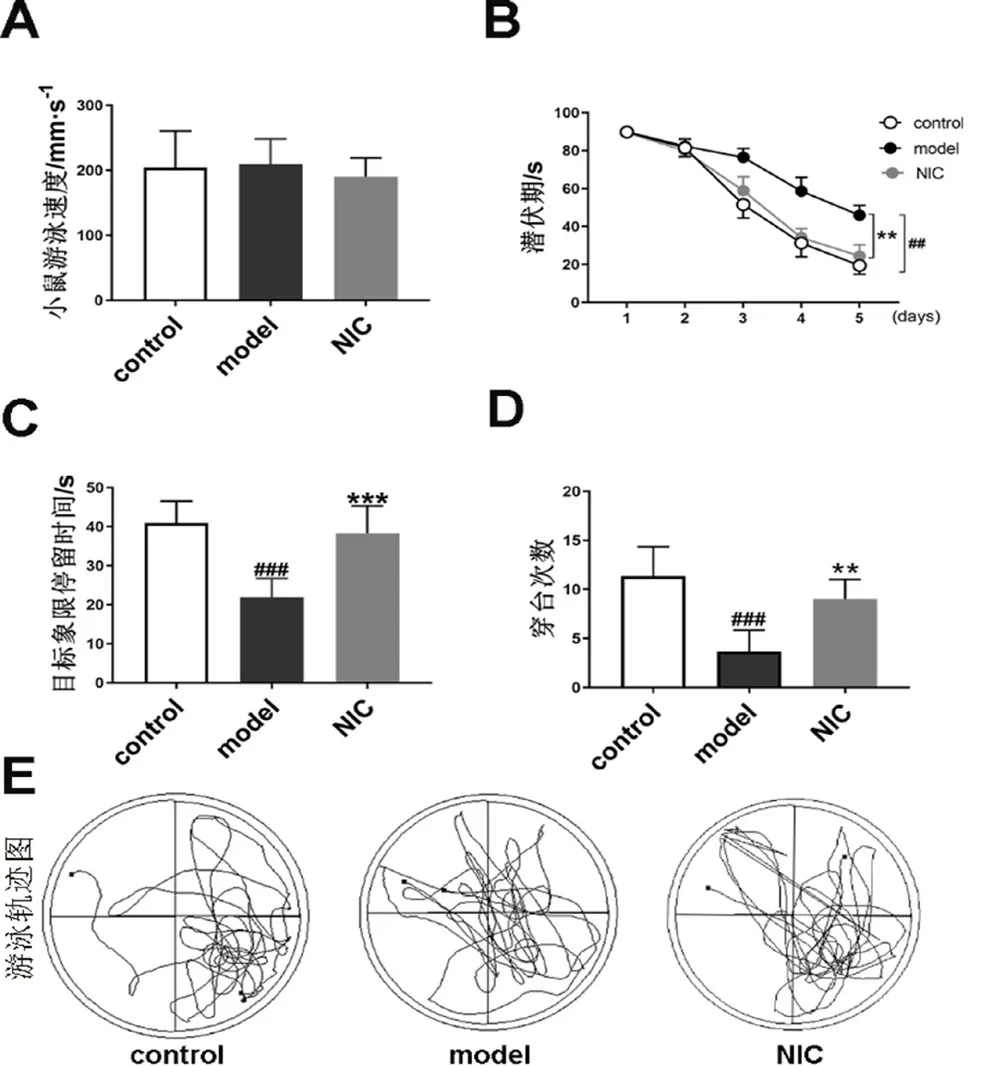
图3 抑制STAT3对 Morris 水迷宫实验中空间学习记忆能力的影响Fig 3 Effect of STAT3 inhibition on spatial learning and memory in Morris water maze test
水迷宫实验第6日,通过穿台次数以及目标象限停留时间考察了各组小鼠的空间记忆能力,结果如图3C及3D所示。与对照组相比,模型组小鼠的穿台次数和目标象限停留时间显著减少(P<0.001),表明模型组小鼠出现了明显的空间记忆损害。与模型组相比,氯硝柳胺给药组小鼠穿台次数和目标象限停留时间均显著增加(P<0.01,P<0.001),说明抑制STAT3后可在一定程度上改善AD小鼠的空间记忆能力。
3.1.4 抑制STAT3对AD小鼠皮层和海马区中病理及功能性蛋白表达影响 如图4所示,与对照组相比,模型组小鼠海马和皮层中Aβ1-42和P-Tau的表达水平显著升高(P<0.01,P<0.001),而PSD95表达水平显著降低(P<0.001)。与模型组相比,氯硝柳胺给药组小鼠海马和皮层中的P-Tau和Aβ1-42表达量显著降低(P<0.05,P<0.01),而PSD95表达水平显著升高(P<0.01)。结果提示AD的发生与STAT3的激活有关,且抑制STAT3能改善AD病理标志物的表达和神经元的损伤。
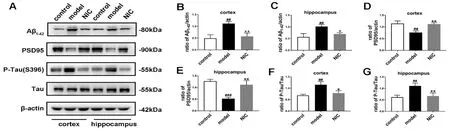
图4 抑制STAT3对阿尔茨海默病小鼠皮层和海马区中病理及功能性蛋白表达影响Fig 4 Effect of STAT3 inhibition on pathological and functional protein expression in cortex and hippocampus of mice with Alzheimer’s disease
3.2 抑制STAT3减轻AD小鼠神经炎症
如图5所示,与对照组相比,模型组小鼠海马和皮层中P-STAT3、IL-1β和TNF-α的表达水平显著升高(P<0.01,P<0.001),而STAT3的表达水平没有显著差异(P>0.05),表明STAT3在Tyr705的磷酸化水平显著提高,STAT3被激活后炎症因子水平显著提高则表明神经炎症发生发展。与模型组相比,氯硝柳胺给药组小鼠海马和皮层中的P-STAT3、IL-1β和TNF-α的表达水平显著降低(P<0.05,P<0.01),表明STAT3在Tyr705位点的磷酸化水平显著降低,STAT3被抑制后炎症因子水平显著降低则表明神经炎症的发生发展被抑制。结果提示神经炎症的发生发展与STAT3的激活有关,且抑制STAT3能减轻神经炎症,最终改善AD小鼠的认知障碍。
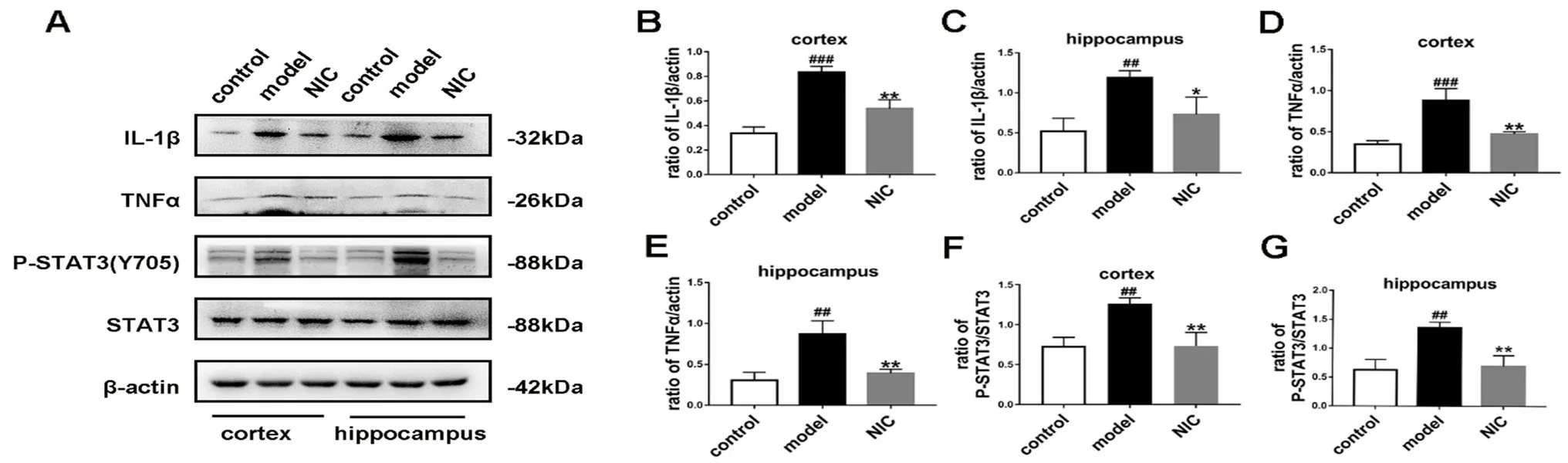
图5 抑制STAT3对阿尔茨海默病小鼠皮层和海马区中炎症因子表达的影响Fig 5 Effect of STAT3 inhibition on the expression of inflammatory factors in cortex and hippocampus of mice with Alzheimer’s disease
3.3 抑制STAT3减轻AD小鼠氧化应激
如图6所示,与对照组相比,模型组小鼠血清中GSH和SOD含量均显著降低,MDA含量显著升高(P<0.01);与模型组相比,氯硝柳胺给药组小鼠血清中GSH和SOD含量均显著升高,MDA含量显著降低(P<0.01)。结果显示抑制STAT3能够增加小鼠体内抗氧化物质的产生。
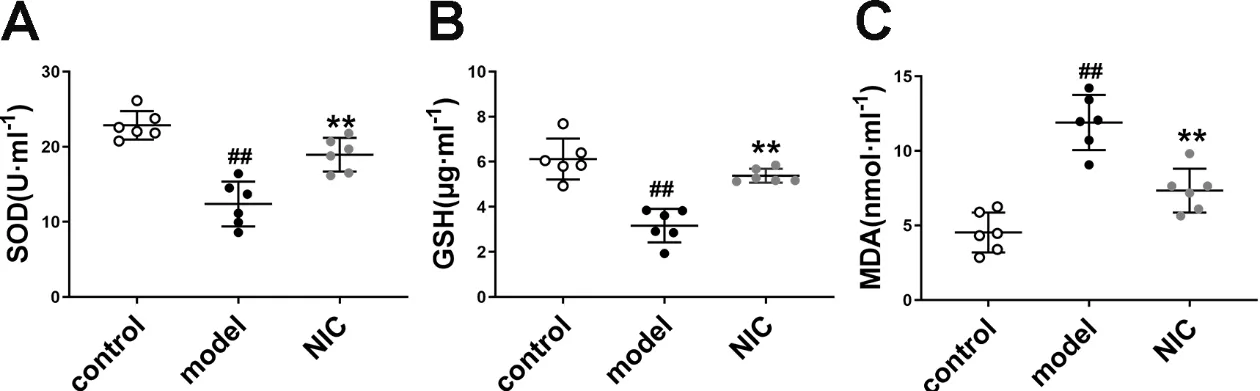
图6 抑制STAT3对阿尔茨海默病小鼠血清中氧化应激相关因子表达的影响Fig 6 Effect of STAT3 inhibition on the expression of oxidative stress related factors in serum of mice with Alzheimer’s disease
3.4 抑制STAT3治疗AD小鼠脑结构损伤且抑制剂氯硝柳胺无明显毒性
AD患者的海马神经元结构会随着疾病发展出现不同程度的损伤,而病理组织切片可以观察到这一现象[15]。图7A显示,模型组小鼠海马细胞数量减少,并出现形态学损伤,但氯硝柳胺给药组细胞数量和形态均有不同程度恢复。给药后锥体细胞排列整齐结构完整,细胞无明显肿胀以及数量增加。这表明抑制STAT3会改善海马神经结构受损。另外图7D显示,氯硝柳胺给药7 d对小鼠的心、肝、肺、脾、肾的正常组织结构无明显影响,说明其安全性较好。

图7 抑制STAT3对改善小鼠脑结构的作用及毒性Fig 7 Effect of STAT3 inhibition on improving brain structure and biocompatibility in mice
4 讨论
现代社会,随着人口老龄化的增加以及人们生活水平的提高,AD发病率日益升高[2]。由于认知功能障碍发生的生理机制复杂,寻求多靶点治疗方案具有相当重要的意义。既往研究着眼于SP和Tau蛋白过度磷酸化两大假说,但接连面临的难关驱使人们寻求更新的治疗靶点[16]。神经炎症被证明在AD发生发展过程中起到重要作用,同时有研究表明STAT3通路的激活显著加剧胶质细胞介导的神经炎症[17]。这提示以STAT3通路为靶点的药物可能对AD有改善作用。STAT3通路的重要作用在于其影响胶质细胞分裂及活化的能力,小胶质细胞的过度激活和星形胶质细胞的反应性增生都会加剧颅内神经炎症,使得疾病进一步恶化[18]。STAT3的主要激活过程是胞外信号刺激受体使得偶联的JAKs磷酸化,激活的JAKs招募游离的非活性STAT3并使其磷酸化,磷酸化后的STAT3经二聚化后转移至细胞核发挥作用[19]。抑制STAT3磷酸化能缓解神经炎症,对神经细胞起到保护作用,这在神经疾病研究领域是一个有希望的方向,但报道尚少见[20]。
本实验选取的工具药氯硝柳胺是临床上常用于治疗肠道寄生虫病的小分子化学药物,近年来研究表明其具有相当的安全性、良好的血脑屏障穿透能力以及非糖蛋白P底物的特性,且具有突出的抗炎能力,这让氯硝柳胺在帕金森病[21]、肌萎缩侧索硬化[20]、脑缺血[14]等中枢神经疾病领域展现出不俗的治疗潜力[22],但在AD中鲜有应用。此外有报道氯硝柳胺是通过抑制STAT3来控制胶质细胞的过度激活,延缓神经炎症的发生,促进神经修复[20]。因此,本文采用双侧海马立体定位注射Aβ1-42建立AD模型小鼠,给予STAT3抑制剂氯硝柳胺,探讨STAT3在认知障碍发生发展中的作用。
首先,在旷场实验中,可以观察到抑制STAT3能提高AD小鼠中央区停留时间,这符合正常小鼠探索空旷地带的天性,表明小鼠的焦虑症状和空间探索能力都有所改善;在新物体识别实验中,观察到抑制STAT3能让AD小鼠对新物体的探索次数增加,这提示小鼠的识别能力和记忆能力都有所恢复;在Morris水迷宫实验中,抑制STAT3能降低训练期AD小鼠的逃避潜伏期,提高测试期AD小鼠的目标象限停留时间和穿台次数,这说明小鼠空间记忆能力的改善。通过动物行为学实验初步证明了抑制STAT3能改善AD小鼠的学习记忆能力。
AD的发生发展主要累及脑组织中的海马及皮层区域,形成神经原纤维缠结和Aβ斑块,造成神经元损伤,突触丢失和功能下降,进而引起认知记忆障碍[23]。PSD95是一种支架蛋白,该蛋白的表达水平可以用来衡量突触的数量以及功能[24]。通过对各组小鼠皮层及海马区组织的分析检测我们发现抑制STAT3能降低Aβ1-42和P-Tau的表达水平,提高PSD95的表达水平,这初步证明了抑制STAT3能从蛋白分子层面降低AD小鼠的病理标志物,改善突触功能。
与神经炎症密切相关的多种细胞参与了AD的发展,包括小胶质细胞、星形胶质细胞和一些外周炎症细胞,IL-1β和TNF-α是由这些细胞分泌的炎症因子[25]。近年来研究发现,STAT3信号通路与神经疾病病理状态下胶质细胞的激活和分裂密切相关,是影响胶质细胞介导神经炎症的关键因素[26]。因此我们进一步利用Western blot对各组小鼠皮层及海马组织中IL-1β、TNF-α进行检测分析。结果表明,抑制STAT3能使这两种炎症指标下调,这表明抑制STAT3能减轻AD小鼠海马和皮层的神经炎症。
AD患者脑组织由于长期处于Aβ斑块等的刺激,氧化应激诱导物质ROS在AD发病过程中会显著增多并因此激活抗氧化系统[27]。内源性抗氧化物是抗氧化系统重要的一环,其中SOD是其中重要的酶类抗氧化物;MDA是体内脂质过氧化的产物,其含量能反映体内氧化应激水平;GSH是重要的抗氧化剂,其随着年龄增加出现全身性的表达下调,在AD中该变化更为显著[27]。在临床治疗中,血液指标的变化也可以作为AD病症发展程度的参考依据[28]。因此我们利用试剂盒对各组小鼠血清进行了检测分析。结果表明,抑制STAT3能降低MDA的表达,并且提高SOD和GSH的表达,这提示抑制STAT3能减轻AD小鼠体内的氧化应激水平。
以上实验结合组织切片结果证明,抑制STAT3蛋白的磷酸化,可使STAT3蛋白激活受阻,减缓神经炎症反应和氧化应激反应的发生,保护神经细胞,最终改善AD小鼠的认知障碍,但是深入的机制还需要后续进一步的探索以及验证。目前关于通过抑制JAK-STAT3通路从而延缓AD病情进展的研究较少,并且临床上也没有类似的药物。本研究表明STAT3有可能成为药物开发的新靶点,并为AD的药物研发以及在临床上的应用提供新的思路。

