不同时期RNA干扰水通道蛋白4对早期创伤性脑水肿影响的观察
赵 旭,宋振全,梁国标,李晓明,李 宾,吕 伟,毛振立,雷 伟,刘洪波
在早期脑损伤(early brain injury,EBI)的发病机制中脑水肿的发生和血脑屏障(blood-brain barrier,BBB)的破坏起重要作用[1]。大量研究证实,脑水肿的发生与水通道蛋白4(aquaporin4,AQP4)紧密相关[2-3]。创伤性脑水肿的早期治疗十分关键,而由于其复杂的机制,人们对伤后AQP4的调节存在争议,对于早期脑损伤的机制也有待进一步探索。许多研究证实应用RNA干扰的方法可有效沉默体内外AQP4和mRNA的表达[4],笔者希望探索在不同时期抑制AQP4蛋白的表达对早期创伤性脑水肿发生发展的影响及相关机制。
材料与方法
1 实验材料
1.1 动物分组 健康成年雄性Wistar大鼠90只,体质量250~300g。实验动物随机数字表法分为:假手术组、单纯创伤组、伤前6h给药组、创伤即刻给药组和伤后6h给药组。
1.2 主要试剂及仪器 采用化学合成法合成的大鼠siRNA(Aqp4-rat-725:5’GCAGUUAUCAUGGGAAACU TT3’,5’AGUUUCCCAUGAUAACUGCTT3’,上海吉玛生物工程有限公司;实验证明,脑室给药后6h可有效降低脑内AQP4蛋白和mRNA的含量,验证过程略)。
2 实验方法
2.1 TBI模型制备 参照改良Feeney’s自由落体硬膜外撞击法制作局灶性脑挫裂伤模型。采用水合氯醛350mg/kg腹腔内注射麻醉,将大鼠俯卧位固定于脑立体定向仪上。以囟门后约1mm,旁开2.5mm为中心以磨钻磨一直径约5mm的骨窗,暴露硬脑膜。将撞杆头端(直径3mm)置于骨窗硬脑膜,其外为垂直聚乙烯套管,用40g打击棒沿外周套管从25cm高度自由落下冲击聚乙炔圆锥,下落冲击力1 000cm×g,造成大脑半球局部脑挫裂伤。
2.2 各实验组处理 分别于伤前6h、创伤即刻和伤后6h向左侧脑室注入AQP4 siRNA20μl[10μM,将0.25OD AQP4 siRNA溶于20μl焦碳酸二乙酯(DEPC)水中];单纯创伤组在创伤即刻向左侧脑室注入生理盐水20μl;假手术组不行创伤,开窗后脑室注入20μl生理盐水,缝合。然后进行脑组织含水量测定,血脑屏障通透性测定,灌注、取材及包埋,HE标本制作及观察,AQP4、ZO-1和MMP9蛋白免疫组织化学观察,原位杂交方法检测AQP4 mRNA的表达。
2.3 数据处理
所测数据采用SPSS 18.0统计软件进行统计分析,检验水准α=0.05,P<0.05为差异有统计学意义。
结 果
1 在精神、运动和行为等方面,各创伤组间未见明显差异。局灶性脑挫裂伤形成后,大鼠平均呼吸暂停时间约15s。有9只大鼠在硬膜外撞击后死亡,死亡率为12.5%(9/72)。
2 颅脑损伤后2d,各损伤组较假手术组的脑组织含水量均明显增加(P<0.05)。与假手术组相比,单纯创伤组和伤后6h给药组的增幅最大,分别为7.78%和6.47%(P<0.05),后两者之间差异无统计学意义(P>0.05)。伤前6h给药组和创伤即刻给药组增幅较小,分别为2.95%和3.07%,两者间差异无统计学意义(见表1)。另外,给予AQP4 siRNA组大鼠于伤后3、5、7d,脑组织含水量较单纯创伤组均显著降低(未加入数据)。
表1 颅脑损伤2d后各实验组大鼠脑组织含水量(%,n=6,±s)

表1 颅脑损伤2d后各实验组大鼠脑组织含水量(%,n=6,±s)
与假手术组比较:●P<0.05;与单纯创伤组比较:▲P>0.05,■P<0.05
实验分组 损伤侧(左侧)含水量假手术组76.83±0.51单纯创伤组 82.81±0.86●伤前6h给药组 79.10±0.67●■创伤即刻给药组 79.19±0.70●■伤后6h给药组 81.80±0.96●▲
3 颅脑损伤2d后,各损伤组单位质量脑组织EB含量明显(P<0.05)增加。与假手术组相比,单纯创伤组、创伤即刻给药组和伤后6h给药组增幅较大,分别为288.83%和243.63%和272.34%;伤前6h给药组增幅最小,为104.91%(见图1)。

图1 颅脑损伤2d后各组大鼠单位质量脑组织EB含量(μg)
4 颅脑创伤2d后,伤前6h给药组和创伤即刻给药组的星形胶质细胞和神经元水肿的范围和程度明显低于伤后6h给药组。假手术组未见水肿迹象,单纯创伤组水肿程度和范围最严重(图2)。
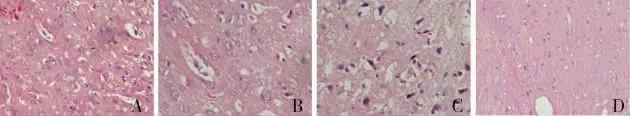
图2 A~C为单纯创伤组TBI2d后,损伤中心脑组织HE染色,D为空白对照组相同位置HE染色。A.星形胶质细胞和神经元细胞水肿明显,细胞质和细胞核染色变淡,损伤周围皮质可见血细胞;B.损伤中心可见到明显的胶质细胞增生,神经元数目减少;C.神经元变性、萎缩,细胞间隙增宽,微血管内皮细胞肿胀;D.未见明显细胞水肿和变性
5 颅脑损伤后2d,单纯创伤组较假手术组的AQP4蛋白平均阳性细胞面积明显升高(P<0.05),伤前6h给药组、创伤即刻给药组和伤后6h给药组较假手术组的AQP4蛋白平均阳性细胞面积明显下降,降幅分别为78.63%,81.91%和73.37%(P<0.05)(见图3);颅脑损伤后2d,单纯创伤组较假手术组的AQP4mRNA平均阳性细胞面积显著升高(P<0.05),伤前6h给药组、创伤即刻给药组和伤后6h给药组较假手术组降幅分别为82.93%,78.46%和65.09%(P<0.05)(见图4)。

图3 颅脑损伤后2d,各组大鼠脑内AQP4免疫荧光组织化学染色(×400)。A.假手术组;B.单纯创伤组;C.伤前6h给药组;D.创伤即刻给药组;E.伤后6h给药组。可见B组阳性细胞数量和荧光强度较其他4组明显升高。C、D和E组阳性细胞较A组明显减少,说明药物在2d后,仍有较高水平的沉默效率,其中,C、D和E组的阳性细胞数量无明显差异

图4 颅脑损伤后2d,AQP4mRNA平均阳性细胞面积(μm2)
6 颅脑损伤后2d,各损伤组脑内MMP9含量均明显(P<0.05)升高。单纯创伤组、创伤即刻给药组和伤后6h给药组增幅最大,分别为371.10%,306.58%和347.12%(P<0.01);伤前6h给药组增幅最小,为136.71%(P<0.05)(见图5和表2)。

图5 颅脑损伤后2d,各组大鼠脑内MMP9免疫组织化学染色(×400)。阳性细胞内的阳性表达境界清楚,呈棕黄色或棕褐色颗粒,主要位于细胞质内,有的细胞突起内也有表达。A.假手术组;B.单纯创伤组;C.伤前给药组;D.创伤即刻给药组;E.伤后给药组
表2 各组大鼠脑内MMP9平均阳性细胞面积(μm2,n=6,±s)
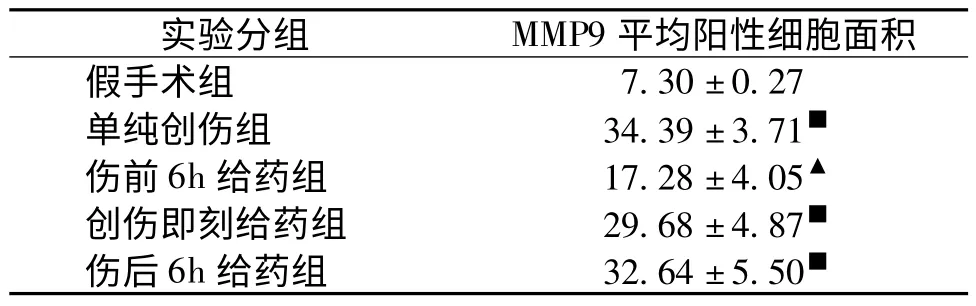
表2 各组大鼠脑内MMP9平均阳性细胞面积(μm2,n=6,±s)
与假手术组比较:▲P<0.05,■P<0.05;与单纯创伤组比较:▲P<0.05
实验分组 MMP9平均阳性细胞面积假手术组7.30±0.27单纯创伤组 34.39±3.71■伤前6h给药组 17.28±4.05▲创伤即刻给药组 29.68±4.87■伤后6h给药组 32.64±5.50■
7 颅脑损伤2d后,各损伤组脑组织中ZO-1蛋白的含量均明显下降(P<0.05)。单纯创伤组、创伤即刻给药组和伤后6h给药组降幅较大,分别为55.51%,47.59%和52.29%;伤前6h给药组降幅较小,为23.07%(P<0.05)。伤前6h给药组较其他创伤组差异有统计学意义(P<0.05)(见图6和表3)。
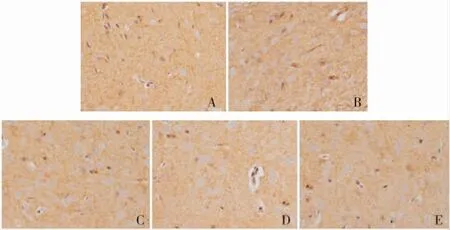
图6 颅脑损伤后2d,各组大鼠脑内ZO-1免疫组织化学染色,条索状褐色影为阳性表达。A.假手术组;B.单纯创伤组;C.伤前6h给药组;D.创伤即刻给药组;E.伤后6h给药组
表3 各组大鼠脑内ZO-1平均阳性面积(μm2,n=6,±s)

表3 各组大鼠脑内ZO-1平均阳性面积(μm2,n=6,±s)
与假手术组比较:▲P<0.05,■P<0.05;与伤前6h给药组比较:▲P<0.05
实验分组 ZO-1平均阳性表达面积假手术组24.23±3.72单纯创伤组 10.78±4.63▲伤前6h给药组 18.64±5.18■创伤即刻给药组 12.70±4.91▲伤后6h给药组 11.56±4.88▲
讨 论
1 AQP4与早期脑水肿
AQP4蛋白是胶质细胞、脑脊液以及血管之间相互调节和运输水分的重要结构基础[5],而且,水通道蛋白可以使水分子顺渗透压梯度双向转运[6]。Klatzo[7]将脑水肿分为血管源性脑水肿和细胞毒性脑水肿两类。研究证实,脑损伤后大量水分通过AQP4进入脑内,导致了细胞毒性脑水肿的形成;AQP4同时能够促进血管源性脑水肿时过多水的再吸收,易于脑内多余水分清除,从而减轻血管源性脑水肿[8-9],可见同为脑水肿,由于形成机制的不同,AQP4所起的作用相反。
研究发现,大鼠外伤后1、4h脑内AQP4表达无变化[10],至外伤后6h,AQP4的含量有统计学意义增加[11]。局灶性脑挫裂伤后1~2d,为损伤侧脑组织含水量的高峰期[12]。实验证明,利用化学合成法合成的AQP4小干扰RNA可以在脑室给药6h内显著降低脑内AQP4蛋白和mRNA的含量。本实验于伤前6h、伤后0h、6h给予AQP4siRNA,分别可以自伤后0h、6h、12h起有效沉默AQP4表达,并可以观察不同处理组间对创伤性脑水肿的影响。
伤前6h给药时,观测发现脑组织含水量和BBB通透性较单纯创伤组均显著降低,说明这一时期以细胞毒性脑水肿为主。本实验中,创伤即刻给药组在伤后6h内抑制AQP4蛋白,伤后2d脑组织含水量明显改善,但是BBB通透性未见明显改善,说明血管内皮存在损伤,血管源性脑水肿仍然存在。本实验伤后6h给药组中,在伤后12h充分抑制AQP4蛋白,伤后2d脑组织含水量和BBB通透性均显著升高,较单纯创伤组未见明显差异。说明创伤发生12h以后抑制AQP4蛋白,无法有效改善脑组织含水量,这一时期以血管源性脑水肿为主。
2 AQP4与ZO-1、MMP9
在病理情况下,BBB连接复合体结构的破坏和功能改变,引起BBB调控失代偿,并最终导致脑损伤。ZO-1是紧密连接蛋白的重要构成部分,其表达水平的下降可以作为BBB破坏的标志[13]。AQP4和MMP9是脑水肿和BBB机能障碍病理机制必不可少的组成部分[14]。本实验创伤即刻给药组、伤后6h给药组和单纯创伤组较伤前6h给药组的MMP9含量均明显升高,而ZO-1含量均明显降低。前三组间MMP9和ZO-1含量无明显差异。说明抑制AQP4无法影响MMP9和ZO-1含量,AQP4与后两种蛋白无直接关联。
总之,目前创伤性脑水肿早期的治疗仍然很大程度上依靠渗透性药物和外科手术治疗,以相关蛋白为靶点的药物治疗常常被人们忽视。头部撞击伤后,对于AQP4蛋白进行激活还是抑制取决于脑水肿的形成和清除机制,也就是该脑水肿是血管源性脑水肿还是细胞毒性脑水肿占主导地位。本实验通过不同时期抑制AQP4蛋白,发现局灶性脑挫裂伤后0~6h沉默AQP4蛋白表达,能够有效抑制伤后早期脑组织含水量,但是无法有效降低BBB的通透性,此时期以细胞毒性脑水肿为主导;伤后7~12h沉默AQP4蛋白,无法有效抑制早期脑水肿和降低BBB的通透性,说明此时期以血管源性脑水肿为主导。
颅脑创伤前抑制AQP4蛋白,可明显抑制早期脑水肿。伤后初期(6h内)抑制AQP4蛋白,可明显抑制伤后脑水肿,但无法改善伤后BBB通透性。伤后6~12h抑制AQP4蛋白无法抑制脑水肿和改善BBB的通透性。
[1]Cahill J,Zhang JH.Subarachnoid hemorrhage:is it time for a new direction[J].Stroke,2009,40(2):86-87.
[2]Papadopoulos MC,Verkman AS.Aquaporin-4 and brain edema[J].Pediatr Nephrol,2007,22(6):778-862.
[3]King LS,Nielsen S,Agre P.Respiratory aquaporins in lung inflammation:the night is young[J].Am J Respire Cell Molboil,2000,22(1):8-10.
[4]Nicchia GP,Srinivas M,Li W,et al.New possible roles for aquaporin-4 in astrocytes:cell cytoskeleton and functional relationship with connexin43[J].FASEB,2005,19(7):1674-1676.
[5]Badaut J,Lasbenns F,Magistretti PJ,et al.Aquaporins in brain:distribution,physiologt and pathophysiology[J].Cereb Blood Flow Metab,2002,22(3):367-378.
[6]Zhao J,Moore AN,Clifton GL,et al.Sulforaphane enhances aquaporin-4 expression and decreases cerebral edema following traumatic brain injury[J].Neurosci Res,2005,82(4):499-506.
[7]Klatzo I.Evolution of understanding concepts of brain edema[M].The 9th international symosium on brain edema(Abstrast book),1993:1.
[8]Papadopoulos MC,Manley GT,Krishna S,et al.Aquaporin-4 facilitates reabsorption of excess fluid in vasogenic brain edema[J].FASEB,2004,18(2):1291-1293.
[9]Nag S,Manias JL,Stewart DJ.Pathology and new players in the pathogenesis of brain oedema[J].Acta Neuropathol,2009,118(5):197-217.
[10]Sun MC,Honey CR,Berk C,et al.Regulation of aquaporin-4 in a traumatic brain injury model in rat[J].J Neurosurg,2003,98(3):565-574.
[11]张琳,袁芳.大鼠脑外伤诱导水通道蛋白4表达增强加重脑水肿[J].首都医科大学学报,2008,29(12):732-736.
[12]Kiening KL,van Landeghem TK,Schreiber S,et al.Decreased hemispheric Aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].J Neurosci Lett,2002,324(9):105-108.
[13]Kirk J,Plumb J,Mirakhur M,et al.Tight junctional abnormality in multiple sclerosis white matter affects all calibres of vessel and is associated with blood-brain barrier leakage and active demyelination[J].J Pathol,2003,201(2):319.
[14]Higashida T,Kreipke CW,Rafols JA,et al.The role of hypoxia-inducible factor-1α,aquaporin-4,and matrix metalloproteinase-9 in blood-brain barrier disruption and brain edema after traumatic brain injury[J].J Neurosurg,2011,114(11):92-101.

