基于纯培养和超高深宏基因组测序技术分析茅台镇两企业高温大曲微生物多样性差异
王玉荣,侯强川,田龙新,刘菊珍,周加平,郭 壮,
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.襄阳市酱香型白酒固态发酵企校联合创新中心,湖北 襄阳 441053;3.酱香型白酒固态发酵襄阳市重点实验室,湖北 襄阳 441614)
白酒作为我国一款传统的酒精饮品,不仅历史悠久,还因其以酯类为主体的复合香味而深受各族人民的喜爱[1-2]。中国白酒最早确立的香型有清香型、酱香型、浓香型和凤香型,随着研究的深入,白酒香型已经扩展至12 种[3]。相较于其他香型,酱香型白酒具有酱香细腻、醇厚柔和、酒体丰满和空杯留香持久等特点[4]。相关研究发现,白酒作为一种微生物发酵制品,酒曲不仅为其发酵过程提供了丰富的微生物和酶类物质[5],并直接或间接地影响着酒体的品质[6-7]。因此,在我国也有“曲为酒之骨”的说法。
根据生产原料差异大致可将酒曲分为麦曲、大曲和小曲等类型,而根据发酵工艺又可分为高温曲、中高温曲和中温曲等。传统酒曲的制作环境较为开放,容易受到制作环境和原料的影响,导致各曲样间存在较大差异[8-9]。科研人员针对酒曲展开了大量卓有成效的研究,Hou Qiangchuan等[10]发现不同类型酒曲中微生物群落结构和功能之间存在明显的差异;Wang Yurong等[11]进一步分析发现不同类型高温大曲显著影响着酱香型白酒的发酵过程,如黑色高温大曲中主要以Thermoactinomyces和Staphylococcus为主,其不仅可以分泌淀粉酶、酯酶和纤维素酶等,还能产生具有酱香风味的吡嗪类物质和其他风味物质,对于酱香型白酒的风味品质具有重要的意义。同时,相关研究证实芽孢杆菌在白酒的发酵过程中发挥着重要的作用,其不仅具有多种酶,可以在发酵过程中分解一些复杂的底物,释放营养物质促进酵母和其他微生物的生长和代谢,部分芽孢杆菌还会产生一些特殊风味的化合物,影响白酒的最终风味。茅台镇作为我国“酱酒圣地”,域内白酒业兴盛,这也使得本研究能较好地解析该地区高温曲中微生物的结构差异,并探究在发酵过程中的积极作用。
酒曲的研究是一个逐步发展的过程,科研人员最初采用纯培养技术对酒曲中的细菌和真菌进行分离鉴定,初步探讨了酒曲中微生物的构成和多样性[12]。纯培养技术具有自身的局限性,不能准确分析酒曲样本中微生物的构成[13],但仍可以通过使用选择性培养基实现对酒曲中目标微生物的分离和鉴定,为后续优良菌株的筛选奠定基础。随着高通量测序和生物信息学技术的迅速发展,高通量测序被广泛应用于传统发酵食品中[14-16]。值得注意的是,受限于扩增偏好和测序片段长度,该方法在解析物种构成和丰度上存在一定误差,无法充分挖掘样本中的微生物信息。近年来,随着测序成本的快速下降,越来越多的科研人员采用宏基因组测序技术挖掘样本中的微生物信息[17],而通过加大测序深度(超高深宏基因组测序)不仅可以获得更加准确的物种鉴定和分类结果,还可以利用Binning技术获得更加完整的基因组,并发现更多的低丰度物种,为解析生态中微生物的构成、多样性和功能提供有利的手段。高温大曲中的微生物结构较为复杂,因此,通过超高深宏基因组测序技术解析其微生物多样性十分必要。
本研究以茅台镇两个酒厂的6 份高温大曲为研究对象,分别采用纯培养技术和超高深宏基因组测序技术对高温大曲中可培养微生物和微生物群落结构及功能进行分析,通过对比茅台镇不同酒厂高温大曲中微生物群落结构和功能的差异,以期为提升高温大曲的品质提供必要的数据支持。
1 材料与方法
1.1 材料与试剂
高温大曲样本均采集自贵州省遵义市仁怀市茅台镇,从A酒厂和B酒厂各采集3 份成品高温大曲样本,均生产自2022年6月21号,编号分别为A1~A3和B1~B3。两酒厂高温酒曲的制作工艺除曲母添加量存在差异外(A酒厂的曲母添加量为4.5%~8.0%,B酒厂的曲母添加量为6.0%~8.0%),其他工艺基本一致。
DNeasy mericon Food Kit DNA基因组提取试剂盒 德国QIAGEN公司;蛋白胨 北京陆桥技术股份有限公司;牛肉膏 南京全隆生物技术有限公司;氯化钠、氢氧化钠 国药集团化学试剂有限公司;5×TransStartTMFastPfu缓冲液、FastPfu Fly DNA聚合酶、dNTPs Mix 北京全式金生物技术有限公司;引物27F/1495R 武汉天一辉远生物科技有限公司。
1.2 仪器与设备
YH-2004电子天平 惠州市英衡电子科技有限公司;DG250型厌氧工作站 英国Don Whitley公司;CR21N型高速离心机 日本日立金属株式会社;R930机架式服务器 美国Dell公司;Illumina Xten高通量测序平台 美国Illumina公司;ND-2000C微量紫外分光光度计 美国Thermo Scientific公司;MGC-300H培养箱上海一恒科学仪器有限公司。
1.3 方法
1.3.1 样品前处理
将收集的高温大曲样本破碎为粉,混合均匀后暂存于-80 ℃冰箱直至开展后续实验。
1.3.2 芽孢杆菌的分离鉴定
使用无菌勺挖取10 g高温大曲粉加入90 mL生理盐水中振荡均匀,使用倍比稀释法将培养物稀释至10-4~10-8梯度后涂布于营养琼脂(nutrient agar,NA)培养基上,37 ℃倒置培养24 h[18]。选取菌落数在30~300的培养皿,并观察平板中各菌落的形态,根据形态、颜色和大小等特征挑选不同的单菌落进行划线纯化。纯化3 次后挑选恰当的菌体进行涂片和革兰氏染色,使用十六烷基三甲基溴化铵法对疑似芽孢杆菌菌株的DNA进行提取,并使用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1495R(5’-CTACGGCTACCTTCTTACGA-3’)对其16S rRNA全序列进行扩增。使用琼脂糖凝胶电泳对扩增产物进行检验,并将检验合格的扩增产物连接到T载体后转化至Escherichia colitop10中。最后,将阳性克隆子寄往测序公司进行测序,并将反馈回的序列拼接后在国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中进行比对并构建系统发育树[19]。
1.3.3 宏基因组DNA提取和测序
参照DNeasy mericon Food Kit DNA基因组提取试剂盒说明书的步骤对高温大曲样本进行宏基因组DNA提取,通过超声将提取的宏基因组DNA打断为350 bp左右,并将DNA末端进行补齐后添加A-tailed构建DNA文库。最后,将构建好的DNA文库使用Illumina Xten测序仪进行宏基因组测序。
1.3.4 生物信息学分析
使用KneadData软件对下机数据进行质量控制,并去除人体基因组序列,将剩下的高质量宏基因组序列用于后续分析[20]。
本研究使用MegaHit软件将高质量序列组装成contigs,选择长度大于1000 bp的contigs构建序列集,并基于Sembin软件对构建的序列集进行宏基因组Binning以获得宏基因组组装基因组(metagenome assembly genomes,MAGs)[21];使用CheckM软件对每一个MAG的质量进行评估,并依照完整度和污染率将MAGs划分为高质量(完整度>80%,且污染率<10%)、中等质量(60%<完整度≤80%,且10%≤污染率<20%)和低质量(完整度≤60%,或污染率≥20%)[22];使用FastANI软件将MAGs与NCBI非冗余核苷酸序列数据库(Nucleotide Sequence Database,NT)和人体肠道微生物的基因组集(Unified Human Gastrointestinal Genome,UHGG)比对以获得MAGs的注释信息[23]。使用HUMAnN2(HMP Unified Metabolic Analysis Network 2)分析流程对质控后的宏基因组序列进行分析[24],并通过MetaphlAn 3软件对高温大曲中微生物的构成和相对丰度进行解析[25]。
1.3.5 核酸登录号
本研究所用测序数据正在上传国家生物技术信息中心SRA数据库保存,该数据在NCBI数据库的编号为PRJNA1008639。
1.4 数据分析及可视化
本研究基于R软件对茅台镇不同酒厂高温大曲中微生物的相对含量、α多样性指数和微生物代谢通路的差异进行分析;使用PAST软件对微生物的群落结构进行主坐标分析(principal co-ordinates analysis,PCoA)。本研究所有数据可视化均使用Origin 2021或R软件完成。
2 结果与分析
2.1 高温大曲中芽孢杆菌的分离鉴定
本研究从6 份茅台镇高温大曲中共分离鉴定到212 株芽孢杆菌,其中从A酒厂高温大曲中共分离鉴定到114 株芽孢杆菌(A1、A2和A3分别鉴定到41、38 株和35 株),而从B酒厂高温大曲中共分离鉴定到98 株芽孢杆菌(B1、B2和B3分别鉴定到31、35 株和32 株),部分纯化后的芽孢杆菌菌株在NA培养基中的菌落形态和细胞形态如图1所示。
由图1A可知,分离株的菌落形态多为圆形,表面粗糙、部分菌落中间凸起,颜色为透明或不透明的乳白色。由图1B可知,菌株在电子显微镜下呈现短杆状或杆状,分离的菌株总体符合芽孢杆菌的典型特征。进一步分析发现,A酒厂分离的菌落形态多为圆形、中间凸起,呈不透明的乳白色,而B酒厂分离的菌落形态大多表面粗糙,呈透明的乳白色。由此可见,不同酒厂高温大曲中分离的芽孢杆菌的形态存在较大差异。为进一步确定分离菌株的分类学地位,本研究对菌株的16S rRNA基因全长进行测定,并在NCBI网站进行BLAST比对,同时将所获得的序列与模式菌株序列通过MEGA软件构建系统发育树,系统发育树结果如图2所示。

图2 基于16S rRNA的212 株芽孢杆菌与标准菌株的系统发育树Fig.2 Phylogenetic tree of 212 Bacillus stains and standard strains based on 16S rRNA sequencing
本研究分离出的212 株芽孢杆菌被鉴定为20 个种,分别为77 株索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、39 株地衣芽孢杆菌(B.licheniformis)、19 株解淀粉芽孢杆菌(B.amyloliquefaciens)、16 株暹罗芽孢杆菌(B.siamensis)、15 株地衣芽孢杆菌(B.licheniformis)、13 株拟蕈状芽孢杆菌(B.paramycoides)和11 株贝莱斯芽孢杆菌(B.velezensis)等。进一步分析可知,B.sonorensis主要由B酒厂中分离得到,B.licheniformis和B.amyloliquefaciens主要由A酒厂中分离得到,而其他菌株在两酒厂中分布差异不明显。综上所述,茅台镇高温大曲中的芽孢杆菌以B.sonorensis、B.licheniformis和B.amyloliquefaciens等为主,占比63.68%。相关研究显示,B.sonorensis、B.licheniformis和B.amyloliquefaciens等为高温大曲中的主要芽孢杆菌,不仅参与酱香型白酒的发酵过程,还可以控制有害微生物的生长,产生一些具有特殊风味的化合物,并可能影响白酒风味。由此可见,通过对高温大曲的芽孢杆菌进行分离鉴定和保藏,可为后续优良菌种的开发提供必要的原材料。
2.2 高温大曲中微生物构成和多样性分析
本研究在纯培养的基础上,通过超高深宏基因组测序对高温大曲微生物类群进行解析,6 个样品共获得867530532 条高质量序列,测序总量为124.08 Gb,每个样本平均获得144588422 条高质量序列,平均测序量为20.68 Gb。在获得宏基因组数据的基础上,本研究采用Binning技术对茅台镇高温大曲中微生物的基因组进行组装,结果如图3所示。
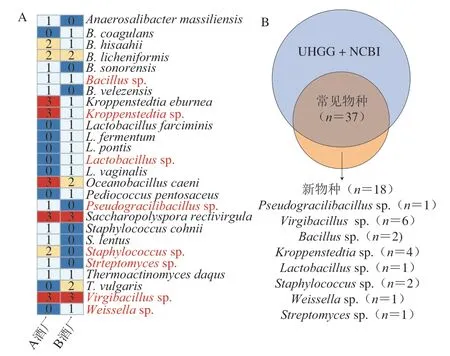
图3 基于宏基因组Binning技术的物种构成分析Fig.3 Species composition analysis based on metagenome binning technology
本研究共获得303 个MAGs,其中高质量的MAGs有55 个。由图3A可知,本研究获得的55 个高质量MAGs分别隶属于13 个属的26 个种。进一步分析可知,Virgibacillussp.和Saccharopolyspora rectivirgula在所有酒曲样本中均能被鉴定到,而Oceanobacillus caeni、Kroppenstedtiasp.和K.eburnea仅在A酒厂的所有大曲中被鉴定到。值得注意的是,Staphylococcus和Streptomyces仅在A酒厂的大曲中被鉴定到,而Lactobacillus仅在B酒厂的大曲中被鉴定到。
将高质量MAGs与数据库中基因组的平均核苷酸相似度(average nucleotide identity,ANI)进行计算发现,55 个高质量的MAGs中有37 个与数据库中的基因组具有较高水平的ANI(≥97%),而剩余18 个与数据库中基因组的ANI较低(<97%)。由此可见,37 个高质量MAGs可以在种水平被注释,而其他18 个为疑似新种(Pseudogracilibacillussp.、Virgibacillussp.、Bacillussp.、Kroppenstedtiasp.、Lactobacillussp.、Staphylococcussp.、Weissellasp.和Streptomycessp.)。在此基础上,本研究进一步对茅台镇高温大曲中微生物的物种构成和多样性进行解析,结果如图4所示。

图4 茅台镇高温大曲中微生物的组成和多样性Fig.4 Composition and diversity of microorganisms in high temperature Daqu from Maotai town
本研究一共注释到6 个菌门和109 个菌种。由图4A可知,高温大曲中的优势(平均相对含量大于1.00%)菌属有8 个,分别为43.21%芽胞链菌属(Desmospora)、22.99%芽孢杆菌属(Bacillus)、7.07%曲霉科_未识别(Aspergillaceae_unclassified)等。由图4B可知,优势菌种有13 个,主要为48.46%Desmosporasp.8437、6.93%B.sonorensis和5.65%B.amyloliquefaciens等。值得注意的是,A酒厂高温大曲中子囊菌门(Ascomycota)的相对含量高达12.74%,其真菌相对含量较高。本研究进一步对不同酒厂高温酒曲中优势菌属和菌种的相对丰度进行分析,发现Desmospora和Bacillus是高温酒曲中的主要菌属,而Desmospora_sp_8437是高温酒曲中的主要菌种。差异分析发现,在优势菌属方面,仅Staphylococcus在A酒厂高温大曲中显著较高(P<0.05),而其他优势菌属均差异不显著(P>0.05);在优势菌种方面,A酒厂高温大曲在B.sonorensis、B.amyloliquefaciens和B.coagulans等芽孢杆菌的相对丰度上显著较低(P<0.05)。由图4C、D可知,A酒厂高温大曲中微生物的Shannon指数和J指数分别为1.01和0.28,而B酒厂高温大曲分别为2.06和0.54。经Wilcoxon检验发现,A酒厂高温大曲中微生物的Shannon指数和J指数均显著低于B酒厂高温大曲(P<0.05)。由此可见,其微生物的多样性和丰富度均显著低于B酒厂高温大曲(P<0.05)。基于Bray-Curtis和Jaccard距离对茅台镇不同高温大曲的菌群结构进行分析,结果如图5所示。

图5 基于Bray-Curtis(A)和Jaccard(B)距离的PCoA图Fig.5 PCoA plots based on Bray-Curtis (A) or Jaccard (B) distance
由图5A可知,在基于Bray-Curtis距离的PCoA图中,A酒厂高温大曲主要集中在第3象限,而B酒厂高温大曲则较为分散,不同高温大曲在空间上呈现明显的分离趋势(F=1.256,P=0.204);由图5B可知,在基于Jaccard距离的PCoA图中,A酒厂高温大曲主要集中在X轴正方向,而B酒厂高温大曲则主要集中在X轴负方向,两种高温大曲亦在空间上呈现明显的分离趋势(F=3.453,P=0.024)。由此可见,高温大曲中的主要微生物存在较大差异,可能各自含有一些较为独特的细菌类群。值得注意的是,A酒厂高温大曲在空间上较为集中,而B酒厂高温大曲在空间上较为分散,表明A酒厂高温大曲中的微生物结构更为相似稳定。
2.3 高温大曲中微生物的代谢途径
本研究基于Humann2分析流程对高温大曲中微生物的功能进行预测,并通过MetaCyc数据库对微生物的代谢途径进行注释。茅台镇不同高温大曲中微生物差异代谢途径如图6所示。
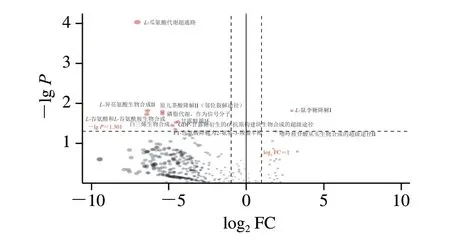
图6 茅台镇不同高温大曲中微生物差异代谢途径分析Fig.6 Analysis of microbial differential metabolic pathways between different high-temperature Daqu from Maotai town
由图6可知,从茅台镇高温大曲中共注释到367 条代谢途径,而有11 条代谢途径在不同高温大曲中存在显著性差异(P<0.05),其中9 条代谢途径的相对丰度在A酒厂高温大曲中显著较高(P<0.05),2 条代谢途径的丰度在B酒厂高温大曲中显著较高(P<0.05)。进一步分析发现,在A酒厂高温大曲中丰度较高的差异代谢通路主要与氨基酸的生物合成相关,而在B酒厂高温大曲中丰度较高的差异代谢通路主要与L-鼠李糖的降解相关。为此,本研究进一步对在差异代谢途径中各菌的贡献度进行分析,具体结果如图7所示。
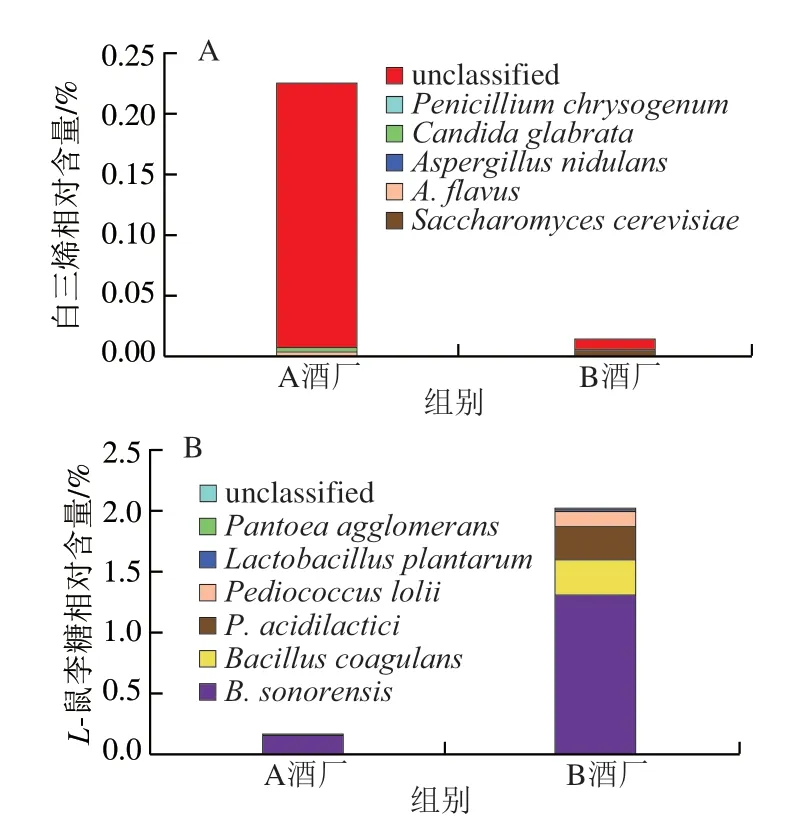
图7 部分差异代谢途径中微生物的贡献度分析Fig.7 Analysis of the contribution of microorganisms to selected differential metabolic pathways
本研究对11 条差异代谢途径的物种贡献进行分析,发现有9 条差异代谢途径的物种贡献为未知,仅有2 条差异代谢途径的物种贡献较为明确。由图7可知,白三烯的生物合成主要由酿酒酵母(Saccharomyces cerevisiae)、黄曲霉(Aspergillus flavus)和构巢曲霉(A.nidulans)等贡献,而L-鼠李糖降解则主要由B.sonorensis、B.coagulans和乳酸片球菌(Pediococcus acidilactici)等贡献。值得注意的是白三烯生物合成的差异主要是由A酒厂高温大曲中的未知物种所贡献。
3 讨论与结论
酒曲作为白酒发酵的灵魂,在白酒的生产发酵中扮演着重要的角色。作为白酒生产过程中重要的糖化剂和发酵剂,其不仅提供发酵过程中所需要的各种微生物,还提供各种酶类及风味物质的前体,直接或间接影响着酒体最终品质的形成[26]。在高温大曲制作时,大量环境或原材料中的微生物进入发酵体系进行富集,并经过一段时间高温发酵,最终形成其所特有的微生物菌群和多样性[27]。有研究发现高温发酵会导致大曲中微生物的构成发生明显变化,使得如Bacillus、嗜热真菌属(Thermomyces)和热子囊菌属(Thermoascus)等对高温耐受性较强的微生物占据优势地位,而酵母等对高温耐受性相对较差的微生物丰度显著降低[28]。通常酵母的存在能有效提高白酒中酮类、酯类和酚类等挥发性化合物的浓度,从而提升白酒的感官品质。本研究通过纯培养技术从茅台镇高温大曲中分离得到212 株芽孢杆菌,其中大部分为B.sonorensis、B.licheniformis和B.amyloliquefaciens等。侯强川等[29]对茅台和尧治河高温大曲中细菌群落结构进行解析时亦发现Bacillus是高温大曲主要菌属,且不同地区和类型的高温大曲中Bacillus的相对含量存在明显差异。Wu Xue等[30]也证实了Bacillus对酱香型白酒中的风味物质具有较大的影响,在酱香型白酒发酵过程中具有广泛的应用。由此可见,通过对高温大曲中的芽孢杆菌进行分离、鉴定和保藏,可为后期菌株的开发利用做准备。
通过Binning技术共获得55 个高质量MAGs,其中有18 个疑似新菌株,主要为Bacillussp.、Lactobacillussp.和Weissellasp.等。本团队在前期研究中通过超高深宏基因测序技术发现房县小曲中存在一株疑似的新菌株Weissellasp.[31],并在后期实验中进行了验证,同时证明其在房县黄酒的发酵过程中扮演着重要的角色[32]。由此可见,通过超高深宏基因组测序结合Binning技术可以为新菌株的鉴定提供可靠技术支持。相关研究证实,真菌在酱香型白酒的发酵过程中起着至关重要的作用,对于其发酵进程和风味形成均有着积极影响[33]。值得注意的是,A酒厂高温大曲中芽孢杆菌的相对含量相较于B酒厂高温大曲明显较低,而这可能与酒曲的制作和发酵环境,以及微生物的相互作用有着紧密的联系[33]。对高温大曲中微生物的多样性进行分析发现,A酒厂高温大曲中微生物的多样性和丰富度均显著低于B酒厂高温大曲,两者微生物的菌群结构存在明显的差异。微生物的多样性与发酵过程中酵母的代谢活性有着密切联系,多样的微生物群落可以在发酵中利用不同底物,从而加速发酵的进行。侯强川等[29]研究发现不同地区采集的大曲中细菌的群落结果存在明显差异。由此可见,除地区因素外,酒曲的制作工艺也会造成高温大曲中微生物群落结构的差异。而值得注意的是,A酒厂高温大曲中微生物的群落结构较为相似,B酒厂高温大曲中微生物群落结构存在较大的差异,而微生物群落的不同组成可以影响酒的感官特性,使其呈现出个性化风味。
在功能方面,两种高温大曲存在多条差异代谢通路,其中在A酒厂高温大曲中显著较高的差异代谢通路大多与氨基酸的代谢相关,而B酒厂高温大曲中的差异代谢通路主要与L-鼠李糖的降解相关。相关研究发现L-谷氨酸和L-异亮氨酸降解加快不仅可以加速发酵的进程,促进酒精的产生,还可能在分解过程中产生香气化合物(如酯类、醛类和酮类等)和一些挥发性酸(如乙酸和丁酸等),从而赋予白酒特殊的芳香特征和口感[34-35]。L-鼠李糖的降解大多是由酵母菌完成,而更高的L-鼠李糖降解速率不仅可以加快发酵速率,产生更多的酒精和香气化合物,还可能产生一些代谢产物,提升酒体的稳定性[36]。由此可见,不同酒厂因其独特的曲种,可能塑造不同的酒体香味特征和口感。对部分差异代谢通路的进一步分析发现,同一代谢通路由多种微生物贡献。不同菌群的最适生长条件存在差异,且菌群在不同环境中生长状态也不相同,这也使得某些代谢途径容易受到环境影响,从而影响白酒的发酵进程。因此,当同一代谢通路由多种微生物贡献,不仅可以提升代谢效率,还可以提升其环境适应性,使得代谢通路表达能维持相对稳定,从而在一定程度上维持酒曲品质的稳定。综上所述,后续研究应进一步扩大酒曲的采样范围和数量,并结合全基因组测序技术进一步解析微生物在酱香型白酒发酵过程中的积极作用,为后期优良菌株的筛选和发酵工艺的改良提供必要数据支持。

