基于多尺度结构表征研究直链淀粉-番茄红素复合物的组装方式
赵文红,何 颖,宫兆海,关二旗,
(1.河南工业大学 国家粮食和物资储备局粮油食品工程技术研究中心,河南省重点实验室,河南 郑州 450001;2.山东鲁花集团有限公司,山东 莱阳 265229)
番茄红素是一种新型功能性食用色素,具有异戊二烯化学结构(图1)。基于其多双键结构(13 个不饱和双键),番茄红素具有强抗氧化活性,能够淬灭活性氧[1]、消除人体自由基[2]、增强机体免疫[3]等作用。流行病学调查显示膳食摄入番茄红素及其制品可有效降低血浆低密度胆固醇、延缓动脉粥样硬化、保护心血管并预防多种癌症[4]的发生。但番茄红素较差的物理化学稳定性和生物利用度制约了其在食品、药品及化妆品等领域的应用。利用改性糊精[5]、乳蛋白[6]以及植物蛋白-多糖复合物等制备番茄红素的负载体系能够较大程度提高番茄红素的水溶性改善其生物利用度[7]。Silva等[8]采用明胶-果胶复合材料为壁材制备番茄红素微胶囊,可高效封装番茄红素,但不能有效阻止贮存过程中番茄红素的降解;Pelissari等[9]的研究表明,在5 ℃真空贮存番茄红素脂质体90 d后,其中番茄红素的损失率达到60%;Tan Chen等[10]发现在4 ℃充氮贮存番茄红素脂质微粒20 d后,其中番茄红素的损失率为58%。因此,仍需开发新的番茄红素载体以改善番茄红素稳定性并拓宽其实际应用。

图1 全反式番茄红素的化学结构Fig.1 Chemical structure of lycopene
食品组分间通过主客体作用,利用主体结构特征形成主客体包结物,是保护内容物、改善产品稳定性的常用手段。目前包合物制剂多为环糊精类物质,利用其分子结构中的刚性空腔包埋客体分子。但由于番茄红素为长链型多不饱和碳氢结构,链长达4.0~6.8 nm,而环糊精为刚性结构,其包合效果受空腔直径(0.47~0.83 nm)和深度(0.79 nm)尺寸限制的影响[11]。因此,尚需进一步研究开发合适的复合载体,以保护内容物、促进产品稳定性。
淀粉为线性多糖,在解链再重排过程中可与客体自发地组装或聚集形成超分子复合物[12],因而作为柔性基材已被应用于敏感性活性成分的复合与保护中[13-14]。伍秀英[15]以多孔淀粉为壁材包埋番茄红素,提高了番茄红素的稳定性及其在食品体系中的分散性;Rocha等[16]使用改性淀粉复合番茄红素,其复合率(复合的番茄红素占番茄红素制备总量的比例)在21.01%~29.73%之间。前期实验发现:土豆来源的直链淀粉(聚合度(degree of polymerization,DP)约1000~6000)与玉米及小麦淀粉(DP为200~1200)相比具有更大的分子长度,因而更适用于番茄红素等长链物质的复合组装。本课题组前期采用土豆来源的直链淀粉为柔性基材,基于淀粉的回生过程,制备了直链淀粉-番茄红素复合物(amyloselycopene complexes,ALCs)。该复合物对番茄红素的复合率可达(81.42±0.63)%,与Ranveer等[17]采用蔗糖和明胶包封番茄红素的复合率(63.90%~82.20%)相当。ALCs在加速实验和常温避光贮存情况下能有效保持番茄红素的色泽、含量及抗氧化活性[18]。其中,室温避光保存28 d后,复合物中番茄红素的保留率可达(65.85±0.17)%,结果表明:ALCs能有效改善番茄红素的贮藏稳定性。但该复合物的精细结构及组装方式尚需进一步明确。本研究即在ALCs的制备基础上,采用扫描电子显微镜(scanning electron microscopy,SEM)观察复合物表面微观形貌;采用X射线衍射(X-ray diffraction,XRD)分析复合物结晶结构;采用差示扫描量热仪(differential scanning calorimetry,DSC)分析复合物的类型;采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)研究复合物中主客体复合类型;使用13C CP/MAS核磁共振(nuclear magnetic resonance,NMR)分析复合物的螺旋结构。通过分析表征复合物的表面微观结构、晶体结构、晶体类型、晶体构成(无定型、双螺旋和单螺旋),明确ALCs主客体可能的组装方式,以揭示其增强番茄红素稳定性的机制,以期为淀粉基番茄红素稳定制剂的制备提供理论依据,促进番茄红素作为功能性色素在食品、药品和材料等方面的应用。
1 材料与方法
1.1 材料与试剂
直链淀粉(土豆来源,75%)、番茄红素 上海源叶生物科技有限公司;蒸馏水由实验室自制;二甲基亚砜、无水乙醇(均为分析纯)天津科密欧仪器试剂有限公司。
1.2 仪器与设备
X Pert PRO型XRD仪 荷兰PANalytical公司;AVANCE III 400WB超导(固体)NMR仪 德国布鲁克公司;超声波仪 深圳德瑞超声仪器有限公司;MX-S涡旋振动器、MS-H280-Pro恒温磁力搅拌器 美国Scilogex公司;氮吹仪、DZF-6050真空干燥箱 上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 ALCs的制备
将300 mg直链淀粉分散于0.4 mL无水乙醇中,加30 mL蒸馏水溶解,95 ℃水浴5 min;将15 mg番茄红素溶于15 mL二甲基亚砜溶液中,保温至50 ℃备用;将直链淀粉溶液降温至50 ℃与番茄红素溶液混合,500 r/min搅拌2 h后,静置,程序降温至4 ℃冷藏6 h;经1500 r/min离心30 min,弃去上清液;加10 mL无水乙醇涡旋振荡1 min,2500 r/min离心25 min,弃去上清液,重复清洗2 遍,除去残余溶液和游离的番茄红素后真空干燥,即得ALCs。所有操作均在避光、避氧条件下进行。
1.3.2 ALCs复合指数(composite index,CI)的测定
采用碘蓝法测定ALCs的CI,以评价淀粉对番茄红素的复合作用。称取0.1 g样品分散于1 mL乙醇溶液中,加入9 mL 1 mol/L的NaOH溶液,于100 ℃水浴锅热处理10 min后定容至10 mL。取2 mL定容液依次加入3 mL 0.09 mol/L NaOH溶液、50 mL水、1 mL 1 mol/L乙酸溶液、1 mL实验用碘液,定容至100 mL;放置15 min后,在680 nm波长处测其吸光度。以直链淀粉为对照,根据吸光度的变化,通过式(1)计算其CI:
式中:A0为对照吸光度;A1为ALCs的吸光度。
1.3.3 ALCs的微观结构测定
室温条件下,采用SEM测定ALCs的微观结构。将样品均匀涂于薄层导电双面胶上,使用真空喷涂仪对样品喷金处理1 min,设置操作电压为3.00 kV,使用SEM观测复合物样品的微观形貌,分析样品的颗粒大小及其形状。
1.3.4 ALCs结晶结构的测定
室温条件下,采用XRD对ALCs进行测试,以表征复合物结晶结构。将样品均匀平铺于样品池中,置于XRD仪样品台中准备测试。设置测试参数为:铜靶CuKα(λ=0.1540598 nm),测试管压40 kV,测试管流40 mA,扫描范围(2θ)5°~36°,扫描速率2°/min,步长0.02°。使用MDI Jade 6.0软件计算相对结晶度。
1.3.5 ALCs结晶稳定性测定
通过DSC对ALCs(已干燥至恒定质量)进行热变分析,研究复合物类型。取3 mg样品置于铝盒中并加入7 μL蒸馏水,将铝盒压紧密封,室温放置12 h后,进行测试。将样品盘放置于样品台上,先将样品在25 ℃保持5 min,再以5 ℃/min升温至200 ℃,记录复合物样品的相变起始温度T0、峰值温度Tp、终止温度Tc,并计算焓变ΔH等热变参数。
1.3.6 ALCs中主客体复合类型测定
室温条件下对ALCs进行FTIR分析,以研究复合物中主客体复合类型。实验采用溴化钾压片法制样,将样品与溴化钾以1∶100比例混合,使用模具压片,设置背景为溴化钾和空气,扫描次数为64,分辨率为4 cm-1。
1.3.7 ALCs结构组成的测定
采用13C CP/MAS NMR测定ALCs的结构有序性。取干燥过的ALCs样品100 mg,用模具压实后密封置于样品管中,放置于仪器样品池中检测。设置参数为:接触时间13 ms,扫描速率20 Hz,扫描次数4096,谱宽38 KHz,检测频率100 MHz。
1.4 数据处理与分析
实验所得数据采用Origin 8.5软件和Microsoft Excel 2016软件制图,并用SPSS 20.0软件进行统计学处理,各项指标表示为,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 ALCs淀粉对番茄红素的包合效果
采用碘量法研究ALCs中淀粉对番茄红素的包合效果,其原理是基于热力作用下碘分子进入直链淀粉的疏水螺旋空腔形成复合物,根据淀粉和碘复合的程度,在680 nm波长处发生吸光度变化,蓝值越大,则复合程度越小。CI表示螺旋空腔中进入番茄红素的直链淀粉(复合)占直链淀粉总量的百分比。
本研究中ALCs的CI为(17.10±0.01)%,表明番茄红素存在进入直链淀粉螺旋空腔(约17%)中的行为,即直链淀粉可包合番茄红素形成复合物。Chen Bingyan等[19]采用莲子淀粉包合不同脂肪酸(C8~C18),其CI为54.60%~86.30%。与之相比,ALCs的CI相对较低,这是由于直链淀粉-配体复合物的包合效果取决于配体C链的长度[20]。与脂肪酸相比,番茄红素具有40 个碳的长异戊二烯结构,其链长可能太长而无法被直链淀粉完全包埋[19],仅部分碳链进入直链淀粉螺旋腔[21]。因此,需进行进一步结构表征以揭示直链淀粉-番茄红素的组装方式。
2.2 ALCs的微观结构
采用SEM观察直链淀粉、番茄红素及ALCs的微观结构,结果如图2所示,直链淀粉呈球状、椭球状和不规则块状,表面光滑有少许凹陷,颗粒间无黏连,粒径约为(10.5±0.5)μm(图2a);番茄红素呈规则的片层状结构(图2b);ALCs镜下观察可见不规则球状、表面有破损孔洞和凹陷,颗粒间基本无黏连(图2c1)。这与Fanta等[22]制备的直链淀粉-脂肪酸复合物具相似的微观结构;此外,ALCs的制备为湿热处理,因此可能对淀粉微观结构造成破坏,可见部分颗粒严重凹陷(图2c2);ALCs的完整球状颗粒粒径约为(17.5±0.8)μm,约为原直链淀粉的1.7 倍。Loksuwan[23]制备的木薯淀粉-β-胡萝卜素复合物也为2~18 μm之间的球形微晶。因此,与原淀粉颗粒相比,ALCs形成复合物后为粒径增大的不规则球状颗粒。

图2 直链淀粉(a)、番茄红红素(b)及ALCs(c)的SEM图Fig.2 SEM of amylose (a),lycopene (b) and ALCs (c)
2.3 ALCs的晶体结构
XRD图谱常用来反映样品的结晶类型,其中衍射尖峰通常反映完整的微晶晶体;而衍射宽峰反映不完整的、具有一定缺陷的晶体,这类破损的晶体称为亚微晶[24]。采用XRD仪对直链淀粉及ALCs进行衍射测定,以解析其结晶结构,结果见图3;并采用MDI JADE 6.0软件分析计算结晶度,研究其晶体结构含量,结果见表1。

表1 直链淀粉及ALCs的结晶度Table 1 Relative crystallinity (RC) of amylose and ALCs

图3 直链淀粉及ALCs的XRD图Fig.3 XRD patterns of amylose and ALCs
如图3所示,直链淀粉分别在15.18°、17.31°、18.02°、19.80°、23.04°和26.39°处存在衍射尖峰(图3a)。其中15.18°、17.31°、18.02°和23.04°这4 处衍射尖峰为A-型微晶的特征衍射峰,19.80°和26.39°处的衍射尖峰为B-型微晶的特征衍射峰,因此,直链淀粉表现为A+B-型晶体结构,其结晶度达(48.53±0.87)%;从ALCs衍射图谱中可见:与原淀粉相比,其衍射尖峰消失,在13°和20°处存在典型的衍射宽峰(图3b),这与前人研究制备的淀粉-脂肪酸复合物结构一致[25],具有典型的V-型晶体结构[26],结晶度为(65.32±0.22)%。已有研究表明,配体的存在利于V-型结构的形成[27],会引起淀粉B-型结构向V-型结构的转变[28];另外,其中的支链淀粉具有‘记忆’功能,经重结晶后仍形成数目基本固定的双螺旋结构[29]。XRD分析结果表明,基于直链淀粉的热特性,其回生再结晶过程中,由于番茄红素存在诱导形成V-型亚微晶结构复合物。
2.4 ALCs的晶体结构稳定性
从焓变的角度可分析复合物的结晶结构稳定性。本研究采用DSC分析研究直链淀粉和ALCs的热特性变化,其参数结果见表2。其中T0、TP、Tc反映样品晶体结构向无定型转变的温度变化,ΔH则表示破坏结晶结构产生的吸热焓变[30]。

表2 直链淀粉和ALCs的热特性参数Table 2 Thermal characteristics of amylose and ALCs
物质的热稳定性可以通过DSC曲线中的相变温度进行比较[31],其峰值温度Tp越高表明复合物的热稳定性越好[32]。由表2 可知,ALCs的峰值温度Tp为(122.43±0.41)℃,显著高于原淀粉((70.55±0.51)℃)(P<0.05)。以往的研究认为,通过糊化和重结晶过程形成的回生淀粉具有更好的热稳定性[33]。本研究中ALCs的制备即基于淀粉的糊化与重结晶过程,因此,与原淀粉相比,ALCs相变温度更高。
淀粉基复合物通常具有I型和II型两种类型的结构[25]。其中,I型复合物具有较低的T0(<100 ℃)和较低的糊化焓(ΔH),而II型复合物具有更高的T0(>100 ℃)和更高的ΔH[32,34]。由表2可见,ALCs的起始温度T0为(106.72±0.63)℃(>100 ℃),高于原直链淀粉的(67.14±0.67)℃。结果表明,ALCs为II型复合物,其结晶结构与原淀粉相比具有更好的稳定性。此外,ALCs的焓变ΔH为(138.92±0.85)J/g,显著大于淀粉的(11.61±0.39)J/g(P<0.05),说明与直链淀粉相比,更大的能量才能改变其晶体结构,因此,ALCs结构稳定性更高。
2.5 ALCs的分子结构
测定直链淀粉、番茄红素、两者混合物及ALCs的红外光谱,分析其分子基团结构,以研究ALCs中主客体的复合类型,结果见图4。在红外光谱图中,1164 cm-1处和930 cm-1处分别为淀粉的糖苷键C—O—C和α-1,4糖苷键的特征吸收峰;在1022 cm-1处的吸收峰用于表征淀粉的无定形结构[35]。与原淀粉相比,ALCs谱图中存在α-1,4糖苷键特征吸收(930 cm-1),同时1022 cm-1处无定型区的吸收峰收窄变尖。由2.1节碘蓝法检测淀粉对番茄红素的复合结果可知,回生过程中分子重排,客体番茄红素可进入淀粉螺旋空腔,占据约17%的结合点,形成螺旋有序结构,因此,ALCs可能具有更好的结晶结构。该变化与2.3节的相对结晶度分析结果相印证,ALCs结晶度((65.32±0.22)%)高于原淀粉((48.53±0.87)%)。

图4 直链淀粉、番茄红素及其混合物和ALCs的FTIR Fig.4 FTIR of amylose,lycopene,their mixture and ALCs
1640 cm-1处为—CH=CH—特征伸缩振动峰,1674 cm-1处为C=C伸长振动吸收峰,960 cm-1处为反式单烯双取代的R1HC=CR2H(反式)摇摆振动吸收峰,该处吸收为番茄红素的特征吸收[36]。与物理混合物相比,ALCs的红外吸收光谱中未观察到960 cm-1处的番茄红素特征吸收峰。这是由于特征吸收峰会保留在两种材料的物理混合物中[37];而在主客体形成的包合物中,其FTIR表现为客体分子原有的特征峰发生位移、减弱或消失[38]。Liu Benguo等[21]对环糊精-木犀草素的结构表征中观察到木犀草素的B环插入β-CD的空腔中形成包合物,其配体分子的原始特征吸收峰的消失。本研究中番茄红素(R1HC=CR2H)在960 cm-1处的光谱特征消失,同时,ALCs的红外光谱中未出现新的吸收峰。由此推断,直链淀粉与番茄红素可能发生了主客体复合作用,通过氢键、疏水相互作用和其他分子间作用力形成了ALCs,从而掩盖了番茄红素的特征吸收。FTIR结果表明,直链淀粉经热处理后晶体结构发生变化,包合配体番茄红素形成ALCs。
2.6 ALCs的结构组成
固体NMR谱图中峰的化学位移能够反映物质短程有序的结构信息,进而可分析其精细结构组成。本研究采用13C CP/MAS NMR检测分析直链淀粉及ALCs的短程有序结构,结果见图5。ALCs和直链淀粉的NMR谱出峰位点结果见表3。ALCs与经典的淀粉NMR谱图具有相似的出峰位点[39]。其中,C1在δ90~110处,δ70~79为C2,3,5的化学位移,δ80~84为C4的化学位移,δ58~65为C6的化学位移。13C NMR谱可解析关于淀粉的结晶区和无定形区的信息,由ALCs的13C CP/MAS NMR谱图可见,ALCs在δ100.41处显示明显出峰,该吸收峰在δ100.3附近说明ALCs含有V-型结构[40];同时,由于A-型和B-型结构在C1区分别表现为三重峰和双峰[41],ALCs NMR谱图中在C1区信号强峰右侧δ98~103处谱峰顶部较宽,并分别在δ97.01和δ102.85处有小突起峰,另在δ92~98区间的δ94.49处有一小峰,表现为混合图谱特征,说明ALCs结构中同时还含有A-/B-型晶体结构。固体NMR谱图谱结果表明,ALCs主要表现为V-型晶体结构,同时含有部分A-/B-型结构。

表3 直链淀粉及ALCs在13C CP/MAS NMR谱图的出峰位点Table 3 Peak positions of amylose and ALCs in 13C CP/MAS NMR spectra

图5 直链淀粉(a)及ALCs(b)的NMR有序亚谱图和无序亚谱图Fig.5 Ordered and disordered NMR sub-spectra of amylose (a) and ALCs (b)
为进一步明晰其分子结构,ALCs的NMR谱图经Solver工具处理后得到无序亚谱和有序亚谱,并采用Peak Fit软件对分解得到的无序亚谱、有序亚谱进行分峰拟合后(拟合谱图系数R2≥0.999),分析计算其双螺旋结构、单螺旋结构及无定形态结构含量组成。如表4所示,ALCs各结构组成及排序为:双螺旋((55.95±3.25)%)>无定形态((26 .21 ± 2 .44 )% )>V-型单螺旋((17.84±0.96)%)。首先,ALCs含有(17.84±0.96)% V-型单螺旋结构,验证了2.2节XRD分析所得ALCs具有V-型亚微晶复合结构的结果;其次,其有序(螺旋)结构占比高达73.79%,因此与原直链淀粉相比,ALCs具有更好的结构稳定性,该结果与DSC热变分析结果一致。13C CP/MAS NMR分析结果表明,直链淀粉包合番茄红素形成了V-型螺旋结构,且番茄红素与直链淀粉可能发生分子链缠绕从而使ALCs的双螺旋结构含量增加。

表4 直链淀粉和ALCs的结构组成Table 4 Structural compositions of amylose and ALCs
3 讨论
在当今“后疫情”时代,人们的健康意识普遍提升,食品加工也加速朝着“美味、营养、健康”的方向发展。番茄红素以食品添加剂、医药原料等形式应用,是一种极具潜力的新型功能性食用色素。加拿大卫生部于2017年8月批准番茄红素作为食品着色剂用于糖果、果酱、乳品饮料、肉制品、冰淇淋等系列食品(NOM/ADM-0099),并于2020年3月批准其在非碳酸甜味水基饮料和运动饮料中使用(NOM/ADM-0143);而我国国家卫生健康委员会发布《2021年第2号公告》进一步扩大番茄红素的使用范围,允许其在糖果和半固体复合调味饮料中使用;《保健食品原料 番茄红素》标准征求意见稿也于2022年2月25日发布。但番茄红素易受光照、氧气、温度和金属等的影响,造成分解及损失[42],制约了其在食品、药品及化妆品等领域的应用。因此,改善番茄红素的稳定性是目前应用中亟待解决的问题。
淀粉是广泛存在于谷类、豆类植物果实及植物块茎中的一种碳水化合物。其中,直链淀粉具有线性结构,在施加的外力(热处理、溶剂处理、超高压等)作用下,其分子内氢键相互作用、链状结构旋转,形成了疏水性的左手螺旋空腔结构;配体分子便可借助疏水作用力进入空腔与其复合[43],形成左手单螺旋结构[44];同时分子间重排可形成双螺旋晶体结构。基于直链淀粉的内络合作用可制备淀粉-配体超分子体复合物,不同的复合客体包括β-胡萝卜素[11]、咖啡酸[45]、儿茶素[46]、姜黄素[12]、酶类及脂肪酸等。因此,直链淀粉可作为柔性基材用于敏感活性物质的保护、改善其稳定性。
淀粉基复合物具有不同的晶体结构。Le等[47]发现C3至C20系列线性饱和脂肪酸的淀粉基复合物可形成V6I、V6II和V73 种晶型;Kong Lingyan等[48]的研究表明抗坏血酸棕榈酸酯与直链淀粉形成V-型复合物;而Biais等[49]制备的直链淀粉与香气化合物复合物分别为V6I型和V6III型复合结构,即大部分客体分子进入螺旋腔而小部分被截留于螺旋结构间的缝隙中。基于淀粉性质和前期研究对淀粉基番茄红素复合物可能的组装方式理论推测为:番茄红素进入到直链淀粉分子的左手螺旋体结构空腔内形成VI型包合物(图6a);截留于淀粉结构间隙形成V6III型络合物(图6b);还可能与散乱的淀粉链相互缠绕形成凝聚物(图6c)。不同淀粉基复合物的组装尚需进一步通过结构表征等研究揭示。

图6 淀粉基复合物可能的组装方式Fig.6 Possible assembly mode of starch based complex
本研究基于直链淀粉可在热力作用下包合客体分子制备ALCs,并对其微观结构、分子结构及精细结构组成进行表征与分析。由碘量法检测可知,复合物中淀粉对番茄红素的CI为(17.10±0.01)%,表明番茄红素可能占据约17%的淀粉螺旋空腔形成包合;复合物颗粒间无明显黏连,呈直径约为17 μm的球状微晶(图2);其在13°和20°处显示为衍射宽峰,这是由于直链淀粉在番茄红素存在情况下,经热处理后其A+B-型晶型转变为V-型亚微晶包合结构(图3),其复合物晶体结晶度可达(65.32±0.22)%(表1);复合物的热变参数峰值温度Tp均高于100 ℃(表2),为稳定结构的II型晶体,因而ALCs具良好的热稳定性;红外光谱显示ALCs可能为包合型复合物,表现为其中的番茄红素特征吸收峰的减弱和消失(图4);13C CP/MAS NMR分析可见ALCs各结构组成(图5),其排序为:双螺旋(55.95%)>无定形态(26.21%)>V-型单螺旋(17.84%)(表4)。因此,基于表征结果推测其组装方式为:直链淀粉在受热后再重排结晶过程中部分包合番茄红素形成V-型螺旋结构;同时,番茄红素与直链淀粉发生分子链缠绕形成双螺旋结构。ALCs主客体组装方式见图7。
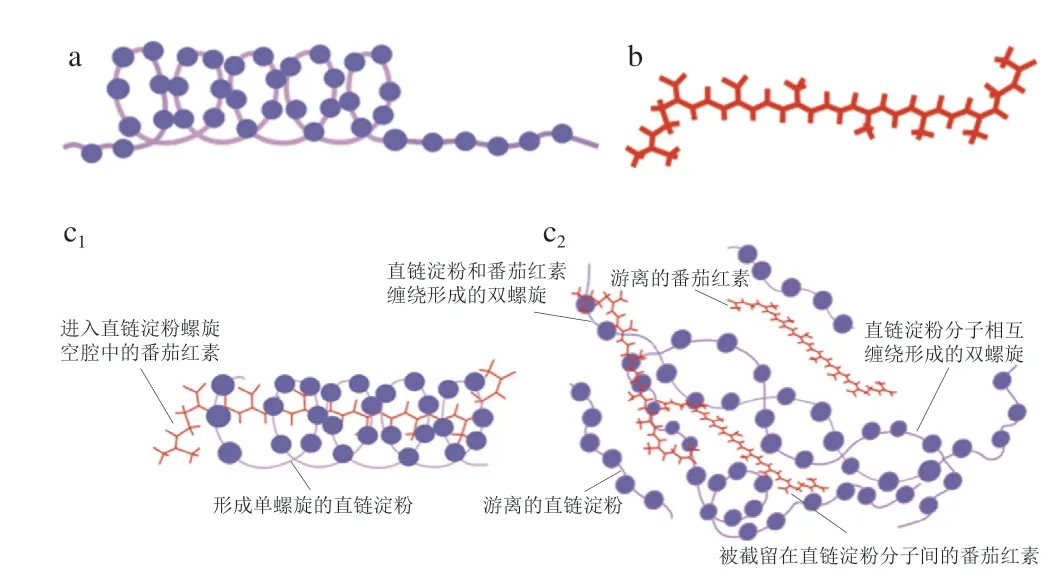
图7 ALCs的主客体组装方式Fig.7 Host-guest assembly mode of ALCs
4 结论
本研究基于多尺度结构表征研究ALCs的组装方式。研究结果表明:番茄红素进入淀粉螺旋空腔,占据约(17.10±0.01)%的结合位点形成ALCs;ALCs为球形亚微晶的II型复合结构;ALCs中淀粉与番茄红素存在主客体间复合作用,形成V-型单螺旋结构。因此,土豆来源的直链淀粉可通过包合和缠绕番茄红素,组装形成热稳定的复合结构。本研究阐明了ALCs的组装方式,揭示了淀粉基复合物改善番茄红素稳定性的机制,可为拓展番茄红素作为功能性色素在食品和药品领域的应用提供理论依据。

