特丁基对苯二酚在不同油脂贮存过程中转化产物的识别、分离与鉴定
徐梦琪,祝振杰,陈小军,李 军,毕艳兰,
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.中原食品实验室,河南 漯河 462300;3.河南启亿粮油工程技术有限公司,河南 郑州 450001)
油脂氧化是造成油脂及富油食品品质劣变的主要因素之一,添加抗氧化剂可有效延缓脂质氧化并延长货架期。具有代表性的合成抗氧化剂特丁基对苯二酚(tertbutylhydroquinone,TBHQ)具有优良的抗氧化效果[1-3],GB 2760—2014《食品添加剂使用标准》中规定在油脂中最大添加量为200 mg/kg。TBHQ在油脂中发挥抗氧化作用的机理是酚羟基提供氢质子与油脂中的自由基(R·、RO·或ROO·)反应,自身形成稳定的自由基共振体,阻断自由基链式反应[4-6]。因含有两个活泼的酚羟基,油脂中的TBHQ在贮存过程中易发生转化导致其含量降低[7]。
研究发现大豆油和猪油在室温条件下贮存2 个月后,TBHQ的检测量比实际添加量分别减少了11%和56%[8]。食品企业也常有检测到的油脂中TBHQ实际含量与其标识添加量不符的现象,例如熔点为33 ℃的棕榈油作为煎炸用油时常加入TBHQ延缓氧化[9],为了方便使用,通常会以60 ℃保温运输贮存。在煎炸使用前检测到TBHQ含量仅为初始添加量的10%~80%,企业会质疑TBHQ的含量降低导致其抗氧化效果不能保障油脂使用过程中的品质。因此,TBHQ在油脂贮存条件下的转化逐步被关注。
在高温加热条件下,关于油脂中TBHQ损耗的研究很多,其结论是加热情况下TBHQ以挥发和转化的形式损耗,主要转化产物是叔丁基对苯醌(2-tert-butyl-1,4-benzoquinone,TBBQ)[10-12],挥发产物包括TBHQ和TBBQ[13]。但是目前关于油脂常温贮存条件下TBHQ转化情况的研究较少。Li Jun等[14]研究发现在常温贮存过程中,TBHQ也会缓慢损失,添加200 mg/kg TBHQ的猪油贮存8 周,TBHQ转化为TBBQ的量为48.02 mg/kg,且TBHQ和TBBQ含量总和比原始添加量减少了16 mg/kg。随着常温贮存时间的延长,TBHQ的减少量大于TBBQ的生成量,这说明常温贮存的油脂中TBHQ的转化产物除了TBBQ外,可能还生成了新物质,这个假设在2019年被Xu Xiaolan等[15]研究证实,其发现在室温贮存下含TBHQ猪油(不含任何天然抗氧化剂)中分离出TBHQ另一种转化产物2-(2-甲基烯丙基)氢醌(2-methylallylhydroquinone,MAHQ),而MAHQ是否也在其他油脂中存在,并且是否会受油脂中的天然抗氧化剂影响,目前鲜见研究报道。
因此,本研究选用含有生育酚的大豆油[16]、含有生育酚和生育三烯酚的棕榈油[17]以及猪油作为原料,研究贮存过程中TBHQ在不同油脂中的转化情况,识别和鉴定TBHQ转化产物,并对其结构进行表征,考察不同种类油脂中TBHQ转化产物是否一致,旨在为科学应用TBHQ提供理论依据。
1 材料与方法
1.1 材料与试剂
精制食用猪油(不含任何抗氧化剂)天津九源油脂有限公司;一级大豆油(不含任何外源抗氧化剂)山东香驰控股有限公司;煎炸用棕榈油(不含任何外源抗氧化剂)白象食品股份有限公司;TBHQ(纯度>98%)阿拉丁试剂(上海)有限公司。
甲醇、正己烷(均为色谱纯)上海麦克林生化科技有限公司;氘代甲醇(纯度≥99.8%)剑桥同位素实验室公司;其余试剂均为国产分析纯。
1.2 仪器与设备
8890气相色谱仪(配有氢火焰离子化检测器及OpenLAB CDS色谱工作站)、1290液相色谱-质谱联用仪(配有电喷雾电离源(electro-spray ionization,ESI))、Mass Hunter Workstation数据处理系统 美国Agilent公司;AVANCE III 500MHz核磁共振(nuclear magnetic resonance,NMR)波谱仪、INVENIO S傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR)瑞士Bruker公司;TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;Rancimat 892油脂氧化稳定性分析仪 瑞士万通科技公司。
1.3 方法
1.3.1 原料油脂基本理化指标
参照GB 5009.168—2016《食品中脂肪酸的测定》、GB 5009.229—2016《食品中酸价的测定》、GB 5009.227—2016《食品中过氧化值的测定》分别测定脂肪酸含量、酸价和过氧化值。氧化诱导期的测定参考GB/T 21121—2007《动植物油脂 氧化稳定性的测定》,参数设置:空气流量:20 L/h;加热温度:110 ℃;样品质量:(3.00±0.01)g;测量池蒸馏水用量:60 mL。生育酚含量的测定参考AOCS Official Method Ce 8-89Determination of Tocopherols and Tocopherols in Vegetable Oils and Fats by HPLC,色谱柱:Sun Fire Prep Silica柱(4.6 mm×250 mm,5 µm);流动相正己烷-异丙醇(99∶1,V/V);进样量:20 µL;流速:0.8 mL/min;柱温:30 ℃;荧光检测器:发射波长330 nm,激发波长290 nm。
1.3.2 油样的配制
分别取一定量的大豆油、猪油(于55 ℃水浴至完全融化)和棕榈油(于60 ℃水浴至完全融化),准确称取0.1 g(精确至0.1 mg)TBHQ溶于499.9 g上述油脂中,准确称取1.25 g(精确到0.1 mg)FeCl3·6H2O溶解于50 mL盐酸溶液中,得到Fe3+质量浓度为0.5 g/100 mL的溶液。使用移液管准确量取上述Fe3+溶液0.1 mL于油样中得到含1 mg/kg Fe3+的油样。混合均匀后分别密封保存在塑料(大豆油)和玻璃(猪油、棕榈油)样品瓶中,大豆油和猪油室温((20±5)℃)贮存,棕榈油60 ℃保温贮存。
1.3.3 油样中TBHQ及其转化产物的提取
油样中TBHQ及其转化产物的提取方法参考美国分析化学家协会的标准方法和杨李胜等[18]的萃取方法,结合本实验作出调整,准确称取(2.00±0.01)g油样于试管中,分3 次加入10 mL色谱级甲醇(4、3、3 mL),封口涡旋3 min,然后4 ℃、3000 r/min离心5 min,移取上清液定容至10 mL,封口置于-18 ℃冰箱中冷冻保存4 h去除多余脂质,吸取上清液过0.22 μm有机滤膜后装入气相小瓶,待气相色谱测定。
1.3.4 油样中TBHQ及其转化产物的检测
油样中TBHQ及其转化产物的检测方法采用气相色谱法,参考Cacho[19]、叶沁[20]、周珏[21]等的气相色谱条件:HP-5毛细管柱(30 m×320 μm,0.25 μm);升温程序:起始温度60 ℃,保持2 min,然后以10 ℃/min升温至250 ℃,保持2 min;载气:氮气,纯度99.999%,流速1 mL/min;进样口温度:230 ℃;进样量:1 μL;进样方式:不分流进样;检测器:火焰离子化检测器;检测器温度:250 ℃;空气流速:300 mL/min;氢气流速:30 mL/min;氮气流速:25 mL/min。
1.3.5 油样中TBHQ及其转化产物的分离纯化
油样中TBHQ 及其转化产物的分离纯化采用制备型液相色谱(preparative liquid chromatography,Prep-LC)技术,参考彭毓敏等[22]的方法,结合本实验作出相应调整。采用Waters 2545制备液相色谱仪;检测器:Waters 2489紫外检测器;色谱柱:XBridge Prep C18(19 mm×250 mm,5 μm);流量:5 mL/min;进样量:300 μL;紫外检测波长:280 nm;柱温箱:35 ℃。流动相:溶剂A是水,溶剂B是甲醇,等度洗脱:流动相A为60%,流动相B为40%;洗脱时间:20 min。将对应色谱峰的物质使用馏分收集器收集于10 mL玻璃试管中,待分析。
1.3.6 油样中TBHQ及其转化产物的鉴定与表征
1.3.6.1 超高效液相色谱-四极杆-飞行时间质谱(ultrahigh performance liquid chromatography-quadrupole-time of flight-mass spectrometry,UPLC-Q-TOF-MS)分析
使用UPLC-Q-TOF-MS分析TBHQ及其在油脂中转化产物的准确相对分子质量以及离子碎片信息,参考倪冰冰[23]和Shin[24]等的方法,结合本实验作出相应调整。液相色谱条件如下,色谱柱:ZORBAX Eclipse Plus C18柱(50 mm×2.0 mm,1.8 μm);流动相A:水,流动相B:乙腈;流速:0.3 mL/min;等度洗脱:流动相A 40%,流动相B 60%;柱温箱:35 ℃;进样量:1 μL。
质谱参数如下,离子源:ESI;离子模式:负离子,MS和MS/MS两种模式;毛细管电压:3500 V;Fragmentor电压:175 V;喷嘴电压:1000 V;鞘气温度:350 ℃,流速:11 L/min;干燥器温度:200 ℃,流速:12 L/min;碰撞电压:25~40 V;ESI扫描范围:50~500。
1.3.6.2 NMR分析
样品预处理:取纯化后的TBHQ、TBBQ和化合物1、2、3溶解于0.6 mL氘代甲醇,完全溶解后转移至核磁管内。仪器:AVANCE III 500 MHz;温度:298 K;一维氢谱:采用30°小角度激发,空扫两次,采样扫描128 次;一维碳谱:采用组合脉冲去耦,空扫4 次,采样扫描1024 次[25]。
1.3.6.3 紫外光谱分析
取纯化后的TBHQ、TBBQ和化合物1、2、3用甲醇配制成20 mg/L工作液,紫外分光光度计设置波长间隔为1 nm,波长范围为200~400 nm,扫描速度为快速,以甲醇为参照对基线进行校正,将待测油样装入石英比色槽2/3高度处进行光谱扫描,得到模拟曲线。
1.3.6.4 FTIR分析
取纯化后的TBHQ、TBBQ和待测物于真空干燥箱中烘干,并按1∶100比例与KBr充分研磨,再压制成均匀透明薄片,采用FTIR测定,扫描范围4000~400 cm-1、分辨率4 cm-1、连续扫描次数32 次,得到模拟曲线。
1.4 数据处理
2 结果与分析
2.1 原料油脂脂肪酸组成及主要理化指标分析
由表1、2可知,所选用原料油脂初始理化指标均符合GB/T 8937—2006《食用猪油》、GB/T 1535—2017《大豆油》和GB/T 15680—2009《棕榈油》的规定,且所选用原料油脂的脂肪酸组成和生育酚组成及含量均符合其典型特征。因此,所选原料油脂用作分析油脂中TBHQ转化情况具有一定代表性。

表1 猪油、大豆油和棕榈油主要脂肪酸组成相对含量及其基本理化指标Table 1 Fatty acid composition and basic physicochemical indexes of lard,soybean oil,and palm oil
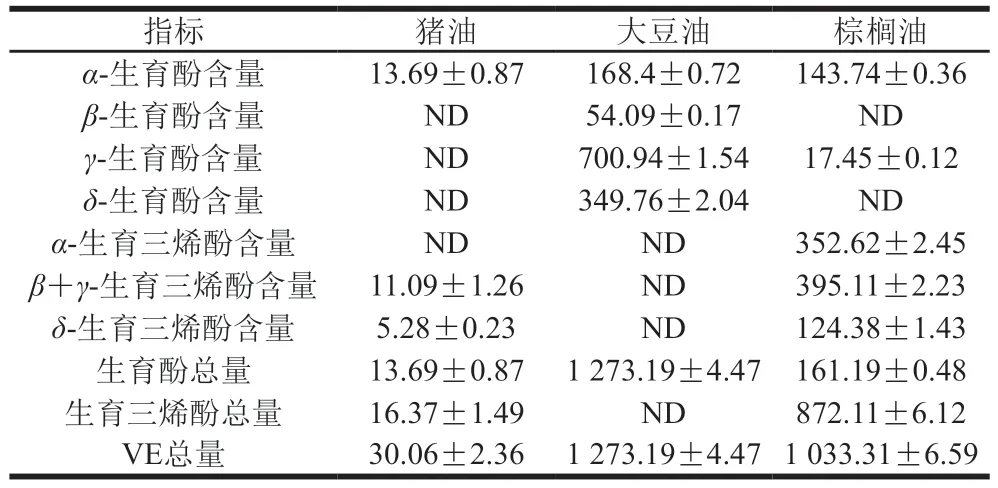
表2 猪油、大豆油和棕榈油中生育酚和生育三烯酚组成及含量Table 2 Compositions and contents of tocopherol and tocotrienol in lard,soybean oil,and palm oil mg/kg
2.2 贮存过程中猪油、大豆油和棕榈油中TBHQ以及TBBQ含量的变化
将添加200 mg/kg TBHQ的猪油、大豆油在室温下贮存,添加200 mg/kg TBHQ的棕榈油在60 ℃下保温贮存6 个月,并使用气相色谱法检测贮存期间各油脂中TBHQ剩余量及TBBQ生成量,结果如图1所示,随着贮存时间的延长,猪油、大豆油和棕榈油中TBHQ含量均呈下降趋势(P<0.05),TBBQ含量呈缓慢上升趋势(P<0.05)。大豆油、猪油和棕榈油中TBHQ含量最初分别为(201.4±1.2)、(201.2±1.2)、(203.6±0.3)mg/kg,在贮存3 个月时TBHQ 和TBBQ 含量之和分别为(163.8±0.7)、(168.1±0.9)、(170.0±2.3)mg/kg,在贮存6 个月时TBHQ 和TBBQ 含量之和分别为(130.1±0.9)、(125.5±0.7)、(131.6±0.7)mg/kg。观察发现,随着时间的延长,TBHQ和TBBQ含量之和越来越小,这表明贮存条件下油脂中TBHQ的转化产物不仅有TBBQ,还有可能存在其他的转化产物。

图1 贮存90 d和180 d后大豆油、猪油和棕榈油中TBHQ和TBBQ含量变化Fig.1 Changes in TBHQ and TBBQ contents in soybean oil,lard and palm oil after storage for 90 and 180 days
2.3 大豆油、猪油和棕榈油中TBHQ转化产物的分离与鉴定
为加速TBHQ在油脂中转化,更加直观了解其在油脂中转化规律,添加Fe3+促进转化进程。将贮存180 d不含TBHQ大豆油、添加有200 mg/kg TBHQ大豆油和添加有200 mg/kg TBHQ+1 mg/kg Fe3+大豆油分别经色谱甲醇提取,经冷冻离心去除多余脂质后与TBHQ和TBBQ标准品进行气相色谱分析,由图2A可知,TBHQ和TBBQ标准品在气相色谱中保留时间分别为12.26 min和8.08 min,含TBHQ大豆油的气相色谱图中除了出现TBHQ和TBBQ的峰外,还出现了另一未知化合物(保留时间12.16 min)(以下称化合物1),在添加有1 mg/kg Fe3+的样品中化合物1含量明显增加,因此,初步推断有新的化合物产生,但是否为Xu Xiaolan等[15]鉴别出的MAHQ,需要进一步研究。图2B、C表明,在贮存180 d不含TBHQ猪油和棕榈油、添加有200 mg/kg TBHQ猪油和棕榈油以及添加有200 mg/kg TBHQ+1 mg/kg Fe3+猪油和棕榈油的甲醇提取液中发现与大豆油中保留时间相同的未知峰(将猪油、棕榈油中未知色谱峰分别记为化合物2和化合物3)。通过Prep-LC技术分别分离纯化出TBHQ、TBBQ和化合物1、2、3,纯化后的化合物1、2、3的气相色谱图中保留时间与图2中未知峰保留时间匹配。

图2 贮存180 d油的甲醇提取液气相色谱图Fig.2 GC chromatograms of oils and fats stored for 180 days
利用UPLC-Q-TOF获得经Prep-LC纯化后的TBHQ、TBBQ和化合物1、2、3的一级、二级质谱图。首先,将质谱数据通过Mass Hunter Workstation软件进行初步处理,采用Qualitative Analysis软件,由提取离子流图和一级高分辨质谱信息获得各物质的保留时间以及准分子质量,结合质谱数据与本地谱库进行匹配,结果如图3所示。TBHQ、TBBQ和化合物1、2、3一级质谱图显示基峰质荷比m/z分别为165.0917、163.1134和163.0131、163.0136、163.0690 [M-H]-的准分子离子峰,从而得到它们的分子质量分别为166、164、164、164、164。化合物1、2、3分子质量相同且与MAHQ的分子质量吻合,分析二级质谱图对比发现碎片离子与Xu Xiaolan等[15]研究结果一致。
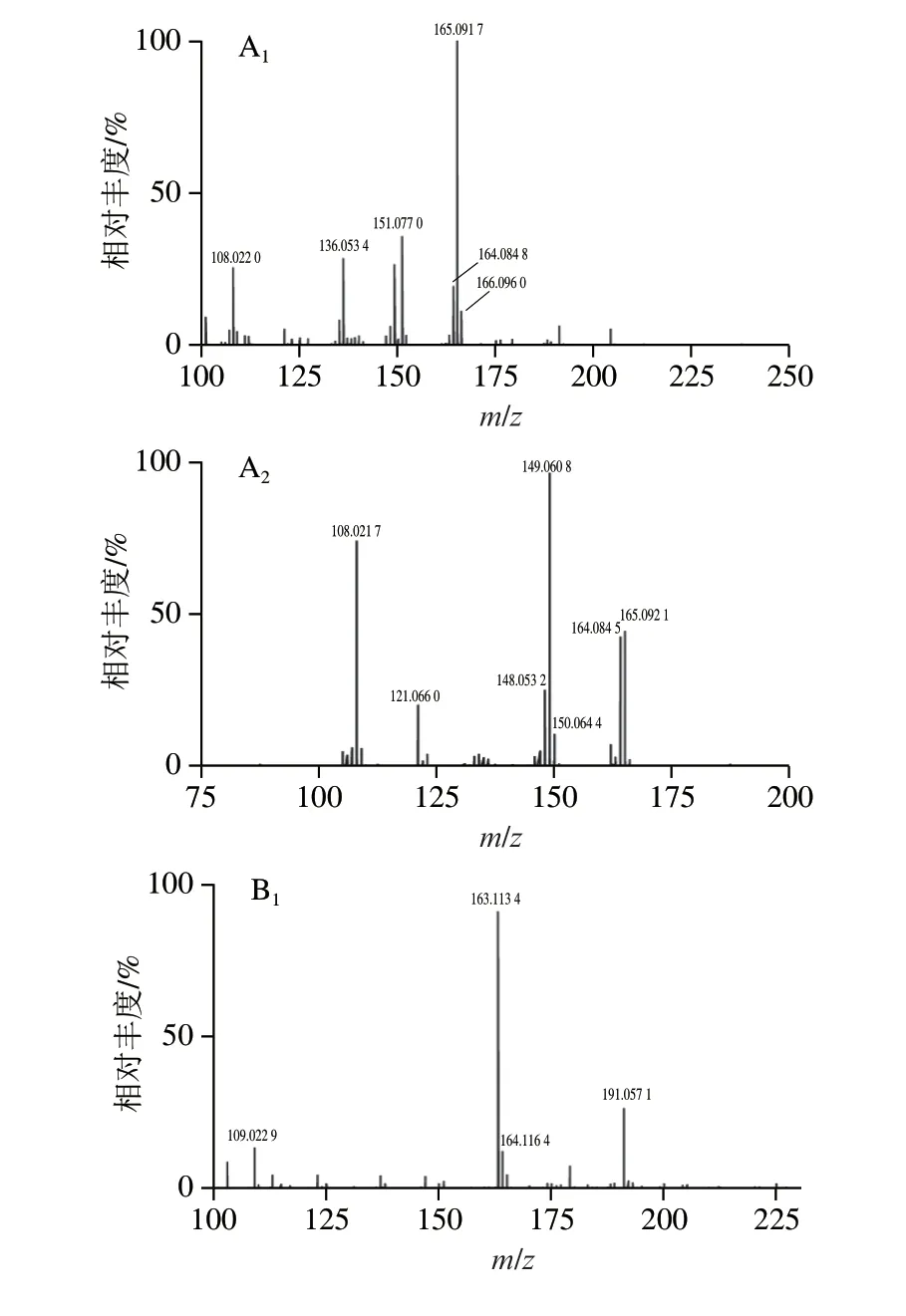

图3 TBHQ、TBBQ及转化产物质谱图Fig.3 Mass spectra of TBHQ,TBBQ and conversion products
为了进一步验证该化合物1、2、3是否均为MAHQ,将纯化后的物质溶解于氘代甲醇中进行NMR分析。图4为TBHQ、TBBQ和未知化合物1、2、3的NMR谱图。分析图4C~E可知,三者NMR谱图一致,对比TBHQ(图4A1)及TBBQ(图4B1)1H-NMR谱图,TBHQ与化合物1均在δ6.5~7.0附近出现苯环上H的化学位移,而在烷基取代基部分H化学位移有所不同。TBHQ的叔丁基取代基上H的化学位移相同,因此H的化学位移均为δ1.35,且响应较高;同样,TBBQ的叔丁基取代基上H的化学位移均为δ1.28,而MAHQ的烷基取代基为甲代烯丙基,其双键上的H化学位移为δ3.24,甲基上H的化学位移为δ1.70。综上分析可知,化合物1、2、3为同种物质且NMR谱图与Xu Xiaolan等[15]研究的MAHQ吻合,由此说明在含TBHQ大豆油、猪油和棕榈油的甲醇提取液中确实存在MAHQ。

图4 TBHQ、TBBQ及转化产物的NMR谱图Fig.4 NMR spectra of TBHQ,TBBQ and conversion products
2.4 TBHQ、TBBQ及MAHQ结构表征分析
由图5可知,TBHQ和MAHQ的分别在294 nm和297 nm出现中等强度吸收峰,250~300 nm是苯环B吸收带的特征吸收,这是由n→π*和π→π*跃迁形成[26],由此进一步表明两者均具有苯环结构。而TBBQ较大吸收峰出现在248 nm,这是由于醌结构中双键的吸收峰。三者在200 nm附近均出现较强的紫外吸收峰,这是由烷基上电子σ→π*跃迁形成[27]。

图5 TBHQ、TBBQ和MAHQ的紫外光谱图Fig.5 UV spectra of TBHQ,TBBQ and MAHQ
由图6可知,TBHQ和MAHQ分别在3254 cm-1和3264 cm-1出现较强吸收,这是由苯环上O—H伸缩振动产生[28-29];在1442 cm-1和1473 cm-1出现较强吸收,这是由C—O原子之间的伸缩振动产生,两者为酚的特征吸收峰。TBHQ、TBBQ和MAHQ分别于2963、2979、3038 cm-1处出现苯环上C—H伸缩振动,于1591、1648、1641 cm-1处出现苯环的环伸缩振动。900~1200 cm-1为三者苯环上取代基吸收峰[26,30]。综上分析,TBHQ在油脂中的另一转化产物MAHQ与TBHQ相比,苯环结构依然存在,且仍存在两个酚羟基,但在苯环上取代基的部分有所不同。
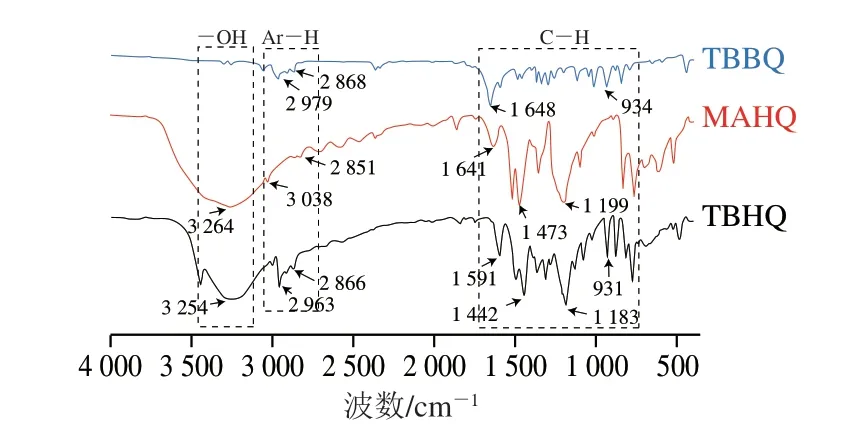
图6 TBHQ、TBBQ和MAHQ的FTIR图Fig.6 FTIR spectra of TBHQ,TBBQ and MAHQ
3 结论
添加TBHQ的猪油、大豆油和棕榈油经贮存一段时间后,TBHQ较原始添加量明显下降,分析得出TBHQ在油脂贮存过程中的转化产物除了TBBQ,还存在MAHQ,且加速油脂氧化后两种转化产物含量均明显增加。TBBQ属于醌类物质,叔丁基取代基未发生变化;MAHQ和TBHQ都是含有两个羟基的酚类物质,而MAHQ苯环上的取代基是甲代烯丙基。由于油脂种类不同,相同时间下TBHQ的转化程度不同,TBBQ与MAHQ生成量也不同。

