不同添加物结合真空渗透处理对冻藏虾仁肌原纤维蛋白稳定性的影响
罗翌元,陈 梁,齐 贺,张 宾,2,房传栋,
(1.浙江海洋大学食品与药学学院,浙江 舟山 316022;2.浙江海洋大学比萨海洋研究生学院,浙江 舟山 316022)
南美白对虾(Litopenaeus vannamei)因其肉质肥美、营养丰富,备受国内外消费者喜爱。由于其酶系发达,死后极易腐败,目前南美白对虾产品主要以冷冻全虾、冷冻虾仁等制品为主。低温冷冻不仅可以抑制南美白对虾中大多数微生物的生长与繁殖,钝化其体内内源酶活性,使其能够长期保存。然而,随着冻藏时间的延长,南美白对虾会出现褐变、汁液流失、口感变差等严重品质劣变现象[1]。利用抗冻剂处理虾仁可有效延缓劣变现象的发生,目前,常见的抗冻剂包括糖类、盐类、蛋白水解类及抗冻蛋白这四大类[2],其中,水产品中常用的抗冻剂为糖类与盐类。
大量研究表明,焦磷酸钠、三聚磷酸钠等磷酸盐可以减少冷冻产品在解冻过程中的损失以及增加鲜活水产品的持水能力,达到改善产品的功能特性及质构特性等目的[3-4],目前已被广泛使用在各类水产品中。然而,过量磷酸盐会使虾仁产生金属涩味,且会影响人体对钙的吸收,导致体内钙磷比例失衡、骨质疏松,加重患心血管和肾脏疾病的风险[5],因此以糖类作为磷酸盐代替品,研究其在水产品中的使用屡有报道。糖类添加物可以对冻藏南美白对虾起到良好的低温保护作用[6],虾仁经其浸泡处理后,可束缚水产品肌肉蛋白质分子表面的结合水,以稳定蛋白质结构、抑制蛋白质变性[7]。前期研究发现,海藻糖、海藻胶寡糖、卡拉胶寡糖可以有效防止虾仁肌肉蛋白质冷冻变性、抑制冷冻冰晶重结晶过程、降低冷冻贮藏中虾仁品质劣变程度[8-9]。因此,本实验选用以上3 种糖类对冻藏虾仁进行处理。
由于虾仁含水量较高,添加物使用普通的浸泡处理浸入虾仁速率较慢,其抗冻保护效果仍有待进一步增强。真空渗透技术是利用真空的压力差引起的流体动力学和变形松弛现象,使得被处理物料内部的气体和液体流动起来,从而实现更好的渗透效果[10-12],在食品的加工及保藏方面具有重大意义[13-14]。真空渗透处理具有渗透时间短、渗透率高等特点[15],在抽真空的作用下,使糖类物质与原先组织中的水分发生置换,有效增大糖类物质的浸入率。目前,关于利用真空渗透处理对虾仁热力学特性、虾仁肌原纤维蛋白稳定性的影响鲜有报道,故而本研究以南美白对虾虾仁为对象,选用焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖、卡拉胶寡糖结合真空渗透技术处理虾仁,探究不同抗冻剂的添加对冻藏虾仁肌原纤维蛋白稳定性的影响,旨在为天然抗冻剂的研究和使用提供基础,为虾仁加工提供新思路。
1 材料与方法
1.1 材料与试剂
鲜活南美白对虾(体长(18±3)cm)购自浙江舟山旭旺养殖基地,购买后立即置于装有30 ℃温海水的保温箱中,快速运至实验室,冰水处死后,去除虾头虾壳,获得完整虾仁。
焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖、卡拉胶寡糖、三氯乙酸、溴酚蓝 国药集团化学试剂有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒 上海碧云天生物科技研究所;Ca2+-ATPase活性测定试剂盒 南京建成生物工程研究所有限公司;硫酸钼、米吐尔、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)美国Sigma-Aldrich公司。
1.2 仪器与设备
DZF真空干燥箱 常州恒隆仪器有限公司;DSC 200 F3型差式扫描量热仪 德国耐驰仪器制造有限公司;206STP型冰箱 青岛海尔集团;HB43-S型快速水分测定仪 瑞士梅特勒-托利多公司;LabSwift-aw型水分活度测定仪 瑞士Novasina公司;751UVGD型紫外-可见光分光光度计 上海第三分析仪器厂;CF-16RN型高速冷冻多用途离心机 日本日立公司。
1.3 方法
1.3.1 样品处理与分组
分别配制蒸馏水组和质量分数为3%的焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖、卡拉胶寡糖溶液处理组。在4 ℃条件下,维持真空度为0.09 MPa,将虾仁分别浸没于以上溶液中保持1.5 h;取出后,拭去虾仁表面水分;将虾仁封装,置于-18 ℃冰箱中长期贮藏。实验周期为90 d,每隔30 d取样一次并测定相关指标。
1.3.2 肌肉解冻损失率测定
将冷冻虾仁取出后立即称质量m1(精确到0.001 g),然后置于带盖平皿中,室温自然解冻2 h后,拭去表面水分,称质量m2(精确到0.001 g)。肌肉解冻损失率按下式计算:
1.3.3 肌肉热力学测定
采用差示扫描量热法(differential scanning calorim etry,DSC)测定不同处理组南美白对虾肌肉玻璃化转变温度(Tg)。南美白对虾Tg测定程序:初温25 ℃恒温2 min,以10 ℃/min速率冷却至-80 ℃,恒温2 min;以10 ℃/min升温至30 ℃,恒温2 min;再以10 ℃/min降至退火温度-35 ℃,恒温30 min;以10 ℃/min降至-80 ℃,恒温2 min;以10 ℃/min升温至30 ℃。
1.3.4 肌原纤维蛋白含量测定
参考薛勇等[16]的报道,称取约5.0 g切碎的虾仁肌肉样品,加入50 mL Tris-顺丁烯二酸缓冲液(20 mmol/L、pH 7.0,含0.05 mol/L KCl);20000 r/min均质1 min,随后10000 r/min、4 ℃离心15 min,弃去上清液;沉淀部分加入10 倍体积的Tris-顺丁烯二酸缓冲液(20 mmol/L、pH 7.0,含0.60 mol/L KCl),匀浆1 min,4 ℃提取l h,随后4 ℃、9000 r/min离心10 min,最终取离心上清液为肌原纤维蛋白提取液,采用Lowry法测定蛋白质含量。
1.3.5 肌原纤维蛋白Ca2+-ATPase活性测定
参考Hossain等[17]的报道,在肌原纤维蛋白溶液中加入0.50 mol/L Tris-顺丁烯二酸缓冲液(pH 7.0)、0.10 mol/L CaCl2及20 mmol/L ATP溶液,混合反应5 min,随后添加质量分数为15%的三氯乙酸溶液终止反应。反应结束后,取反应液加入1.0 mL硫酸钼、0.5 mL米吐尔和2.5 mL水,在室温条件下发色45 min。随后在640 nm波长处测定吸光度,计算Ca2+-ATPase活性。以1 mg蛋白在1 min内产生无机磷物质的量表示肌原纤维蛋白Ca2+-ATPase活力,单位为μmol/(mg·min)。
1.3.6 肌原纤维蛋白表面疏水性测定
参考Riebroy等[18]的方法,采用ANS荧光探针法。激发波长和发射波长分别为380 nm和480 nm,狭缝宽为5 nm。以相对荧光强度与蛋白质浓度作图,其初始斜率即为蛋白质相对表面疏水性。
1.3.7 肌肉蛋白质SDS-PAGE分析
取虾肉5 g,加入质量分数为5%的SDS溶液45 mL,8000 r/min均质5 min,每均质30 s,停30 s,防止过热。均质后的溶液,85 ℃水浴中1 h,离心10 min(10000 r/min、4 ℃),取上清液备用。参照Laemmli等[19]的电泳方法,配制质量分数为10%分离胶、质量分数为5%浓缩胶。电泳样品用样品溶解液(内含质量分数为4%的SDS,质量分数为20%的甘油,质量分数为0.02%的溴酚蓝,0.125 mol/L Tris-HCl缓冲液,pH 6.8)配制,使最终蛋白质量浓度为1 mg/mL。电泳采用1 mm凝胶板;上样量为10 µL;开始电压为80 V,当样品进入分离胶后将电压调大至120 V;电泳结束后取出胶片用考马斯亮蓝染色3 h,最终以甲醇/冰醋酸脱色液脱色至胶片背景清晰。
1.4 数据处理与分析
2 结果与分析
2.1 虾仁肌肉解冻损失率分析
虾仁在冷冻贮藏过程中,重结晶作用会使得其肌肉细胞内冰晶不断生长,造成细胞膜受到机械损伤,同时也会破坏细胞中蛋白质与结合水的连接,最终使得虾仁解冻后出现汁液流失现象[8,20]。不同添加物对真空渗透处理虾仁肌肉解冻损失率的影响如表1所示。冻藏90 d过程中,各处理组解冻损失率均显著上升(P<0.05),除蒸馏水组外,其他5 组的解冻损失率在60~90 d上升最快。其中,蒸馏水处理组在冻藏过程中解冻损失率显著高于其他处理组,在冻藏第90天时解冻损失率为8.67%,但显著低于相关文献报道中未经真空渗透处理虾仁的解冻损失率[21]。这可能是由于真空渗透过程可以通过压力差排出肌肉组织间的空气[22-23],以水分子填补组织间的空隙,提高虾仁含水量,降低解冻过程中的水分流失。经焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖、卡拉胶寡糖真空渗透处理后,虾仁解冻损失率较蒸馏水组均有显著下降,第90天时分别为6.47%、6.31%、6.43%、6.73%和6.79%。磷酸盐可以螯合Ca2+、Mg2+并释放出相同电荷的离子,由于电荷的斥力作用,蛋白质分子间的间隙增大,使得蛋白质的结构变得疏松,可以吸收更多的水分[24-25],此过程可以保留大量的水分,从而降低解冻过程中的损失率。糖类分子中羟基可通过氢键束缚虾仁肌肉组织中的水分子,抑制冰晶的生长,从而减轻冰晶对肌肉细胞结构的损伤;此外,糖类分子可以加固水分子与蛋白质的结合,降低肌肉蛋白质受冰晶挤压作用而导致的凝集作用[19],最终避免解冻过程中的汁液损失。

表1 冻藏期间虾仁肌肉解冻损失率变化Table 1 Changes in thawing loss of shrimp muscle during frozen storage%
2.2 虾仁肌肉蛋白质热力学分析
在冻藏过程中,不同处理的南美白对虾肌肉DSC分析结果,如图1所示。在DSC热流曲线中,从左到右依次出现的3 个峰,分别代表为肌球蛋白、肌浆蛋白和肌动蛋白的热流峰。水分含量对玻璃化转变温度有关键性作用,在高水分虾仁中,由于自由水比例大,虾仁不能发生完全的玻璃化转变,此时玻璃化转变温度Tg为最大冷冻浓缩液状态下的部分玻璃化转变温度Tg’。在低温真空条件下,蒸馏水、焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖处理后,虾仁肌肉Tg’分别为-69.6、-54.5、-54.8、-54.9、-55.8 ℃和-56.3 ℃。其中,焦磷酸钠、三聚磷酸和海藻糖组虾仁Tg’之间无显著差异(P>0.05),海藻胶寡糖和卡拉胶寡糖组二者之间无显著差异(P>0.05),但均显著高于空白组(P<0.05)。由此可知,在真空低温渗透条件下,不同添加物对于提高冻结虾仁样品Tg’均具有积极作用,即对于维持冻藏虾仁肌肉品质具有显著改善作用[26]。

图1 冻藏期间虾仁肌肉DSC分析Fig.1 Differential scanning calorimetry analysis of shrimp muscle duringfrozen storage
随着冻藏时间延长,空白组虾仁肌球蛋白吸热峰峰面积逐渐减小,意味着肌球蛋白焓变值逐渐降低,即其发生去折叠变性所需的能量降低,表明空白组虾仁肌球蛋白稳定性逐渐降低[27]。在冻藏第90天时,海藻糖组(1.29 J/g)、三聚磷酸钠(1.17 J/g)和海藻胶寡糖(1.02 J/g)虾仁肌球蛋白焓变值相对较高,显著高于空白组(0.63 J/g)(P<0.05),表明3 组样品肌肉蛋白质变性程度相比于空白组程度较轻。此外,焦磷酸钠组(0.97 J/g)和卡拉胶寡糖组(0.94 J/g)样品肌球蛋白焓变值之间并无显著差异(P>0.05),但仍显著高于空白组(P<0.05)。另一方面,各组虾仁肌肉中肌浆蛋白吸热峰随着贮藏时间延长而逐渐向左移动,其热焓值和相变温度逐渐减小,因此肌浆蛋白的热稳定性也逐渐降低。同样,不同添加物处理对于虾仁肌肉中肌浆蛋白的贮藏稳定性,也表现出良好的维持作用。此外,在冻藏过程中,各种样品中肌动蛋白变性温度、焓变值等并未发生显著变化,表明其在低温条件下的稳定性相对较好,该现象也符合Louise等[28]研究结果。综上所述,引起虾仁肌肉蛋白质冷冻变性的主要为肌球蛋白和肌浆蛋白,其中肌动蛋白稳定性相对较高;磷酸盐和糖类物质的渗透添加可以对肌肉蛋白质稳定性起有效的保护作用,延缓肌球蛋白和肌浆蛋白低温变性程度,其中三聚磷酸钠、焦磷酸钠和海藻糖的效果较为明显。
2.3 虾仁肌肉中肌原纤维蛋白含量分析
如图2 所示,新鲜虾仁中肌原纤维蛋白含量为129.7 mg/g,蒸馏水组经90 d冻藏后,肌原纤维蛋白含量显著下降至96.4 mg/g。经焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖真空渗透处理的虾仁肌原纤维蛋白含量下降幅度均显著小于蒸馏水处理组,其含量分别为112.6、113.8、109.9、107.1 mg/g和108.2 mg/g,表明添加物结合真空渗透处理对肌原纤维蛋白的稳定性均有较好的保护作用。
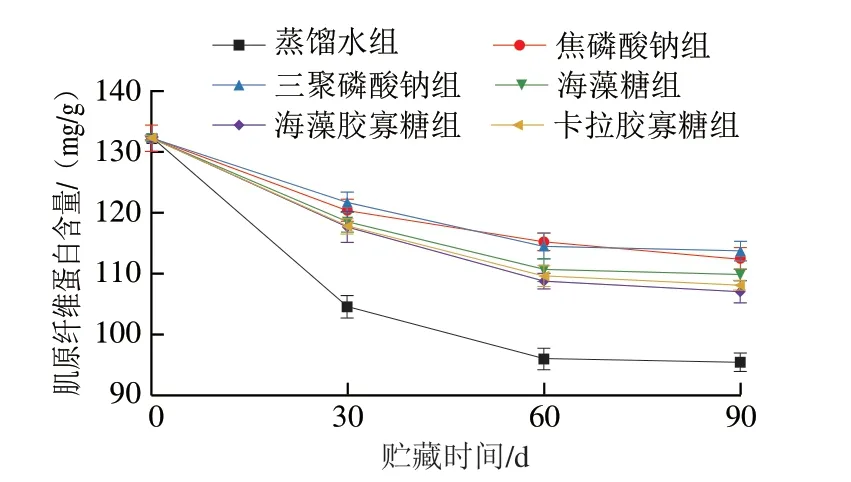
图2 冻藏期间虾仁肌肉中肌原纤维蛋白含量变化Fig.2 Changes in myofibrillar protein content of shrimp muscle during frozen storage
肌原纤维蛋白在冻藏过程中,肌球蛋白间的共价键会被冰晶破坏,凝集形成大分子不溶物,造成肌原纤维蛋白含量降低[29]。研究发现,部分小分子的糖类、糖醇类对肌肉肌原纤维蛋白具有良好的冷冻保护作用[30]。这可能是由于糖类分子中的羟基可通过氢键与蛋白质结合,起到稳定肌原纤维蛋白结构与活性的作用。此外,糖类分子可通过氢键束缚部分游离水,抑制肌肉组织中冰晶的生长,避免冰晶对肌原纤维蛋白结构造成机械损伤。
2.4 虾仁肌肉中肌原纤维蛋白Ca2+-ATPase活性分析
肌原纤维蛋白Ca2+-ATPase活性主要来源于肌球蛋白球状头部,在冻藏过程中冰晶生长会使得体系离子浓度升高,导致肌球蛋白头部结构相互聚集或构象改变,致使Ca2+-ATPase活性下降[31-32]。因此,Ca2+-ATPase活性可以反映肌原纤维蛋白,尤其是肌球蛋白的变性程度。如图3所示,冻藏期间各组虾仁肌肉中Ca2+-ATPase活性不断下降,其中,蒸馏水组在第90天时Ca2+-ATPase活性最低。经焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖处理后,虾仁肌肉Ca2+-ATPase活性均显著高于蒸馏水组,表明这些添加物经真空渗透处理后,对虾仁肌肉中Ca2+-ATPase活性均有一定保护作用。吴海潇等[32]研究发现,卡拉胶寡糖和焦磷酸钠处理后可以延缓虾肉肌原纤维蛋白的冷冻变性,并抑制Ca2+-ATPase活力的下降程度。经糖类抗冻剂处理过的样品能保持Ca2+-ATPase活性,可能是因为糖类在冷冻水产品中通过取代肌肉蛋白质周围的部分水分子形成氢键,从而稳定肌肉蛋白质并防止Ca2+-ATPase活性下降[33]。而磷酸盐能与Ca2+、Mg2+结合,释放肌肉蛋白的羧基,增加蛋白质间的静电斥力,减少蛋白质的聚集变性,从而保护Ca2+-ATPase结构稳定性[2]。

图3 冻藏期间虾仁肌肉中肌原纤维蛋白Ca2+-ATPase活性变化Fig.3 Changes in myofibrillar Ca2+-ATPase activity of shrimp muscle during frozen storage
2.5 虾仁肌肉中肌原纤维蛋白表面疏水性分析
蛋白质的表面疏水性可反映蛋白质分子表面疏水性残基的相对含量,其出现变化说明蛋白质表面性质发生改变,故而可用其定量分析蛋白质的结构变化[18,34]。由图4可以看出,在90 d冻藏期间,虾仁肌肉中肌原纤维蛋白的表面疏水性持续上升。这可能是由于冻藏期间,肌原纤维蛋白发生冷冻变性,埋藏在内部的部分疏水基团被暴露出来,致使表面疏水性升高[35-36]。蒸馏水组在整个冻藏过程中,肌原纤维蛋白表面疏水性大幅提升,说明虾仁肌原纤维蛋白发生明显结构变化,蛋白质冷冻变性程度较高。相比于蒸馏水组,焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖组均可显著抑制肌原纤维蛋白表面疏水性的提高。在前30 d,不同添加物处理组的肌原纤维蛋白表面疏水性差别不显著,随着冻藏时间延长,海藻糖及卡拉胶寡糖对肌原纤维蛋白表面疏水性保护作用显著优于其他处理组,第90天时分别为13.22和13.41,说明海藻糖、卡拉胶寡糖对蛋白质结构的保护作用较优。Zhang Bin等[8]的研究表明,卡拉胶寡糖通过抑制虾仁氧化变性,保护虾仁肌原纤维蛋白的构象。Mehdi等[37]研究发现,糖类抗冻剂可能是通过离子键、氢键或亲水-亲水相互作用与蛋白质分子结合,从而保护肌肉品质。
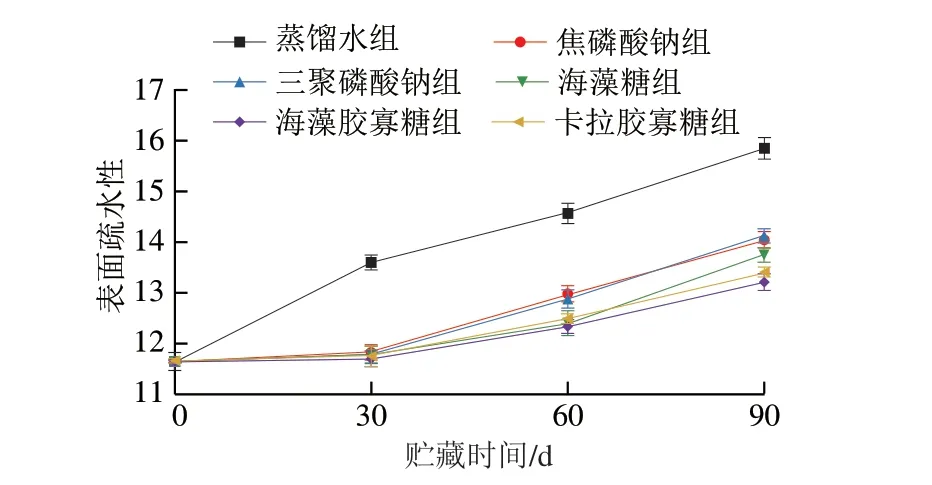
图4 冻藏期间虾仁肌肉中肌原纤维蛋白表面疏水性变化Fig.4 Changes in surface hydrophobicity of myofibrillar proteins from shrimp muscle during frozen storage
2.6 虾仁肌肉蛋白质SDS-PAGE分析
图5为不同添加物处理的南美白对虾肌原纤维蛋白SDS-PAGE图。电泳图谱上较为明显的条带分子质量由大至小分别为肌球蛋白重链、副肌球蛋白、肌动蛋白、原肌球蛋白和肌球蛋白轻链[38]。肌浆蛋白条带不明显,这可能是由于冻藏过程中肌浆蛋白随细胞汁液的流失而损失[39]。经冻藏90 d后,空白组肌球蛋白轻链几乎消失,海藻糖组条带相比于其他组更为明显;三聚磷酸钠组、海藻糖组和海藻胶寡糖组的肌球蛋白重链(200 kDa左右)和副肌球蛋白(75 kDa左右)条带明显,降解程度不高,说明三聚磷酸钠、海藻糖和海藻胶寡糖对虾仁肌肉中肌球蛋白具有明显的保护作用。整个冻藏过程中各组肌动蛋白(48 kDa左右)的条带无明显变化,表明添加物对肌动蛋白的稳定性影响程度较小。
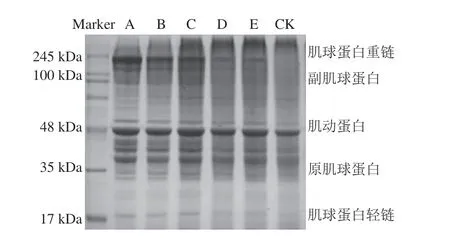
图5 冻藏90 d虾仁肌肉蛋白质SDS-PAGE分析Fig.5 SDS-PAGE analysis of proteins in shrimp muscle frozen for 90 days
3 结论
本实验探究了真空渗透焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖处理对冻藏虾仁肌原纤维蛋白稳定性的影响。结果显示,相比于蒸馏水处理,真空渗透焦磷酸钠、三聚磷酸钠、海藻糖、海藻胶寡糖和卡拉胶寡糖处理可以有效降低虾仁解冻损失率,同时对肌肉中肌原纤维蛋白含量及Ca2+-ATPase活性下降、肌原纤维蛋白表面疏水性的上升及蛋白质冷冻变性均有明显抑制作用。

