有刺枸骨和无刺枸骨在不同CO2 浓度下的光合能力分析
张兴月 陈金鑫 刘国元 余春梅 张 健 姚 彬 魏 辉
(1南通大学生命科学学院,江苏 南通 226019;2南通市观赏植物遗传育种重点实验室,江苏 南通 226019;3南通如皋市万禾花木生态园,江苏 南通 226500)
光合作用对物质的代谢和能量转化有重要作用,其影响植物固定光能和有机物积累的能力,是植物生存和进行各项生命活动的基础[1]。这些基础的生命过程不仅影响植物个体发育,而且对植物生存和分布有重要影响。光照、水分、温度、CO2浓度和矿质元素是影响植物光合作用的主要因素[2]。光照条件对植物的生长发育和形态建成有重大影响[3]。光照较弱无法满足植物生长发育的需求,导致植物生长较慢;光照较强则会灼伤植物的叶片[3],不仅会导致叶绿体和植物细胞被破坏,加快叶片衰老,从而降低植物的光合速率,还会导致光合器官受到损伤,进而降低植物光合能力[4]。此外,光合速率在一定程度上会随着光照强度的减弱而减弱、增加而增加,当光照强度超过光补偿点时,随着光照强度的增加,光合速率的增加会变得缓慢;当光照强度到光饱和点后,光合速率会随着光照强度的增加而下降[5]。水不仅是光合作用的原料,而且是酶活及生化反应的介质。如果植物细胞水分供求失调,将会对光合作用产生重大影响[6]。一方面,水分的缺乏,会增加脱落酸的含量,进而使气孔导度下降,吸收CO2速度下降;另一方面,光合产物输出受到影响,并影响叶片乃至整株植株的生长发育[7]。温度会对光合作用的相关酶的活性、水分供求平衡和植物叶片气孔的状态造成影响,从而对植物光合生理过程产生较大影响[8]。昼夜温差较大可以增加净光合速率,并积累较多的同化产物[9]。自然界CO2浓度会影响植物的整体生长过程,且胞间CO2浓度直接影响光合强度,当达到CO2饱和点时,光合速率达到最大值[10]。矿质元素是维持植物生长发育的重要条件,其对植物细胞叶绿素含量、酶活性等产生影响,从而间接影响植物的光合作用[11-12]。叶绿体中存在大量氮元素,其是1,5-二磷酸核酮糖羧化酶的重要组成物质[13]。磷涉及植物细胞光合磷酸化过程,对碳反应过程中相关酶的活性、光合产物的运输及二磷酸核酮糖的再生有重大影响。此外,钾、镁和铁等矿质元素也参与光合作用中气孔的调节,叶绿素的形成,光合产物的合成与运输等过程[14]。光合作用作为植物特有的生理过程,促进生物的不断演变和自然界的日益发展,并对人类社会的生存和发展也有积极的促进作用。
园林植物作为园林绿化的主要材料,有利于美化环境和满足观赏需求,具有较高的生态效益和社会效益。园林植物不仅在城市绿化上至关重要,而且其光合作用具有降温增湿、调节气候和净化空气等生态功能[15]。枸骨(Ilex cornuta)又名“猫儿刺”“鸟不宿”,为冬青科冬青属常绿小乔木或灌木[16],多产于长江中下游地区,城市绿化和家庭庭院都常有栽培。该树种喜光,稍耐阴,但生长较为缓慢,树皮灰白且平滑,枝形各异且密生,枝形可整塑成多干形、球形及树状盆景。花期4—5 月为黄绿色小花,球形绿色核果,9—11 月果实成熟,形成鲜红核果,且满枝硕果。枸骨的品种较多,例如,叶形小、株型紧凑的枸骨品种,能很好地遮挡灌木下部空间,满足节约型园林的要求;花期较长、核果量大且色泽鲜的枸骨品种,可增加秋冬季园林景观的色彩和趣味性。在园林景观设计上可根据需求进行选择。此外,枸骨多分为有刺枸骨(I. cornuta)和无刺枸骨(I.coruntavar. fortunei),二者都是很好的观叶观果园林树种,对城市生态环境建设起到重要的作用。其中,无刺枸骨是枸骨的自然变种。
光合作用使自然界中的太阳能量进入生态系统,同时,生命的基本物质也来自植物的光合作用。光不仅影响植物的生长发育,也是植物生存演化进程中最重要的环境因子之一。研究植物对光的适应能力对于提高植物的产量和质量,促进植物的分布和引种、驯化等都有重要意义。近年来,育种学家普遍关注不同品种间的光合作用差异,探究高光合作用的品种及机理。因此,了解不同品种枸骨的光合特性,对植树造林和园林植物配置具有重要意义。本文以有刺枸骨和无刺枸骨为对象,研究其净光合速率、胞间CO2浓度、蒸腾速率、气孔导度、叶片饱和蒸气压亏缺、瞬时光合有效辐射强度、CO2补偿点和CO2饱和点的特性,探讨有刺枸骨和无刺枸骨的光合作用存在差异的原因,为该植物的优化种植、品种选育及高效栽培提供参考。
1 材料与方法
1.1 试验地与材料
本试验在2022年8月于江苏如皋万禾花木生态园典型常绿珍贵乡土树种试验基地枸骨园进行。园区种植的无刺枸骨和有刺枸骨均为4年生的成年枸骨,种植密度为3 m × 3 m,种植后覆土盖过根盘10 cm,高垄栽培,垄高于地面20 cm,并在园区设置30 cm×20 cm(宽×高)的排水沟,便于排水。此外,采取适当的水肥管理,一般浇水遵循浇灌均匀且透原则,春秋无雨时每7 d 浇2 次,夏季无雨或干旱季节每天1 次,早晨或傍晚进行;在春季和夏季各追肥1 次,以农家肥鸡粪为主,分别在每棵枸骨4 个角上施加,施用量为每角2 kg左右。
1.2 试验方法
在晴朗无云或者少云日,选取长势一致的无刺枸骨和有刺枸骨进行相关光合指标测定。选用LI-COR 公司的Li-6800 光合仪,配备2 × 3 红蓝光源叶室,设置相对湿度50%,叶室温度30 ℃,光强1000 μmol/(m2·s),选用高压浓缩CO2小钢瓶,将CO2浓度分别设置为0、30、60、90、120、200、400、600、800、1000、1200、1300、1400和1500 μmol/mol,并在上述CO2浓度下设置测定光合相关指标时间120 s。在9:00—11:30对无刺枸骨和有刺枸骨完全展开的新生叶片进行光合作用相关指标的自动测定,每次测定至少重复3次,并按照说明书进行仪器操作。测试无刺枸骨和有刺枸骨的净光合速率、胞间CO2浓度、蒸腾速率、气孔导度、叶片饱和蒸气压亏缺和瞬时光合有效辐射强度,并根据有刺枸骨和无刺枸骨CO2响应曲线分别计算CO2补偿点和CO2饱和点。
2 结果与分析
2.1 净光合速率和胞间CO2浓度比较
有刺枸骨和无刺枸骨的净光合速率随CO2浓度的变化关系如图1 所示。当CO2浓度在0~1200 μmol/mol 时,有刺枸骨和无刺枸骨的净光合速率随着CO2浓度的增加而增加;在CO2浓度大于1200 μmol/mol 时,有刺枸骨和无刺枸骨的净光合速率保持基本恒定,不再随着CO2浓度的增加而增加。其中,CO2浓度为0~600 μmol/mol 时,有刺枸骨和无刺枸骨的净光合速率的增幅最大。相同CO2浓度下,无刺枸骨的净光合速率始终大于有刺枸骨,无刺枸骨的净光合速率最大达到13 μmol/(m2·s),有刺枸骨的净光合速率最大达到9 μmol/(m2·s)(图1A)。此外,有刺枸骨和无刺枸骨的胞间CO2浓度随着CO2浓度的增加而增加。在较低CO2浓度(小于300 μmol/mol)下,有刺枸骨的胞间CO2浓度总体上要高于无刺枸骨;当CO2浓度大于300 μmol/mol时,无刺枸骨的胞间CO2浓度高于有刺枸骨的胞间CO2浓度(图1B)。
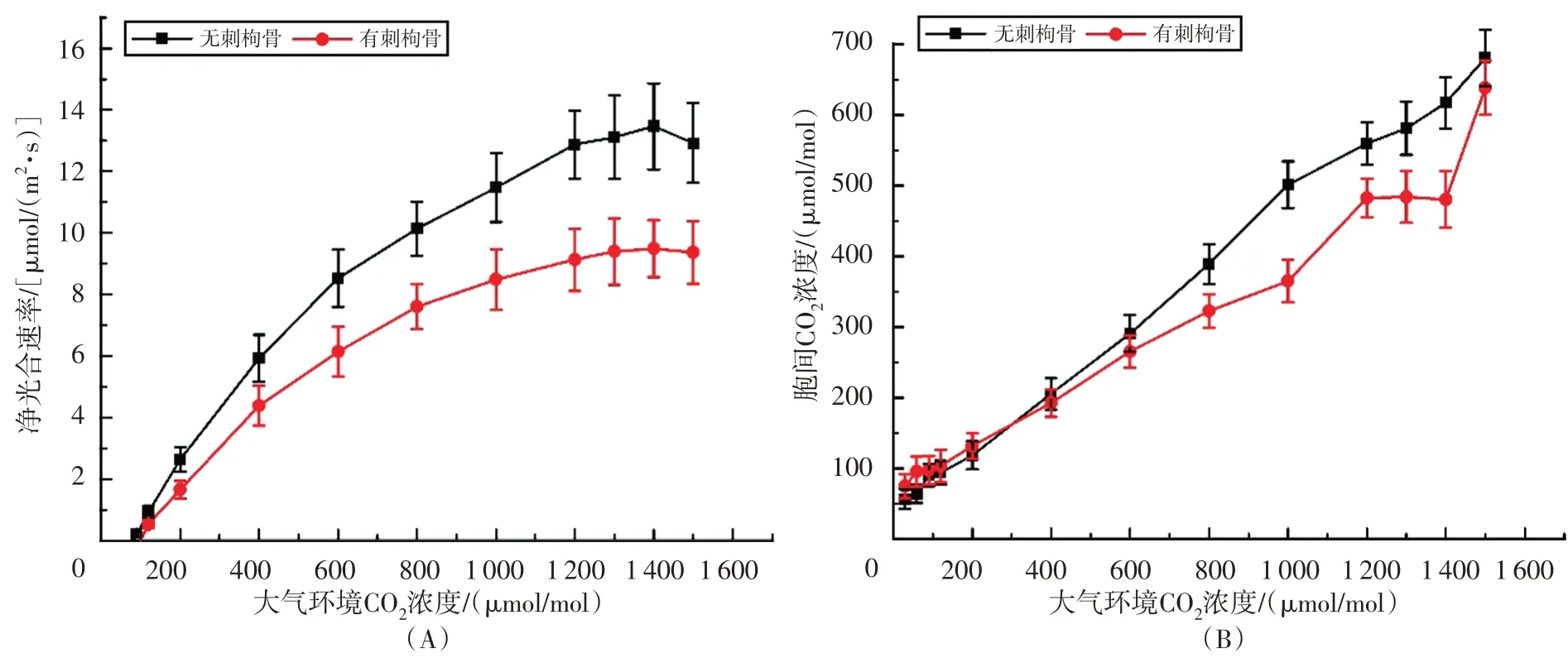
图1 净光合速率和胞间CO2浓度随CO2浓度变化的情况
2.2 气孔导度和蒸腾速率比较
有刺枸骨和无刺枸骨的气孔导度都随着CO2浓度的增加而下降,并且无刺枸骨的气孔导度始终高于有刺枸骨。在CO2浓度在1000 μmol/mol以内时,随着CO2浓度的增加,有刺枸骨气孔导度的降幅较大;在CO2浓度为1000~1500 μmol/mol 时,随着CO2浓度的增加,气孔导度的降幅相对较少。而无刺枸骨的气孔导度的降幅一直保持较大趋势。无刺枸骨的最大气孔导度达到0.063 mol/(m2·s),最小气孔导度仅为0.027 mol/(m2·s);而有刺枸骨的最大气孔导度达到0.053 mol/(m2·s),最小气孔导度仅为0.018 mol/(m2·s)(图2A)。此外,有刺枸骨和无刺枸骨的蒸腾速率都随着CO2浓度的增加而下降,两者的下降幅度基本保持一致。在相同的CO2浓度下,无刺枸骨的蒸腾速率始终高于有刺枸骨。无刺枸骨的最大蒸腾速率达到0.00220 mol/(m2·s),最小蒸腾速率仅为0.00095 mol/(m2·s);而有刺枸骨的最大气孔导度达到0.0017 mol/(m2·s),最小气孔导度仅为0.00056 mol/(m2·s)(图2B)。
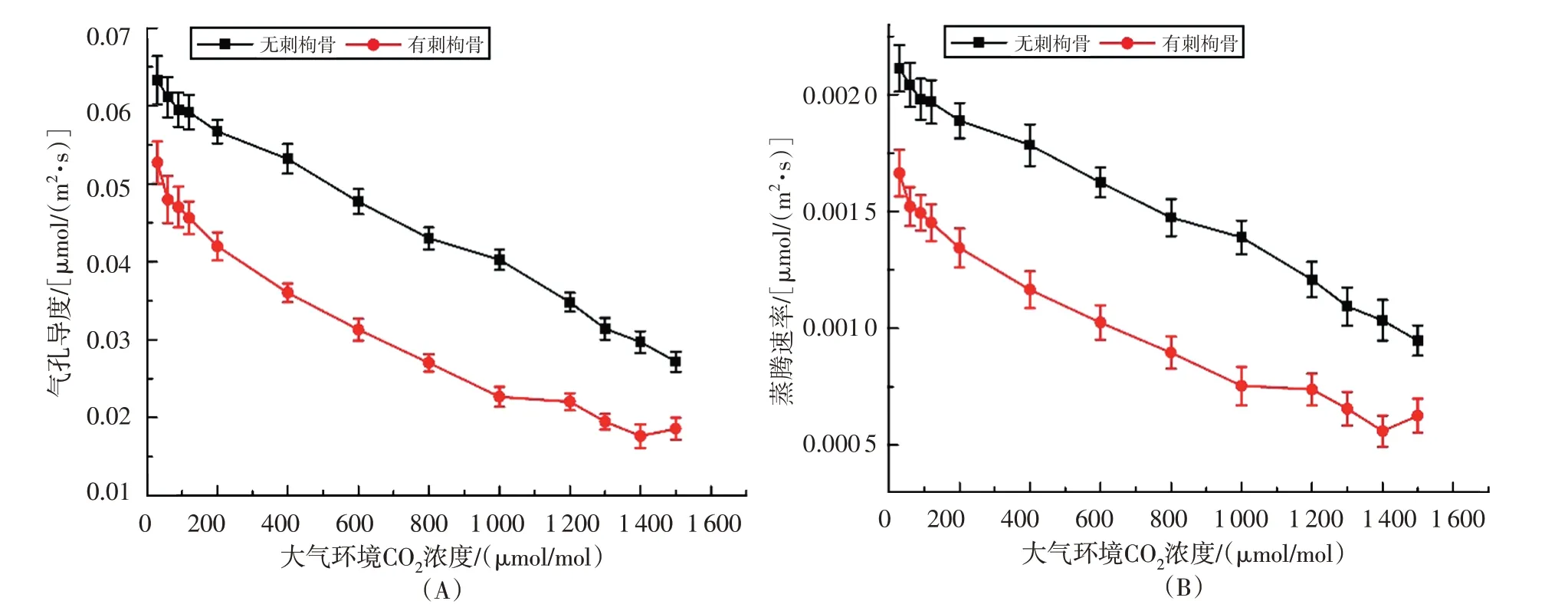
图2 气孔导度和蒸腾速率随CO2浓度变化的情况
2.3 叶片饱和蒸气压亏缺和瞬时光合有效辐射强度比较
有刺枸骨和无刺枸骨叶片饱和蒸气压亏缺在总体上都随着CO2浓度的增加而增加,但是变化幅度相对较小。在相同的CO2浓度下,无刺枸骨的叶片饱和蒸气压亏缺始终比有刺枸骨略大(图3A)。此外,有刺枸骨和无刺枸骨瞬时光合有效辐射强度随着CO2浓度的增加而保持在稳定水平,其中,无刺枸骨的光合有效辐射强度大约在700 μmol/(m2·s),而有刺枸骨的光合有效辐射强度大约在1500 μmol/(m2·s),有刺枸骨的光合有效辐射强度始终比无刺枸骨大(图3B)。
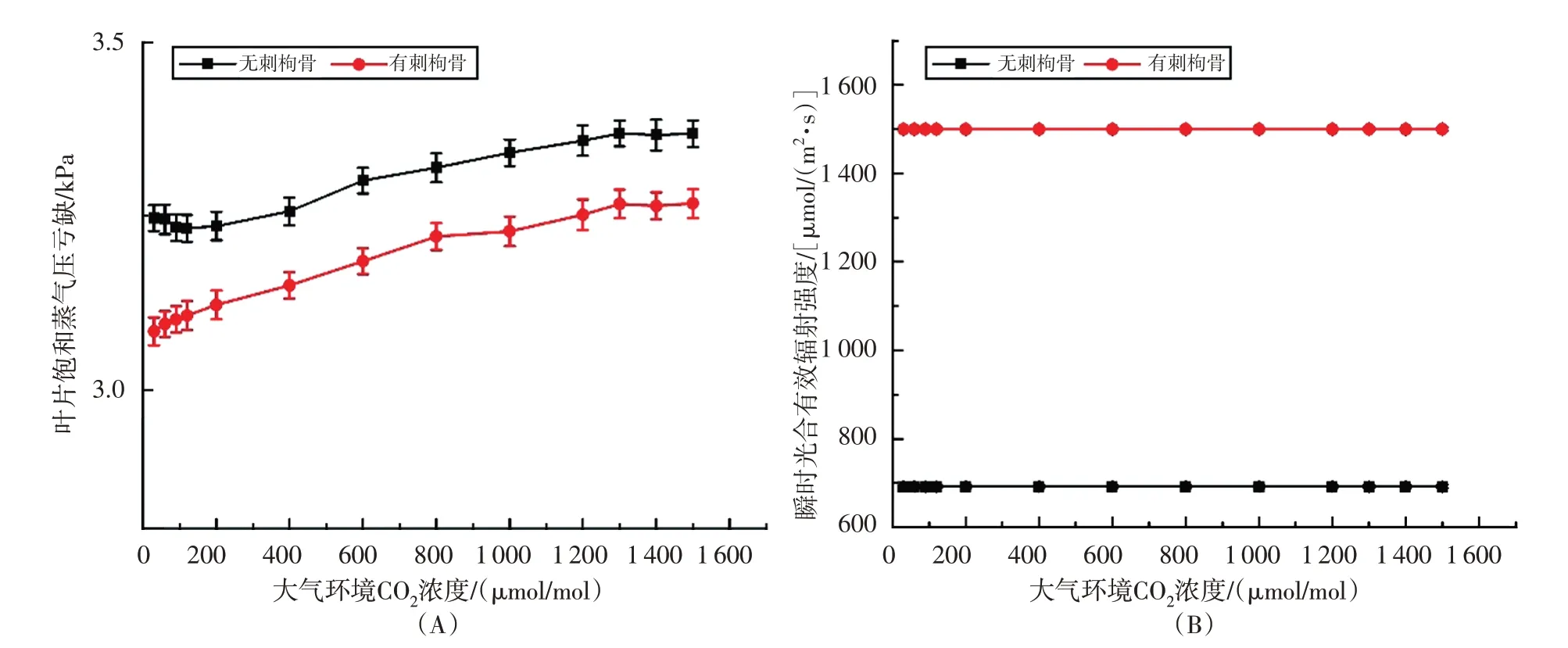
图3 叶片饱和蒸气压亏缺和瞬时光合有效辐射强度随CO2浓度变化的情况
2.4 CO2响应曲线比较
有刺枸骨的CO2响应拟合曲线为y=(-6.43536E-6)X2+0.01695X-1.74077(R2=0.9963)。根据有刺枸骨的CO2响应曲线(图4),可计算出有刺枸骨叶片的CO2饱和点为1373.13 μmol/(m2·s)。此外,无刺枸骨的响应拟合曲线为y=(-7.3944E-6)X2+0.02081X-1.49851(R2= 0.998)。根据无刺枸骨的CO2响应曲线,可计算出无刺枸骨叶片的CO2饱和点为1472.76 μmol/(m2·s)。无刺枸骨相对于有刺枸骨的CO2饱和点较高。在有刺枸骨的CO2响应曲线中,模拟直线与x轴相交,y= 0时的CO2浓度即是CO2补偿点;根据有刺枸骨CO2响应曲线方程可计算出有刺枸骨CO2补偿点为107.05 μmol/(m2·s);根据无刺枸骨CO2响应曲线方程可计算出无刺枸骨CO2补偿点为73.95 μmol/(m2·s)。无刺枸骨相对于有刺枸骨的CO2补偿点较低。
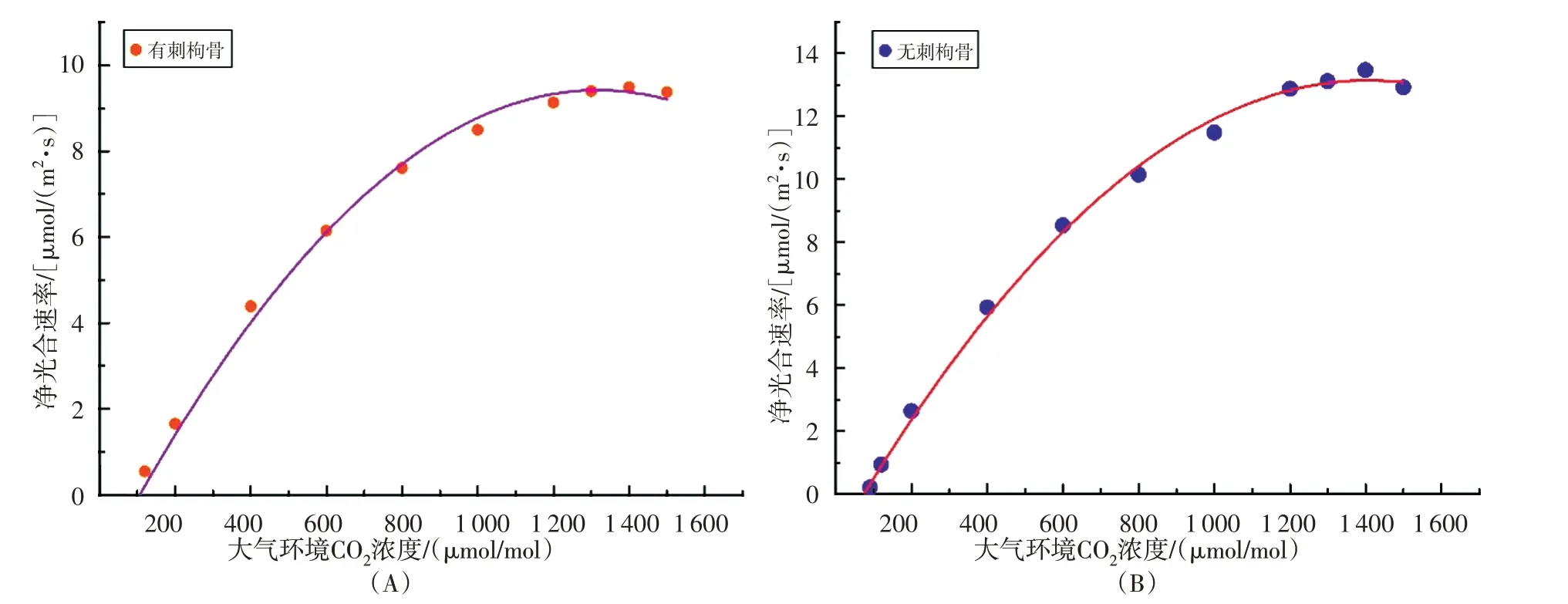
图4 CO2响应曲线
3 结论与讨论
植物的光合作用受光照条件(包括光强、光质)影响[17]。本文研究了枸骨在不同光强下的光合能力,结果表明,在相同的光和强度下,有刺枸骨的净光合速率比无刺枸骨的净光合速率小。此外,植物的光合作用受CO2浓度的影响,短时间内大气CO2浓度升高,植物的光合速率显著增加[18-20]。本研究探究外界环境不同CO2浓度对有刺枸骨和无刺枸骨光合作用的影响。当CO2浓度在0~600 μmol/mol范围内时,有刺枸骨和无刺枸骨的净光合速率迅速上升,而CO2浓度在600~1500 μmol/mol 范围内时,有刺枸骨和无刺枸骨的净光合速率上升趋势逐渐变慢,并趋于平缓。此外,在CO2浓度增加过程中,无刺枸骨的净光合速率始终大于有刺枸骨,这表明在储能和光合产物产生方面无刺枸骨要优于有刺枸骨。引起二者净光合速率存在不同的主要原因包括气孔因素和非气孔因素。其中,气孔因素主要包括气孔导度、气孔数量和气孔孔径,非气孔因素主要包括光合作用中相关酶活及构成。在本研究中,有刺枸骨和无刺枸骨的气孔导度都随着CO2浓度的增加而下降,两者的降幅基本保持一致。气孔蒸腾是植物蒸腾作用的最主要表现形式之一[21],本研究表明无刺枸骨的气孔导度显著大于有刺枸骨,这导致无刺枸骨的蒸腾速率大于有刺枸骨。此外,气孔在植物内外气体交换中发挥重要作用,水、CO2和氧气都要共用这个通道,因此气孔的状态会影响植物光合、呼吸和蒸腾等生理过程[22-23]。枸骨气孔导度随CO2浓度的变化和蒸腾速率随CO2浓度的变化同步。气孔导度首先影响枸骨内水分的变化,其次会影响胞间CO2的交换。本研究中,气孔导度和水分利用率呈负相关,有刺枸骨较无刺枸骨而言有较高的水分利用率。此外,在相同CO2浓度下,无刺枸骨的净光合速率、胞间CO2的浓度以及蒸腾速率都大于有刺枸骨,这表明无刺枸骨具有更高的光合作用、CO2交换率和蒸腾速率。通过对无刺枸骨和有刺枸骨胞间CO2浓度的检测,发现在外界CO2变化的条件下,胞间CO2浓度与净光合速率呈现正相关。基于上述结果,推测气孔导度并不是引起无刺枸骨比有刺枸骨净光合速率大的原因,胞间CO2浓度可能是引起无刺枸骨比有刺枸骨净光合速率大的原因。在相同的CO2浓度下,有刺枸骨的光合有效辐射强度大于无刺枸骨,这表明在相同外界CO2浓度下,无刺枸骨可能具有更高的光合效率,但是由于有刺枸骨具有较强的光合有效辐射,因此,在设置园林景观时,可以混合种植有刺枸骨和无刺枸骨[24-25],以丰富景观造型,且充分利用光能实现物质的积累和吸收环境中过多的CO2[26-28]。

