MALDI-TOF MS 法快速鉴定散装即食食品中3 种食源性致病菌
崔 洁,林吉恒,孙 瑛,严卓彦,夏瑛瑛,黄朱梁
(舟山市食品药品检验检测研究院,浙江舟山 316000)
散装即食食品是提供给消费者可以直接食用的非预包装食品(含预先包装但需要计量称重的散装即食食品),主要包括热处理散装即食食品、部分或未经热处理的散装即食食品和其他散装即食食品三大类[1]。近年来,随着外卖、社区团购的兴起,食品生产加工模式与销售方式发生改变的同时,人们的膳食行为与饮食习惯也在悄然改变。超市和菜场里随处可见的盒装预制菜等散装即食食品都已经过烹煮、烫热,无需再对其进行额外加工处理即可食用,既省去了繁琐的包装,售卖方便,食用也更加便捷,备受生产者与消费者的推崇[2]。但是与预包装食品不同的是,这类散装即食食品并没有经过严格的出厂检验,卫生安全条件难以保证,在制作和销售过程中,加工人员与食品的接触、器具的混用等因素很容易导致微生物的二次污染,更增加了食源性疾病的潜在风险[3-6]。通常,在一些散装熟肉制品和凉拌菜中较易检出沙门氏菌,感染后轻则呕吐腹泻,重则引起急性肠胃炎、败血症等疾病[7-9];另外散装豆制品、生鲜沙拉等也常被金黄色葡萄球菌污染,其产生的肠毒素不易被高温破坏,通过食物入侵人体后易引起急性肠胃炎[10-12];尤其像寿司、饭团、炒饭等散装米饭制品则是蜡样芽孢杆菌感染的重灾区,多在夏秋季高发,其所分泌的腹泻毒素或呕吐毒素污染食物而被人误食后,轻则呕吐腹泻,重则可导致死亡[13-15]。因此,建立散装即食食品中多种食源性致病菌的快速有效的检测方法极为重要。
基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry,MALDI-TOF MS)技术是近几年发展起来的一种新型软电离质谱鉴定手段[16-18]。它的工作原理是将菌体蛋白打碎成一些特异性的碎片,通过质荷比的采集可获取致病菌特异性肽蛋白指纹图谱,将其与数据库中的标准图谱进行比对后,便可鉴定到属、种甚至亚种水平[19-22]。MALDI-TOF MS作为一种基于蛋白质检测的微生物快速鉴定手段发展迅速,它的主要优势在于:a.操作便捷,对操作人员要求不高,只需简单的几步操作便可实现对微生物的复杂鉴定;b.鉴定快速,点样靶板上机后通常只需数十分钟便可得到鉴定结果;c.准确高效,相较于传统生化鉴定法准确率更高[23-26]。近年来,随着MALDITOF MS 技术的快速发展,国内外很多学者都针对各种食品基质中的食源性致病菌展开了适用性研究,如史方等[27]针对即食食品中大肠埃希氏菌O157:H7建立了致病菌快速检测管技术联合基质辅助激光解吸电离飞行时间质谱法,灵敏度可达51 CFU/mL;李滨洲等[28]将MALDI-TOF MS 运用于生鲜猪肉检验过程中大肠杆菌与沙门氏菌的分离鉴定,共检出6 种在HE 和EMB 培养基上与沙门氏菌/大肠杆菌菌落特征类似的肠杆菌科其他细菌;赵宏等[29]建立了免疫富集联合基质辅助激光解吸电离飞行时间质谱法检测牛奶、鸡蛋中沙门氏菌的方法,将浓度为3 CFU/mL 的沙门氏菌特异性富集后选择性增菌9 h即可被MALDI-TOF MS 准确鉴定;周千渝等[30]利用基质辅助激光解吸电离飞行时间质谱快速检测并鉴定从生鲜蔬菜中分离到的5 种致病菌且灵敏度为106CFU/mL。在我国,将MALDI-TOF MS 技术运用于食品安全领域的研究虽尚处于初步探索阶段,但针对多种食源性致病菌的检测研究也已有不少,然而大多数均是针对预包装食品或是初级农产品,预包装食品感染致病菌的风险较低,生鲜猪肉等初级农产品并非即食食品,必须经过高温烹煮后食用,因此也不易感染致病菌,而对于潜伏在我们身边的那些并没有经过食品出厂检验、卫生安全条件难以保证且食源性潜在风险极大的散装即食食品却鲜有研究。
针对常见食源性致病菌的检测,传统的国标法涉及到前增菌、选择性增菌、生化试验和血清分型鉴定等多个步骤,通常需要4~6 d,检测周期冗长且操作复杂繁琐,已无法满足日常检测和暴发检测的需求[31-33]。近年来,散装即食食品的大量涌现、食源性疾病的日益多发和人们食品安全意识的不断增强,都对致病菌检测方法的快速、灵敏、特异等方面提出了更高的要求。2022 年3 月7 日,GB 31607-2021《食品安全国家标准 散装即食食品中致病菌限量》正式实施,本文及时地将基质辅助激光解吸电离飞行时间质谱技术应用于散装即食食品的快速检测研究中,以沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌为模式菌,通过对点样方式、前处理方式、不同培养基及培养时间等各项实验条件的优化筛选确定最佳方法,并考察其检测限和稳定性,最后进行批量食品样本检测来探寻MALDI-TOF MS 技术在散装即食食品中的适用性,以期为食源性致病菌的快速筛查与食品质量安全的有效保障提供新思路。
1 材料与方法
1.1 材料与仪器
缓冲蛋白胨水(BPW)、亚希酸盐胱氨酸增菌液(SC)、四硫磺酸钠煌绿增菌液(TTB)基础、亚硫酸铋琼脂(BS)、木糖赖氨酸脱氧胆盐(XLD)琼脂、Baird-Parker 培养基基础、BHI 肉汤、营养琼脂(NA)、平板计数琼脂(PCA)、胰蛋白胨大豆琼脂(TSA)、胰酪胨大豆多黏菌素肉汤基础、甘露醇卵黄多黏菌素琼脂基础(MYP)北京陆桥技术股份有限公司;哥伦比亚血琼脂 法国科玛嘉公司;三氟乙酸(TFA)、无水乙醇、甲酸、乙腈、α-氰基-4-羟基肉桂酸(CHCA)美国Sigma 公司;Ezup 柱式细菌基因组DNA 抽提试剂盒、琼脂糖、4S GelRed 核酸染料 生工生物工程(上海)股份有限公司;Multiplex PCR Assay Kit 试剂盒、DL1000 DNA Marker(100~1000 bp)、6×Loading Buffer 宝生物工程(大连)有限公司;标准菌株 保藏于舟山市食品药品检验检测研究院内,详见表1。
VITEK MS 全自动快速微生物质谱系统、VITEK 2 ComPact 全自动微生物鉴定及药敏分析系统 法国生物梅里埃公司;NanoDrop one 核酸蛋白分析仪、Legend Micro17 型高速台式离心机 美国Thermo Fisher Scientific 公司;My Cycler 型PCR 扩增仪、Mini-PROTEAN Tetra 型垂直电泳仪、Gel Doc XR 型凝胶成像系统 美国BIO-RAD 公司。
1.2 实验方法
1.2.1 菌株培养与纯化 将表1 中所列菌株均接种于BHI 肉汤中增殖培养,其中沙门氏菌和金黄色葡萄球菌于36 ℃培养18 h,蜡样芽孢杆菌则于30 ℃培养48 h,再划线接种于NA 琼脂平板,36 ℃培养24 h[34-36],平板上纯化菌落用于后续MALDI-TOF MS和生化鉴定。
1.2.2 MALDI-TOF MS 检测
1.2.2.1 点样方式的优化 是否能获得重复性好且稳定的微生物特征性质谱图,取决于微生物样品与基质液是否形成共结晶,共结晶越均匀则重复性越好[29],因此点样方式的优化也十分关键。以金黄色葡萄球菌为模式菌考察以下不同点样方式及点样比例对质谱结果的影响。每种点样方法及比例重复点样4 次,分析鉴定结果的一致性。
a.覆盖法:移取经最优方法前处理后的上清液至靶板,待自然干燥后覆盖CHCA 基质液,室温干燥后上机检测,上清液及基质液的点样量分别为1 µL+1 µL、0.5 µL+1 µL、1 µL+0.5 µL。
b.夹心法:先取0.5 µL 基质液点样,室温干燥后覆以1 µL 样液,自然晾干后再覆盖0.5 µL 基质液。
c.混合干滴法:在点样前先将样液与基质液等比例混合,再取1 µL 混合液进行点样,待自然干燥后上机检测。
1.2.2.2 不同前处理方式的选择 样品前处理效果的优劣直接影响质谱图谱的采集质量,进而会对后续菌种鉴定的结果带来直接影响,不同的前处理方法对不同致病菌蛋白质的提取及纯化效果存在差异[37-38]。通过参考诸多文献[39-43],针对沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌三种致病菌,本实验分别采用最具代表性的三种前处理方式,分别是直涂法、改良法和甲酸乙腈法来对菌体进行破壁前处理,每种处理方式重复点样4 次,考察不同前处理方式对鉴定结果的影响。
a.直涂法:用接种环从营养琼脂平板上挑取单菌落均匀涂抹在靶板孔位中,并覆盖1 µL 基质液,待自然干燥后上机检测。
b.改良法:同直涂法取单菌落均匀涂板后,滴加1 µL 的70%甲酸,待室温晾干后覆以1 µL 基质液,再次晾干后上机检测。
c.甲酸乙腈法:从营养琼脂平板上挑取5~10 mg单菌落样本,在300 µL 灭菌超纯水中涡旋混匀1 min;再加入900 µL 无水乙醇,混匀后12000 r/min 离心2 min 弃上清,重复一次直至完全除去乙醇溶液;加入50 µL 70%的甲酸溶液破壁10 min;再加入50 µL乙腈吹打混匀,12000 r/min 离心2 min 后吸出上清;取1 µL 上清液至靶板晾干,并加1 µL 基质液涂覆,室温干燥后上机检测。
1.2.2.3 不同培养基及培养时间的优化 以革兰氏阴性菌沙门氏菌CMCC50041 和革兰氏阳性菌金黄色葡萄球菌ATCC26112 标准菌株为模式菌,考察不同培养基及培养时间对质谱鉴定结果的影响。将沙门氏菌分别接种于TSA、NA、BS、XLD、HE 五种培养基,36 ℃培养24 h,金黄色葡萄球菌则接种于PCA、NA、TSA 三种非选择性培养基上,分别在36 ℃培养24、48、72 h 后,以最优前处理方式提取蛋白后采用最佳点样方式进行点样,并上机检测。每个处理平行点样8 次,考察鉴定结果的一致性。
1.2.2.4 检测限试验 将过夜培养的沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的纯菌液分别用超纯水10 倍递增稀释至10-8浓度,同时倾注营养琼脂进行菌落计数,每个稀释度的菌液各取1 mL,12000 r/min离心2 min 后弃上清,采用最优前处理方式沉淀菌体并点样分析,每个稀释度重复处理三次,通过分析各个致病菌不同稀释度的鉴定结果以测试其检测限。
1.2.2.5 稳定性试验 将沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌分别在36 ℃培养24 h 条件下进行传代三次,每次传代后各自挑取三个菌落平行样上机检测,通过对比三种目标菌同一批次及不同批次的鉴定结果,以评价MALDI-TOF MS 检测的稳定性。
1.2.2.6 不同来源的金黄色葡萄球菌的鉴定分析不同来源的致病菌可能存在一定地域及宿主差异,在其蛋白组成和表现形式上也可能截然不同,本实验以金黄色葡萄球菌为模式菌,通过从餐饮中毒样本、食品检测样本、能力验证样本中分离出的五株金黄色葡萄球菌以及一株标准菌株进行MALDI-TOF MS 鉴定,分析对比图谱峰型,比较不同来源的金黄色葡萄球菌在蛋白表现上的差异以及MALDI-TOF MS 鉴定的准确度及可靠性。
1.2.3 多重PCR 检测比对
1.2.3.1 模板DNA 提取 取1 mL 过夜培养的菌液加入1.5 mL 离心管中,12000 r/min 离心5 min,弃上清;加入1 mL PBS 缓冲液,12000 r/min 离心5 min后,弃上清;再加入150 µL 双蒸水,振荡混匀;100 ℃煮沸10 min 后12000 r/min 离心10 min,并将上清液转移至新的离心管中,-20 ℃保存备用。
1.2.3.2 多重PCR 扩增 将沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌的DNA 模板等体积混合后进行多重PCR 反应,反应体系与反应程序分别见表2 和表3。

表3 单重PCR 反应程序Table 3 Single PCR reaction procedure
1.2.3.3 多重PCR 产物电泳检测 将沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌三种致病菌随机进行两两组合,采用优化过的多重PCR 反应体系进行PCR 扩增,并对扩增产物进行电泳,用凝胶成像仪分析电泳结果。
1.2.4 生化鉴定比对
由于个体的差异性,不同人群可能对药物的敏感性不同,本例的重点是应用本研究提出的亚组识别的方法,判断患者所适用的药物。
1.2.4.1 国标法生化鉴定 挑取1.2.1 中纯培养的金黄色葡萄球菌单菌落接种至5 mL BHI,36 ℃培养24 h 后进行血浆凝固酶试验,每瓶冻干血浆中加入0.5 mL 无菌生理盐水至完全溶解后,加入0.3 mL BHI 培养物,振荡摇匀,置于36 ℃培养,每半小时观察一次,观察6 h;挑取1.2.1 中纯培养的蜡样芽孢杆菌单菌落进行过氧化氢酶试验、动力试验、硝酸盐还原试验、酪蛋白分解试验、溶菌酶耐性试验、V-P 试验等生化试验,并观察结果。
1.2.4.2 VITEK 2 生化鉴定 挑取1.2.1 中纯培养的沙门氏菌单菌落制成0.5 麦氏浊度的菌悬液,用GN 鉴定卡片进行上机检测。
1.2.5 食品样品的致病菌检测 在本地不同超市、门市店和农贸市场随机购买散装即食食品样本100 份,每份样品均无菌采样500 g,2 h 内带回实验室检测,其中酱卤肉30 份,豆制品15 份,米饭制品20 份,凉拌菜20 份,生鲜沙拉15 份,分别无菌取样25 g 并添加225 mL 增菌液,充分均质混匀后,沙门氏菌和金黄色葡萄球菌放入36 ℃培养箱增菌18 h,蜡样芽孢杆菌则于30 ℃培养48 h。
按照GB 4789.4-2016《食品微生物学检验 沙门氏菌检验》、GB 4789.10-2016《食品微生物学检验 金黄色葡萄球菌检验》、GB 4789.14-2014《食品微生物学检验 蜡样芽孢杆菌检验》对样品中沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌进行分离培养,当各自的选择性培养基上出现可疑菌落时,对目标菌进行纯化分离后利用MALDI-TOF MS 法上机检测。
1.3 数据处理
为确保检测结果的可靠性,每次试验前需选取标准菌株大肠埃希氏菌ATCC8739 作为质控菌株进行校准,并设置仪器参数为:线性正离子模式,收集质荷比范围(m/z):2000~20000 u,激光频率48 Hz,每孔采样率100 次,加速电压20.00 kV。在检测器中放入已点样靶板,打开LaunchPad 软件,选择RuO Mode 进行待测样本的质谱分析,将采集的样本质谱图导入到SARAMIS 数据库中,根据每个特征峰的离子质量及相对强度与标准数据库中的超级图谱和参考图谱进行比对分析,软件根据不同特征峰所分配权重的不同进行计算并给出相应的鉴定分值,可信度结果以百分数表示,并根据可信度不同标识为不同颜色,具体鉴定结果判定见表4。

表4 鉴定结果判读Table 4 Interpretation of identification results
2 结果与分析
2.1 MALDI-TOF MS 检测
2.1.1 最佳点样方式的选择 以不同点样方式及比例进行点样的金黄色葡萄球菌所得图谱见图1。其中三种覆盖法点样平均鉴定得分均为99.9%,夹心法与混合干滴法平均鉴定得分均小于95%,平均峰数目分别为303、321,虽峰数较多,但多为杂峰,且基线噪音较大、峰强度较低,而三种覆盖法点样所获得的平均峰数目分别为312、301、264,基线平滑,信噪比较高,当样液与基质液以1 µL+1 µL 点样时,峰数目更多,特征峰更复杂且强度更高,因此后续试验最终选择覆盖法1 µL+1 µL 进行点样。

图1 不同点样方式及比例得到的金黄色葡萄球菌质谱图Fig.1 Spectra of Staphylococcus aureus by different sample deposition method and sample/matrix proportion
2.1.2 不同前处理方式对鉴定结果的影响 经甲酸乙腈法处理过的沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的平均鉴定得分均在98%以上,经改良法处理过的三种致病菌的平均鉴定得分分别为92.1%、98.3%、89.3%,而使用直涂法直接上机鉴定的三种致病菌的平均得分分别为84%、98%、87.3%。
虽都得到较准确鉴定,但是由图2 可知,同一种致病菌的三种处理方式下的各峰强度仍稍有差异,金黄色葡萄球菌经甲酸乙腈处理后整体出峰点更多,离子峰更密集,峰强度更高,在质荷比约为4813、6888、9633、3446 m/z 处显现多个高强度特征峰。
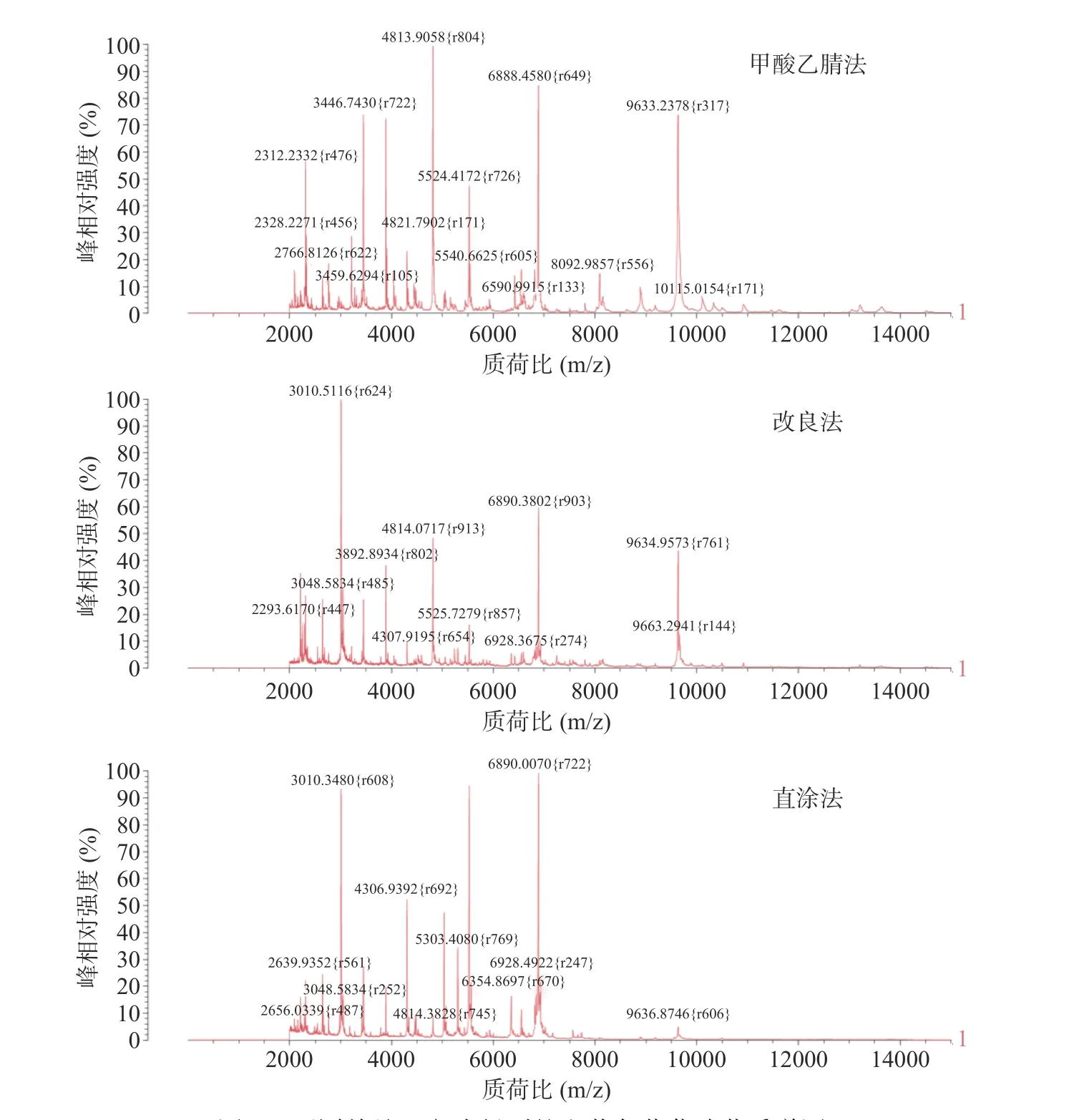
图2 不同前处理方式得到的金黄色葡萄球菌质谱图Fig.2 Spectra of Staphylococcus aureus after different pre-treatment
由图3 可知,沙门氏菌经改良法和直涂法处理后特征峰数量相较于甲酸乙腈法有所减少,特别是在质荷比约3050、3021 m/z 处峰强度极低,出峰不理想,特别是直涂法,不仅背景噪音大,而且出现多峰合并和杂峰干扰的情况,而甲酸乙腈法的图谱中图形更加复杂,离子峰也更加密集陡峭。

图3 不同前处理方式得到的沙门氏菌质谱图Fig.3 Spectra of Salmonella after different pre-treatment
而在图4 中,三种不同前处理方式的区别在蜡样芽孢杆菌的图谱中可以观察得更直观,改良法与直涂法由于菌体处理不干净导致背景噪音大、曲线漂浮严重、基线稳定性差,虽然看似出峰较多,但是多为杂峰,且出现多峰合并现象,峰型很不理想,而甲酸乙腈法则背景干净、基线十分平滑,平均峰数目为304,在质荷比5395 m/z 处出现最强离子峰,不仅质谱峰数量多、图形光滑,且出峰点清晰、峰型平稳、没有杂峰干扰和多峰合并现象。

图4 不同前处理方式得到的蜡样芽孢杆菌质谱图Fig.4 Spectra of Bacillus cereus after different pre-treatment
由试验结果可知,甲酸提取法相较于其他两种方法可获得更多的峰数量和更高的峰强度,不仅信噪比高,且与数据库中的图谱匹配度更高,因此后续试验决定使用准确性和置信度更高的甲酸乙腈法对菌体进行前处理。
2.1.3 不同培养基及培养时间对鉴定结果的影响由表5 和图5 可知,沙门氏菌在NA 和TSA 这两种非选择性培养基上可得到大于99%的平均鉴定得分,且变异系数均小于1%,出峰量多且峰型陡峭,最强离子峰相似,均在质荷比约5369、2086、6257 m/z等处出现多个高强度特征峰;而在BS、XLD、HE 这三种选择性培养基上虽也得到准确鉴定,但是平均得分相较于前者较低且变异系数更高。尤其是BS 和HE 培养基,多数离子峰出峰保守,峰型较缓,且出现杂峰干扰现象。总体而言,非选择性培养基可为目标菌的复壮提供更全面的营养,因而相较于选择性培养基可获得置信度更高的鉴定得分。

图5 NA 与TSA 培养基上的沙门氏菌质谱图Fig.5 Spectra of Salmonella on NA and TSA media

表5 沙门氏菌经不同培养基培养后的鉴定得分(%)Table 5 Identification scores of Salmonella on different media (%)
由表6 和图6 可知,将金黄色葡萄球菌接种于NA 和TSA 培养基并于36 ℃培养24 h 后,均可得到完美鉴定,平均得分均为99.9%,两者特征峰出峰量相似,峰型陡峭且最强离子峰位置并无明显差异,约在质荷比2305、4814、6890、9634 m/z 显现多个高强度特征峰,而用PCA 并以相同时间培养的目标菌质谱图上平均峰数目有所减少,峰型平缓且峰强度普遍较低,可见相比于PCA,使用NA 和TSA 培养基可获得置信度更高的鉴定结果。

表6 金黄色葡萄球菌经不同培养条件培养后的鉴定得分(%)Table 6 Identification scores of Staphylococcus aureus in different cultivation conditions (%)
随着培养时间的延长,质谱图的匹配性逐渐降低,目标菌在培养48 h 和72 h 后,不论是哪一种培养基,平均得分均有所下滑,特别是PCA 在72 h 后平均得分降至84.15%,变异系数达到了8.78%,不仅基线噪音大、出现多峰合并,且在若干个离子峰处出现峰型偏移,整体峰型不理想。
过长的培养时间可使细菌进入稳定期和衰亡期,稳定期时的菌体会产生大量的代谢产物,而衰亡期时菌体则易发生自溶现象,细菌合成的蛋白很可能与对数期合成的蛋白不同,导致部分特征峰的缺失[44],因而当菌株培养时间过长时,图谱的匹配率降低,鉴定结果的准确性也随之下降,经分析,选择NA 培养基培养24 h 作为后续试验菌株的培养条件。
2.1.4 检测限试验结果 根据平板计数的结果,再乘以稀释倍数可算出沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌初始菌液浓度分别为4×108、2×108、3×107CFU/mL,由表7 试验结果可知,当沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌菌液浓度分别处于4×108~4×105、2×108~2×105、3×107~3×105CFU/mL时,鉴定结果较准确,而当菌液浓度降至105CFU/mL 以下时,无法得到鉴定结果,虽然通过观察图7和图8 可知,当目标菌在104~102CFU/mL 菌浓度时,依然有多个出峰点,如沙门氏菌在质荷比约2093、2426 m/z 等处出现离子峰,而蜡样芽孢杆菌在菌液浓度稀释至106CFU/mL 时最强离子峰5395 m/z 消失,而降至低浓度102CFU/mL 时仍在质荷比约2092、2425 m/z 等处峰型显现,分析原因可能有两种,一是确实仍有少量菌体蛋白检出,二是在前处理步骤挑取菌落时,可能刮取到些许培养基,而培养基中多含有蛋白质或多糖等其他物质,因此可能会显现少量离子峰,但是总体蛋白量太少无法准确匹配数据库,置信度极低,因此确定三种目标菌的检测限分别为4×105、2×105、3×105CFU/mL。

图8 蜡样芽孢杆菌灵敏度Fig.8 Sensitivity of Bacillus cereus
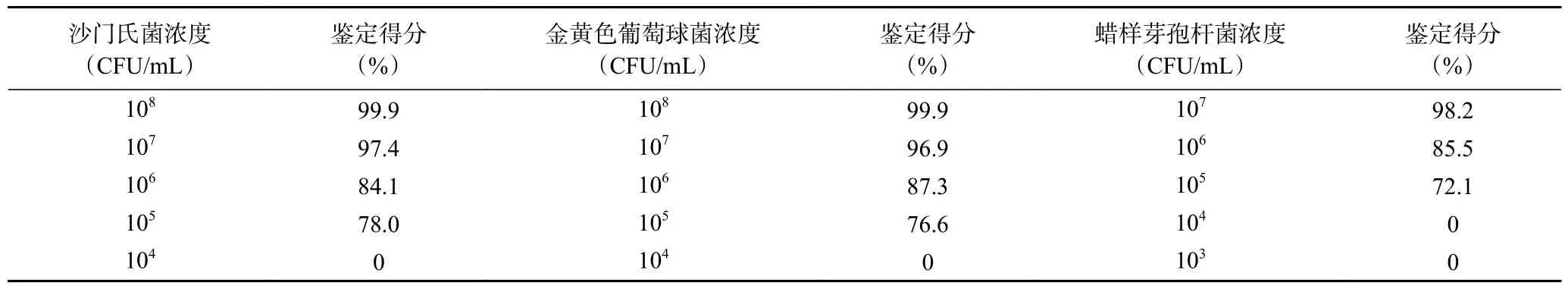
表7 检测限试验结果Table 7 Results of the detection limit
2.1.5 稳定性试验结果 由表8 试验结果可知,同一批次的三个菌落平行样之间鉴定结果异常接近,且不同传代次数的鉴定结果也高度一致,得分均大于95%,变异系数均小于2%,尤其是金黄色葡萄球菌,不论是同一批次或是不同批次鉴定得分完全一致,均为99.9%,且图谱之间相似度极高。因篇幅所限,以沙门氏菌为例,图9 只列出了同一批次沙门氏菌的不同传代次数的六张质谱图,由图谱可见,六者出峰量相似,均在质荷比2420、5369、7266、9251 m/z 处离子峰强度增强,其余质荷比处线型平滑,无杂峰干扰,与数据库图谱匹配性较高,可见该方法具有良好的重复性和稳定性。

图9 同一批次沙门氏菌的不同传代次数的质谱图Fig.9 Spectra of different passages of Salmonella from the same batch

表8 稳定性试验结果Table 8 Results of the detection stability
2.1.6 对不同来源的金黄色葡萄球菌的鉴定与分析结果 按照最佳前处理方式对六株不同来源的金黄色葡萄球菌进行MALDI-TOF MS 检测,获得六株菌株的质谱鉴定结果和不同蛋白指纹图谱,详见图10。
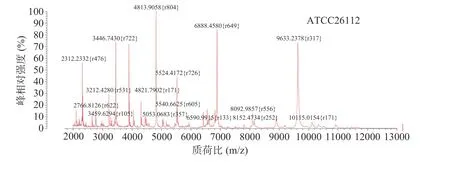
图10 不同来源的金黄色葡萄球菌鉴定结果Fig.10 Results of identification of Staphylococcus aureus from different sources
除了W170130 鉴定得分为86%外,其余鉴定得分均为99.9%,通过分析对比不同离子峰型及原始数据,得出六株目标菌主要的离子峰集中在质荷比2312、3446、4813、6888、9633 m/z 附近,可能是金黄色葡萄球菌的特异性生物标志峰。其中B089 和W152001 整体峰型与ATCC26112 较相似,出峰点清晰,峰型陡峭且密集,均在4814、6889 m/z 处出现两波最强离子峰,而R160747 和W170130 则峰型保守,峰数目较少且峰强度偏低,尤其是W170130 整体峰型偏缓,各个离子峰之间强度差异不显著,或许是某些蛋白未完全溶出导致特征峰缺失而影响最终鉴定得分较低,而在R140715 中虽然多个高强度特征峰与ATCC26112 相似,出峰点清晰且丰度较高,但是在质荷比4814、6890、9636 m/z 等处出现多个特征峰的明显左移。
2.2 多重PCR 比对结果
将三种致病菌随机两两组合,采用优化过的多重PCR 反应体系进行PCR 扩增,由图11 可知,多重PCR 反应均能特异性地扩增出目的片段,扩增片段大小分别为沙门氏菌273 bp、金黄色葡萄球菌164 bp、蜡样芽孢杆菌139 bp,扩增产物与预期片段大小一致,表明多重PCR 法可用于同时检测沙门氏菌、金黄色葡萄球菌、蜡样芽孢杆菌三种致病菌中的一种或几种。

图11 多重PCR 反应特异性Fig.11 Specificity of multiplex PCR reaction
2.3 生化鉴定比对
2.3.1 国标法生化鉴定结果 金黄色葡萄球菌试验株血浆凝固酶0.5 h 后呈现凝固,即判定为阳性;蜡样芽孢杆菌试验株过氧化氢酶、硝酸盐还原、酪蛋白分解、溶菌酶耐性、卵黄反应、V-P 试验均为阳性,有动力,在TSSB 平板上为不透明、似白色毛玻璃状,有草绿色溶血环的浅灰色菌落,而在NA 平板上呈粗糙山谷状生长形态。
2.3.2 VITEK 2 生化鉴定结果 GN 鉴定卡可对革兰氏阴性菌的64 项生化指标进行鉴定,沙门氏菌试验株鉴定结果为98%概率为Salmonella group,主要生化试验结果见表9。

表9 沙门氏菌生化试验Table 9 Biochemical test for Salmonella
2.4 食品样本的检测结果
从100 份散装即食食品样本中共分离得到24 株目标菌,其中沙门氏菌4 株,金黄色葡萄球菌14 株,蜡样芽孢杆菌6 株,在五大类食品样本中,酱卤肉等食品均存在至少被一种致病菌污染的情况,沙门氏菌检出率最低,主要存在于凉拌菜和酱卤肉制品中,熟肉制品由于营养丰富,更适合沙门氏菌的生长繁殖;金黄色葡萄球菌检出率最高,凉拌菜、寿司、生鲜沙拉等食品样本均受到金黄色葡萄球菌不同程度的污染,其中在寿司食品样本中污染量最高,为1600 CFU/g,超出GB 31607《散装即食食品中致病菌限量》规定的限量值(≤1000 CFU/g)。据文献报道[45],当食品中该菌的含量低于103CFU/g 时一般不产生肠毒素,而当其含量高于103CFU/g 时,因其菌体大量生长繁殖,会产生肠毒素,100 ℃加热30 min 不被破坏。成人仅食用100 ng 肠毒素即可引起食物中毒,建议尽量少食凉拌菜、寿司、生鲜沙拉等生食、半生食食品。
蜡样芽孢杆菌主要于寿司等米面制品中检出,因散装米面制品在售卖时常常暴露于空气中,人员密集加上环境湿润,成了蜡样芽孢杆菌污染的重灾区,本次检测结果显示共有6 份寿司样本检出蜡样芽孢杆菌,其中最高污染量为280 CFU/g,虽未达到国标中规定的最大限量10000 CFU/g[1],但是也有可能带来食物中毒的风险,出现呕吐、腹泻等症状[6,46]。综上所述,在五大类散装即食食品中均有致病菌检出,具体目标菌检出情况见表10。

表10 目标菌检出情况Table 10 Detection of target bacteria
从不同散装即食食品样本中分离到的三种致病菌的质谱图见图12~图14。沙门氏菌样品分离株与标准菌株不同,其在质荷比6094 m/z 附近出现两波最强离子峰,其余出峰点强度较低,峰型偏缓,基线轻微漂浮,信噪比偏低,与标准菌株均在质荷比2098、4761、7266、9528 m/z 附近显现主要离子峰;蜡样芽孢杆菌样品分离株整体出峰量较少且强度偏低,质荷比主要在4810、5395 m/z 两处相应的峰强度增强,与标准菌株相比峰数目相似,整体出峰保守,峰型极缓,且均在质荷比5395 m/z 处出现最强离子峰;金黄色葡萄球菌分离株与标准菌株特征峰出峰量相似度极高,峰型陡峭且离子峰高度密集,两者均在质荷比2312、3447、4813、6890、9636 m/z 等多处显现高强度特征峰,从对比图可见,或由于金黄色葡萄球菌肽段种类多且复杂程度高,特征峰数目多且强度较高,因此相较于沙门氏菌与蜡样芽孢杆菌,质谱鉴定得分普遍较高。通过三株样品中的分离目标菌的质谱图与相关标准菌株的质谱图进行对比可见,虽然不同的特征峰强度稍显差异,但是整体峰型走势相似度极高,且各特征峰的离子质量均在误差范围之内。

图12 沙门氏菌质谱图Fig.12 Spectra of different Salmonella

图13 金黄色葡萄球菌质谱图Fig.13 Spectra of different Staphylococcus aureus

图14 蜡样芽孢杆菌质谱图Fig.14 Spectra of different Bacillus cereus
3 讨论与结论
传统检测方法不仅操作繁琐、费时费力,对食物中毒的信息诊断滞后,而且在平板菌落的挑取过程中,若相关检测人员缺乏经验或并未熟悉各种致病菌的菌落形态和生化特性的话,很容易出现肉眼判断误差,造成错判漏检,已难以满足食源性疾病时效性与准确性的要求,特别是在大批量的食品样本检测过程中,这种缺点体现地更加明显。比如在用国标法对某些致病菌进行检测时或需要6~7 d 才能观察结果,因为它依赖于致病菌繁殖到可见菌落的能力;此外当细菌进入活的不可培养状态(Viable but nonculturable state,VBNC)时,其无法正常在培养基上生长而形成肉眼可见的菌落而导致无法从污染样品中分离到致病菌或大大低估该致病菌的数量[33]。而MALDI-TOF MS 是一种基于蛋白质检测的新型微生物鉴定手段,由于每种微生物都是由独特的蛋白质组成,蛋白质约占细胞干重的50%,表达均由遗传性状决定,受到外界环境的影响较小[17],因此蛋白质的不同种类可以作为微生物鉴定的生物标志物[19]。MALDI-TOF MS 不仅所需辅助试剂较少,操作便捷,检测时间较短且准确高效,数据也有利于鉴定分析,作为国标法的有力补充,为食源性致病菌的鉴定、分型、溯源等提供了新的选择[47],但其鉴定结果受样品处理方法、数据库完善程度等因素的影响[48-49]。而是否能获得重复性好且稳定的微生物特征性质谱图,则取决于微生物样品与基质液是否形成共结晶,共结晶越均匀则重复性越好[49],因此点样方式和前处理方式的优化都十分关键。
相较于夹心法和混合干滴法,覆盖法点样可获得的平均峰数目更多,信噪比较高,特征峰更复杂且强度更高。而在前处理方式上,由于革兰氏阳性菌的细胞壁含有肽聚糖和磷壁酸,一般厚度较厚,使用直涂法无法充分破坏肽聚糖,而不完全的菌体裂解可能导致蛋白质的流失,从而影响鉴定结果,因此直涂法往往由于菌体处理不干净导致背景噪音大、基线稳定性差,有多峰合并和杂峰干扰现象,而甲酸提取法不论是处理革兰氏阴性菌还是革兰氏阳性菌,相较于其他两种方法可获得更多的出峰量和更高的峰强度,且与数据库中图谱匹配度更高。
质谱图中的每个谱峰均来源于致病菌细胞膜或细胞壁上的蛋白质经过激光解吸后发射的信号,由于不同种、属间的致病菌都有自己特有的表面特征蛋白,因此可得到不同的特征性谱峰[49],但利用直涂法和改良法进行前处理时给予的信息较少,不能完全反映菌体的结构特征,而甲酸提取法则是将菌体的细胞壁破碎进行全菌体制备,因而更容易获得致病菌的特征谱峰。
MALDI-TOF MS 法在致病菌鉴定方面不仅灵敏、稳定、特异,且操作简便、结果直观,但如果图谱采集效果不佳,则会严重影响数据的分析,进而对后续菌种鉴定的结果带来直接影响,而对质谱图谱的采集质量产生干扰的因素有很多,比如样品在前处理时若培养基成分洗涤不净,则培养基中蛋白质成分经固定析出后,会出现大量低能量端背景信号,从而干扰图谱的采集;在点样时待样液自然干燥后必须尽快覆以基质液,否则易造成蛋白质氧化,不利于图谱采集;在用甲酸乙腈法进行样品处理时,必须让乙醇充分挥发,否则会影响蛋白的溶出,导致图谱采集信号较弱。MALDI-TOF MS 在血清分型、细菌多位点序列分型等细菌分型、蛋白组学等方面的研究已受到越来越多的关注,本文也通过对沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌的蛋白指纹图谱特征峰的比对分析,为后续挖掘这三种目标菌的具体蛋白生物标志物的研究工作奠定了基础。MALDI-TOF MS 技术不仅为食源性致病菌的分析鉴定与分型溯源提供了思路,也为食品检验检测工作的高效有序展开奠定了良好基础,可极大地确保食品质量、预警食品安全,也将更全面地为人民群众“舌尖上的安全”保驾护航,为食品安全放心工程添砖加瓦,为食品安全共治格局提供强有力的技术支撑。

