利用乳酸乳球菌发酵大豆蛋白产低聚肽的研究
卢美欢,仝泽方,马英辉,张美丽,李利军
(陕西省微生物研究所,陕西西安 710043)
大豆是我国主要经济作物,含有丰富的油脂和植物蛋白等,蛋白含量达到35%~40%,具有很好的营养价值和生物活性[1]。大豆蛋白肽是大豆蛋白经酸解或酶解作用后,通过分离、精制等特殊处理而得到的蛋白质水解产物,而低聚肽则通常是由3~6 个氨基酸组成,且相对分子质量低于1000 Da 的低肽混合物[2]。大豆蛋白肽进入人体肠胃后不需要经过消化酶作用,可以直接被吸收,利用效果优于游离氨基酸,因此对于病弱人群是理想的蛋白营养源。同时大豆蛋白肽还具有较低的抗原性、调节免疫力、抗衰老、降低胆固醇、降血压、抗氧化等生物活性和生理功能[3-4]。目前,常采用酶解法和微生物发酵法生产大豆蛋白肽,但酶制剂价格昂贵导致酶解法生产成本高,同时酶解后容易产生苦味肽,影响产品口感,微生物发酵法生产蛋白肽则可以把酶的生产和应用合二为一,成本更低,而且发酵生产过程中可以去除大豆肽苦味,具有更好的口感[5-8]。目前报道可用于大豆蛋白水解的微生物有枯草芽孢杆菌[9]、植物乳杆菌[10]、蛹拟青霉[11]、酵母[12]、米曲霉[13]、短小芽孢杆菌[14]等。
乳酸乳球菌是常用的食品微生物,应用领域有乳品发酵、奶酪加工、泡菜和酸面团等[15]。乳酸乳球菌应用于乳品发酵研究较成熟,它可以将乳品中的乳糖转化为乳酸,同时自身的肽酶和分泌的蛋白酶可以促进乳品的蛋白质水解[16]。随着植物蛋白应用越来越广泛,乳酸乳球菌也开始逐渐用于植物蛋白的发酵分解,相对于其他发酵菌,利用乳酸乳球菌生产植物蛋白制品更安全,具有低免疫原性、降低大豆蛋白肽系酸力的优点,乳酸乳球菌在发酵过程中产生的乳酸菌素也可以起到天然防腐的作用[17]。同时由于乳酸乳球菌良好的遗传稳定性,是产业化理想的生产菌株[18-19]。
为深入开发大豆蛋白资源,从自制泡菜中筛选了一株蛋白转化能力好的菌株PZ1,经鉴定为乳酸乳球菌,对该菌进行了全基因组测定,并分析了该菌株的蛋白分解能力,利用该菌发酵大豆分离蛋白产低聚肽,对低聚肽进行了抗氧化活性研究。
1 材料与方法
1.1 材料与仪器
乳酸乳球菌(Lactococcus lactis)PZ1 从自制泡菜中分离获得,已保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO.M 2 022398;米曲霉(Aspergillus oryzae)、植物乳杆菌(Lactobacillus plantarum)、枯草芽孢杆菌(Bacillus subtilis)本实验室保存菌种;MRS 培养基 蛋白胨10 g、牛肉膏5 g、酵母粉4 g、葡萄糖2 g、吐温80 1 mL、磷酸氢二钾2 g、乙酸钠5 g、柠檬酸三铵2 g、硫酸镁0.2 g、硫酸锰0.05 g、琼脂15~20 g、水1000 mL,pH6;大豆分离蛋白培养基 大豆分离蛋白2%,葡萄糖0.5%;98%大豆分离蛋白、Gly-Gly-Tyr-Arg、维生素C(VC)上海源叶生物科技有限公司;DNA 提取试剂盒 天根生化科技(北京)有限公司;DPPH Sigma公司;硫酸亚铁、水杨酸、邻苯三酚、乙醇 天津市天力化学试剂有限公司;过氧化氢 成都市科龙化工试剂厂;盐酸 成都市科隆化学品有限公司;聚乙二醇标准品 上海子起生物科技有限公司。
FA2104N 电子天平 上海精其仪器有限公司;722 分光光度计 天津市普瑞斯仪器有限公司;DHP-9162 恒温培养箱 太仓科教仪器厂;TH2-C 恒温摇床 太仓市实验设备厂;GeneAmp PCR Syetem 9700 基因扩增仪 美国ABI 公司;HC-2518R 高速冷冻离心机 安徽中科中佳仪器有限公司;BONAGM-011 超滤仪 山东博纳生物科技集团有限公司;PL-GPC 220 凝胶渗透色谱仪 美国Agilent 公司。
1.2 实验方法
1.2.1 菌株筛选 从自制泡菜中收集液体,对液体进行梯度稀释,分别将102、103、104倍稀释液100 µL,涂布于MRS 培养基中,32 ℃恒温培养2 d,挑取单菌落继续在MRS 培养基中划线纯化,获得纯菌株,在大豆分离蛋白培养基中培养,以大豆多肽含量为指标考察菌株对大豆分离蛋白的发酵分解效果,选取效果最好的一株菌命名为PZ1。
1.2.2 菌株鉴定 形态鉴定:PZ1 菌株在MRS 平板上培养,观察菌落形态,具体方法参照《常见细菌系统鉴定手册》[20]。
16S rDNA 鉴定:利用细菌基因组DNA 快速抽提试剂盒提取菌株PZ1 的总DNA,采用16S rDNA通用引物7F:5'-CAGAGTTTGATCCTGGCT-3'和1540R:5'-AGGAGGTGATCCAGCCGCA-3'进行PCR扩增,扩增程序:94 ℃ 4 min,94 ℃ 45 s,55 ℃ 45 s,72℃ 1 min,72 ℃ 10 min,4 ℃保存。PCR 扩增产物送上海生工公司测序,获得的16S rDNA 基因序列在NCBI 网站上进行比对分析。
1.2.3 菌株PZ1 全基因组测定及蛋白水解相关酶分析 将菌株PZ1 送北京百迈克公司Nanopore 测序技术平台进行全基因组测序。全基因组序列提交GenBank,登录号为PRJNA912843。利用基因和蛋白注释数据库对PZ1 的蛋白酶和肽酶等蛋白水解相关基因进行分析。
1.2.4 不同微生物发酵大豆分离蛋白产多肽的比较
将米曲霉、植物乳杆菌、枯草芽孢杆菌(纳豆菌)和乳酸乳球菌PZ1 分别接种至大豆分离蛋白培养基,32 ℃发酵2 d,发酵液测大豆多肽含量和蛋白总量,计算多肽转化率,多肽转化率(%)=肽含量/蛋白总量×100。蛋白总量采用凯氏定氮法测定[21]。
1.2.5 大豆多肽含量测定
1.2.5.1 标准曲线的制作 大豆多肽含量测定参照双缩脲法测定[22]。称取Gly-Gly-Tyr-Arg 四肽20 mg,加入10 mL 5%的TCA 溶解,即为四肽标准溶液。用5% TCA 分别配制浓度为0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 和 1.8 mg/mL 的 Gly-Gly-Tyr-Arg 标准溶液。分别取标准溶液0.75 mL,加入0.5 mL 双缩脲试剂,在漩涡混合器振荡混合均匀,静置10 min,2000 r/min,离心10 min,取上清液在540 nm 下测定OD 值,以不加四肽标准溶液管为空白对照测吸光度值,每个浓度做2 个平行。以四肽的浓度作横坐标x(mg/mL),吸光度(OD 值)作纵坐标y,制作标准曲线。得到标准曲线方程为y=0.1026x-0.0086,R2=0.9933。
1.2.5.2 多肽的测定 大豆分离蛋白经微生物发酵后,测定发酵液中多肽含量,样品用蒸馏水配成一定浓度后,取1.0 mL,加入1.0 mL 10%三氯乙酸(TCA)溶液,混合均匀后静置10 min,离心机4000 r/min 离心15 min,取0.75 mL 上清液转移至2 mL 离心管中,加入0.5 mL 双缩脲试剂,后续操作同1.2.5.1,吸光值与标准曲线对照,即可得到样品的多肽含量(mg/mL)。
1.2.6 大豆多肽的分子量分析 采用安捷伦PLGPC 220 凝胶渗透色谱仪进行大豆多肽的分子量分析,检测器为PL-GPC 50(RI),色谱柱为PL aquqgel-OH MIXED 8 μm 两根串联,洗脱液为超纯水,流速1 mL/min,温度30℃,样品用蒸馏水溶解后配成浓度1 mg/mL,用0.22 μm 膜过滤,取10 μL 上样测试。以聚乙二醇分子量标准品进行分子量分析。
1.2.7 大豆低聚肽的制备 乳酸乳球菌PZ1 转接至MRS 斜面活化24 h,用接种环取2 环接种至灭菌的大豆分离蛋白培养基中,32 ℃培养48 h,得大豆蛋白发酵液PZ1,将大豆蛋白发酵液放置在-20 ℃冰箱冷冻12~24 h,取出室温解冻,超声破碎15 min,超声功率为800 W,用离心管装超声后的溶液在离心机中以10000 r/min,离心10 min。取上清液在超滤装置中进行超滤,分别过5000、1000 和300 Da 的有机膜,收集300~1000 Da 之间的滤液,得低聚肽粗品,冷冻干燥后保存(-20 ℃)备用。采用1.2.5 方法测定粗品中低聚肽含量,并配成合适浓度进行活性测定。
1.2.8 低聚肽抗氧化活性测定 低聚肽、大豆分离蛋白和阳性对照维生素C(VC)分别用蒸馏水稀释,配成浓度梯度为2、1.6、1.2、0.8、0.4、0.1 mg/mL。参考卢美欢等[23]测定低聚肽、大豆分离蛋白和VC的抗氧化活性,分别检测对DPPH 自由基、羟基自由基(·OH)、超氧阴离子自由基(O2-·)的清除效果。
1.3 数据处理
实验数据采用Excel 2021 和DPSv7.05 数据系统进行统计分析,显著性水平分析采用 Duncan’s 新复极差法。
2 结果与分析
2.1 菌株PZ1 的鉴定
PZ1 菌株在MRS 平板上培养,观察菌落形态,并进行革兰氏染色。菌落形态如图1 所示,菌落凸起,乳黄色,表面光滑,湿润,革兰氏染色显紫色,为阳性菌。显微观察菌株形态为圆球状,大小约0.5 μm。

图1 PZ1 菌株的菌落形态(左)和革兰氏染色显微图片(×1000)(右)Fig.1 Colony morphology of strain PZ1 (left) and Gram stain micrograph (×1000) (right)
提取PZ1 菌株DNA,以该DNA 为模板,采用16S rDNA 通用引物进行PCR 扩增,电泳检测获得约1400 bp 的单一特异性条带(图2A)。PCR 产物进行测序,序列长度为1441 bp,通过NCBI 在线比对,显示菌株PZ1 与乳酸乳球菌基因序列同源性达100%,初步判定菌株PZ1 为乳酸乳球菌(Lactococcus lactis)。提取乳酸乳球菌PZ1 的总DNA,利用Nanopore 测序技术平台进行全基因组测序。对乳酸乳球菌PZ1 的全基因组序列进行Nr 同源物种分布分析,结果显示与乳酸乳球菌的同源性为98.34%(图2B),系统进化树分析显示菌株PZ1 和乳酸乳球菌的亲缘最近(图2C)。将乳酸乳球菌PZ1 保藏于中国典型培养物保藏中心,保藏号为CCTCC NO.M 2022398。

图2 PZ1 菌株的16S rDNA PCR 扩增结果(A)、Nr 同源物种分布(B)和系统进化树分析(C)Fig.2 PCR amplification of the 16S rDNA fragmen (A),Nr homologous species distribution (B) and phylogenetic tree analysis of strain PZ1 (C)
2.2 乳酸乳球菌PZ1 的全基因组分析
乳酸乳球菌PZ1 的全基因组测序共得到4083885878 bp Clean Data,组装后完整基因组总长2136240 bp,GC 含量(鸟嘌呤G 和胞嘧啶C 所占的比率)为34.86%。通过Nr 数据库注释(表1),搜索和肽酶、蛋白酶相关基因,发现PZ1 含有肽酶Peptidase、二肽酶Dipeptidase、内肽酶Endopeptidase、羧肽酶Carboxypeptidase、氨肽酶Aminopeptidase 等肽酶基因。通过Swissprot 数据库注释,乳酸乳球菌PZ1 除了存在多种肽酶基因,还发现了多种蛋白酶protease 基因。已有研究表明,蛋白酶的作用是将外源蛋白进行降解,生成大分子肽,肽酶则将大分子肽水解为小分子肽和氨基酸[24]。内肽酶可以切除肽链内部的氨基酸,氨肽酶和羧肽酶都属于外切蛋白酶,氨肽酶在肽链N-末端切除氨基酸,羧肽酶则专一性从肽链的C-末端切除氨基酸,同时羧肽酶可以将短肽末端的疏水性氨基酸切除,达到脱苦的目的[25]。结合以上分析可见乳酸乳球菌PZ1 既能产生蛋白酶和多种肽酶将大分子蛋白质分解成短肽,也能产生羧肽酶达到脱苦的目的。

表1 菌株PZ1 在Nr 和Swissprot 数据库注释的蛋白酶相关基因Table 1 Protease-related genes in strain PZ1 annotated in Nr and Swissprot databases
2.3 不同微生物发酵大豆分离蛋白产多肽的比较
分别采用3 株米曲霉,植物乳杆菌、枯草芽孢杆菌(纳豆菌)和乳酸乳球菌PZ1 发酵大豆分离蛋白,测发酵后的多肽含量,计算多肽转化率见图3。3 株米曲霉对大豆分离蛋白的多肽转化率均低于20%,枯草芽孢杆菌的转化率为47.84%,植物乳杆菌的多肽转化率为85.08%,乳酸乳球菌PZ1 的转化率最高,为88.27%,说明PZ1 可以较好地分解大豆蛋白。该结果进一步证实了PZ1 存在蛋白酶和肽酶基因,可以将蛋白分解为多肽。其他研究也表明乳酸菌可以有效分解大豆蛋白,如刘海燕[26]利用乳酸菌发酵豆粕,可以将豆粕中大分子蛋白质降解为小分子肽,而且增加了豆粕中游离氨基酸含量。何勇锦等[27]利用乳酸短杆菌KLDS-1 降解豆粕粉,经生料厌氧发酵后小肽含量达26.12%,比发酵前提高了22.81%。聂庆杰等[28]采用乳酸乳球菌17 发酵豆粕取得良好的发酵效果,大豆球蛋白降解率为37.29%。和现有研究相比,本研究乳酸乳球菌PZ1 分解大豆蛋白的效率更高,值得进一步开发利用。
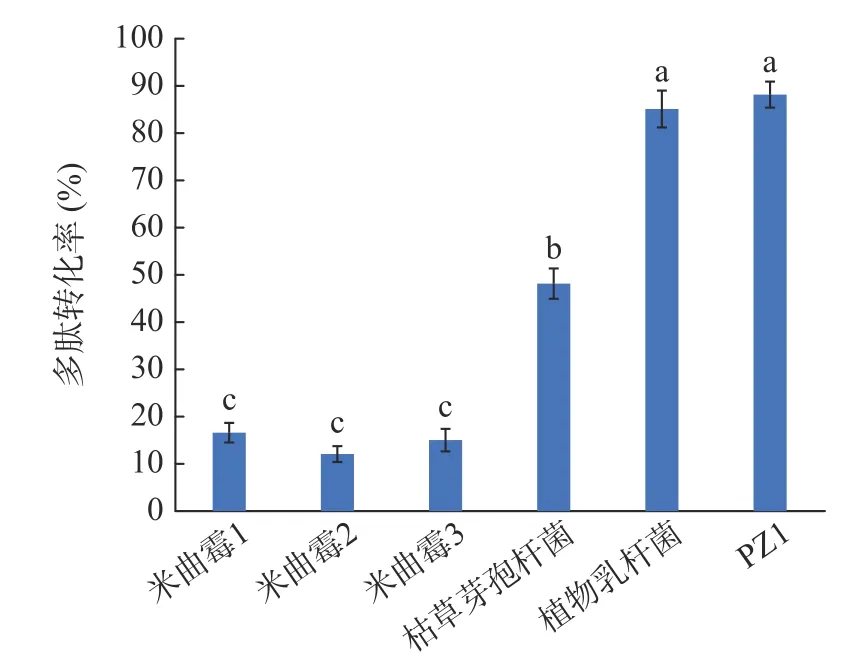
图3 不同微生物发酵大豆分离蛋白产多肽的转化率Fig.3 Conversion rate of polypeptides from soybean protein isolate fermented by different microorganisms
2.4 乳酸乳球菌PZ1 发酵大豆分离蛋白的分子量分析
乳酸乳球菌PZ1 在大豆分离蛋白培养基中发酵培养后,分别将发酵前和发酵后的蛋白溶液进行凝胶渗透色谱分析,色谱图见图4(A)。经PZ1 发酵后的大豆分离蛋白出峰时间更滞后,说明大豆分离蛋白被分解成小分子的多肽。将发酵前和发酵后的蛋白分子量分布进行统计分析,结果如图4(B)所示。结果表明,发酵前的大豆蛋白分子量主要集中在5000 Da以上,占比为76%,分子量1000 Da 以下仅占1%;经PZ1 分解后大豆多肽分子量≤1000 Da 的比例达85%,而分子量在3000~5000 Da 的多肽则只有1%,此外,分子量1000~3000 Da 比例为14%。WEN 等[29]采用中性蛋白酶和碱性蛋白酶对大豆蛋白进行混合酶解,获得87.92%分子量≤1000 Da 的大豆肽,1000~3000 Da 的比例为11.03%,和本研究的分解效果接近,说明采用乳酸乳球菌PZ1 发酵大豆蛋白可以获得较好的降解效果。有资料表明,乳酸菌发酵过程中可以将外源蛋白水解为能直接利用的氨基酸,从而维持自身的正常生长[30]。本研究使用的大豆蛋白培养基只含少量的碳源,其余都是大豆蛋白,营养要素匮乏促使乳酸乳球菌PZ1 分泌大量的蛋白酶类对大豆蛋白进行水解,在维持自身生长的同时也产生了大量小分子低聚肽。

图4 大豆分离蛋白发酵前和PZ1 发酵后的凝胶渗透色谱分析(A)及分子量分布(B)Fig.4 Gel permeation chromatography analysis (A) and molecular weight distribution (B) of soy protein isolate before and after fermentation of PZ1
2.5 低聚肽抗氧化活性测定
根据资料报道,分子量在多肽的生物活性中起着关键作用,分子量低于1000 Da 的低聚肽具有更高的生物活性[31],在增强免疫力、抗氧化作用、吸收性方面均优于分子量较大的多肽[32]。本文通过微生物降解大豆分离蛋白为低聚肽,研究其抗氧化活性。乳酸乳球菌PZ1 发酵大豆分离蛋白后,按照1.2.7 方法进行低聚肽的制备。同时配制相同浓度的大豆分离蛋白和VC测定抗氧化活性。结果显示,在0.1~2 mg/mL 范围内,大豆低聚肽清除DPPH 自由基、羟基自由基和超氧阴离子自由基能力均大于大豆分离蛋白(见图5)。而且随着蛋白溶液浓度的增大,清除率也逐渐增大。浓度为2 mg/mL 时,大豆低聚肽和大豆分离蛋白清除DPPH 自由基能力分别为79.31%和59.92%,清除羟基自由基能力分别为78.27%和60.18%,清除超氧阴离子自由基能力分别为84.62%和66.49%,可见低聚肽的抗氧化活性优于大豆分离蛋白,说明低聚肽具有更好的保健功效。大豆低聚肽清除DPPH 自由基、羟基自由基和超氧阴离子自由基的IC50分别为0.32、0.36、0.26 mg/mL。与阳性对照维生素C(VC)相比,在0.1~2 mg/mL 范围内,VC对DPPH 自由基清除能力优于大豆低聚肽,对羟基自由基清除能力两者没有较大差别,对超氧阴离子自由基清除能力则大豆低聚肽优于VC。

图5 大豆低聚肽和大豆分离蛋白对DPPH自由基、羟基自由基(·OH)和超氧阴离子自由基(O2-·)的清除率Fig.5 Scavenging rate of soy oligopeptide and soy protein isolate on DPPHfree radical,hydroxyl freeradical (·OH) and superoxidefreeradical (O2-·)
3 结论
本研究从泡菜中分离出一株乳酸乳球菌PZ1,具有分解大豆蛋白的能力,全基因组分析PZ1 菌株具有多种肽酶和蛋白酶基因,包括肽酶、二肽酶、内肽酶、羧肽酶、氨肽酶等基因。利用PZ1 发酵大豆分离蛋白,产生的多肽分子量集中在1000 Da 以下,达到85%,分子量1000~3000 Da 比例为14%。通过对大豆分离蛋白发酵液的超滤纯化,获得了300~1000 Da 的低聚肽。研究了大豆低聚肽的抗氧化活性,发现大豆低聚肽清除自由基能力均大于大豆分离蛋白,浓度为2 mg/mL 时,大豆低聚肽对DPPH自由基、羟基自由基(·OH)和超氧阴离子自由基(O2-·)的清除率分别为79.31%、78.27%和84.62%。综上所述,乳酸乳球菌PZ1 可作为大豆蛋白的降解菌株,在生产功能性低聚肽产品具有潜在的应用价值。

