基于细胞模型和网络药理学探究儿茶素抗炎、抗癌的构效关系
应思慧,鲁 森,陈忠正,张媛媛,李 斌,林晓蓉
(华南农业大学食品学院,广东广州 510642)
茶叶为当今世界三大无酒精饮料之一,以其抗氧化[1]、抗炎[2]、抗癌[3]、益思提神[4]、降压减脂[5-6]等健康功效而广受人们喜爱。茶多酚是茶叶中具有突出健康功效的主要理化组分,其含量约占茶叶干重的18%~36%,其中以儿茶素类占比最高,达茶多酚类总量的70%~80%[7]。儿茶素是一类以2-苯基苯并二氢吡喃环为基本结构的黄烷醇类化合物,包括表儿茶素(epicatechin,EC)、儿茶素(catechin,C)、表没食子儿茶素(epigallocatechin,EGC)、没食子儿茶素(gallocatechin,GC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、儿茶素没食子酸酯(catechin gallate,CG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)等8 种主要单体(图1),具有抗氧化、消炎、抗癌、神经保护与抗肿瘤细胞血管生成等多种功能特性[8]。根据B 环羟基数目,可将8 种儿茶素单体分为焦酚型(B 环为含有三个羟基的没食子基,包括EGC、GC、EGCG、GCG)和儿茶酚型(B 环为含有两个相邻羟基的儿茶酚基,包括EC、C、ECG、CG);根据C 环C3连接基团,可分为酯型(C 环C3的-OH 与没食子酸酯化形成没食子酰基,包括ECG、CG、EGCG、GCG)和非酯型(EC、C、EGC、GC);根据C 环C2、C3不同取代基的空间位置,又可分为顺式构象(C2上的B 环和C3上的羟基或没食子酰基在环平面的同一侧,包括EC、EGC、ECG、EGCG)和反式构象(C2上的B 环和C3上的羟基或没食子酰基不在环平面的同一侧,包括C、GC、CG、GCG)[7]。
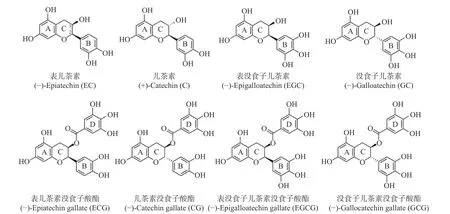
图1 8 种儿茶素单体的化学结构Fig.1 Chemical structure of eight catechin monomers
儿茶素的功能活性与其化学结构密切相关。研究表明,酯型儿茶素比非酯型儿茶素具有更强的抗氧化[9-10]、抗肿瘤增殖[11-13]、抗肥胖[14-15]、抗过敏[16]等活性;焦酚型儿茶素B 环的邻苯三酚结构有助于增强其抗氧化[17-18]、抗肿瘤[19]活性,但焦酚型儿茶素抑制口腔肿瘤细胞增殖[20]和自由基引起的大鼠肝脏微粒过氧化等活性[21]低于儿茶酚型结构;反式儿茶素GCG 的抗动脉粥样硬化[22]、抗糖尿病[23]、降胆固醇和降血脂[24]等作用均比其顺式构象EGCG 更强,但二者抗癌[25]、抗过敏活性[26]相当。这些研究说明,儿茶素B 环、C 环的取代基类型和空间位置会影响其抗氧化、抗癌等生物活性的发挥,但这种构效关系背后的分子机制尚未完全阐明。网络药理学是基于系统生物学、多向药理学、生物信息学、网络科学等多学科发展起来的新兴学科,主要利用基因、蛋白质、疾病、药物等网络数据库的丰富信息,通过计算机、分析软件、算法等,分析药物对基因、靶点、通路和疾病的干预和影响,从而阐释药物的系统性药理机制,指导多靶点新药的设计和研发[27-28],为揭示儿茶素等天然产物、药物等多靶点、多途径的分子作用机制提供了新的研究策略。
1 材料与方法
1.1 材料与仪器
人结肠癌细胞HCT116、小鼠巨噬细胞RAW 264.7 中国科学院典型培养物保藏委员会细胞库;胰蛋白酶-EDTA 溶液(0.25%)、罗斯韦尔公园纪念研究所1640 培养基(RPMI 1640)、杜氏磷酸盐缓冲液(DPBS,pH 为7.0~7.3)、南美胎牛血清(FBS)美国Gibco 公司;杜氏改良伊格尔培养基高糖培养基(DMEM,含酚红)、青霉素(100 U/mL)/链霉素(100 μg/mL)、L-谷氨酰胺 美国Hyclone 公司;EC(≥98%)、C(≥98%)、EGC(≥98%)、GC(≥98%)、ECG(≥98%)、CG(≥98%)、EGCG(≥98%)、GCG(≥98%)、台盼蓝、噻唑蓝粉末(MTT)上海源叶生物科技有限公司;LPS、二甲基亚砜(DMSO)美国Sigma-Aldrich 公司;25 cm2细胞培养瓶 丹麦Nunc公司;Coster 96 孔细胞培养板 美国Corning 公司。
BS 124S/ BT 25S 电子天平 瑞士Mettle Toledo公司;Milli-Q Integral 3 纯水机 德国Merck-Millipore 公司;VersaMax 酶标仪 美国Molecular Devices 公司;AIRTECH 超净工作台 苏州净化设备有限公司;GHP-9080 隔水式恒温培养箱 上海一恒科学仪器有限公司;HERAcell 150i CO2培养箱 美国Thermo 公司;QYC-200 恒温培养摇床 上海福玛实验设备有限公司;Vortex-5 涡旋混合仪 江苏麒麟医用仪器厂。
1.2 实验方法
1.2.1 细胞培养 小鼠巨噬细胞RAW264.7 经解冻复苏后,置于含5%的CO2培养箱(37 ℃)中培养,培养液成分为88%的DMEM 高糖培养基(含酚红)、1%青霉素(100 U/mL)/链霉素(100 μg/mL)溶液(双抗)、10%胎牛血清(FBS)与1% L-谷氨酰胺(4 mmol/L),每2~3 d 继代一次;人结肠癌细胞HCT116 经解冻复苏后,置于含5%的CO2培养箱(37 ℃)中培养,培养液组成为89% RPMI 1640 培养基、10% FBS 及1%双抗,每3~4 d 继代一次。
1.2.2 儿茶素体外抗炎活性评价 参考Zhang 等[29]方法并作适当调整,具体操作如下:RAW264.7 细胞以5×105个/mL 的浓度接种到96 孔培养板中,每孔细胞液体积为200 μL,于5%的CO2培养箱(37 ℃)中培养24 h。吸去旧培养基,按顺序添加100 μL 不同浓度的儿茶素溶液及100 mL LPS 溶液(终浓度为1 μg/mL),混匀,于37 ℃、5%的CO2培养箱中培养24 h。
1.2.2.1 NO 产生百分比测定 吸取100 μL 上清液至新的96 孔培养板,并加入100 μL 的Griess 试剂,避光静置10 min 后,用酶标仪测定其在542 nm 波长处的吸光值,按照公式(1)计算NO 产生百分比(%)。
式中:ALPS表示仅添加LPS、未添加样品时的吸光值,ALPS颜色对照表示未添加细胞、仅添加LPS 时的吸光值;A样品表示添加LPS 和样品共培养后的吸光值,A样品颜色对照表示无细胞情况下添加LPS 和样品时的吸光值。计算空白组的NO 产生量时,A样品表示未添加样品时培养基的吸光值,并将LPS 组的NO 产生量记为100%。
1.2.2.2 细胞存活率测定 参考Mosmann[30]的方法并作适当调整,具体操作如下:将旧96 孔培养板中剩余细胞液弃去,每孔加入0.05 mg/L 的MTT 溶液100 μL,37 ℃培养1 h,弃去MTT 溶液,每孔加入200 μL 的DMSO 溶液,于37 ℃、转速100 r/min 的摇床中振荡处理15 min。吸取150 μL 上清液,用酶标仪测定其在波长550 nm 处的吸光值,按照公式(2)计算细胞存活率(%)。
那年部队来征兵,招财报名,所幸的是老支书庆高伯卸职去公社林场了,不然的话会是第一个就被刷下来。他在部队几年,是站岗、放哨?还是练武、杀鬼子?谁也不知道。他娘桃娭毑也不知道。他虽然小时候读过三个一年级,两个二年级,后来还混到四年级,可他不会写信,就是写了信寄回来,桃娭毑也不会看,她扁担倒地,一字不识。
式中:A样品表示细胞与样品共培养时的吸光值,A空白表示未添加样品,细胞单独培养时的吸光值。
1.2.3 儿茶素体外抗癌活性评价 将HCT116 细胞以2.5×104个/mL 的浓度接种到96 孔培养板中,每孔细胞液体积为200 μL,于含5%的CO2培养箱(37 ℃)中培养24 h。吸出100 μL 上清液至新的96 孔培养板,每孔加入50 μL 儿茶素溶液与50 μL含FBS 的培养基,空白组每孔加入100 μL 含FBS培养基,充分混匀,于37 ℃、5%的CO2培养箱中培养48 h。
1.2.3.1 细胞存活率测定 参考Mosmann[30]的方法并作适当调整,具体操作如下:取出96 孔培养板并弃去细胞液,每孔加入0.25 mg/L 的MTT 溶液100 μL,37 ℃培养2 h,弃去MTT 溶液,每孔加入200 μL 的DMSO 溶液,于37 ℃、转速100 r/min 摇床中振荡处理15 min。吸取150 μL 上清液,用酶标仪测定其在波长550 nm 处的吸光值,按照公式(2)计算细胞存活率。
1.2.4 儿茶素抗炎、抗癌作用机制预测
1.2.4.1 抗炎、抗癌靶点筛选 参考王腾飞等[31]的方法并作调整,具体操作如下:使用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)检索8 种儿茶素的SMILES 号,将其导入SIWSS 数据库(http://swisstargetprediction.ch/)中,预测其作用靶点,去除重复靶点后,作为儿茶素的潜在作用靶点。以“inflammation”、“cancer”为关键词,分别在人类基因GeneCards 数据库(https://www.genecards.org/)、孟德尔遗传代谢OMIM 数据库(https://omim.org/)、DisGeNET 数据库(https://www.disgenet.org/)和TTD数据库(http://bid.nus.edu.sg/group/cjttd/)中进行检索,收集炎症、癌症相关靶点,合并去除重复后,使用Venny 2.1.0 网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制儿茶素潜在作用靶点与炎症、癌症相关靶点的韦恩图,根据二者交集确定8 种儿茶素的潜在抗炎、抗癌作用靶点。利用STRING 数据库(https://string-db.org/)对潜在靶点做蛋白相互作用(Protein-protein interaction,PPI)分析,物种设定为“Homo sapiens”,将得到的蛋白相互作用网络导入Cytoscape 3.8.0 软件,根据拓扑学参数筛选关键抗炎、抗癌靶点。
1.2.4.2 GO 功能富集和 KEGG 通路富集 利用计算机R 语言中“ClusterProfiler”、“enrichplot”和“org.s.eg.db”等程序包对儿茶素的潜在抗炎、抗癌靶点进行GO 功能富集和KEGG 通路富集分析,根据P值大小(P值<0.05)分别筛选生物过程(BP)、细胞组成(CC)与分子功能(MF)的富集结果,并通过富集条目数的可视化显示排名前10 的功能和通路。
1.2.4.3 组分-靶点-通路-疾病网络构建 将8 种儿茶素及其潜在抗炎、抗癌作用靶点导入Cytoscape3.8.0 软件,绘制其组分-靶点-通路-疾病网络图,节点(node)代表儿茶素、通路、疾病和作用靶点,边(edge)代表组分、通路、疾病和作用靶点之间的相互作用关系。
1.2.4.4 分子对接 以8 种儿茶素为配体,以其抗炎、抗癌关键靶点为受体,利用AutoDock 分子模拟软件进行分子对接模拟,根据对接结合能分析儿茶素与关键靶点的结合能力,利用PyMOL 软件对结合能最低的组合进行可视化处理,并利用Discovery Studio 2019 Client 软件作二维示意图。
1.3 数据处理
所有实验含三次平行、两次重复,结果以平均值±标准差表示,组间差异采用邓肯多重检验进行显著性分析,不同小写字母表示组间差异显著(P<0.05)。
2 结果与分析
2.1 8 种儿茶素的体外抗炎活性比较
巨噬细胞经LPS 刺激会产生大量的炎症介质NO,通过检测细胞上清液中NO 的产生百分比,能够反映细胞内炎症反应的强弱程度[32]。为初步分析儿茶素的体外抗炎活性及其构效关系,本研究采用MTT 法和Griess 试剂法比较分析了8 种儿茶素对LPS 处理的RAW 264.7 细胞存活率及炎性介质NO 产生百分比的影响,结果如图2 所示。
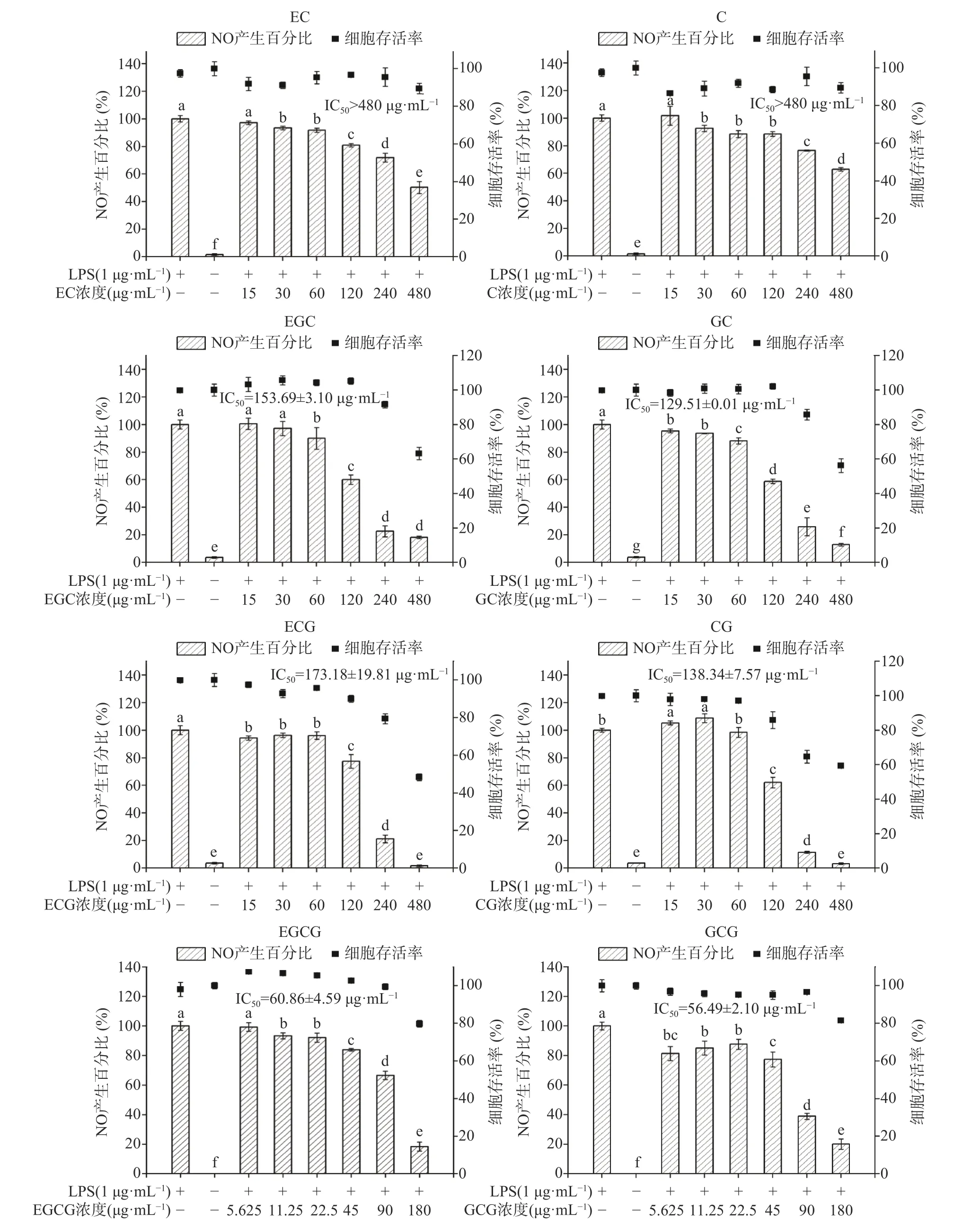
图2 8 种儿茶素处理RAW 264.7 细胞的存活率和NO 产生百分比Fig.2 Cell viability and production percentage of NO of RAW 264.7 cells treated with eight catechins
由图2 可知,与LPS 单独处理组相比,空白组的NO 产生百分比不足3.83%;与空白组相比,LPS单独处理对RAW264.7 的细胞存活率无显著影响,说明LPS 处理24 h 能够显著刺激RAW264.7 细胞产生炎性介质NO,且不存在明显的细胞毒性,表明体外炎症细胞模型建立成功。与LPS 单独处理组相比,CG、ECG、GC、EGC、C、EC 在15~480 μg/mL浓度范围,GCG、EGCG 在5.625~180 μg/mL 浓度范围内,细胞存活率均大于50%,而其NO 产生百分比随儿茶素浓度升高而不断降低,说明8 种儿茶素单体均能有效抑制LPS 诱导巨噬细胞产生NO;但不同儿茶素对NO 产生的抑制作用存在明显差异,根据其抑制NO 产生的IC50,各儿茶素单体对NO 的抑制作用强弱依次为:GCG>EGCG>GC>CG>EGC>ECG>C、EC。这一结果表明,当其他取代基类型和空间位置相同时,酯型儿茶素的体外抗炎活性强于其非酯型结构(GCG>GC,EGCG>EGC,CG>C,ECG>EC),焦酚型儿茶素的体外抗炎活性强于儿茶酚型(GCG>CG,EGCG>ECG,GC>C,EGC>EC);对于酯型儿茶素或焦酚型儿茶素,反式构象强于其顺式构象(GCG>EGCG,GC>EGC,CG>ECG)。由此可知,D 环没食子酰基、B 环的邻苯三酚结构能够增强儿茶素的体外抗炎活性,且当D 环和B 环不在同一侧时更利于儿茶素体外抗炎活性的发挥。
2.2 8 种儿茶素的体外抗癌活性比较
为探讨儿茶素结构与抗癌活性的关系,本研究采用MTT 法比较分析了8 种儿茶素单体对人结肠癌细胞HCT116 增殖的影响,结果如图3 所示。
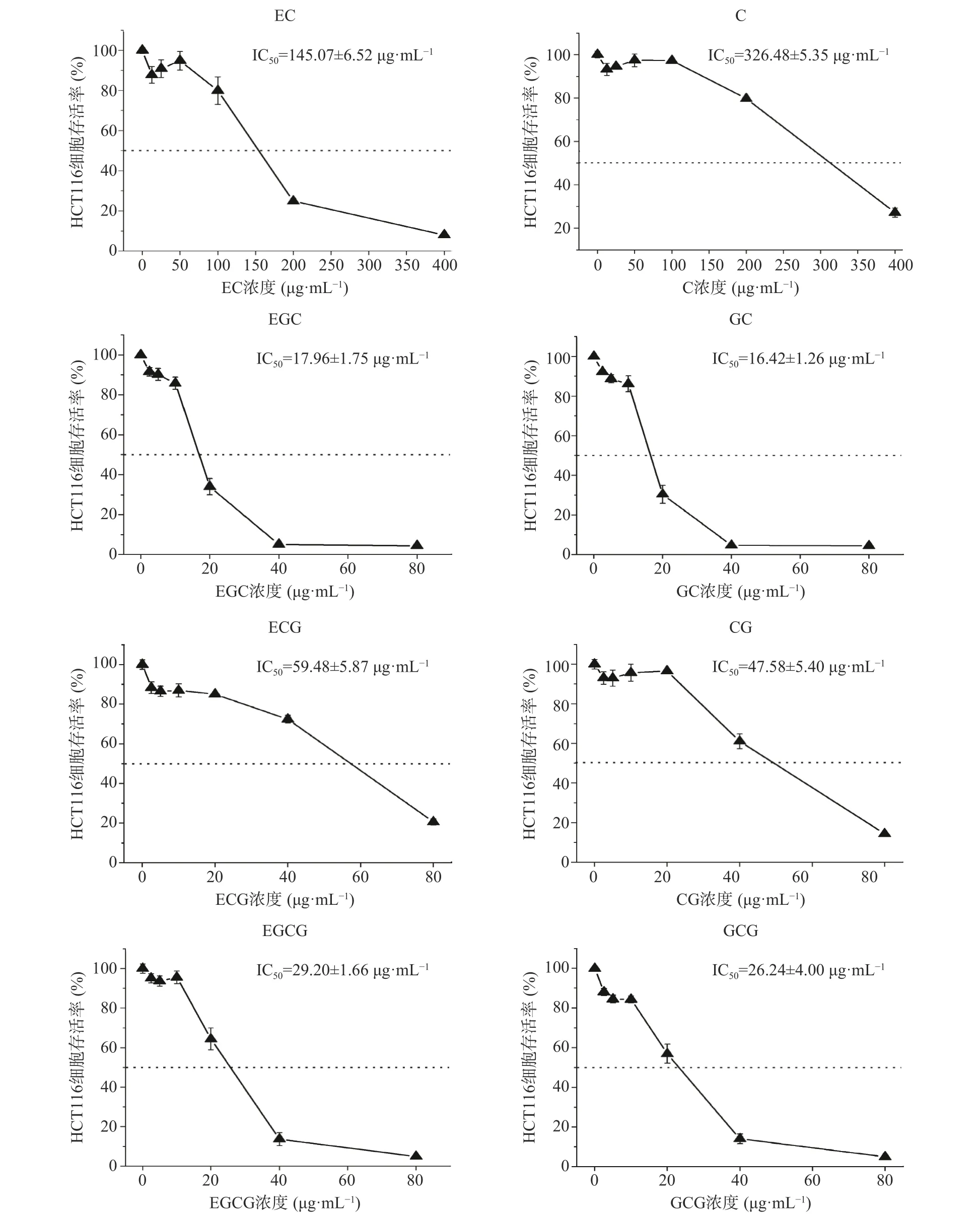
图3 8 种儿茶素单体和人结肠癌细胞HCT116 共培养的细胞存活率Fig.3 Cell viability of human colorectal carcinoma cells HCT116 co-cultured with eight catechin monomers
由图3 可知,人结肠癌细胞HCT116 与8 种儿茶素单体共培养48 h 后,GC、EGC、GCG、EGCG、CG、ECG 在20~80 μg/mL 的浓度,EC、C 在50~400 μg/mL 的浓度范围内,细胞存活率随儿茶素浓度升高而显著降低,说明8 种儿茶素单体均能有效抑制HCT116 细胞的增殖;根据其抑制细胞增殖的IC50值,8 种儿茶素单体对HCT116 细胞增殖的抑制作用大小依次为:GC>EGC>GCG>EGCG>CG>ECG>EC>C。构效关系分析显示,所有焦酚型儿茶素(GC、EGC、GCG、EGCG)的体外抗肿瘤增殖活性均强于儿茶酚型(CG、ECG、C、EC);在4 种焦酚型儿茶素中,非酯型结构的抗肿瘤活性强于酯型结构,但在4 种儿茶酚型儿茶素中,酯型结构的体外抗肿瘤活性比非酯型更强,对于酯型儿茶素或焦酚型儿茶素,反式构象的抗肿瘤活性强于其顺式构象(GC>EGC,GCG>EGCG,CG>ECG)。这些结果表明,邻苯三酚结构是儿茶素发挥抗肿瘤活性的关键结构,其中,B 环具有邻苯三酚结构能够增强不同结构儿茶素的抗肿瘤增殖活性,但D 环没食子酰基仅在B 环为邻苯双酚结构时才能增强儿茶素的抗增殖活性;当D 环和B 环不在同一侧时更利于儿茶素发挥其体外抗肿瘤活性。
2.3 8 种儿茶素的抗炎、抗癌作用机制预测
为进一步探究8 种儿茶素抗炎、抗癌的构效机制,本研究利用网络药理学预测并筛选其抗炎、抗癌的关键靶点,结果如图4 所示。由图4a 可知,通过GeneCards、TTD、OMIM 和DisGeNET 等数据库筛选出炎症靶点3092 个、癌症靶点6715 个,通过SWISS 数据库预测获得8 种儿茶素的潜在作用靶点86 个,通过韦恩图分析三者交集靶点,筛选出儿茶素的抗炎、抗癌靶点各59 个,其中相同靶点48 个。对儿茶素抗炎、抗癌靶点的PPI 分析结果显示,8 种儿茶素发挥抗炎活性涉及IL6、原癌基因表达蛋白JUN、MMP-2、基质金属蛋白酶-9(matrix metallopeptidase 9,MMP-9)、过氧化物酶体增殖物活化受体-γ(peroxisome proliferator-activated receptor gamma,PPARG)、前列腺素内过氧化物合酶-2(prostaglandin-endoperoxide synthase 2,PTGS2)、TNF、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、苏氨酸蛋白激酶(serine/threonine kinase1,AKT1)、淀粉样前体蛋白(amyloid precursor protein,APP)、半胱氨酸-天冬氨酸蛋白酶-3(caspase-3,CASP3)、趋化因子配体-2(C-C motif chemokine ligand 2,CCL2)、上皮钙黏蛋白(E cadherin,CDH1)、雌激素受体-1(estrogen receptor 1,ESR1)、缺氧诱导因子1-α(hypoxia-inducible factor 1-alpha,HIF1A)和热休克蛋白(heat shock protein 90-alpha,HSP90AA1)共16 个靶点(图4b);抗癌活性涉及IL6、JUN、MMP-9、PPARG、PTGS2、TNF、VEGFA、AKT1、CASP3、CCL2、CDH1、ESR1、HIF1A、HSP90AA1 等14 个关键靶点(图4c),且14 个癌症靶点均包含于16 种关键炎症靶点中。炎症的持续发展有可能导致癌症的发生,这与许多慢性炎症的诱因会增加癌症感染的风险有关,大多数诱因的关键在于包括IL1、IL6、TNF、IL23 等炎症细胞因子和NF-κB 等转录因子在内的炎性介质聚集于肿瘤组织中,从而诱发组织中恶性细胞的增殖、促进血管生成及肿瘤转移[33-37]。由此说明,8 种儿茶素单体可通过作用于相关炎症、癌症靶点发挥抗炎、抗癌活性。
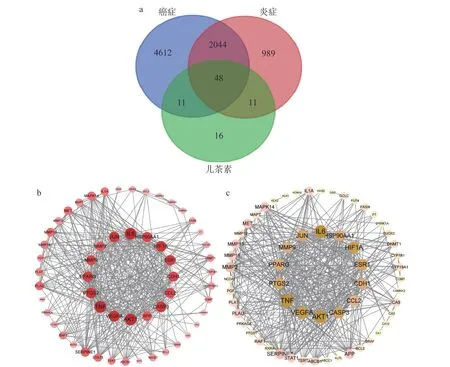
图4 8 种儿茶素单体的抗炎、抗癌靶点Fig.4 Anti-inflammatory and anti-cancer targets of eight catechin monomers
根据上述8 种儿茶素单体的48 个抗炎、抗癌靶点,采用GO 功能富集和KEGG 通路富集分析,并对排名前10 的条目和通路进行可视化处理,结果如图5 所示。
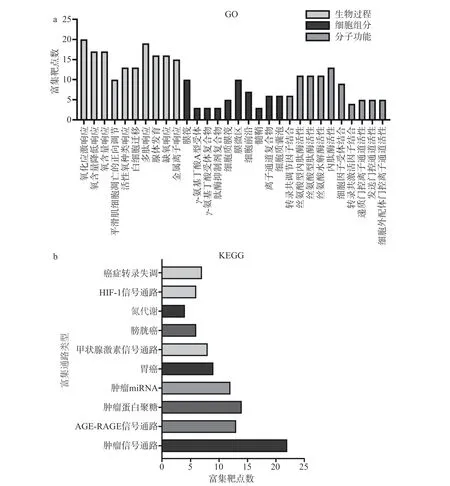
图5 8 种儿茶素单体抗炎、抗癌靶点的GO 功能富集(a)和KEGG 通路富集(b)Fig.5 GO functional enrichment (a) and KEGG pathway enrichment (b) of the anti-inflammatory and anti-cancer targets of eight catechin monomers
GO 功能注释分析显示生物过程相关条目1586个、细胞组成相关条目46 个、分子功能相关条目95 个,KEGG 富集显示相关通路20 条。由图5 可知,8 种儿茶素单体的抗炎、抗癌靶点参与氧化应激响应、平滑肌细胞凋亡的正向调节、白细胞迁移、腺体发育、缺氧响应、多肽响应、金属离子响应等生物过程,位于膜筏、γ-氨基丁酸A 型受体、肽酶抑制剂复合物、膜微区、细胞前沿、髓鞘、离子通道复合物、细胞质囊泡等细胞结构组成部位,富集的分子功能涉及调节丝氨酸型内肽酶、丝氨酸水解酶、内肽酶等酶活性,调控递质门控离子通道活性与细胞外配体门控离子通道活性,促进转录共调节因子、细胞因子受体及转录共激活因子的结合,参与介导氮代谢、HIF-1 信号通路、甲状腺激素信号通路、AGE-RAGE 信号通路、癌症转录失调、肿瘤miRNA、肿瘤蛋白聚糖、膀胱癌及胃癌的相关肿瘤信号通路等通路。此分析显示,儿茶素的抗炎、抗癌功效具有多靶点、多通路的特性。
进而利用8 种儿茶素及其抗炎、抗癌靶点和KEGG 通路富集的前20 条通路,构建儿茶素抗炎、抗癌的“组分-靶点-通路”网络模型,结果如图6 所示,其中,蓝色、红色、紫色节点分别表示组分、靶点、通路。通过分析度值、平均最短路径及介值等拓扑学参数,比较各儿茶素的抗炎、抗癌活性,结果如表1 所示。由表1 度值比较可知,各儿茶素单体的抗炎活性强弱依次为:CG>GCG>ECG>EGCG>EC>C>EGC、GC;抗癌活性强弱依次为:CG>GCG>ECG、EGCG>EC>C>EGC>GC。8 种儿茶素的抗炎、抗癌活性显示了相近的变化趋势,即4 种酯型儿茶素(CG、GCG、ECG、EGCG)的抗炎、抗癌活性强于非酯型儿茶素(EC、C、EGC、GC);酯型儿茶素中,反式构象(CG、GCG)的抗炎、抗癌活性强于顺式构象(ECG、EGCG),但非酯型儿茶素以顺式构象的活性更强;当其他取代基类型和空间位置相同时,儿茶酚型儿茶素的抗炎活性强于焦酚型(CG>GCG,ECG>EGCG,EC>EGC,C>GC);除ECG 外,其他儿茶酚型儿茶素的抗癌活性强于其焦酚型结构(CG>GCG,EC>EGC,C>GC)。这些预测结果提示,D 环没食子酰基是儿茶素与多靶点相互作用的关键基团,该结构有利于儿茶素作用于多个抗炎、抗癌靶点;当C 环的C3连接D 环时,D 环和B 环上不在同一侧有利于儿茶素与其抗炎、抗癌靶点结合,如果C3连接羟基,则羟基与B 环在同一侧更利于儿茶素与靶点相互作用;B 环邻苯三酚结构不利于大部分儿茶素与其抗炎、抗癌靶点相互作用。
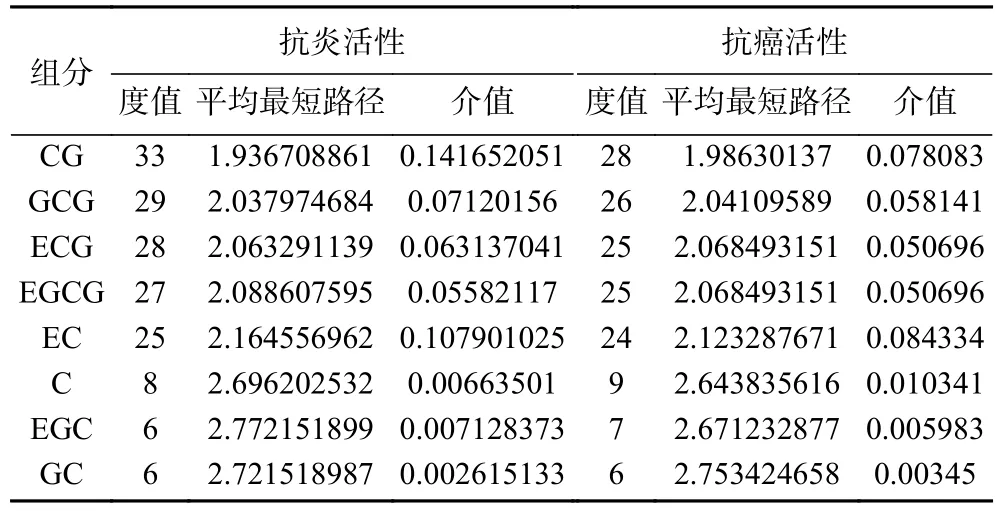
表1 8 种儿茶素单体抗炎、抗癌活性的拓扑学参数Table 1 Topological parameters of the anti-inflammatory and anti-cancer activities of eight catechin monomers
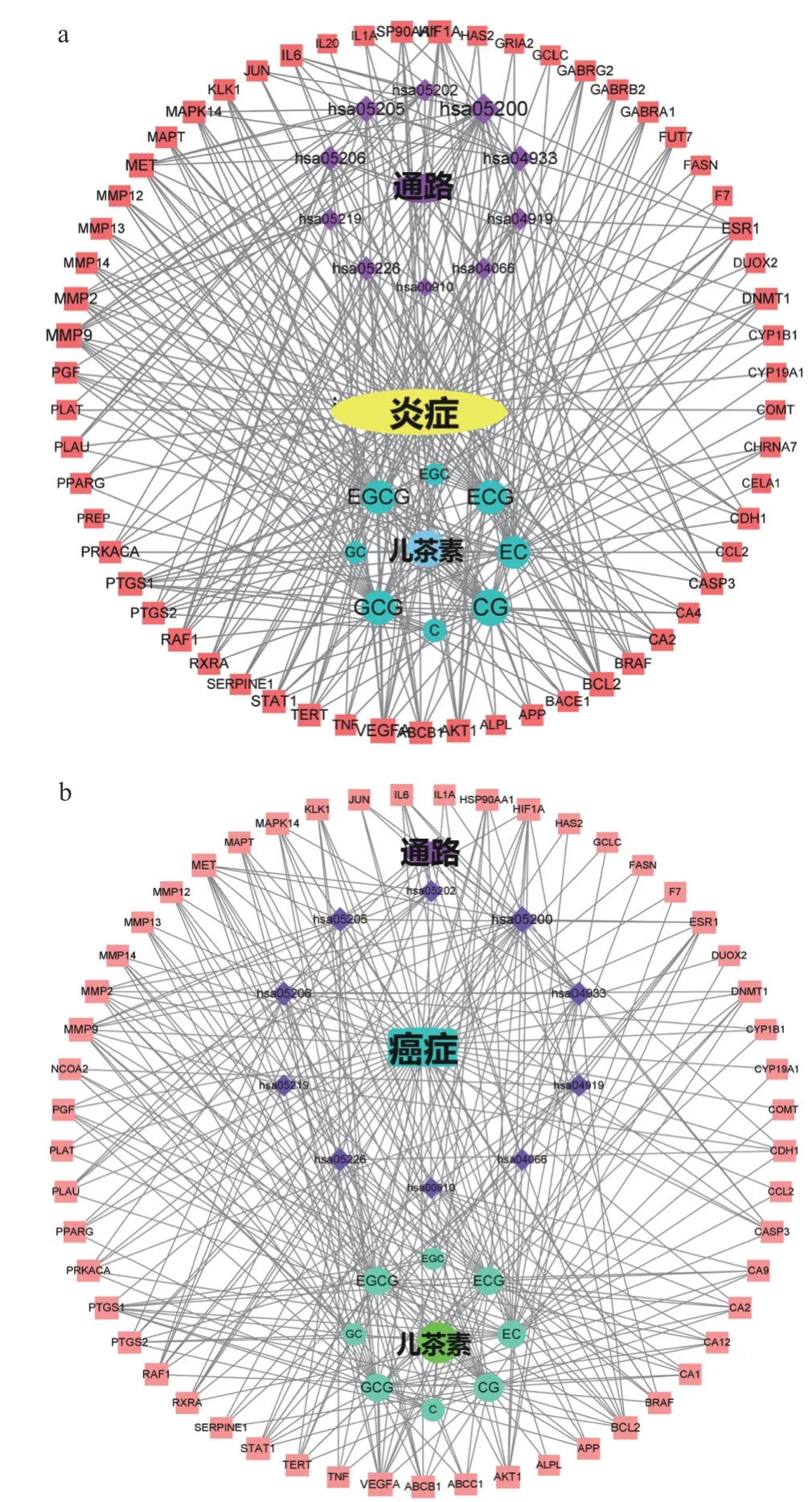
图6 儿茶素抗炎(a)和抗癌(b)的组分-靶点-通路网络Fig.6 Component-target-pathway networks of catechins for anti-inflammatory (a) and anti-cancer (b)
2.4 8 种儿茶素与关键靶点蛋白的相互作用
为进一步探究8 种儿茶素的抗炎、抗癌作用机制,在上述网络药理学筛选出的关键抗炎、抗癌靶点基础上,本研究选取其中度值最高的IL6、TNF 和AKT1 三个靶点蛋白,采用分子对接技术模拟儿茶素与3 个靶点蛋白的相互作用,计算二者的结合能,并选取其中结合能最低的组合进行可视化处理,结果如表2 和图7 所示。
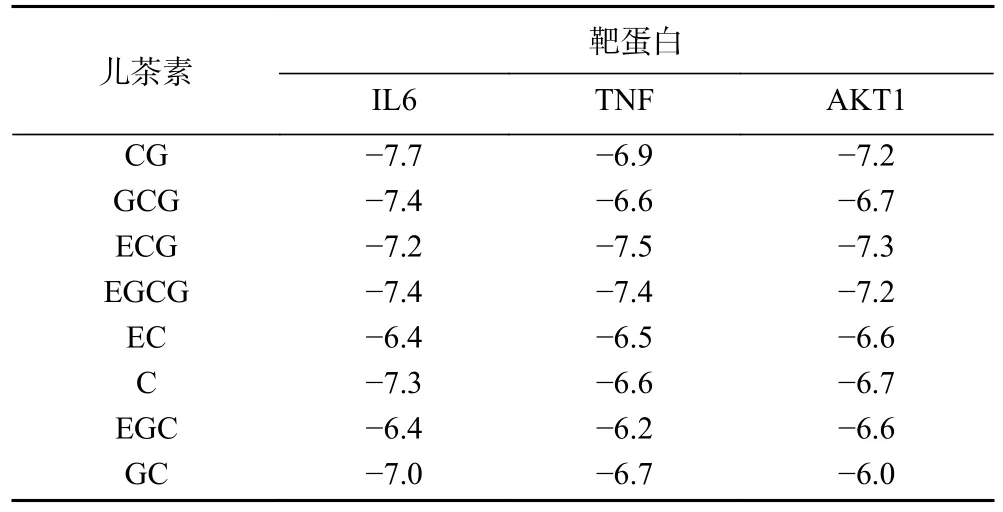
表2 8 种儿茶素单体与3 种靶蛋白的结合能(kcal/mol)Table 2 Binding energy of eight catechin monomers to three target proteins (kcal/mol)
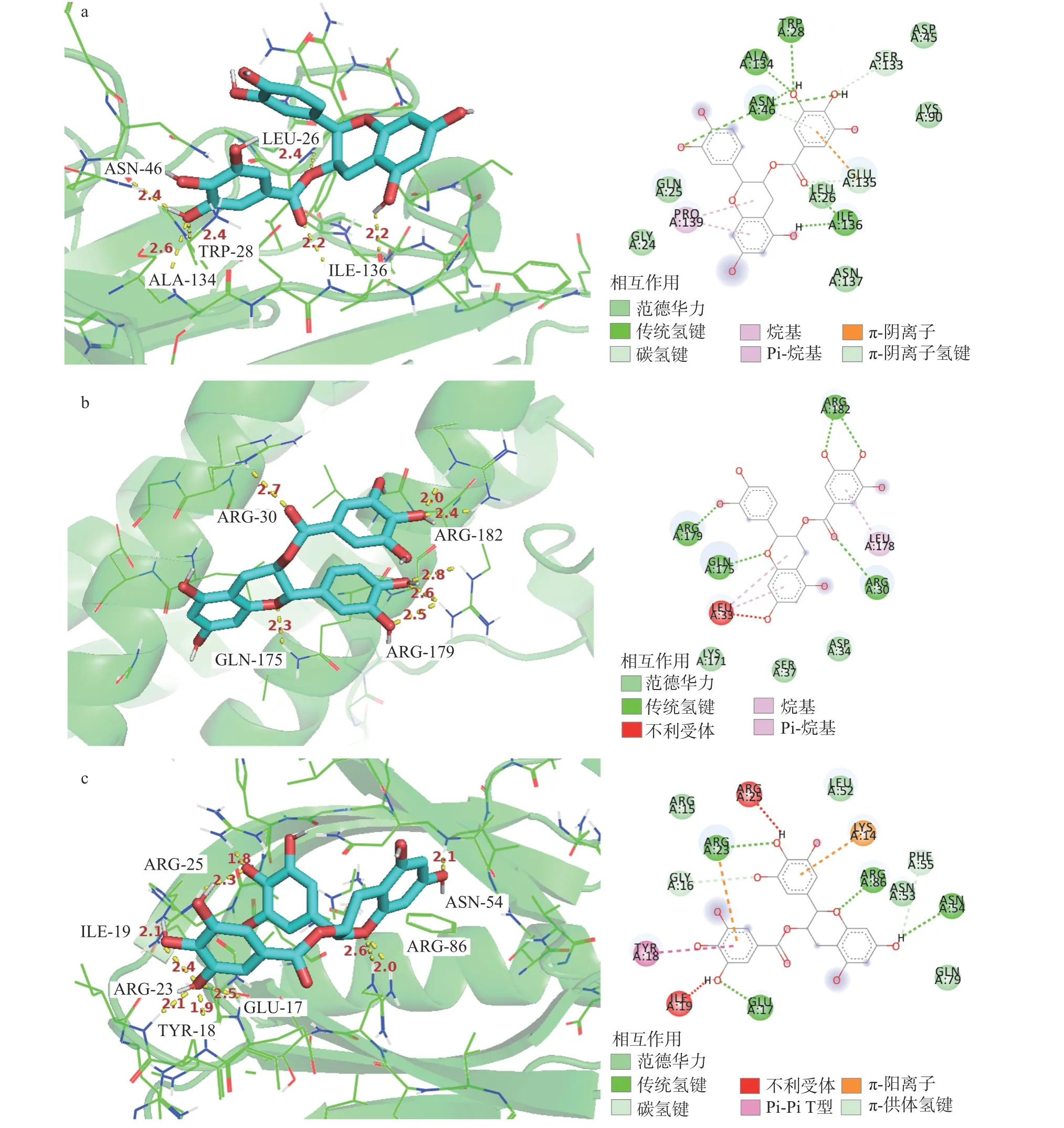
图7 ECG-TNF(a)、CG-IL6(b)、EGCG-AKT1(c)的分子结合可视化图Fig.7 Visualization of molecular binding of ECG-TNF (a),CG-IL6 (b),and EGCG-AKT1 (c)
由表2 可知,8 种儿茶素和IL6、TNF 和AKT1三个靶点蛋白的结合能均小于-5.5 kcal/mol,表明各儿茶素与3 个靶点蛋白均有较强的结合能力;各组分中,以ECG-TNF、CG-IL6 和ECG-AKT1 的结合能最低;8 种儿茶素与IL6 的结合能力大小依次为:CG>GCG、EGCG>C>ECG>GC>EC、EGC;与TNF的结合能力强弱依次为:ECG>EGCG>CG>GC>GCG、C>EC>EGC;与AKT1 的结合能力大小依次为:ECG>CG、EGCG>GCG、C>EGC、EC>GC。这一结果说明,4 种酯型儿茶素与3 个关键靶蛋白的结合能力整体强于非酯型儿茶素;C2、C3立体构象对儿茶素与靶点蛋白结合的影响因靶蛋白不同而异,顺式构象利于儿茶素与TNF、AKT1 结合,但反式儿茶素与IL6 的相互作用强于其顺式构象;B 环羟基数目对儿茶素-靶蛋白相互作用的影响较复杂,但大部分儿茶酚型儿茶素与三个关键靶蛋白的结合能力强于其焦酚型结构。进而,利用PyMol 软件对ECGTNF、CG-IL6、EGCG-AKT1 这3 组对接结合能较低的靶点与组分间的分子对接结果进行可视化处理,由图7 可知,ECG 通过氢键与TNF 的亮氨酸26、色氨酸28 和天冬酰胺46 结合,键长均为2.4;通过氢键与TNF 的丙氨酸134、异亮氨酸136 结合,键长分别为2.6、2.2。CG 与IL6 的精氨酸30、谷氨酰胺175 以氢键结合,键长分别为2.7、2.3;与IL6 的精氨酸179 形成3 个氢键,键长分别为2.5、2.6 和2.8;与IL6 的精氨酸182 形成2 个氢键,键长分别为2.0、2.4。EGCG 通过氢键与AKT1 的谷氨酸17、酪氨酸18、异亮氨酸19、精氨酸23、精氨酸25、天冬酰胺54 及精氨酸86 结合,键长均小于2.6。说明三种酯型儿茶素单体通过多个氢键与关键抗炎、抗癌靶点蛋白的不同氨基酸残基结合,且键长均小于2.8,结合作用较强。
结合上述体外细胞模型、网络药理学预测结果可知:a.与非酯型儿茶素相比,酯型儿茶素与关键靶蛋白的结合能力更强、作用靶点更多,体外抗炎、抗肿瘤活性更强,Fechtner 等[38]研究同样发现,酯型儿茶素EGCG 对人类风湿性关节炎滑膜成纤维细胞、鼻粘膜成纤维细胞和A549 支气管上皮细胞[39]的体外抗炎活性强于非酯型儿茶素EGC、EC、C;Kinjo等[10]亦指出,D 环没食子酰基能够增强儿茶素对人胃癌细胞MK-1 的抑制活性。酯型儿茶素与关键抗炎、抗癌靶蛋白具有更强的结合能力,与其具有更多的羟基,更易与靶蛋白形成氢键有关,陈榆[40]指出酯型儿茶素(EGCG 和ECG)较非酯型儿茶素(EC 和EGC)与黄嘌呤氧化酶的催化活性中心有更多π-π 疏水相互作用力和氢键作用,说明酯型儿茶素与其结合的作用更强,从而阻碍底物黄嘌呤进入活性位点,起到竞争性抑制,进而阻碍黄嘌呤氧化成尿酸。b.儿茶酚型儿茶素的抗炎、抗癌靶点较焦酚型更多,与关键靶蛋白的结合能力更强。但焦酚型儿茶素的体外抗炎、抗癌活性更强,提示了除作用靶点数目及与IL6、TNF、AKT1 的结合能力外,存在其他因素调控B 环对儿茶素抗炎、抗癌活性的影响。雷志伟等在比较儿茶素及其类似物抗流感病毒活性的构效关系时发现,多酚B 环羟基的数目并非与其抗病毒活性呈正相关,B 环的多羟基结构会引起空间位阻,不利于儿茶素活性的发挥[41]。此外,Babich 等[20]发现B 环的邻苯三酚结构可能会削弱酯型儿茶素对口腔肿瘤细胞HSC-2 的增殖抑制作用,这种现象可能与不同结构儿茶素的亲疏水性差异有关[19],没食子酰基能够提高儿茶素的疏水性,增强其与细胞膜的磷脂双分子层结合[14,42-43],但B 环的邻苯三酚结构却降低了儿茶素与磷脂双分子层的亲和力[44]。c.反式儿茶素与IL6 的结合能力较顺式构象更强,抗炎活性更突出。本课题组前期研究发现,GCG 对LPS 诱导的RAW264.7 细胞产生NO 的抑制作用强于EGCG,但后者对NO 合成酶(nitric oxide synthase,iNOS)的蛋白及mRNA 表达、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、IL6 的分泌等的抑制作用均强于GCG[45],提示了GCG 可能通过调控iNOS、TNF-α、IL6 以外的其他靶点抑制NO 的产生。Li等[46]研究发现,EGCG 抑制LPS 诱导的脂肪细胞3T3-L1 产生单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)产生的作用强于GCG,但二者对炎症因子白细胞介素-6(interleukin-6,IL6)、活化的B 细胞核因子κ-轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NFκB)的抑制作用相当。这些结果表明,顺/反式儿茶素的抗炎活性可能因模型不同而存在差异,且可能通过多种途径调控抗炎活性的发挥。
3 结论
本研究利用体外小鼠巨噬细胞RAW264.7 炎症模型和人结肠癌细胞HCT116 癌症模型,结合网络药理学和分子对接技术,分析发现EGCG 等8 种儿茶素均具有较强的体外抗炎、抗癌活性,但其功能活性因分子结构不同而异。其中,儿茶素分子结构中B 环的邻苯三酚结构、D 环没食子酰基与C 环C2、C3的反式构象更有利于儿茶素体外抗炎、抗癌活性的发挥,但B 环的邻苯三酚结构与D 环没食子酰基之间可能具有拮抗效应。8 种儿茶素较强的体外抗炎、抗癌活性得益于其与多靶点的相互作用,D 环没食子酰基和B 环儿茶酚型结构能够增强儿茶素与IL6、TNF 及AKT1 等多个炎症、癌症靶点的调控与相互作用,从而促进儿茶素体外抗炎、抗癌活性的发挥。本研究探究的儿茶素抗炎、抗癌构效关系及其作用机制的预测结果,为未来利用细胞、动物模型等深入研究儿茶素功能活性的构效机制提供了前期的理论研究基础。

