基于多光谱技术分析绿原酸与肌原纤维蛋白相互作用的初步研究
李 杰,郭 欣,2,3,袁天帅,屈启超,朱新荣,2,3, ,张 建,2,3,
(1.石河子大学食品学院,新疆石河子 832003;2.农业农村部特色农产品加工与质量安全控制重点实验室(部省共建),石河子大学食品学院,新疆石河子 832003;3.食品营养与安全控制兵团重点实验室,石河子大学食品学院,新疆石河子 832003)
多酚是植物体内的次生代谢产物,含多个酚羟基结构,主要来源于水果、蔬菜和中草药[1]。多酚是天然的抗氧化剂,在食品贮藏保鲜上起到延缓脂质/蛋白质氧化,提高食品品质的作用,通常以功能添加成分用于食品加工。目前已有研究报道,植物多酚能替代合成的抗氧化剂添加到肉类食品中,减少营养物质的损失,延长货架期[2-3]。
多酚与蛋白质具有良好的亲和性,能通过共价或非共价相互作用形成复合物,改变蛋白质的空间结构,优化蛋白功能性质,进而提升产品感官特性和经济价值。例如,茶黄素、绿原酸和飞燕草素-3-O-葡萄糖苷影响β-乳球蛋白的二级和三级结构;在中性条件下,低浓度茶多酚可以提高蛋清蛋白的抗氧化活性和乳化性能;表没食子儿茶素没食子酸酯(Epigallocatechin Gallate,EGCG)Results 原 酸(Chlorogenic Acid,CA)能降低大豆7S 蛋白敏化的程度[4-6]。此外,乳清分离蛋白与EGCG,槲皮素,芹菜素和柚皮素的共价作用可提升蛋白抗氧化力;豌豆分离蛋白与EGCG,CA 和白藜芦醇的非共价相互作用可提升蛋白的乳化性、起泡性以及消化率等功能性质;乳铁蛋白-单宁配合物能增加蛋白的泡沫稳定性[7-9]。
肌原纤维蛋白(Myofibrillar Protein,MP)是组成肌肉中肌原纤维的主要蛋白质,约占肌肉总蛋白的50%~60%,通常作为衡量肌肉品质的主要指标,也对蛋白质产品的乳化、起泡、凝胶性质起着至关重要的作用。已有研究报道多酚在氧化条件下对肌原纤维蛋白具有延缓蛋白质降解、保护蛋白质结构,以及提高蛋白质凝胶性等影响[10-11]。然而,多酚与肌原纤维蛋白的相互作用通过多光谱学技术分析不同浓度多酚-蛋白的结合对蛋白质结构变化,以及采用热力学技术分析多酚-蛋白相互作用力的探索鲜有系统研究。
因此,本文以高白鲑MP 为研究对象,通过与不同浓度CA 的相互作用,探究多酚-蛋白复合物的总巯基含量,表面疏水性的理化性质;傅里叶红外光谱,三维荧光光谱探究蛋白质二级、三级结构变化;最后通过同步荧光光谱,紫外光谱等多光谱学技术并结合热力学变化分析多酚-蛋白质的结合能力情况,阐明水溶性多酚CA 与高白鲑MP 的结合性质,旨在为多酚与肌原纤维蛋白相互作用提供有价值的信息,为后续不同结构多酚-高白鲑肌球蛋白的凝胶特性变化及作用机制奠定研究基础。
1 材料与方法
1.1 材料与仪器
新鲜高白鲑(Coregonus peled)新疆温泉县赛湖渔业技术开发有限公司提供;绿原酸(纯度>98%)上海源叶生物科技有限公司;5,5'-二硫代双(2-硝基苯甲酸)、三羟甲基氨基甲烷(Trihydroxymethyl Aminomethane,Tris)、溴化钾 北京博奥拓达科技有限公司;氯化钾、氯化钠、乙二胺四乙酸(Ethylenediamine Tetraacetic Acid,EDTA)、磷酸二氢钠、磷酸二氢钠、1-苯胺基萘-8-磺酸、尿素 天津永晟精细化工有限公司;盐酸 北京化工厂;以上试剂均为分析纯。
T-3200 紫外分光光度计 上海佑科仪器仪表有限公司;F-4700 荧光分光光度计 日本日立公司;970CRT 荧光分光光度计 上海精密仪器仪表有限公司;NicoletiS10 傅里叶远红外光谱仪、Thermo Multifuge XIR 冷冻高速离心机 美国赛默飞世尔科技公司;1X71 多功能酶标仪 美国博腾仪器有限公司;HX-10-50B 真空冷冻干燥机 上海乔枫实业有限公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 参考Guo 等[12]方法略调整。采用10 倍体积去离子水(4 ℃预冷)与鱼肉背部肌肉混合于10000 r/min 均质30 s。匀浆4 ℃离心10 min(8000 r/min)后取沉淀,沉淀与10 倍体积0.3% NaCl 溶液混合重复上述步骤一次。再次取沉淀与4 倍体积的20 mmol/L Tris-HCl 提取液(含0.6 mol/L NaCl,pH7.0)混合,4 ℃下浸提1 h,使肌原纤维蛋白充分溶解。2 层纱布过滤,收集滤液。滤液用预冷去离子水以1:4(v:v)比例稀释,4 ℃离心10 min(8000 r/min)取沉淀。加入20 mmol/L 的PBS 缓冲液(含0.6 mol/L NaCl,pH7.0)重新溶解沉淀,并用1 层纱布过滤,滤液即为肌原纤维蛋白溶液。蛋白浓度采用双缩脲法进行测定。
1.2.2 绿原酸(CA)与肌原纤维蛋白的孵育 将1.2.1 制备的肌原纤维蛋白溶液采用20 mmol/L 的PBS 缓冲液(含0.6 mol/L NaCl,pH7.0)稀释至10 mg/mL;用相同PBS 缓冲液制备10 mmol/L CA 母液,分别加入等体积的不同浓度CA 溶液,使其终浓度为6、30、150 和300 µmol/g,25 ℃反应2 h,以未加多酚的蛋白加入相同体积PBS,作为空白对照(以每克肌原纤维蛋白含量为基准计算,调整CA 浓度,以下实验方法中,CA 浓度均如此确定)。
1.2.3 总巯基含量测定 参考 Liu 等[13]方法并做调整,测定按1.2.2 条件制备的CA 终浓度分别为6、30、150 和300 µmol/g 肌原纤维蛋白样品的总巯基含量。用20 mmol/L PBS 缓冲液分别将以上样品液稀释至1 mg/mL。取1 mL 蛋白样品,加入4 mL 50 mmol/L 的缓冲液(含0.6 mol/L KCl,10 mmol/L EDTA,8 mmol/L 尿素,pH7.0)。取4 mL 上述混合液,加入0.4 mL 的0.2 mmol/L 的5,5-二硫代双(2-硝基苯甲酸),充分混匀后40 ℃反应25 min(水浴),412 nm 处测定吸光度。以20 mmol/L 的PBS 缓冲液作为空白对照。
式中:R,总巯基含量,μmol/g;A,吸光度;B,蛋白质的质量浓度,mg/mL;C,摩尔吸光系数13.6,mol·cm/mL;D,稀释倍数。
1.2.4 表面疏水性测定 参考Pessato 等[14]的方法使用1-苯胺基萘-8-磺酸(ANS)测定按1.2.2 制备的蛋白样品(添加CA 终浓度分别为6、30、150 和300 µmol/g)的表面疏水性。将样品的蛋白质浓度分别稀释至0.05~0.2 mg/mL。将20 μL 8 mmol/L ANS(10 mmol/L 磷酸缓冲液中,pH7.0)与4 mL 蛋白质样品混合。混合物置于黑暗中保持2 min。在390 nm 激发波长和470 nm 发射波长下记录荧光强度。通过计算荧光强度值对蛋白质浓度的初始斜率,获得样品的表面疏水性。
1.2.5 傅里叶红外变换光谱(FTIR)参照吴黎明等[15]的方法。将按1.2.2 制备的蛋白样品(添加CA 终浓度分别为6、30、150 和300 µmol/g)在4 ℃去离子水中透析,反复更换透析液。透析12 h后,样品冷冻过夜,后续用真空冷冻干燥机进行冷冻干燥。样品与溴化钾以1:100 比例进行研磨,压片。以溴化钾为背景,扫描波段为400~4000 cm-1,用Peak fit 软件进行分析。
1.2.6 同步荧光光谱的测定 参考王志军等[16]的方法,利用970CRT 荧光分光光度计对按1.2.2 制备的蛋白样品(添加CA 终浓度分别为6、30、150 和300 µmol/g)进行测定。用20 mmol/L 的PBS 缓冲液将样品稀释至0.4 mg/mL。分别在波长差 Δλ=15 nm 和Δλ=60 nm 下记录样品的同步荧光光谱。
1.2.7 三维荧光光谱的测定 参考Guo 等[11]的方法测定按1.2.2 制备的蛋白样品(添加CA 终浓度分别为6、30、150 和300 µmol/g)。样品采用20 mmol/L PBS 缓冲液分别稀释至0.1 mg/mL 后,利用F-4700荧光光度计测定,记录200~500 nm 波段的荧光光谱。
1.2.8 紫外吸收光谱的测定 将按1.2.2 制备的蛋白样品(添加CA 终浓度分别为6、30、150 和300 µmol/g)分别用PBS 缓冲液(20 mmol/L)稀释至1 mg/mL,记录200~700 nm 波段样品的紫外吸收光谱。
1.2.9 荧光猝灭及热力学分析测定 参考李改霞等[17]的方法测定。热力学分析采用温度段为25~45 ℃,而高浓度多酚在较高温度下,会加速蛋白沉淀,测试效果极差;同时为保证荧光猝灭数据曲线拟合的精度,本实验选择小范围内的多酚终浓度(0、20、40、60、80、100、120、140、160 μmol/g CA)进行扫描荧光光谱。样品用20 mmol/L 的PBS 缓冲液稀释至0.4 mg/mL,分别加入等体积不同浓度CA(终浓度为0~160 μmol/g),分别在25、35、45 ℃反应2 min。利用970CRT 荧光分光光度计,在激发波长λex=280 nm,狭缝5 nm,记录300~450 nm 波段数据。
利用Stern-Volmer 方程计算分析动态和静态猝灭机制:
式中:F0,初始荧光强度;F,添加的猝灭剂的荧光强度;Kq,淬灭速率常数;τ0,没有任何猝灭剂的生物分子的平均荧光寿命(τ0=10-8s);Ksv,淬火常数;[Q],淬灭剂的浓度。
利用双对数方程计算结合常数(Ka)和结合位点的数量(n),分析静态猝灭。计算方程如下:
通过Van’t Hoff 公式可计算蛋白质和多酚在结合过程中相关的热力学参数[18]。获得相应温度(25、35、45 ℃)下的焓变(ΔH)、熵变(ΔS)和吉布斯自由能变化(ΔG)。
式中:T,绝对温度;Ka,相对温度下的结合常数;R,气体常数8.314,J/(mol·K)。
通过上述公式(2)~(5)计算确定蛋白质-多酚体系中的主要作用力的类型。
1.3 数据处理
对不同批次制备的新鲜样品分别重复三次实验,数据以平均值±标准偏差(SD)表示。用SPSS 25.0 进行方差分析,以考虑平均值之间的显著性水平(P<0.05),并用Origin 8.5 构建图形。
2 结果与分析
2.1 绿原酸对肌原纤维蛋白总巯基含量的影响
蛋白质氨基酸侧链基团如果发生变化,通常可通过总巯基含量的改变得到印证。如图1 所示,相比对照组,依次添加不同浓度CA,蛋白质总巯基含量分别下降2.99%,10.93%,17.30%,25.65%,结果表明总巯基含量随CA 浓度呈剂量依赖性下降,且均与对照组呈显著差异(P<0.05)。为防止巯基转化为二硫键,排除因二硫键的生成而导致巯基含量下降,在反应试剂中添加了尿素阻断此反应。因此,结果表明巯基含量下降的主要原因是CA 与蛋白的相互作用。CA 具有5 个羟基,可以通过多酚羟基与蛋白质巯基基团形成分子间氢键[19]。此外,本实验在大气环境中进行,故不可避免的发生氧化作用。酚类物质在反应过程中易被氧化成不稳定的醌类物质,进而与巯基发生加成反应,形成硫醇-醌加成产物,导致巯基含量进一步降低[20]。与Cheng 等[21]研究结果相似,桑葚多酚中的芦丁,槲皮素以及咖啡酸均会降低肌原纤维蛋白的总巯基含量。

图1 绿原酸对肌原纤维蛋白总巯基含量的影响Fig.1 Effect of chlorogenic acid on total sulfhydral content of myofibrillar protein
2.2 表面疏水性分析
外源性荧光探针ANS 可以反映疏水位点的表面暴露和蛋白质构象的变化。如图2 所示,与对照相比,添加6、30 μmol/g CA 后,蛋白质表面疏水性分别下降2.28%和8.26%,有下降趋势但不显著。进一步添加150、300 μmol/g CA,蛋白表面疏水性显著下降31.66%和40.26%(P<0.05)。一方面,多酚可通过疏水相互作用与蛋白质结合,降低表面疏水性。另一方面,具有酚羟基结构的多酚与蛋白质结合时,引入额外的羟基会增加蛋白质的亲水环境,阻碍ANS 的激发,并降低其荧光强度。此外,有研究发现多酚物质会与荧光探针ANS 竞争与蛋白质芳香环上的疏水性氨基酸侧链基团结合位点[22]。Jiang等[23]从疏水性层面的探究推断CA 影响乳清分离蛋白的表面疏水性比酪蛋白表面疏水性更剧烈,其原因是由于乳清分离蛋白对CA 具有更多的结合位点,因此导致乳清分离蛋白的表面疏水性下降程度更高。胡云鹏[24]研究表示少量多酚诱导蛋白解折叠,暴露内部疏水基团,引起表面疏水性的增加;但疏水基团的持续暴露会使蛋白质之间产生疏水相互作用而聚集,导致疏水基团的屏蔽,因此外源性荧光探针无法结合。本结果与上述学者研究类似,随着CA 浓度的增加,蛋白质表面疏水性显著下降,CA 与蛋白的相互作用减少了荧光探针与蛋白的结合机率。同时由后续的FTIR 结果也可证实蛋白随CA 的增加而展开,持续性的疏水作用可能导致蛋白质聚集而掩盖疏水基团。
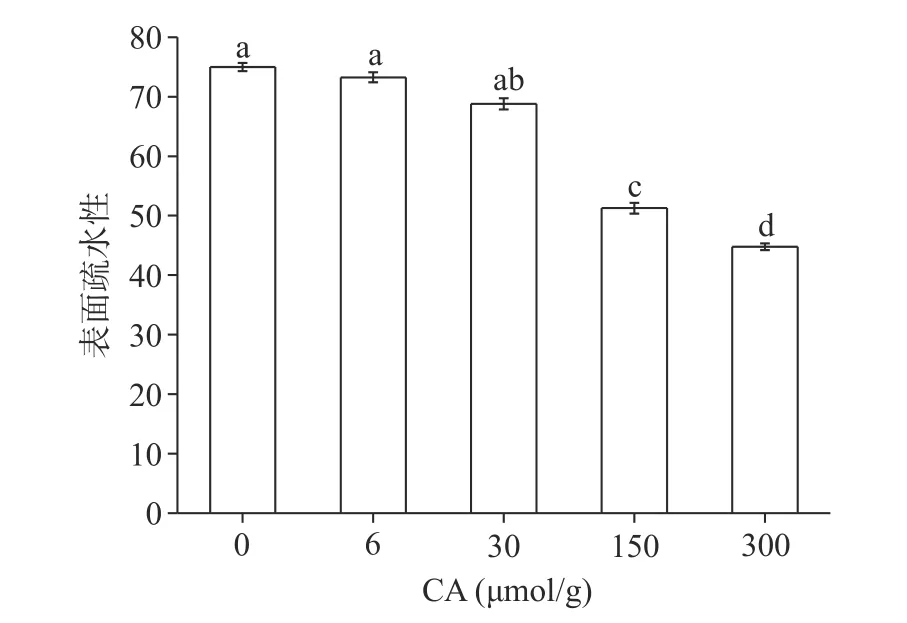
图2 绿原酸对肌原纤维蛋白表面疏水性的影响Fig.2 Effect of chlorogenic acid on surface hydrophobicity of myofibrillar protein
2.3 绿原酸对肌原纤维蛋白二级结构的影响
图3 为不同浓度CA 作用于蛋白质的红外吸收光谱谱图以及解谱后得到的二级结构含量图。其中图3(a)显示了特征峰强度的变化,1500~1600 cm-1为酰胺Ⅱ带,主要与蛋白的C-N 拉伸振动以及NH 弯曲振动有关;1600~1700 cm-1为酰胺Ⅰ带,主要与C=O 伸缩振动有关。酰胺Ⅰ带和酰胺Ⅱ带无明显的波段位移,但在峰强度上有很明显的变化,说明CA 影响分子间相互作用[25]。

图3 绿原酸对肌原纤维蛋白二级结构的影响Fig.3 Effect of chlorogenic acid on secondary structure of myofibrillar protein
酰胺Ⅰ带对蛋白质结构变化较为敏感,广泛用于蛋白质二级结构变化研究。通过Peak Fit 对酰胺Ⅰ带(1600~1700 cm-1)的解谱。如图3(b)所示,随着升高CA 浓度,相较于对照组,蛋白质的二级结构含量发生变化。尤其是添加30、150、300 μmol/g CA分别使α-螺旋结构含量显著降低28.80%,29.85%和28.85%,而β-折叠含量显著增加28.07%,30.33%和27.92%(P<0.05)。蛋白质α-螺旋结构可向β-折叠转化,这通常是蛋白质分子变性和展开的结果[26]。β-转角含量显著上升(P<0.05),无规卷曲含量降低,但相较α-螺旋变化可忽略。本研究结果中,α-螺旋含量的降低表明蛋白的二级结构在CA 作用下由有序转变为无序状态。Huang 等[27]研究与本研究结果相似,肌原纤维蛋白α-螺旋含量与迷迭香酸、鼠尾草酸和鼠尾草酚剂量呈负相关。三种多酚均对蛋白质的二级结构产生影响,此外多酚中羟基的数量与其结合能力相关。
2.4 同步荧光分析
蛋白质的构象变化也可采用同步荧光研究分析。通常根据蛋白质的同步荧光谱中,色氨酸(波长差Δλ为60 nm)和酪氨酸残基(波长差Δλ为15 nm)的光谱信息来推断蛋白质构象的变化[28]。
如图4 所示,对照组中色氨酸的荧光强度为594.18,酪氨酸的荧光强度为334.63,这表明蛋白质的荧光强度主要来源于色氨酸。当添加CA 后,荧光强度随CA 浓度呈浓度依赖式降低。当CA 浓度为300 µmol/g 时,与对照组相比,样品蛋白质中色氨酸与酪氨酸的荧光强度分别降低了80.20%和72.30%。此结果表明CA 对色氨酸的猝灭效果强于酪氨酸,意味着色氨酸在CA 与MP 的相互作用中起着关键作用。此外,色氨酸发生红移,酪氨酸发生蓝移,表明CA 对MP 荧光存在猝灭作用,且蛋白质色氨酸残基周围微环境发生变化,亲水性增加,而酪氨酸残基周围微环境疏水性增加,蛋白质构象发生变化。温鹤迪等[29]在卵白蛋白与CA 复合物研究表明色氨酸与酪氨酸微环境均向疏水环境变化,且色氨酸猝灭强度大于酪氨酸,由此判断色氨酸残基位置更接近于蛋白-多酚的结合位点。与本研究的氨基酸残基微环境变化结果不符的原因,可能是蛋白质种类或多酚的浓度不同导致。

图4 绿原酸对肌原纤维蛋白同步荧光光谱的影响Fig.4 Effect of chlorogenic acid on synchronous flurescence spectra of myofibrillar protein
2.5 三维荧光分析
三维荧光光谱可反映全部荧光特征信息。Peak 1 主要与酪氨酸和色氨酸的残基的光谱行为有关,Peak 2 主要与多肽链结构的变化有关[30]。图5 结果表明,随着CA 浓度的上升,酪氨酸和色氨酸的荧光强度依次减小。同时,Peak 2 峰的峰面积与荧光强度降低,说明CA 改变了MP 的蛋白结构。由FTIR 结果显示,蛋白质结构随CA 浓度的增加而逐渐展开,这会暴露蛋白内部的疏水基团。在进一步高含量的多酚存在下,可能通过疏水作用结合,从而导致了荧光强度的降低[31]。此结果与上述的同步荧光和二级结构结果可相互印证。Sui 等[32]研究大豆蛋白与花青素的共价与非共价相互作用时,三维荧光光谱中的Peak 1 特征峰颜色显著变浅,Peak 2 区域变小甚至消失,这表明色氨酸和酪氨酸残基被消耗或屏蔽。同时,与非共价相互作用形成的复合物相比,共价作用能使花青素与色氨酸和酪氨酸残基结合表现出更强的荧光猝灭。此外,膳食姜黄素喂养的鸭肉肌原纤维蛋白,其蛋白的三维荧光光谱Peak 1 峰荧光强度随姜黄素含量的增加而下降[33]。以上研究均表明多酚对蛋白质的荧光强度及肽链结构具有猝灭和展开作用。

图5 绿原酸对肌原纤维蛋白三维荧光光谱的影响Fig.5 Effect of chlorogenic acid on three-dimensional fluorescence spectrum of myofibrillar protein
2.6 绿原酸对肌原纤维蛋白紫外光谱的影响
紫外-可见吸收光谱在一定程度上可反映蛋白质与小分子化合物的相互作用。图6 为MP 与CA 在不同浓度下的紫外吸收光谱。MP 在280 nm 附近具有显著的紫外吸收峰(色氨酸、酪氨酸和苯丙氨酸的特征吸收)。多酚的加入增加了蛋白质在280 nm 处的吸收值,表明埋在蛋白质内部的芳香氨基酸被暴露出来,即氨基酸微环境或蛋白结构在蛋白质与多酚结合时发生变化。同时,观察到在280 nm 附近的吸收峰在CA 存在的情况下显示出显著的红移(从277.5 nm 到284.8 nm),表明结合位点的极性在与多酚结合时发生了改变。值得注意的是,在超过150 μmol/g 的CA 浓度下产生了一个新的紫外吸收峰,这可能是CA 本身的吸收峰,并且新峰出现的位置与多酚结构有关。Xu 等[4]在β-乳球蛋白与三种多酚相互作用的研究中发现,β-乳球蛋白-茶黄素系统的紫外光谱谱图中,在370 nm 和470 nm 处出现新的吸收峰;而在β-乳球蛋白-绿原酸系统的紫外谱图中,342 nm 处出现新峰。此结果与本研究结果类似。动态猝灭并不改变物质的吸收光谱,只影响荧光分子的激发态,而静态猝灭会改变荧光分子的吸收光谱(复合物的形成)[34]。基于以上,可以推断MP-CA之间的猝灭机制是静态猝灭。

图6 绿原酸对肌原纤维蛋白紫外光谱的影响Fig.6 Effect of chlorogenic acid on ultraviolet absorption spectral of myofibrillar protein
2.7 荧光猝灭与热力学分析
将 CA 加入到MP 溶液后,二者之间会形成MPCA 复合物而导致蛋白自身的荧光强度的降低,即荧光猝灭[35]。荧光猝灭主要有两种类型:静态猝灭和动态猝灭。猝灭剂与荧光团发生扩散和碰撞而导致的称为动态猝灭;静态猝灭则是两者之间形成了基态复合物[36]。通常,可依据扩散碰撞速率常数Kq来判断荧光猝灭的类型,当Kq>2.0×1010L/mol/s 时,为静态猝灭;反之则为动态猝灭。
为了阐明猝灭机制,MP-CA 的Stern-Volmer 曲线及其数据如图7 和表1 所示。根据Stern-Volmer方程,F0/F 与多酚浓度的曲线显示出良好的线性关系(R2>0.9)。Kq值(4.008~4.582×1012L/mol/s)大于猝灭常数2.0×1010L/mol/s。乳清蛋白和绿原酸、EGCG 与扇贝性腺分离蛋白的结合也有类似的结果[37-38]。

表1 不同温度下CA-MP 反应的荧光猝灭参数Table 1 Fluorescence quenching parameters of CA-MP reaction at different temperature

图7 绿原酸对肌原纤维蛋白荧光猝灭的影响Fig.7 Effect of chlorogenic acid on fluorescence quenching of myofibrillar protein
采用双对数曲线方程分析静态猝灭数据,可获得结合常数(Ka)和结合位点数(n),结果见表1。在本研究中,三个温度条件下的n 值均接近1,这意味着MP 上可能有一个酚类化合物的单一结合位点。Ka的值大于104L/mol/s 表明对多酚的亲和力很高。此外,Ka随着温度的变化而增加,这表明MPCA 复合物的形成变得更加有利,并且复合物的稳定性增加,这是疏水相互作用的特征[39]。这与以下热力学参数结果一致。
多酚-蛋白质复合物的相互作用力包括氢键、范德华力、疏水作用等,ΔH、ΔS 的正负值可用于判断复合物之间的相互作用力的类型。当ΔH<0,而ΔS>0 时,则静电相互作为主导作用力;当ΔH<0,ΔS<0 时,则氢键和范德华力作为主导作用力;而当ΔH>0,ΔS>0 时,则疏水作用作为主导作用力[40]。如表1 所示,ΔG 均为负数,表明此结合是自发反应,且ΔH>0,ΔS>0,可知MP-CA 结合的相互作用力主要为疏水作用力。许多研究表明,多酚和蛋白质主要通过疏水相互作用、氢键和范德华力结合[41]。由于羟基的存在,蛋白质和多酚之间的氢键相互作用也是可能的。已有研究发现,豌豆蛋白和EGCG 通过氢键和范德华力相互作用,但花生蛋白与CA 主要通过静电相互作用形成复合物[8]。本文中的这种不一致性可能归因于不同蛋白质的复杂结构。
3 结论
绿原酸与高白鲑肌原纤维蛋白的相互作用会改变蛋白活性基团含量与结构构象,造成蛋白侧链氨基酸活性基团的损耗以及蛋白结构展开。在长期暴露蛋白内部疏水性的基础上,30~300 μmol/g 绿原酸的羟基与蛋白相互作用,屏蔽蛋白表面疏水性。多光谱学技术验证了绿原酸与肌原纤维蛋白通过疏水相互作用结合,在静态猝灭下产生复合物,且色氨酸残基距离相互作用位点更近。本研究通过多光谱学技术结合热力学分析推断绿原酸-肌原纤维蛋白的结合性质,为分子层面的模拟提供理论依据,也为后续研究不同结构多酚-肌球蛋白相互作用机制提供研究基础。

