基于PI3K/Akt/HIF-1α 通路探讨桂枝茯苓胶囊-散结镇痛胶囊-宫血宁胶囊联用抑制子宫腺肌病进展的作用机制
王楚矗,王 信,于敏敏,王 哲,曹 涵,师 伟*,刘志勇*
1. 山东中医药大学,山东 济南 250355
2. 山东中医药大学附属医院,山东 济南 250014
子宫腺肌病(adenomyosis,AM)是一种妇科常见疑难病,以子宫内膜腺体与间质侵入子宫肌层为主要病理特征[1]。近年来,越来越多证据表明AM的发病率呈逐年上升和年轻化趋势[2-3]。主要临床症状包括进行性痛经加重、月经量过多及慢性盆腔疼痛等,可导致不孕并对辅助生殖技术助孕产生不利影响[4-5],严重威胁女性身心健康。尽管现代医学采用孕激素、促性腺激素类似物等控制疾病进展[6],但也存在明显的不良反应,且复发率高;手术切除子宫虽为根治性解决方案,但难以兼顾女性生育需求。因此,寻求更加安全有效的AM 治疗方法是当下亟待解决的问题。
AM 的发病机制十分复杂,至今尚未完全阐明。AM 虽被归类为良性疾病,但却表现出与恶性肿瘤相似的异常增殖生长特点。已有报道表明,与正常内膜细胞相比,AM 异位内膜细胞增殖能力明显增强[7],这可能进一步导致子宫内膜-肌层交界区(endometrial-myometrial interface,EMI)的不规则增厚并引发功能异常[8]。磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/缺氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)通路是一个调控细胞增殖等生物过程的重要信号轴[9],该通路的异常激活常在癌症[10]及炎症损伤相关疾病[11-12]中被热切关注。同时,研究表明p-Akt 与HIF-1α 的表达水平在AM 中也明显上调[13-15]。提示PI3K/Akt/HIF-1α 通路在AM 的发生、发展中可能起到关键作用。
与化学药治疗不良反应较大、容易反复相比,中医治疗AM 具有其独特的优势,如控制痛经症状、调经助孕等,被2020 年《子宫腺肌病诊治中国专家共识》治疗指南所推荐[16]。近年来,中医药疗法在治疗AM 中展现出独特的优势。AM 在中医古籍中并无病名记载,可归于“痛经”“癥瘕”“月经过多”等,以“瘀血阻滞”为主要病机[17]。本课题组认为,AM 病程长、症状重且缠绵难愈,“久病入络”[18],当行通阳化瘀法,故治以桂枝茯苓胶囊-散结镇痛胶囊-宫血宁胶囊联用(简称GSG)方案,在临床诊疗中效果较好。因此,本研究基于PI3K/Akt/HIF-1α 信号通路,探究GSG 方案对AM 的改善作用,并阐释相关分子机制。
1 材料
1.1 AM 患者组织收集
选择2019 年6 月在临沂市中心医院接受腹腔镜手术的AM 患者1 例,年龄42 岁,术前3 个月内未进行激素治疗,于手术室无菌获取AM 病灶组织。本研究方案已获得山东中医药大学附属医院伦理委员会的批准(批准号2019ky061),遵循赫尔辛基宣言进行,患者已签署知情同意书。
1.2 动物
7 周龄SPF 级ICR 雌鼠24 只及雄鼠12 只,购自维通利华有限公司[SYXK(鲁)2018-0015],饲养于山东中医药大学附属医院动物实验中心的SPF屏蔽环境,饲养条件为(22±2)℃的稳定饲养温度,12 h/12 h 昼夜循环,常规喂养。动物实验经山东中医药大学附属医院实验动物伦理委员会批准(批准号AWE-2022-071)。
1.3 药品与试剂
桂枝茯苓胶囊(国药准字Z10950005,批号220914)、散结镇痛胶囊(国药准字Z20030127,批号220909)购自江苏康缘药业股份有限公司;宫血宁胶囊(国药准字Z20020087,批号ZHC2301)购自云南白药集团股份有限公司;米非司酮(批号26593)购自美国MedChemExpress 公司;复方米非司酮片(国药准字H20040365,批号07221001)购自武汉九珑人福药业有限责任公司;他莫昔芬(批号WXBD7619V)购自美国Sigma-Aldrich 公司;DMEM-F12 培养基(批号F3023N1)、磷酸盐缓冲液(批号C2123N3)购自中科迈晨(北京)科技有限责任公司;胎牛血清(批号TA01501)购自苏州双洳生物科技有限公司;0.25%胰蛋白酶(批号J121102)、青链霉素混合液(批号J121004)购自上海源培生物科技股份有限公司;4%组织细胞固定液(批号20191217)、牛血清白蛋白(bovine serum albumin,BSA,批号1130W052)、Triton X-100(批号304L022)、2.5%结晶紫染色液(批号202111009)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒(批号2306001)、血尿素氮(blood urea nitrogen,BUN)检测试剂盒(批号2305001)购自北京索莱宝科技有限公司;CCK-8 试剂盒(批号ECK-A362)购自武汉伊莱瑞特生物科技股份有限公司;kFluor488-Edu 法细胞增殖检测试剂盒(批号20221114)购自江苏凯基生物技术股份有限公司;苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(批号HADGP)、DAB 显色试剂盒(批号DUKLY)、HRP 标记的山羊抗兔IgG 二抗(批号HPHHP)购自山东思科捷生物技术有限公司;p-Akt 抗体(批号3523071101)购自武汉爱博泰克生物科技有限公司;p-PI3K 抗体(批号6)购自美国CST 公司;HIF-1α抗体(批号10017918)购自美国Proteintech 公司。
1.4 仪器
Memmert 二氧化碳培养箱(德国Memmert 公司);5424R 型高速低温离心机(德国Eppendorf 公司);DK-8D 型电热恒温水浴锅(上海比朗仪器制造有限公司);Multiskan Go1510 型酶标仪(美国Thermo 公司);Axiovert 40 型倒置相差显微镜(德国Carlzeiss 公司);DHG-9070A 型鼓风干燥箱(上海一恒科学仪器有限公司);HP30 型自动组织脱水机[达科为(深圳)医疗设备有限公司];BM450A型包埋机、BM450 型包埋冷冻台、PH60 型病理组织漂烘仪(常州派斯杰医疗设备有限公司);531CMY43 型轮转式切片机(德国Leica 公司)。
2 方法
2.1 给药溶液的制备
参照药品说明书中的标准临床用量与药物规格,将桂枝茯苓胶囊、散结镇痛胶囊、宫血宁胶囊以0.47∶0.80∶0.13 的比例充分混合,溶解至14 mL PBS 中,以37 ℃、50 Hz 超声振荡30 min 后,使用滤菌器滤过,制成质量浓度为100 mg/mL 的GSG母液。称取米非司酮粉末25 mg,溶解于100 μL 二甲基亚砜中,制成250 mg/mL 的米非司酮母液。母液存于-20 ℃长期避光保存,用前以培养基稀释,用于体外实验。
按人与小鼠体表面积比值换算法计算不同给药组各药剂量,GSG 的1/2、1、2 倍临床剂量相当于0.635、1.270、2.539 g/kg,复方米非司酮的1 倍临床剂量相当于3.25 mg/kg。根据各组剂量,将桂枝茯苓胶囊、散结镇痛胶囊、宫血宁胶囊按比例充分混合后溶解于生理盐水中,复方米非司酮片溶解至生理盐水中[19],用于体内实验。
2.2 体外实验
2.2.1 原代细胞提取及培养 取AM 患者新鲜子宫组织,剪切至1 mm3大小,利用胶原酶IV 在37 ℃下消化4 h,期间每隔10 min 振荡混匀1 次,至组织呈乳糜状,先后使用70 μm 和40 μm 的过滤器滤过,以1 000 r/min 离心5 min,收集细胞沉淀后使用PBS 清洗,再次离心后加入含10%胎牛血清、1%青链霉素混合液的DMEM/F12 完全培养基,置于37 ℃、5% CO2的细胞培养箱中培养。参照Suzuki-Kakisaka 等[20]方法对原代细胞进行表型鉴定,确定为AM 异位内膜衍生细胞(adenomyosis derived cells,AMDC)。取3~10 代原代培养细胞用于后续实验。
2.2.2 CCK-8 法检测细胞活力 AMDC 以3.5×103个/孔接种至96 孔板中,每孔100 µL,培养24 h 后,加入不同质量浓度(1、2、4、8、16 mg/mL)的GSG溶液或不同质量浓度(12.89、25.78、51.55、103.10、206.20 μg/mL)的米非司酮,对照组加入不含药物的培养基,每组设置3 个复孔。干预48 h 后,更换为含10% CCK-8 试剂的完全培养基,37 ℃恒温培养2 h,采用酶标仪检测450 nm 处的吸光度(A)值。通过GraphPad Prism 9 软件对数据进行统计分析,计算药物处理AMDC 后的半数抑制浓度(half inhibitory concentration,IC50)。
2.2.3 克隆形成实验 AMDC 以2×103个/孔接种至6 孔板中,每孔2 mL,培养24 h 后,分别加入不同质量浓度(0.2、0.4、0.8 mg/mL)的GSG 溶液,对照组加入不含药物的培养基,置于培养箱中继续培养,每3 天换液1 次,10 d 后终止培养。使用4%组织细胞固定液固定细胞30 min,0.1%结晶紫染色20 min,PBS 冲洗2 次,待干燥后拍照并计数。
2.2.4 EdU法检测细胞增殖能力 AMDC以2×105个/孔接种至24 孔板中,每孔1 mL,培养24 h 后,分别加入不同质量浓度(0.4、0.8、1.6 mg/mL)的GSG溶液,对照组加入不含药物的培养基,干预48 h 后终止培养,按照试剂盒说明书加入2×EdU 工作液100 μL,37 ℃孵育2 h,弃去培养基,使用4%组织细胞固定液、0.5% Triton X-100 固定及通透,以3%BSA 冲洗2 次,每次5 min,加入Click 反应液均匀覆盖各孔底部,避光孵育30 min。再次以3% BSA冲洗2 次,每次5 min,PBS 冲洗5 min,加入Hoechst 33342 溶液,避光孵育10 min,吸出后以PBS 冲洗2 次,每次5 min,最后进行荧光拍照。
2.3 AM 发病机制的生信分析
2.3.1 AM 数据集检索及差异表达基因(differentially expressed genes,DEGs)分析 从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/#)中检索“adenomyosis”、种属为“homo sapiens”、表达类型为“expression profiling by array”的数据集。通过GEO2R 在线分析网站(https://www.ncbi.nlm.nih.gov/geo/geo2r/)对DEGs 进行归一化与差异分析,获取满足P<0.05、|log2FC|>1 的DEGs。利用R 4.2.1 软件ggplot2 包对差异结果进行可视化。
2.3.2 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 对获取的DEGs 进行ID 转换,导入R 4.2.1 软件clusterProfiler包进行GO 和KEGG 富集分析,利用ggplot2 包对结果进行可视化。
2.4 体内实验
2.4.1 动物造模、分组与给药 ICR 小鼠适应性饲养1 周后,以雌雄为2∶1 的比例合笼饲养,获取新生雌性ICR 小鼠48 只,通过随机法将小鼠分为对照组、模型组、复方米非司酮(3.25 mg/kg)组和GSG低、中、高剂量(0.635、1.270、2.539 g/kg)组,每组8 只。对照组小鼠于出生第2~5 天滴喂5 μL/g的花生油-卵磷脂-炼乳混合液(2∶0.2∶3),每天1次。除对照组外,其余小鼠于出生第2~5 天滴喂5 μL/g 花生油-卵磷脂-炼乳+2.7 μmol/kg 他莫昔芬,每天1 次。造模后常规饲养90 d,各给药组小鼠每日ig 100 μL 给药溶液,对照组和模型组ig 等体积生理盐水,连续干预30 d。小鼠ip 150 mg/kg 戊巴比妥钠处死,获取子宫、肝、脾、肾组织和血液样本,置于4%组织细胞固定液中固定过夜。
2.4.2 HE 染色观察子宫及肝脾肾病理形态 将经固定的各组小鼠子宫、肝、脾、肾组织脱水包埋,放入切片机中切片,将切片展开并黏附于载玻片上,晾干。对切片进行脱蜡水化,苏木素染色20 s、伊红复染30 s 并流水冲洗,再对切片进行脱水透明处理,用封片剂封片,对切片进行镜下观察与拍照,子宫组织切片以20、40 倍镜分别拍摄,肝、脾、肾组织切片均以20 倍镜拍摄。请经验丰富的病理科于敏敏医师对切片的形态学改变情况进行判断。
2.4.3 免疫组化检测子宫组织中p-PI3K、p-Akt 和HIF-1α 蛋白表达 将子宫组织切片进行脱蜡水化,再通过内源性过氧化物酶封闭液封闭去除内源性过氧化物酶。将切片置于稀释后的柠檬酸钠抗原修复液中,95 ℃水浴条件下修复25 min,用山羊血清封闭液封闭30 min,滴加一抗孵育过夜(p-Akt 抗体稀释比为1∶150、p-PI3K 抗体稀释比为1∶100、HIF-1α 抗体稀释比为1∶200),滴加二抗孵育40 min(稀释比为1∶200),加入DAB 工作液后根据显微镜下观察的情况终止显色。苏木素染色液复染30 s,进行脱水透明处理后封片,观察p-PI3K、p-Akt 和HIF-1α 免疫组化染色情况。使用Image J 软件IHC Profiler 插件根据染色强度与染色面积统计阳性面积比。
2.4.4 血清ALT 活性和BUN 含量的检测 取各组小鼠血液,3 200 r/min 离心15 min 后,获得上清液,按照试剂盒说明书测定ALT 活性和BUN 含量。
2.5 统计学分析
采用GraphPad Prism 9.0 软件进行统计分析,数据以±s表示,多组间数据采用 One-way ANOVA 分析。
3 结果
3.1 体外实验
3.1.1 GSG 和米非司酮对AMDC 活力的影响 为探究细胞对药物的敏感性,利用梯度质量浓度的GSG 溶液及阳性对照药米非司酮分别干预AMDC 48 h 后,采用CCK-8 法对细胞活力进行检测。如图1 所示,GSG 和米非司酮均能有效抑制AMDC 活力,GSG 和米非司酮的IC50值分别为(1.59±0.04)mg/mL、(47.94±2.73)μg/mL,表明GSG 对AMDC活力的具有较强的抑制作用。因此,后续采用梯度质量浓度(0.4、0.8、1.6 mg/mL)的GSG 溶液处理AMDC,检测相关指标改变。
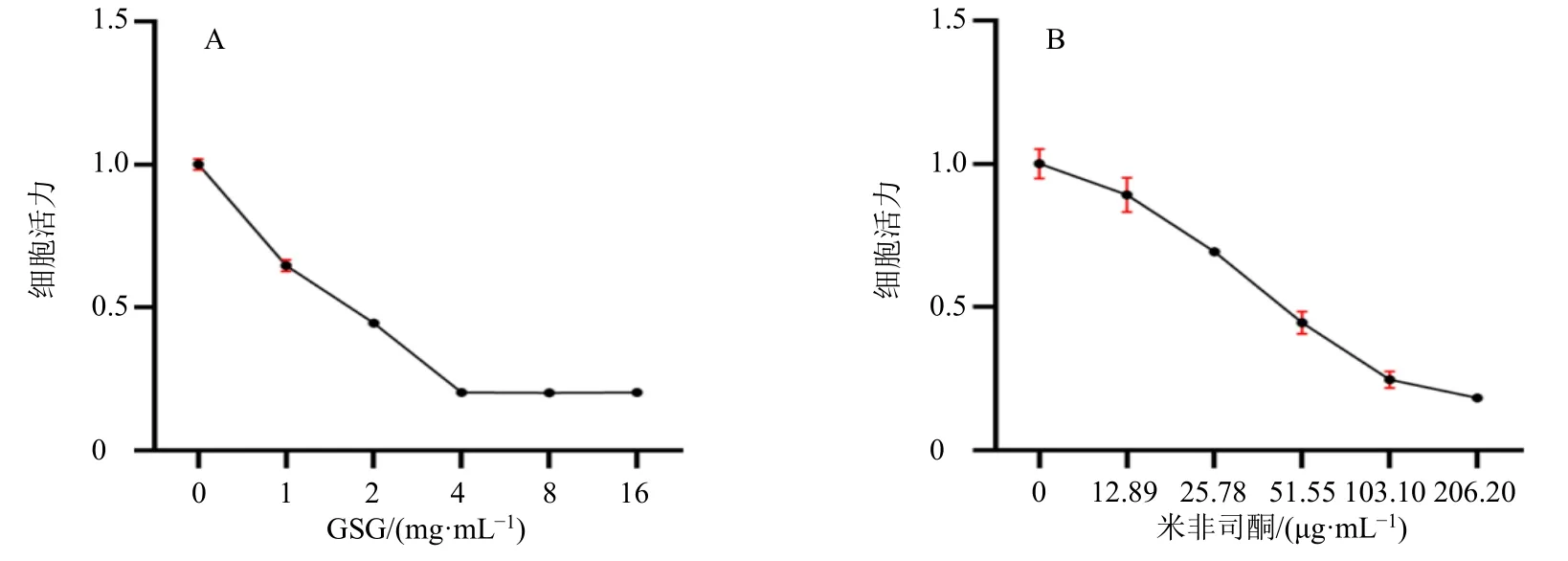
图1 GSG (A) 和米非司酮 (B) 对AMDC 活力的影响 (±s, n = 3)Fig.1 Effects of GSG (A) and mifepristone (B) on viability of AMDC (±s, n = 3)
3.1.2 GSG 抑制AMDC 的克隆形成能力 AM 具有恶性肿瘤的特征,利用克隆形成实验检测GSG 对AMDC 克隆能力的影响。由于以1.6 mg/mL 的GSG溶液干预细胞后无法产生细胞团,故以梯度质量浓度(0.2、0.4、0.8 mg/mL)的GSG 溶液干预AMDC 10 d,4%组织细胞固定液固定染色后晾干,拍照并统计各孔内细胞数量>50 个的细胞团数量。如图2所示,与对照组比较,GSG(0.4、0.8 mg/mL)组细胞克隆形成数目均显著降低(P<0.001),表明GSG能够有效抑制AMDC 的克隆形成能力。

图2 GSG 抑制AMDC 的克隆形成能力 (±s, n = 3)Fig.2 GSG inhibits clonal formation ability of AMDC (±s, n = 3)
3.1.3 GSG 抑制AMDC 的增殖能力 克隆形成与细胞增殖密切相关,为了更直观地评估药物对AMDC 增殖能力的影响,采用EdU 增殖检测试剂盒检测GSG 对AMDC 增殖能力的影响。以梯度质量浓度的GSG 溶液干预AMDC 48 h 后,使用EdU工作液孵育处理2 h,4%组织细胞固定液固定染色,检测其在2 h 内的细胞增殖情况。如图3 所示,与对照组比较,GSG(0.4、0.8、1.6 mg/mL)组细胞增殖率显著降低(P<0.001),表明GSG 对AMDC增殖能力具有较强的抑制作用。
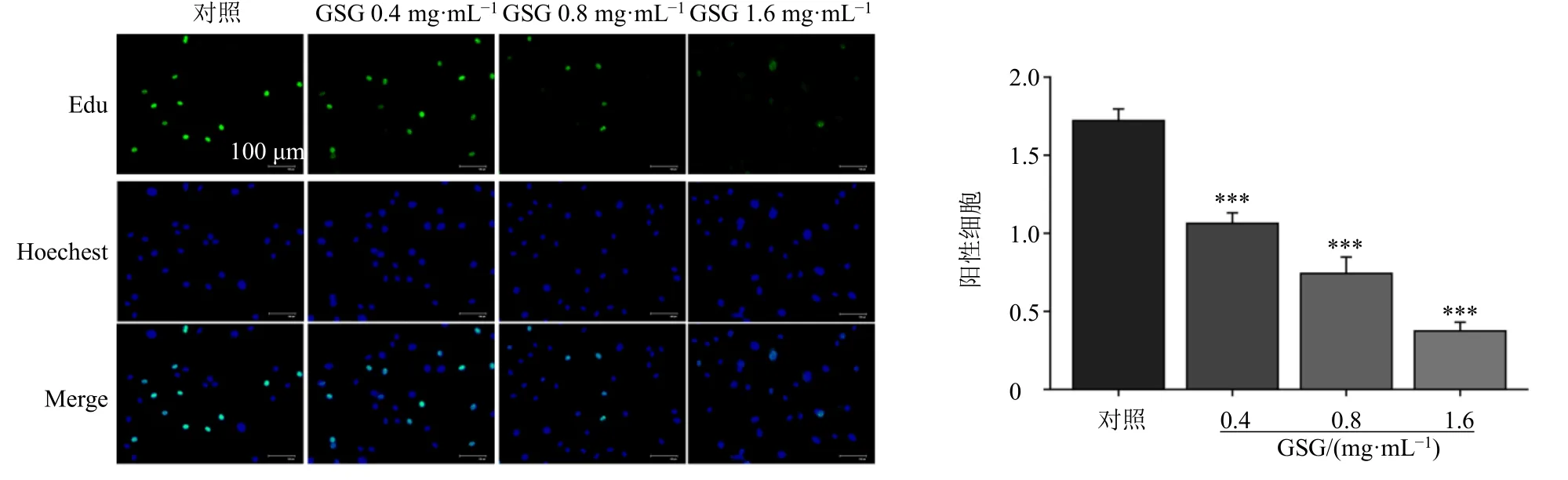
图3 GSG 抑制AMDC 的增殖能力 (±s, n = 3)Fig.3 GSG inhibits proliferation ability of AMDC (±s, n = 3)
3.2 AM 发病机制的生信分析
为探究AM 发病相关分子机制,在GEO 数据库中获取鉴定AM DEGs 的数据集GSE68870(包括4 个AM 组织样本和4 个正常组织样本)。通过GEO2R 在线分析网站对本数据集包含的70 523 个基因进行归一化及差异分析,共获得来自GSE68870 数据集的266 个DEGs,其中包括111 个上调基因和155 个下调基因(图4-A)。
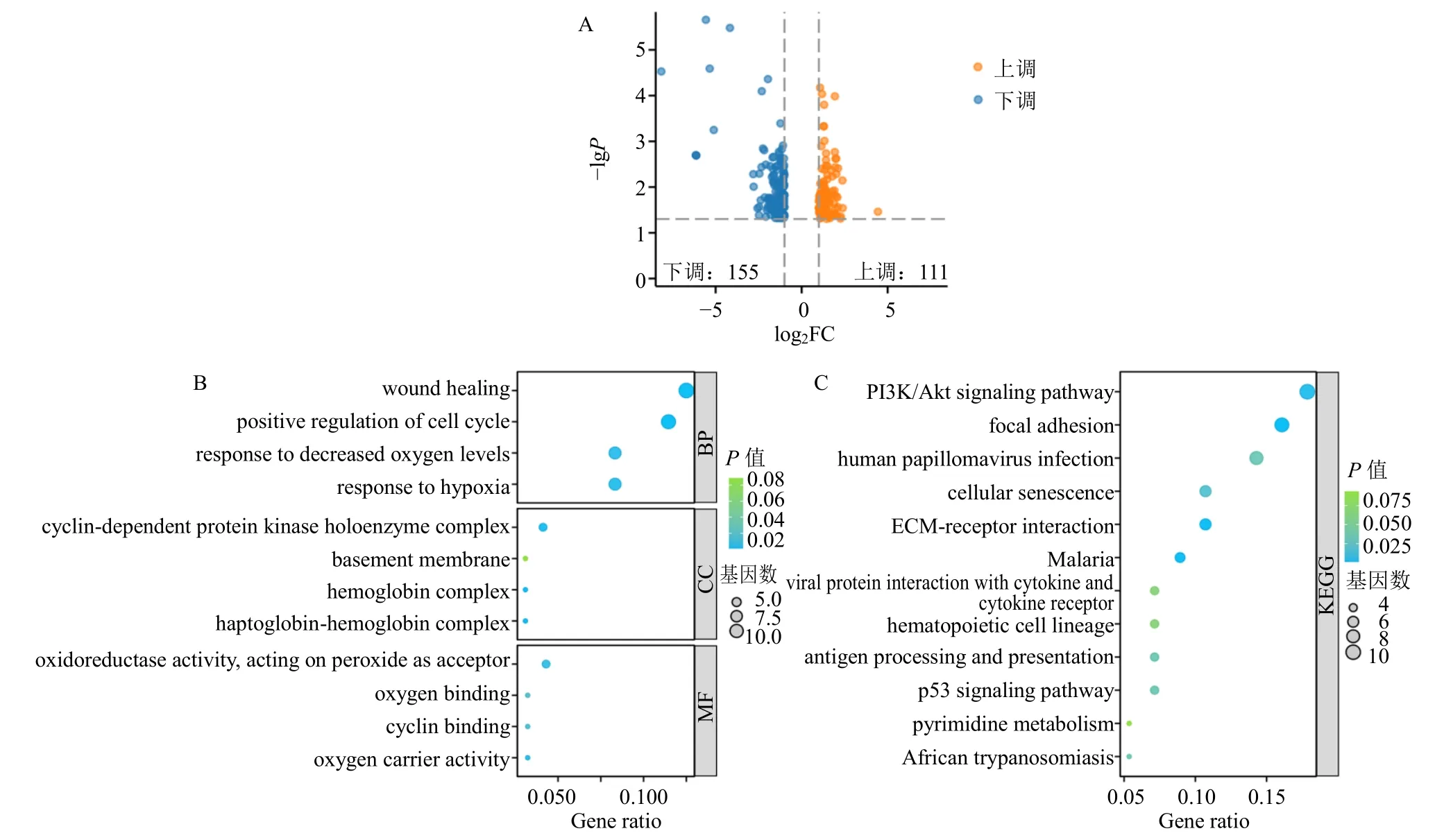
图4 AM 发病机制的生信分析Fig.4 Bioinformatics analysis of pathogenesis of AM
基于DEGs 在疾病的起源与进展中扮演重要角色,进一步分析了其主要影响的生物学过程及信号通路。对DEGs 进行GO 和KEGG 富集分析,结果显示,缺氧反应相关条目在GO 分析中富集(图4-B),PI3K/Akt 信号通路则在KEGG 分析中富集(图4-C)。已有报道表明,AM 异位内膜组织中可能存在缺氧环境,并促进疾病进展,引起异常增殖[21],PI3K/Akt 信号通路在AM 异位内膜细胞增殖中发挥重要作用,并且低氧环境中HIF-1α 稳定表达,是PI3K/Akt 通路下游重要的调控因子[22],并对缺氧环境做出应答[23]。以上结果提示PI3K/Akt 通路介导的HIF-1α 激活是缺氧环境下AM 异位内膜细胞异常增殖的驱动因素。因此,进一步通过体内实验验证GSG 方案是否通过该通路发挥作用。
3.3 体内实验
3.3.1 GSG 改善AM 小鼠模型中腺体向肌层侵袭基于AM 是以子宫内膜的腺体、间质侵入肌层为病理特征的疾病,利用滴喂他莫昔芬法构建小鼠AM模型,采用HE 染色法观察各组小鼠子宫的病理学改变。如图5 所示,对照组小鼠子宫内膜与肌层边界清晰,无子宫内膜腺体与间质侵入子宫肌层表现;模型组小鼠子宫内膜与肌层边界模糊,可见多处子宫内膜腺体与间质侵入肌层深部,腺体增多;GSG低剂量组子宫内膜与肌层边界欠清晰,可见子宫内膜腺体与间质侵入肌层,较模型组浸润深度减轻、数量较少;复方米非司酮组和GSG 中剂量组子宫内膜与肌层边界较清晰,偶见腺体与间质侵入肌层,较模型组浸润深度明显减轻、数量减少;GSG 高剂量组子宫内膜与肌层边界清晰,肌层连续,少见明显子宫内膜腺体与间质侵入肌层。表明GSG 能够改善AM 的病理进展,以高剂量组改善效果最为明显,子宫肌层结构恢复最接近对照组,腺体侵入肌层数量明显减少;GSG 中剂量组和复方米非司酮组改善效果相似,即中剂量的GSG 与米非司酮药效基本相同。
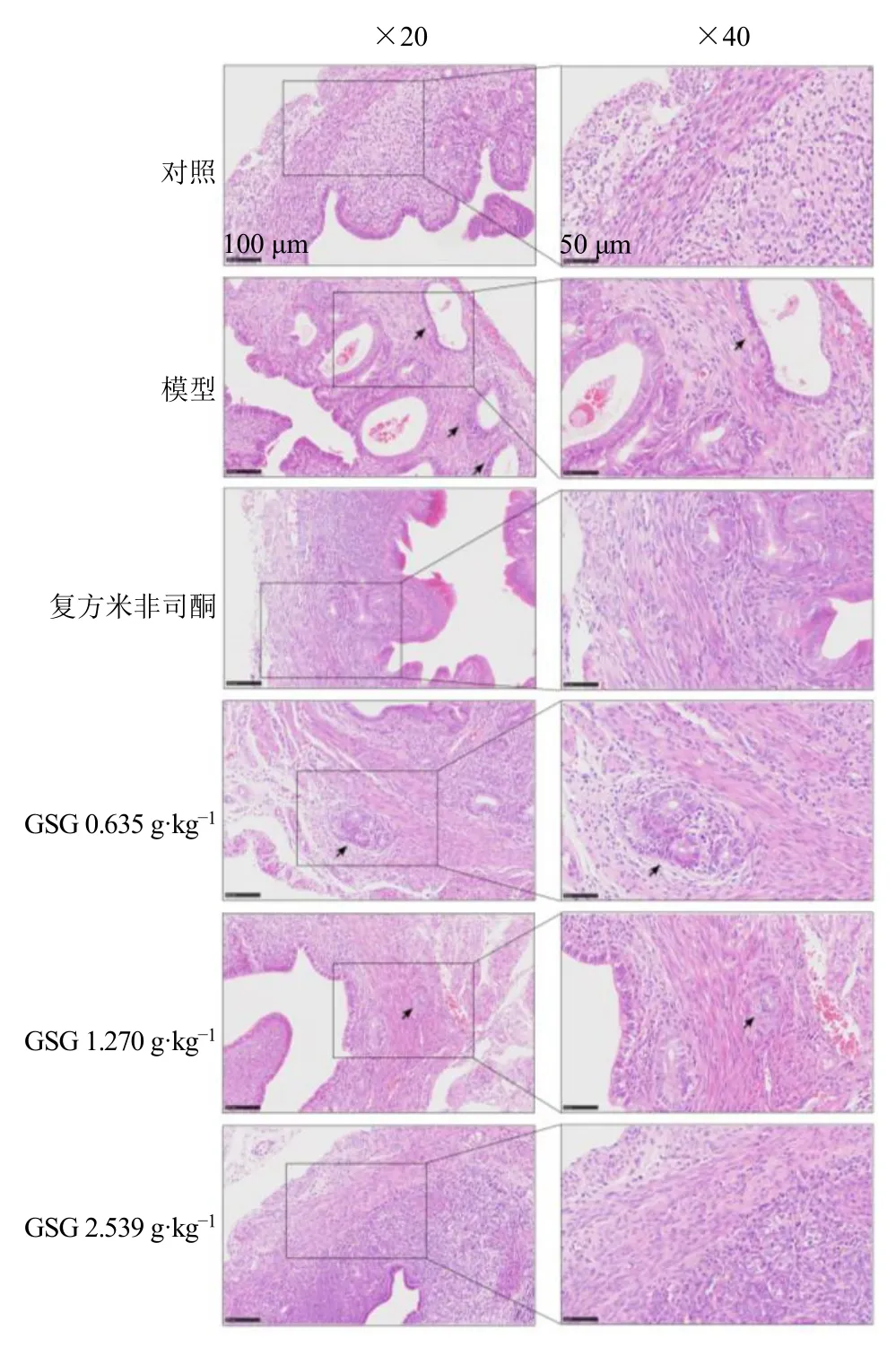
图5 各组小鼠子宫组织HE 染色Fig.5 HE staining of uterine tissue of mice in each group
3.3.2 GSG 抑制AM 小鼠模型子宫组织中p-PI3K、p-Akt 和HIF-1α 的表达 生信分析结果提示PI3K/Akt 通路及HIF-1α 表达与AM 发病密切相关,采用免疫组化法检测各组小鼠子宫组织中p-PI3K、p-Akt和HIF-1α 的表达,如图6 所示,与对照组比较,模型组小鼠子宫组织中p-PI3K、p-Akt 和HIF-1α 表达水平显著增加(P<0.01、0.001);与模型组比较,各给药组子宫组织p-PI3K、p-Akt 表达均显著降低(P<0.01、0.001),复方米非司酮组和GSG 中、高剂量组HIF-1α 表达显著降低(P<0.05、0.01)。综合以上结果,GSG 能够降低AM 小鼠子宫组织中p-PI3K、p-Akt 和HIF-1α 的表达,抑制PI3K/Akt/HIF-1α 通路。
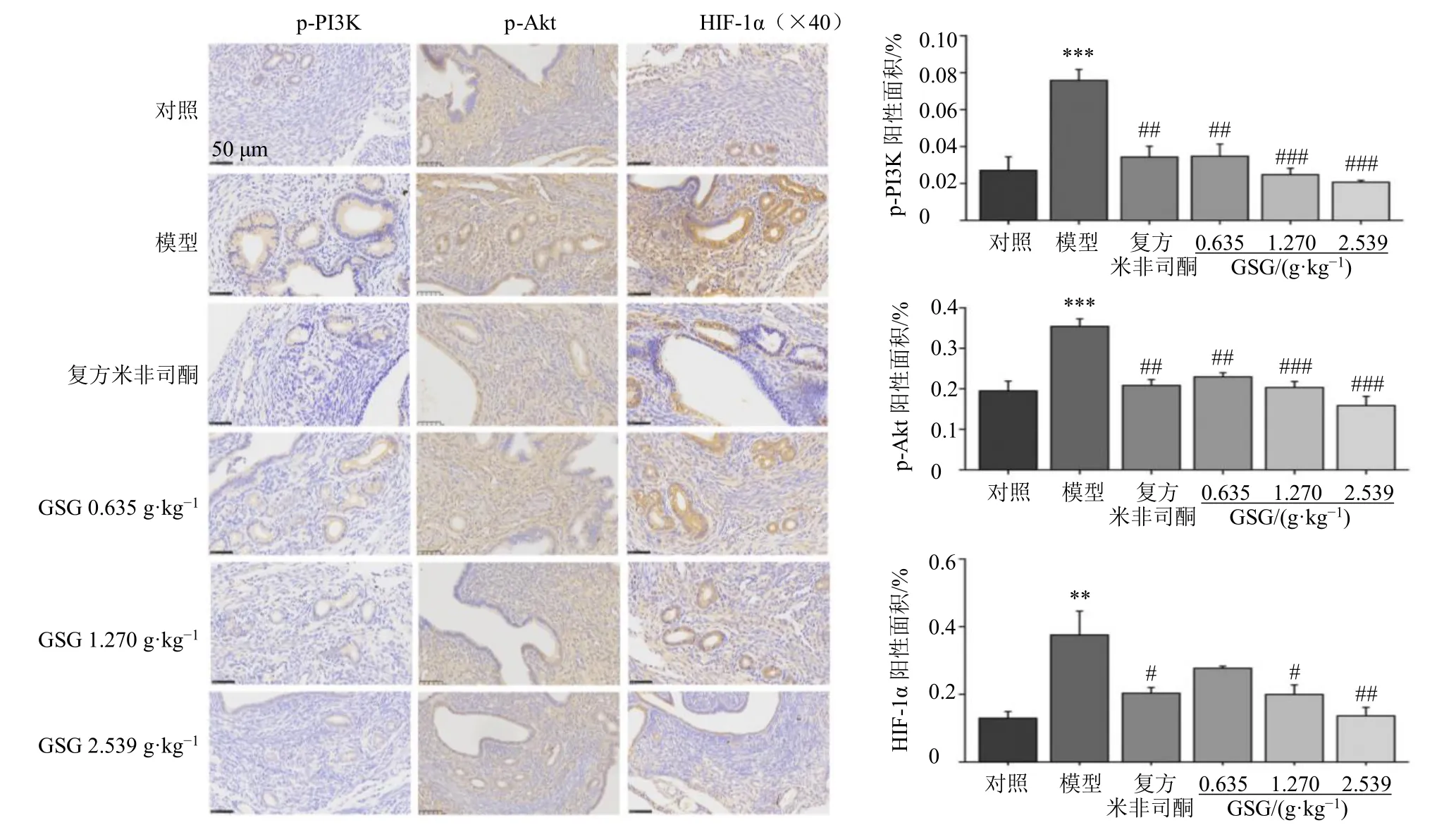
图6 免疫组化检测各组小鼠子宫组织中p-PI3K、p-Akt 和HIF-1α 的表达 (±s, n = 3)Fig.6 p-PI3K, p-Akt and HIF-1α expressions in uterine tissue of mice in each group by immunohistochemistry (±s, n = 3)
3.3.3 GSG 对AM 模型小鼠肝、脾、肾组织病理变化的影响 为观察GSG 对肝、脾和肾组织是否具有损伤性,采用HE 染色观察各组小鼠肝、脾和肾组织的形态学改变。如图7 所示,各组小鼠肝、脾和肾组织病理形态均未见明显改变,表明GSG 处理未引起AM 模型小鼠肝、脾和肾的病理性变化。
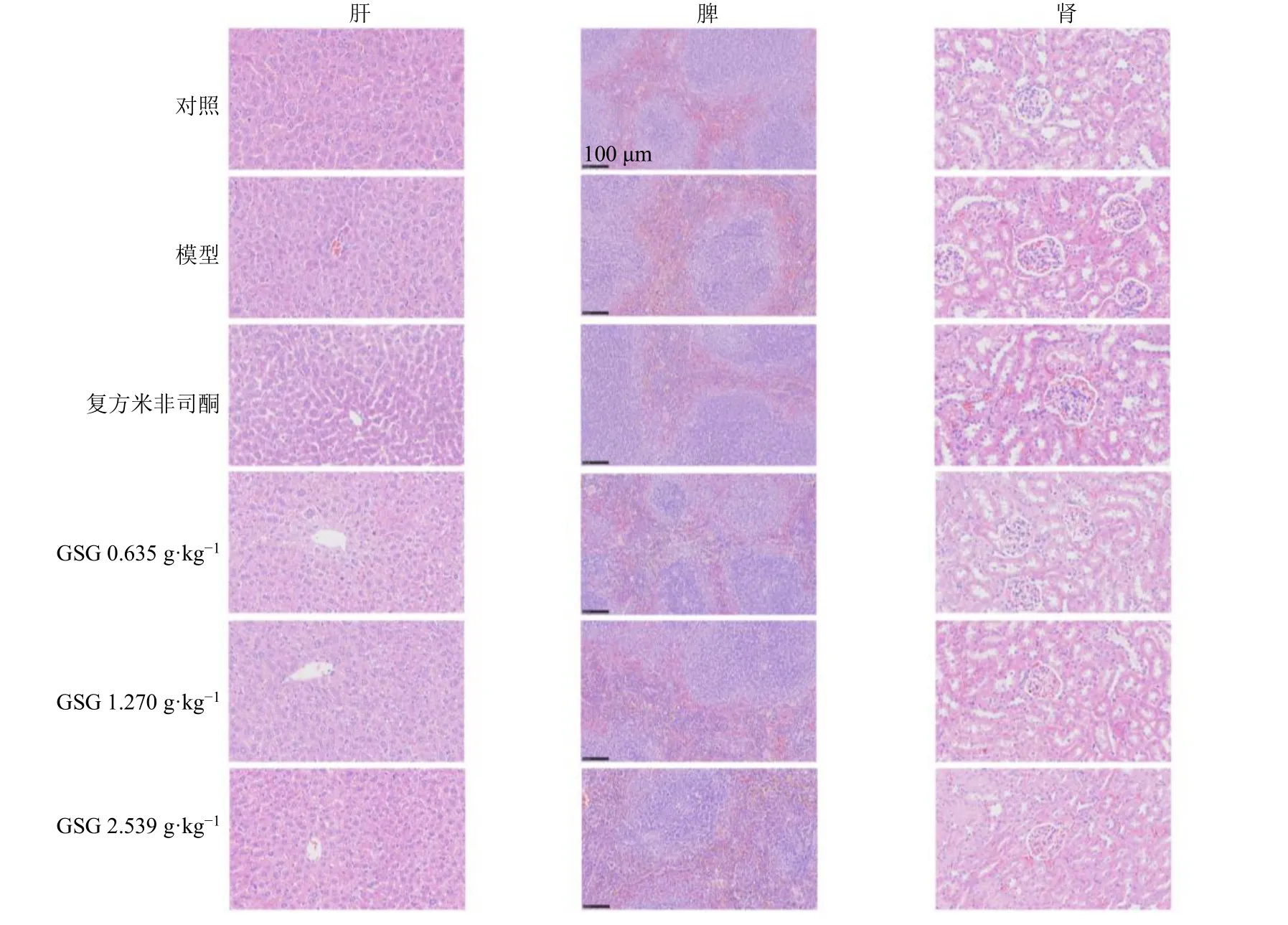
图7 各组小鼠肝、脾和肾组织HE 染色 (×20)Fig.7 HE staining of liver, spleen and kidney tissues of mice in each group (× 20)
3.3.4 GSG 对AM 模型小鼠血清ALT 活性和BUN水平的影响 ALT 是一种指示肝功能的常规指标,其活性升高提示肝功能受损。BUN 是由肾脏排出的代谢废物,其水平升高通常提示肾功能异常。如图8 所示,各给药组血清ALT 活性和BUN 水平无统计学差异,表明GSG 处理未引起AM 模型小鼠明显肝、肾功能损伤。
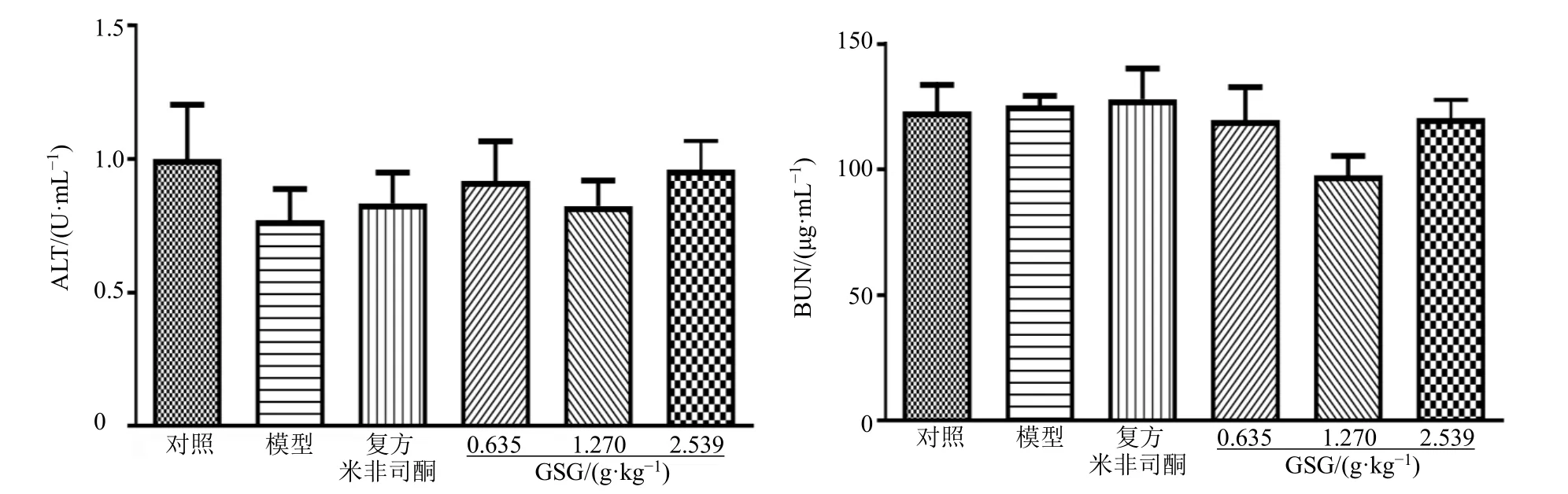
图8 GSG 对AM 模型小鼠血清ALT 活性和BUN 水平的影响 (±s, n = 4)Fig.8 Effect of GSG on ALT activity and BUN level in serum of AM model mice (±s, n = 4)
4 讨论
AM 是一种易反复的妇科常见疑难病,严重影响患者生活质量。近年来,随着生育需求的增加,现有医学方法难以同时满足AM 患者的症状控制与生育问题。然而,中医药在改善症状、调经助孕方面显示出潜在优势,中成药因应用便捷和对控制症状的积极效果广泛应用于临床。《中成药治疗痛经临床应用指南(2021 年)》[24]明确推荐,在AM 的治疗中,桂枝茯苓胶囊可以缩小异位病灶,散结镇痛胶囊可缓解痛经、降低复发率。《宫血宁胶囊妇产科临床应用指导建议》[25]也明确指出宫血宁胶囊能够减少异常子宫出血患者的出血量。此3 药针对AM的症状各有所长,且有研究表明,中成药联用可打破单用的局限性,减毒增效,更贴合中医辨证论治的特点[26]。本课题组常以GSG 方案用于临床,收效甚佳,但其作用机制尚不明确,故本研究结合体内外实验对此展开深入探讨。
在中医理论中,AM 的主要病理因素为“瘀血”。《临证指南医案》曰:“初为气结在经,久则血伤入络”,气滞血停,久病入络,瘀血胶着阻滞络脉,则易积聚为癥瘕,缠绵难愈[27]。故以“通阳化瘀”法通利脉络、祛瘀消癥,治以GSG 方案。桂枝茯苓胶囊源于经方桂枝茯苓丸,是治疗“癥瘕”的基础用方。其中桂枝温经通阳,可以辛散之性引诸药于营卫络脉之中;茯苓甘淡,利水渗湿;桃仁辛润入络、丹皮辛寒入血、赤芍苦平除血痹,三者入络消癥、清热凉血;诸药合用可通阳化瘀、清热利湿。散结镇痛胶囊药简力繁,其中血竭味咸,可入络搜邪,破癥祛瘀止痛;三七通脉行瘀,和营止血;浙贝、薏苡仁清热散结,通利络脉;诸药合用可破癥祛瘀、化痰散结。宫血宁胶囊由重楼单味药组成,长于清热解毒、散肿止痛、化瘀止血[28]。现代药理研究表明,重楼还具有抗肿瘤、抗菌消炎、抗病毒、止血镇痛的作用[29]。GSG 方案基于消癥化瘀,以辛散温通之品引诸药入络,直达病所,同时避免苦寒之品凝滞气血,多药协同,辩证灵活。
子宫内膜腺体与间质异位并侵入肌层是AM 的病理基础,异位内膜细胞的异常增殖可加重AM 进展[30]。Xu 等[31]研究显示,槲皮素可以通过抑制子宫异位内膜基质细胞的增殖能力,影响细胞迁移与侵袭能力,进而改善AM。因此,抑制异位内膜细胞增殖是干预AM 发生过程的重要措施。本研究发现,GSG 可抑制AMDC 活力,0.8 mg/mL GSG 溶液可有效抑制AMDC 克隆形成和增殖能力。
在表观遗传学研究中,疾病的DEGs 富集情况常指示疾病潜在的分子机制。本研究对AM的DEGs进行分析后发现,GO 分析中与缺氧相关的条目被富集,这与AM 组织中可能存在缺氧微环境相一致,PI3K/Akt 信号通路则富集在KEGG 分析中。PI3K作为脂质激酶家族成员[32],可以通过诱导磷脂酰肌醇4,5-二磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2 ) 向 磷 脂 酰 肌 醇 3,4,5- 三 磷 酸(phosphatidylinositol 3,4,5-trisphosphate,PIP3)的转化进而促进Akt 磷酸化,介导下游重要效应因子的表达[33-34],进而调节细胞增殖。研究提出,在AM发生过程中,异位内膜细胞的快速增殖与炎性反应的发生通常导致了氧气快速消耗并造成组织缺血缺氧状态[35]。此时,具有调节多种细胞功能能力的PI3K/Akt 通路可通过调节促进或抑制细胞凋亡的相关蛋白参与对缺血缺氧状态的抗性反应,并诱导HIF-1α 表达,进一步诱导下游蛋白表达,促进细胞发生适应性改变。在缺氧条件下,AM 异位内膜中的HIF-1α 与p-Akt 表达增加,且p-Akt 表达峰值早于HIF-1α[35]。因此,PI3K/Akt/HIF-1α 通路是参与AM 发生发展的重要通路。
基于PI3K/Akt/HIF-1α 通路在AM 中的重要作用,本研究进行了GSG 的体内实验研究,以评估药物在真实生理环境中的治疗效果。结果表明,在子宫病理学形态改变上,低、中、高剂量的GSG 均能减轻AM 病灶腺体浸润深度,减少腺体数量,且中剂量的GSG 与米非司酮显示出大致相同的疗效。同时发现,GSG 可降低子宫组织中p-Akt、p-PI3K和HIF-1α 蛋白表达,显示出对PI3K/Akt/HIF-1α 通路的下调作用。提示GSG 对AM 小鼠的改善作用可能与抑制PI3K/Akt/HIF-1α 通路相关。而中剂量的GSG 和米非司酮之所以能够达到相似的疗效,可能是由于两药通过影响不同的生物学过程,但导致了相似的治疗结果。米非司酮作为孕激素受体拮抗剂,可阻断孕酮,抑制腺体分泌,缩小病灶,并改善临床症状[36]。而中剂量的GSG 可能是通过PI3K/Akt/HIF-1α 通路抑制AMDC 增殖、减轻腺体和间质侵入肌层的倾向从而改善AM。这也说明AM的发病机制具有多样性和复杂性,不同的治疗方法间可能存在协同作用。
桂枝茯苓胶囊-散结镇痛胶囊-宫血宁胶囊联用中的3 种中成药分别经安全性分析,显示总体安全性较好[37-39]。鉴于联合用药可能增加肝、肾损伤风险,本研究进行了体内实验以对GSG 方案进行药物安全性评估。研究发现,AM 小鼠经GSG 连续干预30 d 后,各组肝、脾和肾形态学均未见明显改变,血清ALT 活性和BUN 水平无显著性差异。即使在2.539 g/kg 药物剂量下,即相当于2 倍人的临床用量,在动物体内也未见明显不良反应,这些初步结果提示,GSG 方案是安全的治疗选择。但目前研究仅集中于体外及动物实验中,尚未进行广泛的临床试验,接下来可将联用方案进行临床研究拓展,以验证其安全性与有效性。
综上,GSG 方案可能通过抑制PI3K/Akt/HIF-1α 通路来降低AMDC 增殖,阻断AM 模型小鼠疾病进展,且不良反应有限,提示其是针对AM 临床治疗的潜在可用方案。
利益冲突所有作者均声明不存在利益冲突

