大苞藤黄叶化学成分研究
梅 贵,陆正阳,谷英姿,石 可,熊 慧,陈 玉,杨光忠,
1. 中南民族大学药学院,湖北 武汉 430074
2. 中南民族大学化学与材料科学学院,湖北 武汉 430074
3. 国家中医药管理局民族药学三级实验室,湖北 武汉 430074
大苞藤黄GarciniabracteataC. Y. Wu ex Y. H.Li,又称为花皮树、万年果(云南麻栗坡),为藤黄科(Guttiferae)藤黄属GarciniaL.植物,主要分布于中国云南南部至广西南部,生于海拔400~1 300 m 的石灰山杂林中。藤黄属植物用于治疗多种疾病,如炎症、氧化应激、微生物感染和癌症。大苞藤黄果实可食用且具有极高的营养价值,富含维生素、蛋白质和矿物质等多种营养成分[1-2]。近年来,通过对其茎皮[3]、叶[3-7]、枝干[2,8-11]及果实[11-12]的植物化学研究发现该植物含有多环多异戊烯基间苯三酚类化合物(polycyclic polyprenylated acylphloroglucinols,PPAPs)、二苯甲酮衍生物、酮、黄酮、三萜、甾体、联苯等多种结构类型的化学成分,其中酮和PPAPs 是其特征及活性成分。课题组前期从大苞藤黄果实中分离出一系列结构新颖的PPAPs和酮类化合物,并展现出抗肿瘤、抗炎和降血糖等多种生物活性[13-16]。为进一步实现药用植物的可持续利用和发现结构新颖的天然产物,本研究对大苞藤黄叶的化学成分进行了系统研究,采用正、反相硅胶柱色谱及半制备高效液相色谱等多种分离技术进行分离纯化,并通过波谱学数据和量子化学的计算鉴定化合物结构。从大苞藤黄叶醋酸乙酯提取物中分离得到了12 个化合物(图1),分别鉴定为1,3,5-三羟基-5,6,7,8- 四氢酮( 1,3,5-trihydroxy-5,6,7,8-tetrahydroxanthone,1)、1,3-二羟基-5-羰基-5,6,7,8-四氢酮(1,3-dihydroxy-5-oxo-5,6,7,8-tetrahydroxanthone,2)、1,3,5,6-四羟基-8-异戊烯基缩酚酸环醚(1,3,5,6-tetrahydroxy-8-prenyl-depsidone,3)、松脂醇(pinoresinol,4)、对羟基苯丙烯酸[3-(4-hydroxyphenyl) acrylic acid,5]、3-甲氧基-4,4',5-三醇联苯([1,1'-biphenyl]-3-methoxy-4,4',5-triol,6)、(2S)-2,9-巨豆二羟基-6-烯-1-酮 [(2S)-2,9-dihydroxymegastigm-6-en-1-one,7]、(2R)-2,9-巨豆二羟基-6-烯-1-酮 [(2R)-2,9-dihydroxy-megastigm-6-en-1-one,8]、(5Z)-9-羟基-1,5-巨豆二烯-2-酮 [(5Z)-9-hydroxy-1,5-megastigmadien-2-one,9]、2-氧代-α-紫罗兰醇(2-oxo-α-ionol,10)、黑麦草内酯(loliolide,11)、gardeterpenone A(12)。化合物1、2 为新的酮类化合物,化合物3 为新的缩酚酸类化合物,命名为为大苞藤黄甲素、大苞藤黄乙素和大苞藤黄丙素(garbractinones A~C);化合物7~10 为降倍半萜类化合物,化合物11~12 为单萜类化合物,均是首次从大苞藤黄叶中分离得到。CCK-8 实验表明,所有化合物(50 μmol/L)对人非小细胞肺癌A549 细胞没有表现明显的抗增殖活性,其抑制率小于50%。
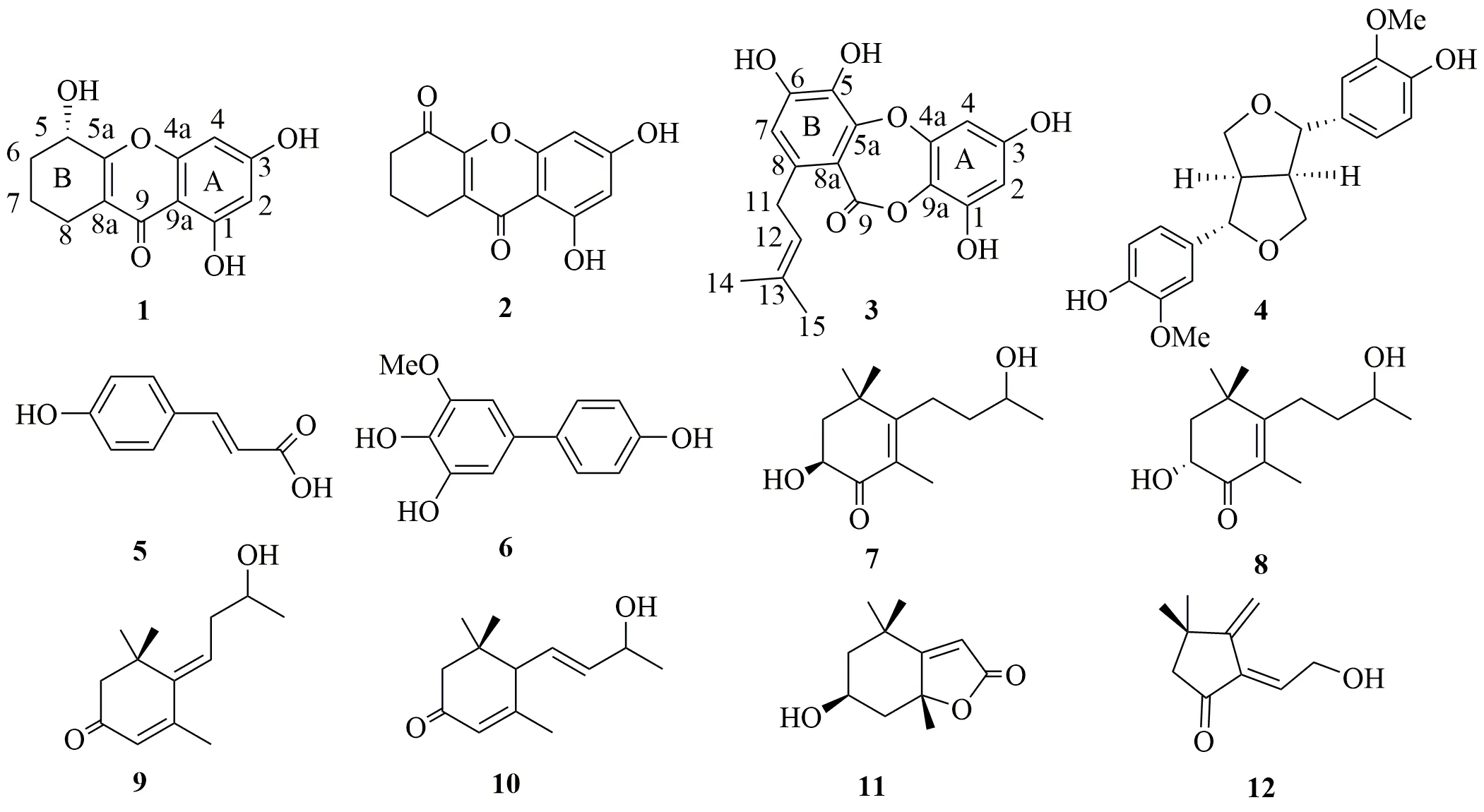
图1 化合物1~12 的结构Fig.1 Structures of compounds 1—12
1 仪器与材料
AM-500/600 型核磁共振波谱仪(德国Bruker公司);Ultimate 3000 半制备型高效液相色谱仪(美国戴安公司,VWD,DAD 检测器);半制备型色谱柱(YMC-Pack ODS-A,250 mm×10 mm,5 μm);AX224ZH/E 型电子天平(奥豪斯仪器常州有限公司);柱色谱硅胶(200~300、300~400 目,青岛海洋化工厂);石油醚、醋酸乙酯、正丁醇、乙醇、甲醇(分析纯,国药集团);甲醇(色谱级,Sigma 公司);乙腈(色谱级,中国昌泰兴业有限公司);ZF1-II 紫外分析仪(上海嘉鹏科技有限公司);UH5300紫外可见分光光度计(日立高新技术公司);Autopo1IV-T 全自动数字旋光仪(美国鲁道夫公司);Chirascan Plus 圆二色谱仪(美国应用光物理公司);Q Exactive 高分辨质谱仪(赛默飞世尔科技有限公司)。高糖培养基(DMEM,美国Gibco 公司);0.25%胰酶-EDTA 消化液(美国Gibco 公司);磷酸盐缓冲液(PBS,美国Gibco 公司);胎牛血清(FBS,杭州四季青生物科技有限公司);青-链霉素混合液(双抗,美国Gibco 公司);二甲基亚砜(dimethyl sulfoxide,DMSO,北京索莱宝科技有限公司);SP-MAX3500FL 多功能酶标仪(上海闪谱生物科技有限公司);紫杉醇(货号B21695,上海源叶生物科技有限公司);冬凌草甲素(自制,质量分数大于98%)。
大苞藤黄叶于2021 年9 月采集于云南省文山州西畴县,由中南民族大学药学院刘新桥教授鉴定为藤黄科藤黄属植物大苞藤黄G.bracteataC. Y. Wu ex Y. H. Li 的叶,植物标本(20210901)保存于中南民族大学药学院药用植物标本室。
2 方法
2.1 提取与分离
取干燥的大苞藤黄叶20.0 kg,粉碎成粗粉,将粗粉置于95%乙醇中浸泡,室温提取3 次,每次24 h。将浸提液进行减压抽滤,合并滤液浓缩干燥,得到乙醇浸膏2.29 kg。将上述浸膏用10%甲醇-水溶解,再依次用石油醚、醋酸乙酯萃取3 次,浓缩、干燥后得到醋酸乙酯提取物0.43 kg。取醋酸乙酯粗提物0.3 kg,用硅胶(200~300 目)柱色谱进行分离,以石油醚-醋酸乙酯(10∶1、8∶2、7∶3、6∶4、1∶1、3∶7、0∶1)为洗脱液进行梯度洗脱,TLC检测合并所得的组分,最后得到13 个组分(A~M)。将H 组分(14.27 g)用反相硅胶柱色谱进行分离,用30%、50%、60%、70%、80%、100%水-甲醇依次洗脱后,TLC 检测合并所得的组分,最后得到10个组分(H.01~H.10)。再将其中的H.02 和H.03 组分合并过正相硅胶柱,以石油醚-醋酸乙酯(10∶1、6∶1、8∶2、7∶3、6∶4、1∶1、0∶1)为洗脱液进行梯度洗脱,得到19 个组分(H0203-01~H0203-19)。将组分H0203-10 通过高效液相色谱(DAD 检测器,乙腈-水24∶76)分离纯化,得到化合物7(1.23 mg,tR=17.1 min)、8(1.12 mg,tR=17.8 min)、5(68.36 mg,tR=13.5 min)、11(9.15 mg,tR=26.4 min)和6(4.83 mg,tR=28.6 min)。将组分H0203-13 通过高效液相色谱(乙腈-水27∶73)分离纯化,得到化合物3(10.18 mg,tR=96.1 min)和4(10.37 mg,tR=29.3 min)。将组分H0203-14 通过高效液相色谱(乙腈-水25∶75)分离纯化,得到化合物1(18.9 mg,tR=22.9 min)。将组分H0203-12 通过高效液相色谱(乙腈-水22∶78)分离纯化,得到化合物10(1.4 mg,tR=50.1 min)和9(4.18 mg,tR=27.5 min)。将组分H0203-7 通过高效液相色谱(乙腈-水27∶73)分离纯化,得到化合物2(11.9 mg,41.2min)和12(4.2 mg,tR=14.0 min)。
2.2 抗增殖活性测试
采用CCK-8 法测定化合物体外抑制A549 细胞增殖活性[17]。以化合物1~12 为实验组,紫杉醇和冬凌草甲素为阳性对照组,同时设对照组(等体积的不含细胞空白培养基)和空白组(等体积的含10%CCK-8 培养基)。取处于对数生长期的A549 细胞,以5×103个/孔密度接种于96 孔板培养至细胞贴壁后给药,每孔加入浓度为50 μmol/L 的受试化合物(1~12)100 μL 于37 ℃、5% CO2的培养箱中继续培养48 h,然后,吸弃各培养孔上清液,向每孔加入100 μL含10% CCK-8 工作液的培养基,于37 ℃、5% CO2中继续培养1 h,用酶标仪测定各孔在450 nm处的吸光度(A)值。重复实验3 次,各组分别设定6个复孔。根据测得的A值计算抑制率。
抑制率=(A对照-A实验)/(A对照-A空白)
3 结果与分析
3.1 结构鉴定
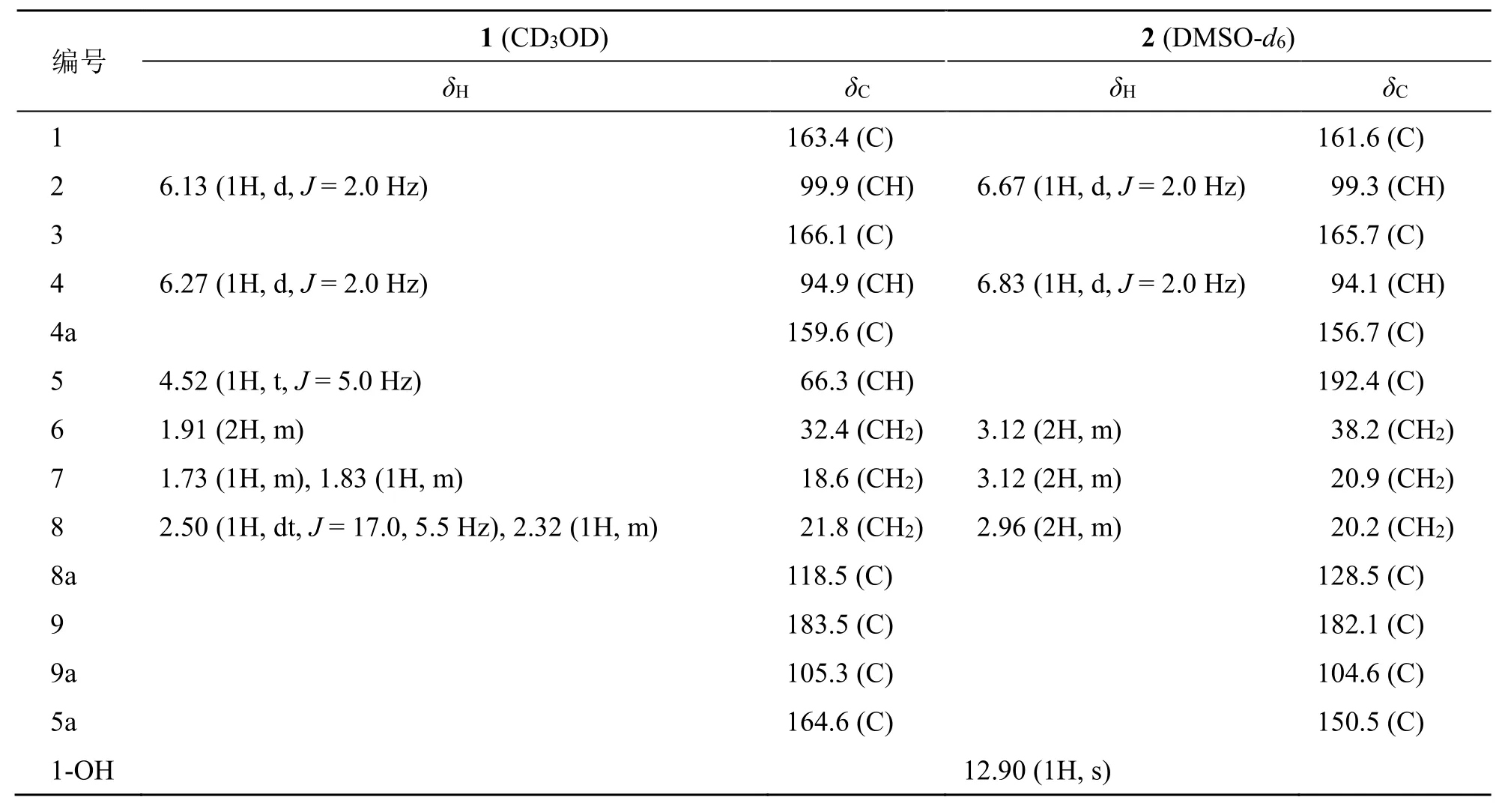
表1 化合物1 和2 的1H-NMR 和13C-NMR 数据Table 1 1 H-NMR and 13C-NMR data of compounds 1—2
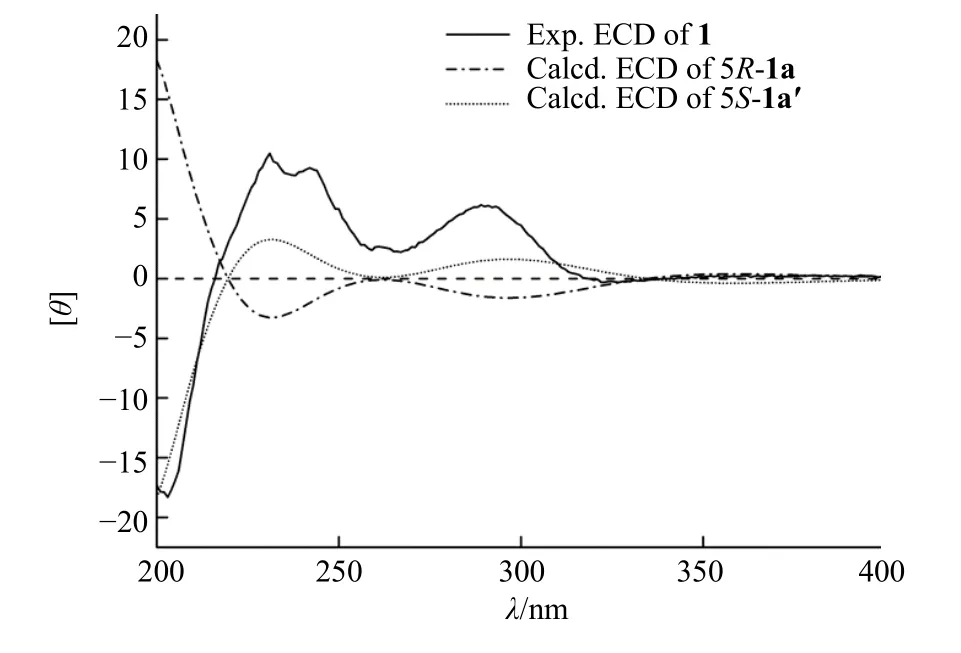
图4 化合物1 的实验ECD 和计算ECD 图谱Fig.4 Experimental and calculated ECD spectra of compound 1
化合物2:黄色粉末,由HR-ESI-MSm/z:247.060 12 [M+H]+(C13H11O5+,计算值247.061 01),结合13C-NMR 及DEPT 135 数据确定该化合物的分子式为C13H10O5,不饱和度为9。同化合物1 相比,多1 个饱和度,比较2 个化合物的NMR 数据,发现化合物2 比化合物1 多1 个共轭羰基的信号δC192.4 (s),而少1 个连氧次甲基的信号,说明化合物2 为化合物1 的5-OH 氧化成羰基,HMBC 图谱中H-6 (δH3.12) 与δC150.5 (C-5a), 192.4 (C-5) 相关,H-8 (δH2.96) 与δC128.5 (C-8a), 182.1 (C-9),δC150.5(C-5a) 相关证实了上述推断,因而,化合物2 的结构鉴定为1,3-二羟基-5-羰基-5,6,7,8-四氢酮。
化合物3:橙黄色无定型粉末,由HR-ESI-MSm/z: 345.096 86 [M+H]+(C18H17O7+,计算值345.096 88),结合13C-NMR 及DEPT 数据确定该化合物的分子式为C18H16O7,不饱和度为11。1HNMR 图谱(表2)显示有1 对苯环间位偶合的芳香质子信号 [δH6.18 (1H ,d,J= 3.0 Hz ), 6.40 ( 1H , d,J= 3.0 Hz )],1 个孤立的芳香质子信号δH6.57 (1H,s),2 个单峰甲基信号 [δH1.70 (3H, s);1.66 (3H, s)],1 个亚甲基信号 [δH3.40 (2H, d,J= 7.0 Hz)],1 个双键质子信号 [δH5.19 (1H, t,J= 7.5 Hz)]。由13C-NMR和DEPT-135 图谱可知存在1 个共轭酯羰基 [δC166.5 (s)],1 个异戊烯基 [δC32.7 (t), 124.5 (d), 134.0(s), 18.1 (q), 26.1 (q)],3 个sp2杂化的次甲基 [δC102.0 (d), 100.5 (d), 115.2 (d)],9 个非质子化的碳[150.2 (s), 156.5 (s), 154.6 (s), 151.4 (s), 135.4 (s),151.7 (s), 138.2 (s), 113.5 (s), 127.8 (s)],综合以上数据,推测该化合物结构类型为缩酚酸环醚,带有4个羟基和1 个异戊烯基[19]。A 环的羟基取代的模式同化合物1 一致,HMBC 证实了上述推断。HMBC图谱中H-7 (δH6.57) 与δC151.7 (C-6), 135.4 (C-5),113.5 (C-8a) 相关,H2-11 (δH3.40) 与δC113.5 (C-8a), 115.2 (C-7), 138.2 (C-8) 相关,说明剩余的2 个羟基分别连在C-5 和C-6 位,异戊烯基连在C-8。综上所述,鉴定化合物3 的结构为1,3,5,6-四羟基-8-异戊烯基缩酚酸环醚。

表2 化合物3 的1H-NMR 和13C-NMR 数据 (500/125 MHz, CD3OD)Table 2 1H-NMR and 13C-NMR data of compound 3(500/125 MHz, CD3OD)
化合物4:白色粉末,分子式为C20H22O6。1HNMR (500 MHz, CD3OD)δ: 6.94 (2H, d,J= 2.0 Hz,H-2, 2'), 6.76 (2H, d,J= 8.0 Hz, H-5, 5'), 6.80 (2H, dd,J= 8.5, 2.0 Hz, H-6, 6'), 4.69 (2H, d,J= 4.5 Hz, H-7,7'), 3.13 (2H, m, H-8, 8'), 4.22 (2H, dd,J= 9.0, 7.0 Hz,H-9a, 9'a), 3.82 (2H, m, H-9b, 9'b), 3.84 (6H, s, 3, 3'-OMe);13C-NMR (125 MHz, CD3OD)δ: 134.0 (C-1,1'), 111.1 (C-2, 2'), 149.3 (C-3, 3'), 147.5 (C-4, 4'),116.3 (C-5, 5'), 120.3 (C-6, 6'), 87.2 (C-7, 7'), 55.6 (C-8, 8'), 72.8 (C-9, 9'), 56.6 (3', 3-OMe),以上数据与文献报道基本一致[20],故鉴定化合物4 为松脂醇。
化合物5:白色粉末,分子式为C9H8O3。1HNMR (500 MHz, CD3OD)δ: 6.28 (1H, d,J= 16.0 Hz,H-2), 7.60 (1H, d,J= 16.0 Hz, H-3), 7.45 (2H, d,J=8.5 Hz, H-2', 6'), 6.81 (1H, d,J= 8.5 Hz, H-3', 5');13CNMR (125 MHz, CD3OD)δ: 171.3 (C-1), 115.7 (C-2),146.8 (C-3), 127.3 (C-1'), 131.2 (C-2'), 116.9 (C-3'),161.2 (C-4'), 116.9 (C-5'), 131.2 (C-6')。以上数据与文献报道基本一致[21],故鉴定化合物5 为对羟基苯丙烯酸。
化合物6:黄色粉末,分子式为C13H12O4。1HNMR (500 MHz, CD3OD)δ: 6.63 (1H, s, H-2, 6), 7.34(1H, d,J= 8.5 Hz, H-2', 6'), 6.79 (1H, d,J= 8.5 Hz, H-3', 5');13C-NMR (125 MHz, CD3OD)δ: 134.0 (C-1),103.3 (C-2), 150.1 (C-3), 134.5 (C-4), 147.0 (C-5),108.4 (C-6), 134.5 (C-1'), 128.8 (C-2'), 116.6 (C-3'),157.7 (C-4'), 116.6 (C-5'), 128.8 (C-6'), 56.9 (3-OMe),以上数据与文献报道基本一致[22],故鉴定化合物6为3-甲氧基-4,4',5-三羟基联苯。
化合物7:白色固体,分子式C13H22O3。-36(c0.05, MeOH),ECD (2.02×10-3M, MeOH)λ(θ)210 (+4.76), 250 (-9.72), 311 (+1.06) nm;1H-NMR(500 MHz, CD3OD)δ: 4.28 (1H, dd,J= 14.0, 5.5 Hz,H-2), 2.03 (1H, dd,J= 12.5, 5.5 Hz, H-3a), 1.74 (1H,t,J= 13.5 Hz, H-3b), 2.30 (1H, m, H-7a), 2.40 (1H, m,H-7b), 1.56 (2H, m, H-8), 3.79 (1H, m, H-9 ), 1.21 (3H,d,J= 6.0 Hz, CH3-10), 1.28 (3H, s, CH3-11), 1.22 (3H,s, CH3-12), 1.80 (3H, s, CH3-13);13C-NMR (125 MHz,CD3OD)δ: 201.6 (C-1), 70.6 (C-2), 47.2 (C-3), 39.0 (C-4), 167.1(C-5), 129.9 (C-6), 28.2 (C-7), 39.1 (C-8), 69.1(C-9), 23.4 (C-10), 25.9 (C-11), 30.2 (C-12), 12.1 (C-13)。以上数据与文献报道基本一致[23],结合CD 图谱,鉴定化合物7 为 (2S)-2,9-巨豆二羟基-6-烯-1-酮。
化合物8:白色固体,分子式C13H22O3。+28° (c0.05,MeOH)。ECD (2.02×10-3M, MeOH)λ(θ) 210 (-4.85), 250 (+9.00), 320 (-9.22) nm;1HNMR (500 MHz, CD3OD)δ: 4.28 (1H, dd,J= 14.0, 5.5 Hz, H-2), 2.20 (1H, dd,J= 12.5, 5.5 Hz, H-3a), 1.75(1H, t,J= 13.0 Hz, H-3b), 2.51 (1H, m, H-7a), 2.19(1H, m, H-7b), 1.56 (2H, m, H-8), 3.79 (1H, m, H-9),1.20 (3H, d,J= 6.5 Hz, CH3-10), 1.28 (3H, s, CH3-11),1.21 (3H, s, CH3-12), 1.80 (3H, s, CH3-13);13C-NMR(125 MHz, CD3OD)δ: 201.6 (C-1), 70.6 (C-2), 47.2 (C-3), 39.0 (C-4), 167.1 (C-5), 129.9 (C-6), 28.2 (C-7),39.1 (C-8), 69.0 (C-9), 23.5 (C-10), 26.0 (C-11), 30.1 (C-12), 12.1 (C-13)。以上数据与文献报道基本一致[23],结合CD 图谱,故鉴定化合物8 为 (2R)-2,9-巨豆二羟基-6-烯-1-酮。
化合物 9:黄色无定型粉末,分子式为C13H20O2。1H-NMR (500 MHz, CD3OD)δ: 5.89 (1H,s, H-1), 2.35 (2H, s, H-3), 6.23 (1H, t,J= 7.0 Hz, H-7),2.61 (2H, t,J= 6.5 Hz, H-8), 3.89 (1H, m, H-9), 1.23(3H, d,J= 6.0 Hz, CH3-10), 1.31 (3H, s, CH3-11), 1.30(3H, s, CH3-12), 2.12 (3H, d,J= 1.0 Hz, CH3-13);13CNMR (125 MHz, CD3OD)δ: 134.8 (C-1), 202.3 (C-2),54.8 (C-3), 39.5 (C-4), 158.9 (C-5), 143.9 (C-6), 125.9(C-7), 40.6 (C-8), 68.8 (C-9), 23.6 (C-10), 29.5 (C-11),29.5 (C-12), 22.8 (C-13)。以上数据与文献报道基本一致[24],故鉴定化合物9 为 (5Z)-9-羟基-1,5-巨豆二烯-2-酮。
化合物10:黄色固体,分子式为C13H20O2。1HNMR (600 MHz, CD3OD)δ: 5.88 (1H, brs, H-1), 2.42(1H, d,J= 16.8 Hz, H-3a), 2.05 (2H, d,J= 16.8 Hz, H-3b), 2.66 (1H, d,J= 9.6 Hz, H-5), 5.58 (1H, ddd,J=15.6, 9.0, 1.2 Hz, H-7), 5.68 (1H, dd,J= 15.0, 6.0 Hz,H-8), 4.28 (1H, m, H-9), 1.24 (3H, d,J= 6.6 Hz, CH3-10), 0.98 (3H, s, CH3-11), 1.03 (3H, s, CH3-12), 1.96(3H, d,J= 1.8 Hz, CH3-13);13C-NMR (150 MHz,CD3OD)δ: 126.3 (C-1), 202.3 (C-2), 48.5 (C-3), 37.3(C-4), 56.9 (C-5), 166.3 (C-6), 127.6 (C-7), 140.4 (C-8), 69.0 (C-9), 24.0 (C-10), 28.2 (C-11), 27.6 (C-12),24.0 (C-13)。以上数据与文献报道基本一致[25],故鉴定化合物10 为2-氧代-α-紫罗兰醇。
化合物11:淡黄色粉末,分子式为C11H16O3。1H-NMR (500 MHz, CD3OD)δ: 2.41 (1H, td,J= 2.5,13.5 Hz, H-1a), 1.72 (1H, dd,J= 4.0, 13.5 Hz, H-1b),4.21 (1H, m, H-2), 1.98 (1H, td,J= 2.5, 14.5 Hz, H-3a), 1.52 (1H, dd,J= 4.0, 14.5 Hz, H-3b), 5.74 (1H, s,H-7), 1.46 (3H, s, CH3-9), 1.27 (3H, s, CH3-10), 1.75(3H, s, CH3-11);13C-NMR (125 MHz, CD3OD)δ: 46.6(C-1), 67.4 (C-2), 48.2 (C-3), 37.4 (C-4), 185.9 (C-5),89.2 (C-6), 113.5 (C-7), 174.6 (C-8), 27.1 (C-9), 31.2 (C-10), 27.6 (C-11)。以上数据与文献报道基本一致[26],故鉴定化合物11 为黑麦草内酯。
化合物 12:黄色无定型粉末,分子式为C10H14O2。1H-NMR (600 MHz, CD3OD)δ: 2.39 (2H,s, H-5), 6.21 (1H, s, H-6), 4.44 (2H, d,J= 1.2 Hz, H-7), 5.43 (1H, d ,J= 1.2 Hz, H-8a), 5.46 (1H, s, H-8b),1.21 (6H, s, CH3-9, 10);13C-NMR (150 MHz, CD3OD)δ: 202.1 (C-1), 159.0 (C-2), 150.4 (C-3), 40.1 (C-4),53.2 (C-5), 124.0 (C-6), 62.1 (C-7), 114.1 (C-8), 28.7(C-9, 10)。以上数据与文献报道基本一致[27],故鉴定化合物12 为gardeterpenone A。
3.2 抗增殖活性测试结果
采用CCK-8 方法,以冬凌草甲素和紫杉醇为阳性药,测试所有分离的化合物对A549 细胞体外抗增殖的活性,结果表明,在50 μmol/L 下,所有化合物对A549 细胞没有表现出明显的抗增殖活性,其抑制率小于50%,而阳性药冬凌草甲素(50 μmol/L)和紫杉醇(10 μmol/L)的抑制率分别为97.83%和74.77%。
4 讨论
本研究从大苞藤黄叶醋酸乙酯提取物中分离得到了12 个化合物,其结构类型涉及到酚类(1~6)和萜类化合物(7~12)。酚类化合物包括2 个新的四氢酮和1 个缩酚酸环醚类化合物,为首次从该植物中发现的新结构类型,萜类化合物包括降倍半萜类和单萜,均是首次从该植物中分离得到,这些发现丰富了大苞藤黄化学成分的结构类型。尽管本研究在进行抗增殖活性的筛选中,并没有发现所分离的化合物具有明显的抗增殖活性,结合前期文献报道[5],大苞藤黄叶发挥抗肿瘤活性的物质基础可能是酮(包括异戊烯基和笼状酮),但这些化合物在抗炎和降血糖方面的生物活性值得进一步挖掘。研究成果为深入研究大苞藤黄叶的药效物质基础奠定了基础,也为这一药用植物资源的合理开发及可持续利用提供了科学依据。
利益冲突所有作者均声明不存在利益冲突

