基于UHPLC-Q-Orbitrap HRMS 技术的肾康注射液在大鼠体内代谢产物的鉴定及代谢途径分析
杨彦涛 ,李卓伦 ,周 霖 ,康 建 ,程 旭,孙 志 *
1. 郑州大学第一附属医院 药学部,河南 郑州 450052
2. 河南省精准医学临床质谱工程研究中心,河南 郑州 450052
3. 复旦大学药学院,上海 201203
肾康注射液(Shenkang Injection,SKI)是由丹参、大黄、红花、黄芪4 味中药提取加工制成的中药复方,具有降逆泄浊、益气活血和通腹利湿等功效,临床应用已20 余年,疗效显著且应用广泛。研究表明,肾康注射液在治疗糖尿病肾病方面,可显著改善多项肾功能指标,如降低尿白蛋白排泄率、24 h 尿蛋白、血肌酐和尿素氮等,从而减轻糖尿病对肾脏的损伤作用,提高肾功能[1]。慢性肾功能衰竭是由各种病因引起肾脏损害和进行性加重的结果,肾康注射液可使该病患者内生肌酐清除率升高,降低血肌酐,有效率达73.05%[2]。在造影剂肾病防治方面,肾康注射液亦表现出良好的改善肾功能指标的作用,大大减少了造影剂肾病的发生[3]。研究表明SKI 治疗糖尿病肾病的机制可能与减轻高糖诱导的肾小管细胞衰老和肾小管间质损伤、抑制肾系膜细胞增殖和诱导细胞凋亡有关[4-6]。然而,目前关于SKI 体内代谢物的研究尚不系统全面[7],这限制了SKI 的药理学、毒理学和作用机制的进一步研究。因此亟需一种具有高通量、高分辨率和高灵敏度且能准确鉴定其在人体内的代谢产物的方法,以对SKI 进行进一步的分析探索。
超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)具有高通量、高分辨率和高灵敏度的特点,可用于快速准确鉴定中药药效成分在人体内的代谢产物;其可在一个分析周期内获得大量高精度的一级、二级质谱信息,为人体内微量乃至痕量的代谢产物结构的确定提供了客观可靠的数据支持。Compound Discoverer(CD)代谢平台是一种基于LC-MS 获得代谢物检测数据的数据挖掘技术,其可通过对样本组和对照组进行差异性分析,结合对待测物质色谱质谱峰的数据分析,筛选出样品组中存在而对照组中不存在的化合物,并提示可能的生物转化途径[8-10]。
在本课题组前期研究中,SKI 中共鉴定出90 种化学成分,主要化学结构类型为酚酸类、黄酮类和蒽醌类等[11]。随后,又研究了SKI 在大鼠体内的组织分布和药动力学[12]。为了鉴定SKI 在体内的代谢产物,本研究基于UHPLC-Q-Orbitrap HRMS 和CD平台,提出了“提取-化合物筛选-鉴定-验证”的大鼠体内代谢产物的鉴定策略,最终从iv SKI 后的大鼠血浆、尿液和粪便中筛选出并鉴定了92 种代谢产物,明确了SKI 在大鼠体内的代谢谱,为针对SKI进一步的药物研究奠定了坚实的理论和数据基础。
1 仪器与材料
Ultimate 3000 UHPLC(美国Dionex 公司);Q Exactive HRMS(美国Thermo Fisher Scientific 公司);Xcalibur 3.0 数据处理系统(美国Finnigan 公司)。
肾康注射液(批号202109111)由西安世纪盛康药业有限公司生产。对照品没食子酸(批号MUST-18032801)、丹参素(批号MUST-18060920)、咖啡酸(批号MUST-19032003)、原儿茶酸(批号MUST-16032102 )、 5- 羟甲基糠醛( 批号MUST-16031202)、羟基红花黄色素 A(批号MUST-16070508)、阿魏酸(批号MUST-19032928)和芹菜素(批号MUST-16061301)均购自成都Must生物技术有限公司;对照品大黄酸(批号wkq16062204)购自成都维可奇生物技术有限公司。所有对照品经HPLC-UV 检测质量分数均大于98%。甲醇和乙腈为高效液相色谱级,购自美国Thermo Fisher Scientific 公司。HPLC 级甲酸购自阿拉丁工业有限公司。
雄性SD 大鼠(180~220 g)12 只购自郑州大学动物实验中心,合格证号SCXK(豫)2021-0002。所有动物实验操作经郑州大学第一附属医院动物伦理委员会批准(伦理审批号2023-KY-0543)。
2 方法
2.1 色谱条件
色谱柱为Waters BEH C18柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;流动相为0.1%甲酸水溶液(A)-乙腈(B),体积流量0.2 mL/min;梯度洗脱: 0~3 min,5% B;3~16 min,5%~15% B;16~20 min,15%~22% B;20~26 min,22%~55%B;26~30 min,55%~100% B;30~35 min,100%B;35~36 min,100%~5% B;36~40 min,5% B。进样量5 μL。
2.2 质谱条件
质谱仪采用加热电喷雾离子源(HESI)。离子传输管温度320 ℃,辅助气体积流量为10 μL/min。正离子模式下:喷雾电压为3.5 kV,鞘气体积流量为40 μL/min。负离子模式下:喷雾电压为-2.8 kV,鞘气体积流量为38 μL/min。全扫描质量范围m/z80~1 200。碰撞能梯度为20、40、60 eV。
2.3 动物饲养和给药
将SD 大鼠随机分为给药组和对照组,每组6只。随后将各组再进一步随机均分为采血组(3 只)和收集尿液及粪便组(3 只),这些大鼠均饲养在光照/黑暗周期为12 h 的动物房内,温度25 ℃,相对湿度在60%左右,饲养1 周。在这1 周内,大鼠喂养标准饲料和水。给药前,在代谢笼中的大鼠被禁食12 h,只自由饮水[13]。给药组大鼠注射剂量为9 mL/kg(相当于临床剂量的6.3 倍),使用前SKI 先浓缩,浓度提高5 倍,经尾iv 给予大鼠。对照组大鼠同样方法注射生理盐水[14]。
2.4 生物样本采集和预处理
2.4.1 血浆样本 采血组大鼠,ip 10%水合氯醛水溶液(0.2 mL/100 g)进行麻醉。分别于尾iv SKI或生理盐水后0.5、1、2、4、8、12、24 h 从大鼠眼眶静脉中采集血液各0.3 mL,置于肝素钠抗凝EP管中,在4 ℃下以1.3×104r/min 离心10 min,取上清液。最后将各时间点血浆上清液混合在一起,取2 mL 与8 mL 甲醇混合,涡旋、离心、干燥。用200 μL 50%甲醇-水再溶解残余物,制备成供试液。
2.4.2 尿液和粪便样本 收集尿液和粪便组大鼠在代谢笼内尾iv SKI或生理盐水后24 h的尿液和粪便样本。尿液样本滤过后,在4 ℃下以1.3×104r/min 离心10 min。取2 mL 上清液与8 mL 甲醇混合,涡旋、离心。室温下氮气干燥上清液。用200 μL 50%甲醇-水将残余物再溶解。另外,取1 g 干燥后的粪便样品,加入10 mL 甲醇,超声处理30 min后滤过。然后涡旋、离心。上清液干燥。用200 μL 50%甲醇-水复溶,制备成供试液。所有供试液在进样前均用0.22 μm 微孔滤膜滤过[15]。
2.5 对照品溶液的制备
取对照品没食子酸、丹参素、咖啡酸、原儿茶酸、5-羟甲基糠醛、羟基红花黄色素A、阿魏酸、芹菜素、大黄酸各1.0 mg,精密称定后,分别置于10 mL 量瓶中,加入50%甲醇-水溶解并稀释至刻度,摇匀,最终制备成质量浓度为0.1 mg/mL 的对照品储备液;分别精密量取上述对照品储备液适量,将其混合后加入50%甲醇-水稀释,最终制备成各对照品质量浓度均为1 μg/mL 的混合对照品溶液。
2.6 数据处理
采用Xcalibur 3.0 软件对质谱数据进行分析,包括总离子流图、提取离子流图、MS2质谱图、碎片离子和元素组成,质量误差均在5×10-6以内。大鼠静脉注射SKI 后,各生物样本的总离子流图见图1。将Q Exactive HRMS 获取的原始数据文件导入Compound Discoverer 2.1(CD)软件(美国Thermo Fisher Scientific 公司)进行代谢物的筛选鉴定。选择“Metabolism w Statistics Expected w Fish Scoring and Unknown w Pattern and Compound Class Scoring”处理流程,根据导入的原型化合物结构和所选的代谢反应类型,系统自动筛选出潜在的代谢物。主要参数:最大位移0.2 min,质量误差5×10-6,最小质量150,最小峰强度1×105。峰面积的比值(给药组/对照组)设置为大于5。
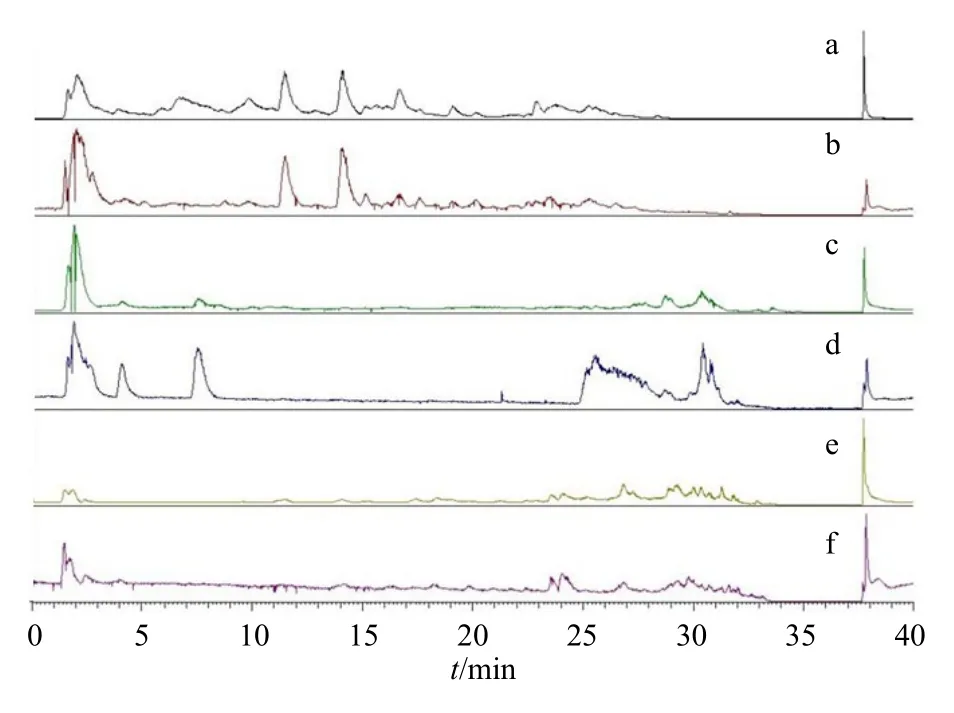
图1 大鼠iv SKI 后各生物样本的总离子流图Fig.1 Total ion chromatograms (TICs) of bio-samples after intravenous administration of SKI in rats
2.7 大鼠体内代谢物的鉴定策略
为了系统分析SKI 在大鼠体内的生物转化和代谢产物结构鉴定,提出了“提取-化合物筛选-鉴定-验证”的大鼠体内代谢产物的鉴定策略,如图2 所示。第一步,根据文献检索信息和标准品质谱数据建立化合物数据库。该数据库不仅包含SKI 中的已知化学成分,还包含文献报道的部分化合物的已知代谢物,包括化合物名称、分子式、相对分子质量、化学结构和特征碎片离子等信息[16]。
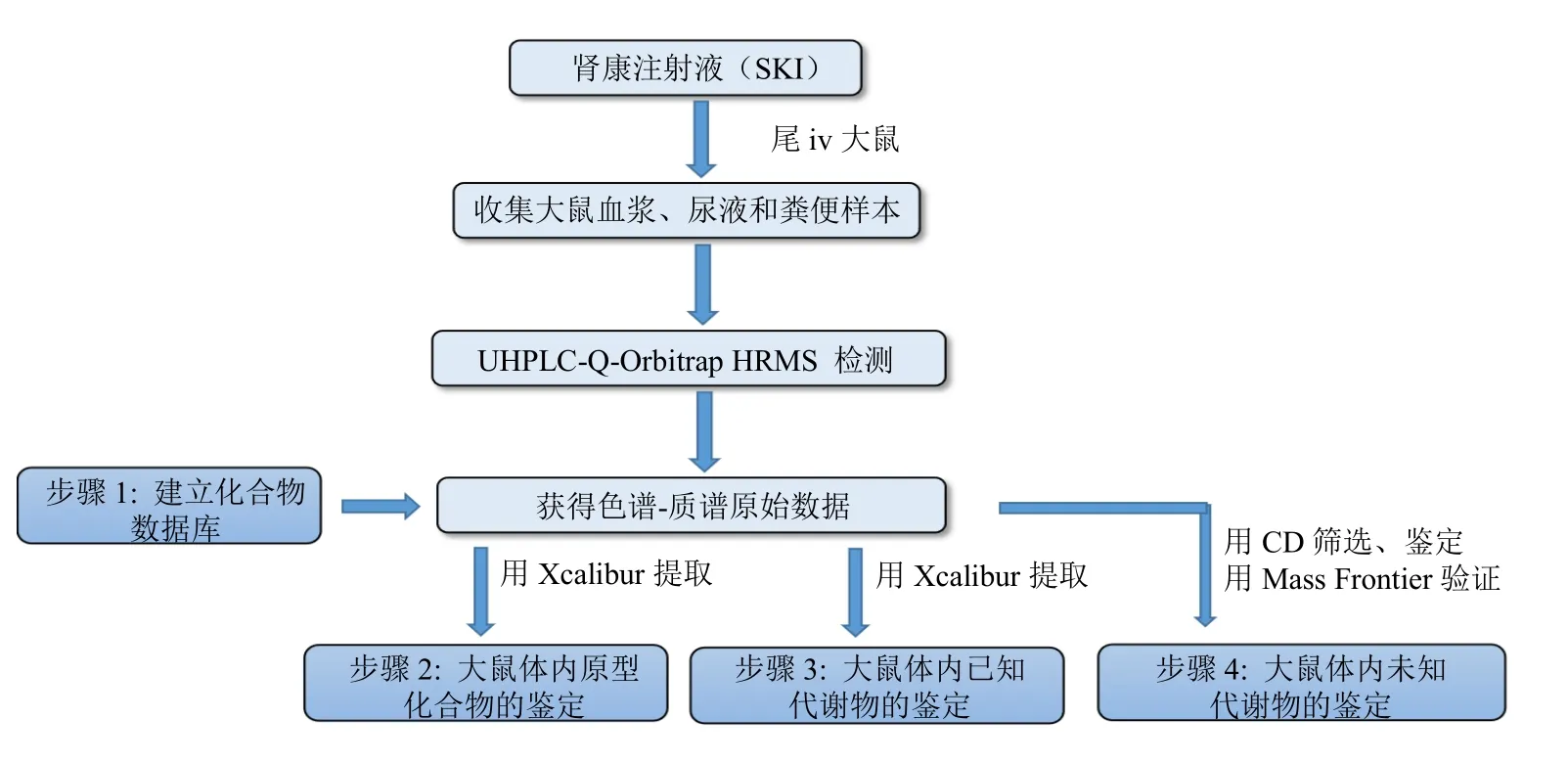
图2 大鼠体内代谢产物的鉴定策略Fig.2 Identification strategy of metabolites in rats
第二步,原型化合物的体内鉴定。依据建立的数据库,利用Xcalibur 软件从生物样本的色谱图中提取原型化合物,然后根据精确相对分子质量、分子式和特征碎片离子进行确认。
第三步,已知代谢物的鉴定。这些代谢物是文献已经报道的,来源于SKI 中某一味草药或某一种活性成分的体内代谢研究。同样,用Xcalibur 软件从生物样本的色谱图中提取已知代谢物,然后根据精确相对分子质量、分子式和特征碎片离子进行确认。
第四步,未知代谢物的鉴定。通过Compound Discoverer 2.1 和Mass Frontier 7.0 软件(美国Thermo Fisher Scientific 公司)对未知代谢物进行筛选和鉴定。将给药组、对照组和空白溶剂组的原始数据文件导入CD 软件。空白溶剂组用于去除背景和噪声。另外,导入SKI 中35 个代表性活性成分的化学结构,选择15 种I相代谢反应和19 种Ⅱ相代谢反应。设定好参数运行,系统筛选出较多潜在代谢物。然后,根据原型化合物结构、代谢反应、中性损失和特征碎片离子,推测潜在代谢物的结构。将该化学结构导入Mass Frontier 7.0 软件,可以自动生成理论的碎片离子和二级质谱图。随后将该二级质谱图与CD 筛选出的潜在代谢物的二级质谱图进行匹配。根据匹配结果验证推测的代谢物结构是否正确。
3 结果
3.1 大鼠体内SKI 原型化合物的鉴定
大鼠iv SKI 后,在其血浆、尿液和粪便中共检测到29 种原型成分。通过与标准品和文献数据的比较,确定了原型的化学结构。其中包括17 种酚酸类、5 种蒽醌类、3 种黄酮类、壬二酸、5-羟甲基糠醛、莲花掌苷和羟基红花黄色素A。原型化合物的质谱数据如表1 所示。
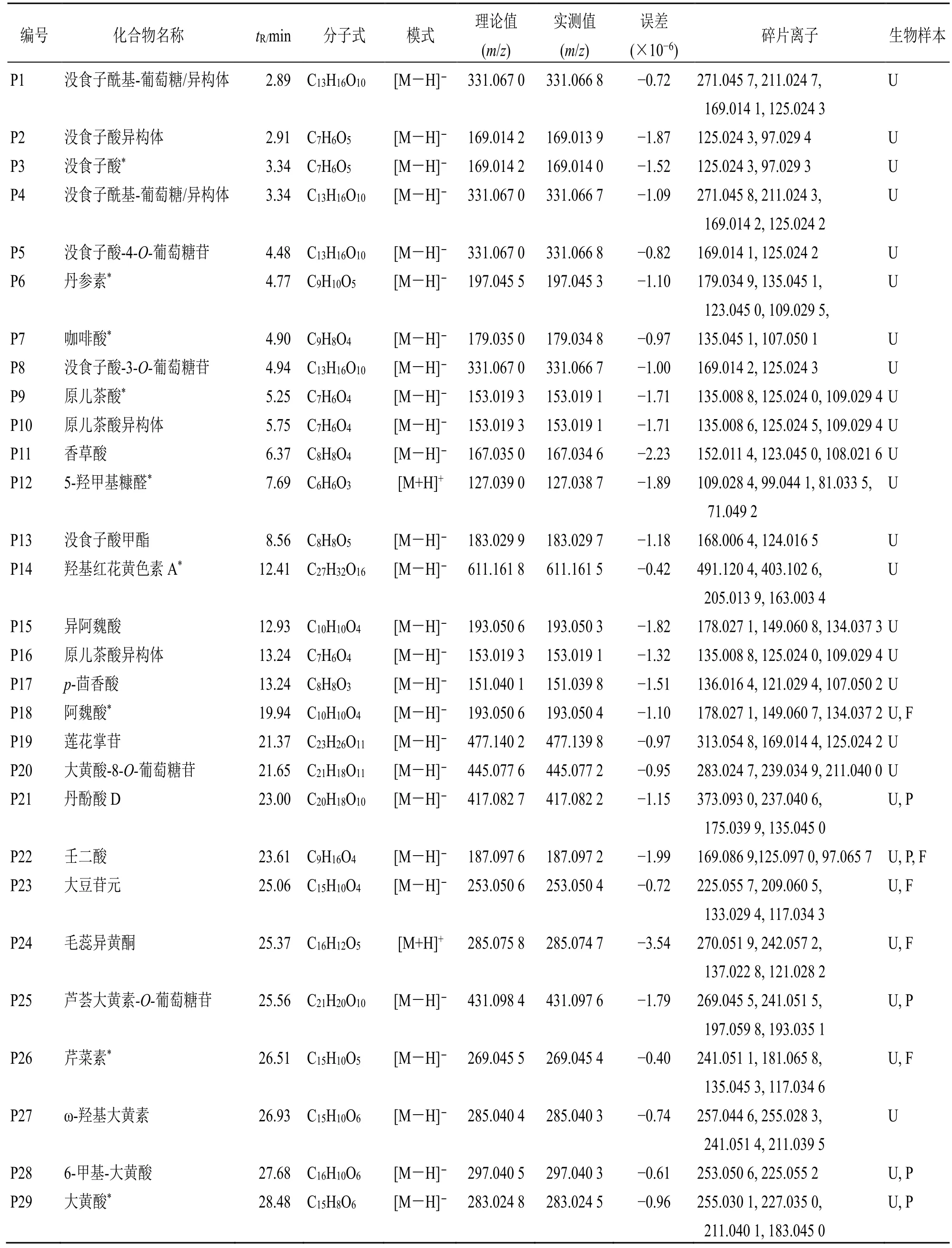
表1 大鼠iv SKI 后血浆、尿液和粪便中的原型化合物Table 1 Prototype compounds in rat plasma, urine and feces after intravenous administration of SKI
3.1.1 酚酸类 P3 的母离子m/z169.01 和特征碎片离子m/z125.02、m/z97.03 与没食子酸一致,P3 为没食子酸。P2 具有与P3 相同的母离子和碎片离子,是没食子酸的异构体。P1、P4、P5、P8 具有相同的母离子m/z331.07,比没食子酸高162(C6H10O5),且具有相同的特征碎片离子m/z169.01 和m/z125.02。另外,仅P1 和P4 具有碎片离子m/z271.04和m/z211.02。因此,P5 和P8 鉴定为没食子酸-4-O-葡萄糖苷和没食子酸-3-O-葡萄糖苷[11],P1 和P4 为没食子酰基-葡萄糖或其异构体[17]。P13 的母离子比没食子酸的母离子高14(CH2),碎片离子m/z168.01和124.02 是母离子连续丢失CH3和CO2。因此,P13被认为是没食子酸甲酯[11]。P10 和P16 显示出与原儿茶酸(P9)相同的母离子和碎片离子,被鉴定为原儿茶酸的异构体。P11 母离子m/z167.03 和碎片离子m/z152.01、123.04、108.02 与香草酸均一致,P11 为香草酸[11,18]。P7 的分子离子比丹参素(P6)小18(H2O),碎片离子m/z135.04 和107.05 是从母离子连续丢失CO2和CO 产生,经鉴定P7 为咖啡酸。而P18 的母离子比P7 高14(CH2),鉴定为阿魏酸。P15 显示出与阿魏酸相同的母离子和碎片离子,鉴定为异阿魏酸[11,19]。P21 的碎片离子m/z373.09、237.04、197.04、175.04、135.04 与文献报道的丹酚酸D 相同,P21 为丹酚酸D[18]。
3.1.2 蒽醌类 P25 的母离子比芦荟大黄素高162(C6H10O5),碎片离子一致,鉴定为芦荟大黄素-O-葡萄糖苷[11]。同理,P20 经鉴定为大黄酸-8-O-葡萄糖苷。P27 的母离子比大黄素高16(O),考虑为ω-羟基大黄素[20]。P28 的母离子比大黄酸(P29)高14(CH2),鉴定为6-甲基大黄酸[17]。
3.1.3 黄酮类 由于黄酮类化合物的特殊碎裂模式,黄酮类特征碎裂离子的命名参考了Zhang 等[21]的研究。P26 的母离子和主要碎片离子均与芹菜素相同,鉴定为芹菜素。P23 的开环碎片离子m/z135.01、133.03 和117.03 分别对应 [M-H-C8H6O,1,3A]-、[M-H-C7H4O2, 0,3B]-和[M-H-C7H4O3,1,3B]-,通过与文献比较,P23 被鉴定为大豆苷元[21-22]。P24 显示 [M+H]+为m/z285.08,碎片离子m/z270.05、242.06 和214.06 是从母离子依次中性损失CH3、CO 和CO 所得。开环碎片离子m/z137.02、134.04 和121.03 分别对应 [M+H-C9H8O2,1,3A]+、[M+H-CH3-C7H4O3, 1,3B]+和 [M+HC9H8O3, 0,3A]+。根据以上质谱信息和文献数据,P24被明确地定性为毛蕊异黄酮[11,21]。
3.1.4 其他 经与对照品的母离子和碎片离子比较,P12 和P14 分别被明确鉴定为5-羟甲基糠醛和羟基红花黄色素A。P19 的二级碎片离子m/z169.01和125.02 与没食子酸的特征碎片离子一致,经鉴定P19 为莲花掌苷。P22 的碎片离子m/z169.09、125.10和97.06 从母离子先后丢失H2O、CO2和C2H4,可鉴定为壬二酸[11]。
3.2 大鼠体内SKI 代谢产物的鉴定
基于本课题组提出的大鼠体内SKI 代谢产物的鉴定策略,共筛选并鉴定了92 种代谢产物。对其中39 种已知代谢产物进行了提取和确认。又利用CD代谢平台,导入SKI 中35 种代表性活性成分的化学结构为母化合物,设置15 种I 相代谢反应和19种II 相代谢反应,筛选并鉴定了53 种未知代谢产物。所有代谢产物的质谱数据如表2 所示。
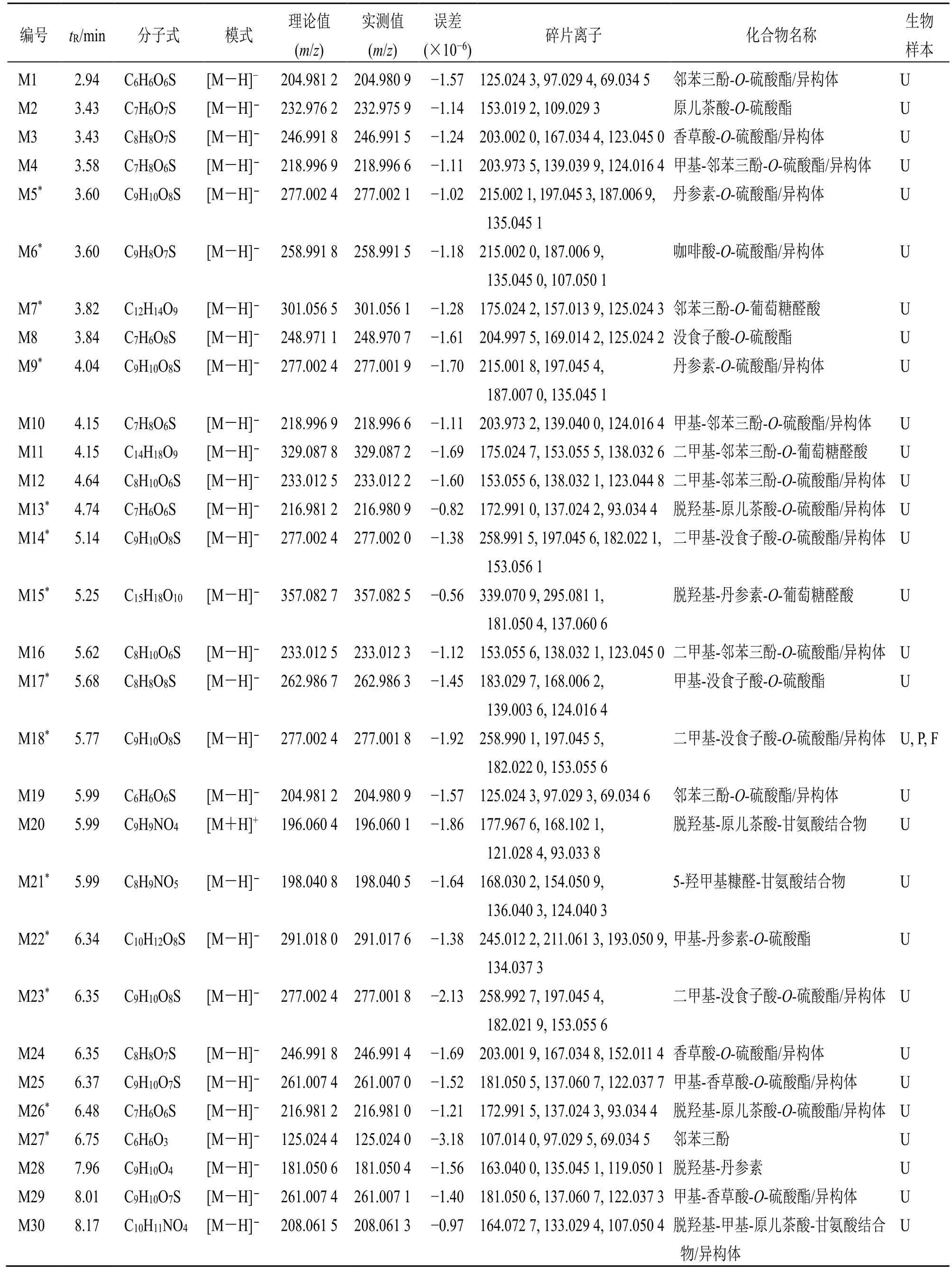
表2 大鼠iv SKI 后血浆、尿液和粪便中的代谢产物Table 2 Metabolites in rat plasma, urine and feces after intravenous administration of SKI
3.2.1 酚酸类代谢物 大鼠静脉注射SKI 后,检测到15 种没食子酸(P3)代谢物。其代谢途径如图3所示。M8 的母离子比没食子酸大80(SO3),两者的特征碎片离子m/z169.01 和125.02 相同。因此,M8 是没食子酸的硫酸化产物,鉴定为没食子酸-O-硫酸酯。M17 的母离子比M8 高14(CH2),M17的碎片离子m/z183.03 和139.00 也比M8 的碎片离子m/z169.01 和125.02 高14,因此,M17 是没食子酸经过甲基化和硫酸化后的代谢产物。同样,M14、M18、M23 也是M17 的甲基化产物,它们被鉴定为二甲基-没食子酸-O-硫酸酯或其异构体。M42 的碎片离子m/z125.02 是由母离子连续丢失C2H3ON 和CO2产生,它也是没食子酸的特征碎片离子;另一个碎片离子m/z151.00 是由母离子损失C2H5O2N(甘氨酸)产生的,这表明化合物与甘氨酸进行了结合。M42 被初步鉴定为没食子酸-甘氨酸结合物。M27 的母离子m/z125.02 比没食子酸少44(CO2),碎片离子m/z125.02、97.03 和69.03 均与没食子酸的特征碎片离子一致。M27 是没食子酸脱羧基代谢产物,鉴定为邻苯三酚[17]。M1 和M19是具有相同分子式和碎片离子的同分异构体,母离子比M27 高80(SO3),结合特征碎片离子m/z125.02、97.03 和69.03,认为M1 和M19 是邻苯三酚的硫酸化产物。M4 和M10 的母离子比M1 高14(CH2),特征碎片离子分别为m/z203.97 [M-HCH3]-、139.04 [M-H-SO3]-和124.02 [M-HSO3-CH3]-。结果表明,M4 和M10 是由邻苯三酚通过甲基化和硫酸化生成的。同一分析方法,M12和M16 被确认为邻苯三酚经过硫酸化和二甲基化的代谢物。M7 的母离子比邻苯三酚高 176(C6H8O6),为邻苯三酚的葡萄糖醛酸化产物。M11的母离子m/z329.09 比邻苯三酚大204,对应的是加入了C6H8O6和2CH2。初步鉴定M11 为二甲基-邻苯三酚-O-葡萄糖醛酸。
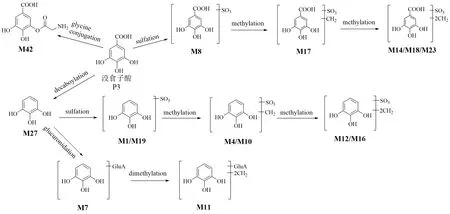
图3 没食子酸在大鼠体内的代谢途径Fig.3 Metabolic pathway of gallic acid in rats
大鼠iv SKI 后,检测到原儿茶酸(P9)的12种代谢产物。代谢途径如图4 所示。M2 的母离子比原儿茶酸高80(SO3),碎片离子相同,可表征为原儿茶酸-O-硫酸酯。M35、M48、M71 的母离子比原儿茶酸少16(O),碎片离子m/z93.03 和65.04是母离子连续损失CO2和CO 产生。M35、M48、M71 被鉴定为脱羟基-原儿茶酸或其异构体。M13和M26 为M35 的硫酸化产物,经鉴定为脱羟基-原儿茶酸-O-硫酸酯或其异构体[23]。同样,M31 经鉴定为脱羟基-原儿茶酸-O-葡萄糖醛酸。M41 和M52 的母离子m/z151.04 和碎片离子m/z123.04、107.05 均比M35 高14(CH2),鉴定为脱羟基-甲基-原儿茶酸。M20 的碎片离子m/z121.03 [M+HC2H5NO2]+和93.03 [M+H-C2H5NO2-CO]+显示其为甘氨酸结合产物,且M20 和M35 相同的碎片离子m/z93.03 为羟基苯离子,因此,M20 被初步鉴定为脱羟基-原儿茶酸-甘氨酸结合物,结合部位发生在甘氨酸的氨基。此外,M30 和M50 可能是M20 经过甲基化反应的产物,亦可能是M41 与甘氨酸结合的产物。
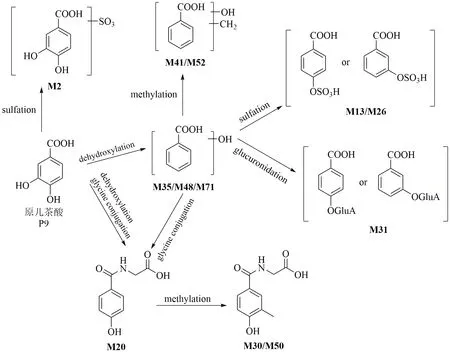
图4 原儿茶酸在大鼠体内的代谢途径Fig.4 Metabolic pathway of protocatechuic acid in rats
M33 的母离子和碎片离子均比香草酸大14(CH2),M33 是香草酸的甲基化产物。M25、M29、M34 的准分子离子 [M-H]-(m/z261.01)比M33高80(SO3),碎片离子相同,它们是由M33 硫酸化产生的,经鉴定为甲基-香草酸-O-硫酸酯或其异构体。同样,M3 和M24 被鉴定为香草酸-O-硫酸酯或其异构体。
大鼠iv SKI 后,检测到丹参素(P6)的19 种代谢物,代谢途径如图5 所示。M39 的碎片离子m/z193.05、178.03 和134.04 是从母离子连续丢失H2O、CH3和CO2产生,均比丹参素高14(CH2),M39 被认为是丹参素的甲基化产物[19]。由于碎片离子相同且分子式多SO3,M22 是M39 的硫酸化产物,被鉴定为甲基-丹参素-O-硫酸酯。M5、M9 也是丹参素的硫酸化产物[24]。M45 显示其特征碎片离子为m/z181.04 [M-H-CH2OCO]-和179.04 [MH-CH3COOH]-,且其母离子比丹参素高 42(C2H2O),因此,M45 是丹参素的乙酰化产物[18]。M28 的特征碎片离子为m/z135.04 [M-HHCOOH]-和109.03 [M-H-HCOOH-C2H2]-,其母离子比丹参素少16(O),这表明M28 是脱羟基化产物,且脱羟基位置发生在羧基的α-C。M15 的母离子比M28 高176(C6H8O6),为葡萄糖醛酸化产物,经鉴定为脱羟基-丹参素-O-葡萄糖醛酸。由于O 的减少和CH2的加入,M36 的母离子比丹参素小 2,其特征碎片离子m/z151.08 [M+HHCOOH]+、137.06 [M+H-CH3COOH]+和123.04[M+H-CH3COOH-CH2]+表明对应的基团变化是去羟基化和甲基化,M36 可鉴定为脱羟基-甲基-丹参素。同时,M40、M44 又是M36 的硫酸化产物,经鉴定为脱羟基-甲基-丹参素-O-硫酸酯或其异构体。M79 的特征碎片离子为m/z120.06 [M-HCO2-CH3COO]-,其母离子比M28 高42(C2H2O),因此,M79 为乙酰化产物,初步鉴定为脱羟基-乙酰基-丹参素。M85 为M79 的甲基化产物,初步鉴定为脱羟基-甲基-乙酰基-丹参素。依据文献报道[24],M57、M60 作为已知代谢物被提取验证,结果表明,M57、M60 是丹参素的脱二羟基产物。另外,M38、M46 是M57、M60 的硫酸化产物,鉴定为脱二羟基-丹参素-O-硫酸酯或其异构体。由于减少2O 和增加2CH2,M86 的母离子比丹参素少4,M86 可能是丹参素的脱二羟基和二甲基化产物。M56、M66 的母离子比M86 高14(CH2),初步鉴定为脱二羟基-三甲基-丹参素或其异构体。
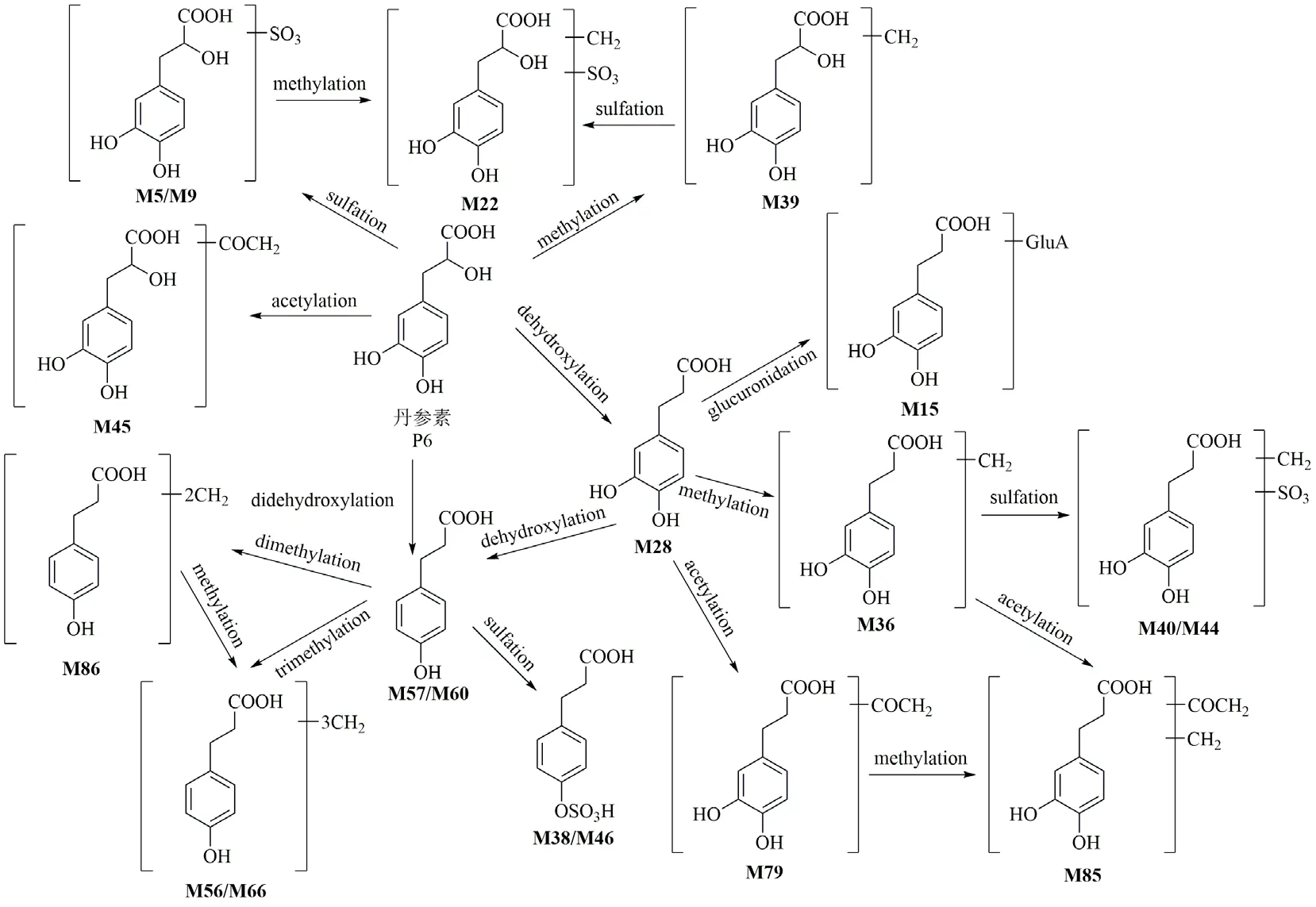
图5 丹参素在大鼠体内的代谢途径Fig.5 Metabolic pathway of danshensu in rats
M6 和M32 的碎片离子与咖啡酸相同,但母离子比咖啡酸高80(SO3),M6 和M32 是咖啡酸的硫酸化代谢产物。M51 的碎片离子m/z193.05、178.03 和134.04 由母离子连续丢失C6H8O6、CH3和CO2产生。结合文献数据,M51 是咖啡酸的甲基化和葡萄糖醛酸化产物,且甲基化位置发生在羧基[19]。基于文献报道的质谱数据[23],M67 和M43 在总离子流图中提取得到。MS2碎片离子结果表明,M67是由咖啡酸经去羟基产生的,M43 是M67 的硫酸化产物。
M49 和M37 具有共同的碎片离子m/z193.05、178.03、149.06 和134.04,且与阿魏酸相同。此外,M49 和M37 的母离子分别比阿魏酸大80(SO3)和176(C6H8O6)。因此,M49 是阿魏酸的硫酸化产物,M37 是阿魏酸的葡萄糖醛酸化产物[25]。M69的母离子m/z209.04 和碎片离子m/z165.06 均比阿魏酸大16(O),结合其他碎片离子,M69 可能是阿魏酸的羟基化产物。M54 的母离子比阿魏酸大57(C2H3NO),结合碎片离子m/z177.06 [M-HC2H3NO2]-和 134.04 [M-H-CO2-CH3-C2H3NO]-,M54 是阿魏酸的甘氨酸结合产物。M80的特征碎片离子m/z193.05 [M-H-C11H8O5-H2O]-与阿魏酸的母离子相同,且其母离子比丹酚酸D 高14(CH2),认为M80 为丹酚酸D 的甲基化产物[18]。
3.2.2 蒽醌类代谢物 M73、M87 和M75 具有相同的碎片离子m/z269.04、241.05、225.06,与大黄素一致。根据文献报道,M73 和M87 为大黄素的葡萄糖醛酸化产物,M75 为大黄素-O-葡萄糖苷的葡萄糖醛酸化产物[26-27]。由于加入SO3和2H,M90的母离子比大黄素大82,且其碎片离子m/z271.06和243.06 比大黄素的碎片离子m/z269.04 和241.05也大2。因此,M90 是大黄素的还原氢化和硫酸化产物,经鉴定为9(10)-羟基-大黄素-O-硫酸酯。M91的母离子和主要碎片离子均比M90 小16(O),故初步鉴定M91 为脱羟基-9(10)-羟基-大黄素-O-硫酸酯。M68 的母离子比芦荟大黄素高176(C6H8O6),两者均有特征碎片离子m/z269.04 和240.04。M68是芦荟大黄素的葡萄糖醛酸化产物。M74 的母离子经连续丢失C6H10O5(162)和C6H8O6(176)产生碎片离子m/z429.08 和253.05,且与大黄酚具有相同的碎片离子m/z253.05 和225.06,M74 被认为是大黄酚-O-葡萄糖苷-O-葡萄糖醛酸。M62 的母离子比大黄素甲醚高176(C6H8O6),碎片离子相同,M62 是大黄素甲醚的葡萄糖醛酸化产物。M70 也是大黄酸的葡萄糖醛酸化产物,而M83 是大黄酸的硫酸化产物。
3.2.3 黄酮类代谢物 M84 的母离子比芹菜素(P26)大80(SO3),碎片离子相同,M84 被鉴定为芹菜素-O-硫酸酯。由于增加了2C6H8O6,M53的母离子比芹菜素高352,M53 是芹菜素的二葡萄糖醛酸反应产物。M76 和M59 的母离子分别比大豆苷元(P23)高80(SO3)和176(C6H8O6),两者和大豆苷元具有相同的碎片离子m/z253.05、225.06、209.06、197.06、135.01 和133.03,因此,M76 为硫酸化产物,M59 为葡萄糖醛酸化产物[28-29]。M63 也是毛蕊异黄酮通过葡萄糖醛酸化反应产生的代谢物。由于增加SO3和2H,M92 的母离子比柚皮素高82,此外,其开环的特征碎片离子m/z199.01 [M-H-C7H6O4, 1,3B]-和137.02 [M-HSO3-C8H8O2,0,3A]-表明M92 是柚皮素的还原氢化和硫酸化产物,且硫酸化的位置发生在B 环。因此,M92 被表征为4-羟基-柚皮素-O-硫酸酯。M89的母离子m/z367.05 和碎片离子m/z287.09 与151.04 均比M92 高14(CH2),另外,通过比较M89 的特征碎片离子m/z272.07 [M-H-SO3-CH3]-与 136.02 [M-H-SO3-C8H8O2-CH3,0,3A]-和M92 的特征碎片离子m/z273.08 [M-HSO3]-与137.02 [M-H-SO3-C8H8O2,0,3A]-,M89可确认为M92 的甲基化产物,鉴定为甲基-4-羟基-柚皮素-O-硫酸酯。
3.2.4 壬二酸类代谢物 大鼠iv SKI 后,检测到壬二酸(P22)的11 种代谢物,代谢途径如图6 所示。由于CH2和O 的加入,M64 的母离子比壬二酸高30,其碎片离子m/z199.10 [M-H-H2O]-、157.09 [MH-CH3COOH]-和143.07 [M-H-CH3COOHCH2]-表明M64 很可能是壬二酸的甲基化和羟基化产物。初步鉴定M64 为羟基-甲基-壬二酸。M58 的主要碎片离子m/z215.09、197.08、155.07、153.09、135.08、111.08 比M64 均少2(2H),M58 是脱饱和产物。M65、M81 的母离子由于CH2的加入和2H 的损失比壬二酸的母离子高12,推测M65、M81是壬二酸经过甲基化和脱饱和的产物。M72 的主要碎片离子m/z199.10、181.08、153.09、135.08、107.08和93.07 比M65 少2(2H),M72 是脱饱和产物。M88 的母离子由于CH2的加入和O 的减少比壬二酸小2,结合生物转化和碎片离子,推测M88 是壬二酸的甲基化和还原(-O)产物,其中1 个羧基(-COOH)还原为醛基(-CHO)。M47 的碎片离子m/z124.01 [M-H-C9H12O3,C2H6NO3S]-和106.98 [MH-C9H12O3-NH3,C2H3O3S]-表明它是牛磺酸的结合产物,另外,中性丢失C9H12O3表明其为脱饱和产物。因此,M47 被鉴定为壬烯二酸-牛磺酸结合物。M61 的碎片离子及归属为m/z261.12 [M+HNH3]+、201.11 [M+H-C2H7NS]+、183.10 [M+HC2H7NS-H2O]+、155.11 [M+H-C2H7NSHCOOH]+、137.10 [M+H-C2H7NS-H2OHCOOH]+和 123.08 [M+H-C2H7NS-H2OCH3COOH]+,半胱氨酸的分子式是C3H7NO2S(C2H6NS-COOH),由此可推测它是半胱氨酸结合产物;另外,根据拟合的分子式也表明它经历了还原反应(-O,+2H),其中1 个羧基(-COOH)还原为醇羟基(-CH2OH),最后鉴定M61 为9-羟基-壬酸-半胱氨酸结合物。M55 的大部分碎片离子比M61 小2(2H),M55 是M61 的脱饱和产物,鉴定为9-羟基-壬烯酸-半胱氨酸结合物。M78、M82的碎片离子及归属分别为m/z167.11 [M-HCH3COOH-H2O]-、153.09 [M-H-CH3COOHH2O-CH2]-、141.13 [M-H-CH3COOH-CO2]-和125.10 [M-H-CH3COOH-CH3COOH]-,结合CD软件分析的生物转化反应,M78、M82 经历了羟化、甲基化、还原(-O,+2H)和乙酰化反应,初步鉴定为9-羟基-甲基-羟基-乙酰基-壬酸/异构体。
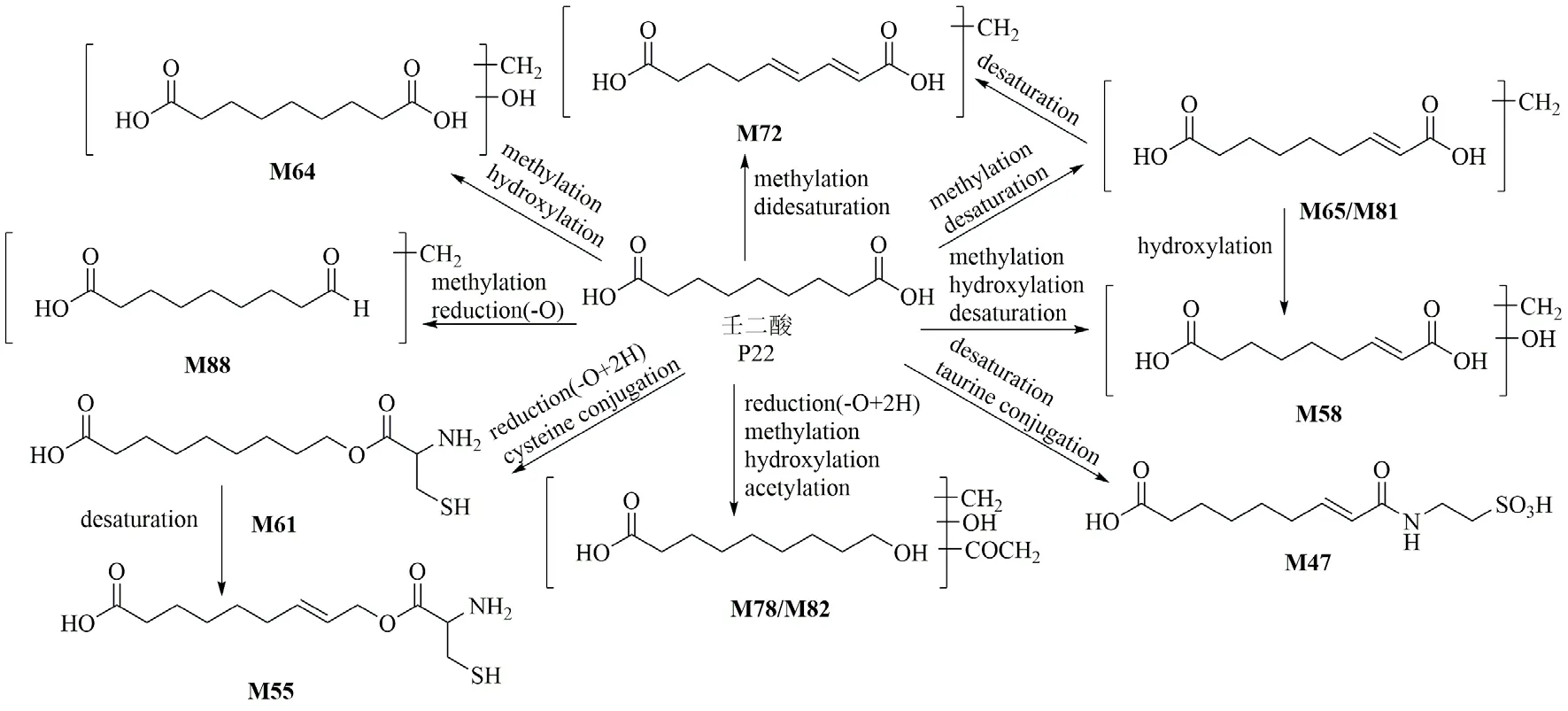
图6 壬二酸在大鼠体内的代谢途径Fig.6 Metabolic pathway of azelaic acid in rats
3.2.5 其他代谢物 M21的母离子比5-羟甲基糠醛(P12)大73,质量的变化是由于增加了NH2CH2COOH(甘氨酸,75)并脱去2H,结合其碎片离子m/z168.03[M-H-HCHO]-、154.05 [M-H-CO2]-和136.04[M-H-CO2-H2O]-,表明M21 是甘氨酸结合产物[30],结合部位发生在甘氨酸的氨基和5-羟甲基糠醛的醛基,生成了酰胺。M77 的母离子比二氢丹参酮I高16(O),且其碎片离子m/z277.09、267.10、249.09、239.11 和221.10 与文献报道的羟基-二氢丹参酮I 相同[31],可鉴定为羟基-二氢丹参酮I。
4 讨论
在iv SKI 后的大鼠尿液、血浆和粪便中鉴定出29 种原型成分,分别为酚酸类、蒽醌类、黄酮类和壬二酸类等。然而,仅发现了其中16 种原型成分的代谢产物。另外,有趣的是,一些原型成分的代谢物(M62、M68、M73~M75、M77、M87、M89~M92)很容易被检测到,但它们的原型化合物(大黄素、芦荟大黄素、大黄酚、大黄素甲醚、柚皮素和二氢丹参酮I 等)在大鼠的尿液、血浆和粪便中没有被检测到。这些现象表明体内药物代谢研究的难点仍在于复杂成分的生物样本中痕量的原型化合物或代谢物,加之受到内源性物质的干扰[23,31]。
SKI 在大鼠体内的原型化合物和代谢产物来源于尿液样本较多,而血浆和粪便样本中较少,与文献报道结果一致[17,22],这可能与药物半衰期、蛋白结合率、取样方式、代谢排泄途径等有关。大鼠体内SKI 成分主要经历了I 相代谢反应(羟基化、还原、脱饱和)和II 相代谢反应(甲基化、硫酸化、葡萄糖醛酸化、乙酰化、甘氨酸结合、半胱氨酸结合和牛磺酸结合)。值得注意的是,甘氨酸、半胱氨酸和牛磺酸是具有重要生物学功能的内源性物质[32]。对与甘氨酸、半胱氨酸和牛磺酸结合的代谢物(M20、M30、M42、M47、M50、M54、M55、M61)的进一步研究可能有助于阐明SKI 在体内的作用机制。
本研究共鉴定了SKI 在大鼠体内的121 种化合物。其中,通过一些代谢反应从原型中产生了92种代谢物,参与的代谢反应主要包括羟基化、脱饱和、甲基化、硫酸化和葡萄糖醛酸化等。其中有53种代谢物是首次在大鼠的生物样本中鉴定出来的。一些与内源性物质甘氨酸、半胱氨酸和牛磺酸结合的代谢物由于其潜在的活性将被重点研究。本研究将为SKI 在体内的药效学、毒理学、网络药理学及作用机制的进一步研究奠定了物质基础。同时,本文基于UHPLC-Q-Orbitrap HRMS 和CD 代谢平台,提出的“提取-化合物筛选-鉴定-验证”的鉴定策略能快速、系统、全面的鉴定体内化合物原型及其代谢产物,有助于体内药效物质的研究。
利益冲突所有作者均声明不存在利益冲突

