厚朴挥发油纳米乳凝胶的制备及其对溃疡性结肠炎小鼠的药效评价
张 倩,刘 芳,张芮苑,邓鸿丹,杨璐萍,任 虹
成都中医药大学 西南特色中药资源国家重点实验室,四川 成都 611137
厚朴为木兰科植物厚朴MagnoliaofficinalisRehd. et Wils.或凹叶厚朴M.officinalisRehd. et Wils.var.bilobaRehd. et Wils.的干燥干皮、根皮及枝皮,具有下气除满、燥湿消痰之功[1]。厚朴主要含有木脂素、苷类、生物碱、挥发油等成分[2],研究表明厚朴挥发油中石竹烯[3]、柠檬烯[4]、萜品烯-4-醇[5]等成分与抗溃疡性结肠炎(ulcerative colitis,UC)紧密相关,课题组前期研究证明厚朴挥发油对葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的UC 小鼠具有治疗作用[6]。
然而厚朴挥发油具有易挥发、稳定性差、无明确结肠靶向作用等特点,在口服递送中易受肝脏首过效应及肠道黏膜的代谢而降低其疗效[7],因此如何改善厚朴挥发油稳定性和将其有效递送到炎症肠道部位,成为厚朴挥发油治疗UC 需解决的关键问题。纳米乳凝胶兼具纳米乳和凝胶的双重优点,纳米乳能够显著改善药物的溶解度,提高药物稳定性,凝胶则能提高纳米乳的黏附性,增强药物在结肠中的滞留,实现持续药物释放的作用[8]。因此,本实验制备了厚朴挥发油纳米乳(MagnoliaeOfficinalis Cortexvolatile oil nanoemulsion,MN)和厚朴挥发油纳米乳凝胶(MagnoliaeOfficinalisCortexvolatile oil nanogel,MNG),并对其理化性质进行表征,同时考察了MNG 在小鼠消化道内的靶向释药行为,验证了其对UC 小鼠模型的治疗效果,以期为厚朴挥发油新剂型和抗UC 新药的开发提供候选方案。
1 仪器与材料
1.1 仪器
CPA225D 型电子天平,美国奥豪斯仪器有限公司;Spectra MAX Plus384 型酶标仪,美谷分子仪器有限公司;KZ-III-F 型高速低温组织研磨仪,武汉赛维尔生物科技有限公司;UPH-Ⅱ-10T 型优普超纯水制造系统,成都超纯科技有限公司;BA410 型显微镜,麦克奥迪实业集团有限公司;DZKW-4 型电子恒温水浴锅,北京中兴伟业仪器有限公司;IVIS Spectrum 型小动物三维光学活体成像仪,珀金埃尔默企业管理有限公司;JEM-1400plus 型透射电子显微镜,日本电子株式会社;Axio Imagerm2 EVO10 型光电联用成像系统,上海准权仪器设备有限公司。
1.2 药材与试剂
厚朴干皮收采于四川省都江堰市虹口乡,经成都中医药大学药学院高级实验师连艳老师鉴定为木兰科厚朴属植物厚朴M.officinalisRehd. et Wils.的干燥干皮;柳氮磺胺吡啶肠溶片,批号09220207,购自上海信谊天平药业有限公司;白细胞介素-6(interleukin-6,IL-6)试剂盒(批号20230512E19)、白细胞介素-10(interleukin-10,IL-10)试剂盒(批号20230512E11)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号20230505E03),均购自上海茁彩生物科技有限公司;Servicebio®ZO-1抗体,批号L14OC15,购自武汉赛维尔生物科技有限公司;Meilunbio®葡聚糖硫酸钠(dextran sodium sulfate,DSS),批号M0508D,购自大连美仑生物技术有限公司;聚山梨酯80,批号2018022801,购自成都市科龙化工试剂厂;Zenbio®Claudin-1 抗体,批号M11AP01,购自苏州四正柏生物科技有限公司;无水乙醇(批号2023022401)、海藻酸钠(批号2021123001)、丙三醇(批号2021110201)、聚乙二醇-400(批号 2022092901)、醋酸乙酯(批号2022033101)、正丁醇(批号2019120301),均购自成都市科隆化学品有限公司;蓖麻油聚氧乙烯醚-40(EL-40,批号109896007100)、聚氧乙烯氢化蓖麻油(CO-40,批号109607008240),均购自山东优素华工科技有限公司;细胞膜近红外荧光探针(1,1′-dioctadecyl-3,3,3′,3′-tetramethylindotricarbocyanine iodide,DiR),批号D4006,购自上海百赛生物技术股份有限公司;透明质酸钠,批号S12034,购自上海源叶生物科技有限公司。
1.3 动物
7~9 周龄雄性ICR 小鼠84 只,购自北京斯贝福生物技术有限公司,许可证号为SCXK(京)2019-0010,于成都中医药大学实验动物中心进行实验。所有动物实验遵循成都中医药大学实验动物管理和使用的规定,均符合3R 原则。
2 方法与结果
2.1 厚朴挥发油的制备
将厚朴按照前期研究[9]进行发汗处理,随后将发汗厚朴打粉,用水蒸气蒸馏法提取挥发油,大火煮沸后微火加热至无挥发油产生为止,收集挥发油,密封后保存于4 ℃冰箱。
2.2 标准曲线的建立
以正己烷为空白参照[10],于200~400 nm 进行紫外扫描,测定得到厚朴挥发油正己烷溶液于361 nm 处存在最大吸收,故选择361 nm 作为厚朴挥发油紫外检测波长。将厚朴挥发油溶液稀释至标准系列质量浓度(48.24、24.12、12.06、6.03、3.02、1.51 mg/mL),以正己烷为空白,在厚朴挥发油最大吸收波长361 nm 处测定标准溶液的吸光度(A)值,以A值为纵坐标、厚朴挥发油质量浓度为横坐标(C)绘制厚朴挥发油标准曲线,得回归方程为A=0.055 4C-0.013 1,R2=0.999 1,结果表明厚朴挥发油在1.51~48.24 mg/mL 线性关系良好。
2.3 MN 的制备
2.3.1 厚朴挥发油在不同助乳化剂中溶解度的测定由于厚朴挥发油的溶解性较差,故以厚朴挥发油在不同辅料中的溶解度为前提筛选助乳化剂,比较溶解度的大小。取各辅料0.50 g 于2 mL 离心管中,分别加入过量厚朴挥发油,涡旋混匀5 min 后超声4 h 助溶,静置过夜后,5 000 r/min 离心10 min,取上清液用正己烷稀释至适当质量浓度,在361 nm 处测定厚朴挥发油在各辅料中的平衡溶解度[11]。结果见表1,无水乙醇对挥发油的溶解能力较强,故选用无水乙醇做助乳化剂。
2.3.2 乳化剂的筛选 以无水乙醇为助乳化剂,厚朴挥发油为油相,乳化剂与助乳化剂的质量比(Km)为3∶1,分别以聚山梨酯80、CO-40、EL-40 为乳化剂,制备MN,绘制伪三元相图。结果如图1 所示,与聚山梨酯80 和CO-40 形成的乳区面积相比,EL-40 作为乳化剂时所形成的MN 区域面积更大,因此,选择EL-40 作为乳化剂进行以下实验。

图1 乳化剂 (CO-40、EL-40、聚山梨酯80) 筛选的伪三元相图Fig.1 Pseudo-ternary phase diagram for selection of emulsifier (CO-40, EL-40, polysorbate 80)
2.3.3 伪三元相图的绘制及Km值的确定 根据“2.3.2”项乳化剂的试验结果,将乳化剂EL-40 和助乳化剂无水乙醇按照Km分别为2∶1、3∶1、4∶1混合,再将该混合物(Smix)与厚朴挥发油以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9 的质量比配制成混合溶液,在磁力搅拌下加超纯水滴定,观察各溶液的颜色、乳光和澄明度,判断临界点,记录体系由浑浊变澄清时的加水量,计算临界点时各组分的比例。用OriginPro 8.5 软件绘制伪三元相图,图中各临界点连线下方的区域即为MN 区域,比较该区域面积大小,确定乳化剂与助乳化剂的质量比。结果如图2 所示,Km值为3∶1 时,该体系形成的MN 面积最大,故确定EL-40 与无水乙醇的比例为3∶1。

图2 Km 值筛选的伪三元相图Fig.2 Pseudo-ternary phase diagram for selection of Km
2.3.4 MN 的制备 按照最优Km值制备Smix,分别以Smix与油相比例为9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9 的质量比配制成混合溶液,使其总质量为1 g,于磁力搅拌下加超纯水滴定,观察不同比例的油相形成的MN 放置7 d 后乳液的形态,选取形成的乳液最稳定、不出现分层的MN,记录各组分的比例。结果见表2,Smix与厚朴挥发油的比例为8∶2 时,形成的乳液更加稳定,没有出现分层、絮凝或粒径增大的情况,最终确定MN的最佳处方为EL-40-无水乙醇-厚朴挥发油的质量比为6∶2∶2。
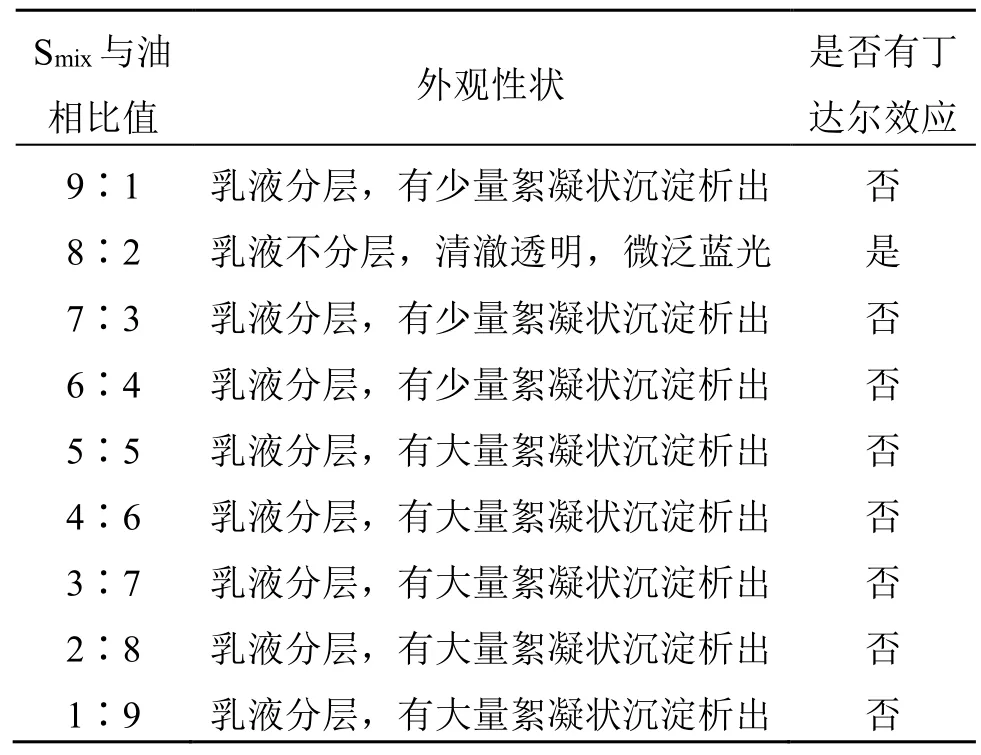
表2 Smix 与油相比例筛选结果Table 2 Ratio screening result of Smix and oil
2.4 MN 的质量评价
2.4.1 宏观和微观形态观察 采用透射电子显微镜对MN 的微观形态进行表征,取适量制备好的MN,用去离子水适当稀释,滴在覆盖有碳膜的铜网上,滴加质量分数为1%的磷钨酸溶液进行负染2 min,用滤纸吸取多余的溶液,自然晾干后在透射电子显微镜下观察纳米乳液的形态。结果如图3 所示,MN经透射电子显微镜观察发现,纳米乳外观澄清、透明、微泛蓝光,符合纳米乳的制剂特征。

图3 纳米乳的宏观和微观形态Fig.3 Macroscopic and microscopic morphology of nanoemulsion
2.4.2 粒径、多分散指数(polydispersity index,PDI)和ζ 电位 按优化后处方制备MN 3 批,取0.1 mL MN 并稀释100 倍,在室温下使用纳米粒度仪测量纳米乳液的平均粒径、多分散系数(polydispersity index,PDI)以及ζ 电位。结果如图4、5 所示,MN平均粒径为(61.56±1.67)nm,PDI 为0.16±0.37,ζ 电位为(-21.37±0.45)mV,呈正态分布。

图4 MN 的粒径分布Fig.4 Particle size distribution of MN

图5 MN 的ζ 电位分布Fig.5 ζ potential distribution of MN
2.4.3 pH 值及黏度 按最优处方平行制备3 批MN,使用pH 计和旋转黏度计于室温条件下测定其pH 值,各平行3 次。测量结果表明,最优处方MN的pH 值为6.07±0.07,黏度为(54.49±0.99)mPa·s。
2.4.4 包封率的测定 参照文献方法[12],测定了MN 中游离油和总油的含量,并根据以下方程计算纳米乳的包封率。将2 mL MN 加入5 mL 正己烷中,振荡1 min,静置分层后取上层有机相,在361 nm 处测定其A值,所得值为游离油含量;取4 mL MN 在400 W 超声破碎10 min,使其破乳,加入10 mL 正己烷后振荡1 min,静置分层,取上层有机相在361 nm 处测定其A值[13],所得值为总油含量。将游离油含量和总油含量代入标准曲线,用公式计算得到MN 的包封率为(85.25±0.50)%。
包封率=(总油量-游离油量)/总油量
2.5 MNG 的制备
2.5.1 成胶时间的测定 采用倾斜法测定成胶时间,海藻酸钠和透明质酸溶液接触后开始计时,然后倾斜西林瓶,观察溶液的流动情况,待倾斜西林瓶时体系不再流动则停止计时,该时间即为成胶时间。
2.5.2 空白水凝胶基质的选择 以成胶时间为评价指标,优化水凝胶的处方比例。取透明质酸溶解在蒸馏水中,形成质量浓度为10、20、30 mg/mL 的均匀溶液;海藻酸钠溶解在蒸馏水中,形成质量浓度为10、20、30、40 mg/mL 的均匀溶液。
将等体积的海藻酸钠和透明质酸溶液混合均匀,并直至成胶。形成的空白水凝胶基质根据组成基质的初溶液质量浓度进行命名(例如20 mg/mL 的海藻酸钠溶液和30 mg/mL 的透明质酸溶液形成的空白基质命名为S2H3),优选最优成胶比。各组水凝胶混合1 min 时的成胶状态见图6,可以发现海藻酸钠和透明质酸的质量浓度均对水凝胶的成胶状态有显著影响,随着二者质量浓度的增大,1 min 时水凝胶越来越稳定。
当海藻酸钠质量浓度和透明质酸质量浓度均为10 mg/mL 时,无法形成稳定的水凝胶。当海藻酸钠质量浓度为10 mg/mL 时,随着透明质酸的质量浓度由20 mg/mL 增大到40 mg/mL,成胶时间由301.67 s 缩短至216.17 s,水凝胶趋于稳定。当海藻酸钠质量浓度为30 mg/mL 时,随着透明质酸的质量浓度由10 mg/mL 增大至40 mg/mL,成胶时间进一步由172.34 s 缩短至26.91 s,水凝胶趋于稳定且在透明质酸质量浓度为40 mg/mL 时达到最佳水凝胶状态。
2.5.3 载药纳米乳水凝胶的制备 取最优比透明质酸和海藻酸钠粉末用MN 溶解,并继续搅拌15 min,即得MNG。
2.6 MNG 的质量评价
2.6.1 微观形态特征 将冻干后的样品进行喷金处理,通过光电联用成像系统观察其表面形态、支架结构。结果如图7 所示,水凝胶的孔隙与孔隙之间相互贯通,结构整齐,形成的三维网格孔洞结构均匀分布。

图7 扫描电镜图Fig.7 Scanning electron image
2.6.2 pH 值及黏度测定 按最优处方平行制备3 批MNG,应用pH 计和旋转黏度计于室温条件下测定其pH 值,各平行3 次。测量结果表明,MNG 的pH值为6.07±0.07,黏度为(54 392.33±809.52)mPa·s。
2.6.3 体外模拟药物释放度测定 参考《中国药典》2020 年版中的方法[14]配制人工模拟胃液(simulated gastric fluid,SGF)、人工模拟小肠液(simulated intestinal fluid,SIF)和人工模拟结肠液(simulated colonic fluid,SCF)来模拟人体消化。分别取MN和MNG 各1.0 g 置于透析袋中,放入SGF 中2 h,取出水洗后接着放入SIF 中消化4 h,最后放入SCF中42 h。前6 h 每隔0.5 h 取样,后42 h 每隔1 h 取样[15],整个过程中溶液放置在37 ℃恒温水浴锅中并以100 r/min 振荡,每次吸取5 mL 模拟液测定1次厚朴挥发油的含量,同时补足对应的新鲜模拟液5 mL。使用正己烷萃取厚朴挥发油并根据A值计算出厚朴挥发油的含量,计算释放率(R),R的计算公式如下。
R=Rt/Mi
Rt为厚朴挥发油在t时刻的累积释放量,Mi为最开始加入的厚朴挥发油的原始质量
结果从图8 中可得MN 和MNG 的最终累积释放率分别为(89.83±0.50)%和(61.68±1.15)%,其结果表明,这2 种制剂最终释放度有显著性差异,MN 在SGF 消化过程中释放较为明显,累积释放率为(34.32±0.89)%,MNG 在SGF 中释放减少,累积释放率为(19.37±1.39)%(0~2 h),其结果表明,这2 种制剂在0~2 h 释放度有显著性差异;MN 在SIF 消化过程中释放率为(53.48±0.13)%,MNG 在SIF 中释放较少,释放率为(32.85±0.89)%(2~6 h),其结果表明,这2 种制剂在2~6 h 释放度有显著性差异;MN 在SCF 消化过程中释放明显,消化至24 h 释放率为(89.05±0.20)%,而MNG在SCF 消化过程中呈缓慢逐渐释放趋势,至24 h 释放率为(50.16±0.80)%,其结果表明,这2 种制剂在24 h 释放度有显著性差异。结果显示,MN 在口服递药中易在胃和小肠中释放,使其递送至结肠部位时含量降低,而MNG 在胃和小肠内相对稳定,可以减少挥发油受胃和小肠侵蚀,达到结肠靶向的作用。

图8 体外缓释累积释放曲线Fig.8 Cumulative release curve of sustained release in vitro
2.6.4 小鼠活体生物分布评价 24 只ICR 小鼠通过在7 d 内自由饮用3% DSS 来诱导UC 小鼠模型,而后将其随机分为MN 组、MNG 组、Free-DiR 组,每组8 只。制备含有相同质量浓度DiR 的各组制剂,使用酶标仪检测其DiR 荧光含量,分别以DiR 0.5 mg/kg 的剂量给小鼠ig,小鼠分别在ig 给药后4 个不同时间点(3、6、12、24 h),使用活体成像系统对小鼠进行成像,并在24 h 处死剩余全部小鼠,从体内分离结肠后立即检测荧光。
结果如图9 所示,给药3 h 或6 h 后,各组荧光差异非常小。在12 h 时,MNG 组的结肠部位荧光强度最强,其次是MN 组和Free-DiR 组,这种状态一直持续到24 h 结束,且在24 h 解剖小鼠后结肠中凝胶组的荧光强度依然很强,如图10 所示。然而,MN 组和Free-DiR 组的荧光值趋势非常相似,可能由于没有凝胶外层保护的情况下而过早降解,继而不能再体内凸显纳米乳凝胶的靶向作用。因此,小鼠全身荧光变化的结果突出了纳米乳凝胶可以在口服递送中保护挥发油减少胃和小肠侵蚀的优势。
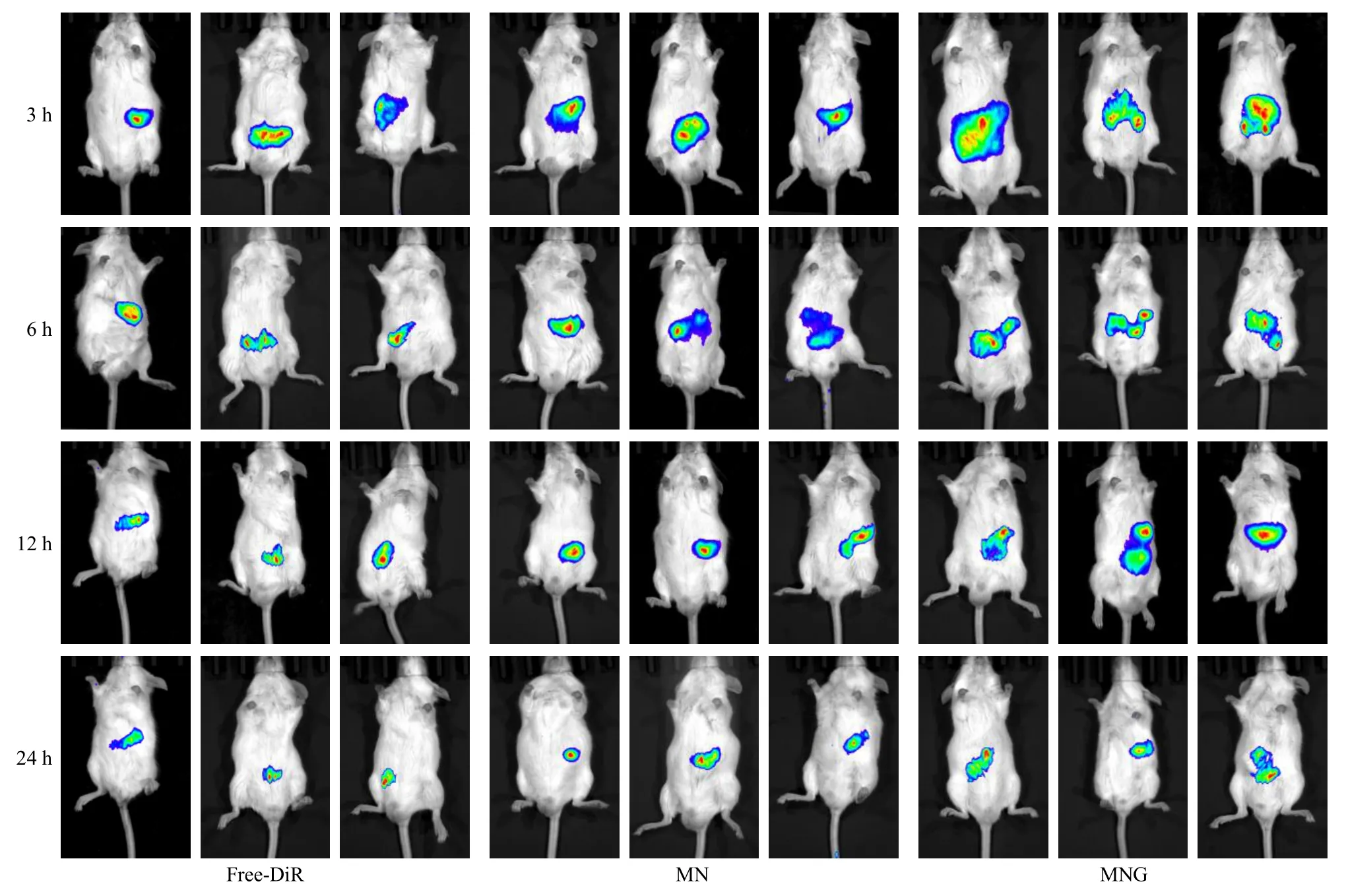
图9 活体生物分布图Fig.9 Living organisms distribution maps

图10 荧光结肠分布图Fig.10 Fluorescent colon distribution maps
2.7 MNG 对UC 的治疗作用
2.7.1 分组与造模 60 只小鼠适应性喂养7 d,称定质量并标号,随机分为空白组(10 只)以及造模组(50 只)。空白组给予自由饮用蒸馏水,造模组自由饮用配制的3% DSS 水溶液,饮用3 d,隔天更换新鲜DSS 溶液。在第3 天造模结束后,根据疾病活动指数(disease activity index,DAI)评分对模型进行评价,DAI 评分>1 分为造模成功[16]。50 只小鼠均造模成功,再将其随机分为模型组、柳氮磺吡啶组、空白挥发油组、MN 组、MNG 组,每组10只,继续给予3% DSS 水溶液自由饮用4 d。
2.7.2 药物处理 依据《中国药典》2020 年版[14],规定厚朴饮片用量为3~10 g,以成人体质量70 kg 用药剂量为10 g 计,参照《中药药理研究方法学》[17],结合厚朴挥发油得率(约为0.25%),根据预试验结果,按照厚朴挥发油最高给药剂量为26 mg/kg,使制得的MN、MNG 中发汗厚朴挥发油的含药量为26 mg/kg,从造模第3 天开始,分别给予小鼠ig,柳氮磺吡啶组ig 给予柳氮磺吡啶混悬液(200 mg/kg),空白组和模型组ig 给予等体积的蒸馏水,所有小鼠ig 体积均为10 mL/kg,每天1 次,连续给药7 d,每天早晨观察小鼠一般情况,记录DAI 评分。
2.7.3 标本制备与采集 第9 天完成给药,第10 天脱颈处死小鼠,再将小鼠的结肠从腹腔中完整取出,测量结肠长度拍照后取出肠内容物,称取结肠质量,注意不要将结肠弄破,将其分为两端段,一段用冰PBS 漂洗后用锡箔纸包裹,冻存于-80 ℃超低温冰箱中,用于Elisa 实验;另一段置于4%多聚甲醛溶液中固定,常温放置,用于结肠组织HE 染色和免疫荧光实验。
2.7.4 统计学分析 使用SPSS 25.0 统计软件对实验数据进行处理,各组间比较采用单因素方差分析比较,以P<0.05 为差异有统计学意义。
2.7.5 小鼠的粪便性状、便血情况及DAI 评分的影响 自实验第1 天起,每天于相同时间段内,观察记录小鼠的体质量、腹泻、便血、活动状态和死亡情况。结肠炎小鼠的疾病活动指数评分标准见表3。

表3 DSS 小鼠DAI 评分标准Table 3 DAI scoring standard of DSS mice
DAI=(体质量丢失评分+腹泻评分+便血评分)/3
结果如图11 显示,在第10 天治疗结束时,空白组小鼠精神状态良好,毛发有光泽,大便正常,肛门无出血。与空白组相比,模型组小鼠DAI 评分明显升高(P<0.001),精神萎靡,食欲减退,毛发暗淡,出现腹泻、血便。与模型组相比,柳氮磺吡啶组的小鼠DAI 评分显著降低(P<0.001),MNG组的小鼠DAI 评分明显降低(P<0.01),小鼠精神状态良好,食欲有增加,毛发更有光泽,腹泻及血便情况好转。结果表明,相比于空白挥发油及MN组,MNG 具有更好的治疗效果,药效更佳。

图11 DAI 评分的影响 (±s, n = 10)Fig.11 Effect on DAI score (±s, n = 10)
2.7.6 对小鼠结肠长度、结肠单位长度质量和脾脏系数的影响 末次给药后处死小鼠,取小鼠结肠和脾脏。直尺测量结肠自然长度,并拍照。滤纸吸干结肠及脾脏外表面血液,称量并记录小鼠结肠及脾脏质量。
脾脏系数=小鼠脾脏质量/小鼠体质量
结肠单位长度质量=结肠质量/结肠长度
结果如图12 和表4 显示,与正常组相比,模型组小鼠结肠长度显著缩短(P<0.001),脾脏系数和单位长度结肠质量显著升高(P<0.001)。与模型组比较,柳氮磺吡啶组及MNG 组的小鼠结肠长度显著增加(P<0.01、0.001);MNG 组及柳氮磺吡啶组脾脏系数显著降低(P<0.001),MN 组及空白挥发油组脾脏系数明显降低(P<0.05、0.01);柳氮磺吡啶及MNG组单位结肠质量系数显著降低(P<0.01、0.001)。结果表明,相比于空白挥发油及MN 组,MNG 组具有更好的治疗效果,药效更佳。

图12 对结肠长度的影响Fig.12 Effect on colon length
表4 对结肠长度、结肠单位长度质量和脾脏指数的影响(±s, n = 10)Table 4 Effect on colon length, colon unit length weight and spleen index (±s, n = 10)
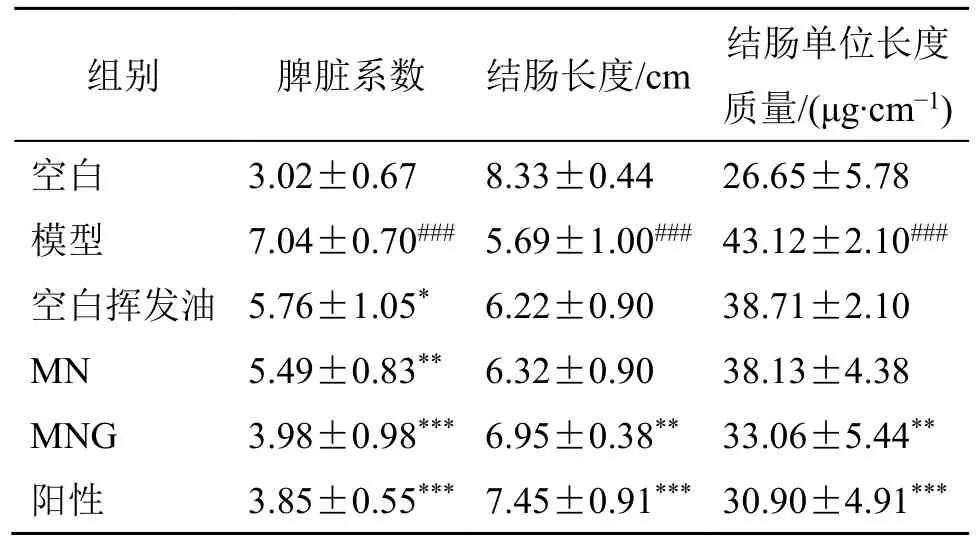
表4 对结肠长度、结肠单位长度质量和脾脏指数的影响(±s, n = 10)Table 4 Effect on colon length, colon unit length weight and spleen index (±s, n = 10)
与空白组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01***P<0.001;表5 同。###P < 0.001 vs blank group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group; same as table 5.
组别 脾脏系数 结肠长度/cm 结肠单位长度质量/(μg·cm-1)空白 3.02±0.67 8.33±0.44 26.65±5.78模型 7.04±0.70### 5.69±1.00### 43.12±2.10###空白挥发油 5.76±1.05* 6.22±0.90 38.71±2.10 MN 5.49±0.83** 6.32±0.90 38.13±4.38 MNG 3.98±0.98*** 6.95±0.38** 33.06±5.44**阳性 3.85±0.55*** 7.45±0.91*** 30.90±4.91***
2.7.7 HE 染色观察小鼠结肠黏膜病理变化 取多聚甲醛固定的结肠组织,经脱水、石蜡包埋和组织切片后,HE 染色。光学显微镜下观察小鼠结肠组织结构、黏膜、杯状细胞、绒毛排列和炎性细胞浸润等形态表现并拍照。结果如图13 显示,空白组小鼠肠道组织细胞饱满且排列整齐,黏膜完整,杯状细胞明显,腺体排列规则,隐窝结构清晰可见。与空白组相比,模型组小鼠肠道组织细胞出现上皮细胞破损且排列紊乱,肠道黏膜受损,腺体排列紊乱,隐窝有不同程度的损坏,存在有大量的炎性细胞浸润现象。与模型组相比,各给药组小鼠的结肠黏膜受损情况有所改善,炎性细胞浸润减少,腺体排列规则,杯状细胞明显增多,隐窝结构恢复,且MNG组恢复情况优于空白挥发油及MN 组。

图13 对小鼠结肠组织病理的影响 (HE 染色)Fig.13 Effect on colon histopathology of mice (HE staining)
2.7.8 对小鼠结肠组织中炎症因子水平的影响取各组小鼠结肠组织,称定质量,加适量PBS,匀浆,离心,收集上清液,按照ELISA 试剂盒说明书检测IL-6、IL-10、TNF-α 水平。结果表5 显示,与空白组比较,模型组小鼠结肠组织中的TNF-α、IL-6 水平显著升高(P<0.001),IL-10 的水平显著降低(P<0.001)。与模型组比较,柳氮磺吡啶组及MNG 组小鼠结肠组织中的TNF-α、IL-6 水平显著降低(P<0.001),IL-10 水平明显升高(P<0.05、0.01);MN 组TNF-α、IL-6 水平明显降低(P<0.01)。结果表明,MNG 可有效抑制促炎因子分泌、增强抗炎因子的分泌来抑制肠道炎症。
表5 各组小鼠结肠组织中TNF-α、IL-6、IL-10 含量(±s, n = 10)Table 5 Contents of TNF-α, IL-6 and IL-10 in colon tissue of mice in each group (±s, n = 10)
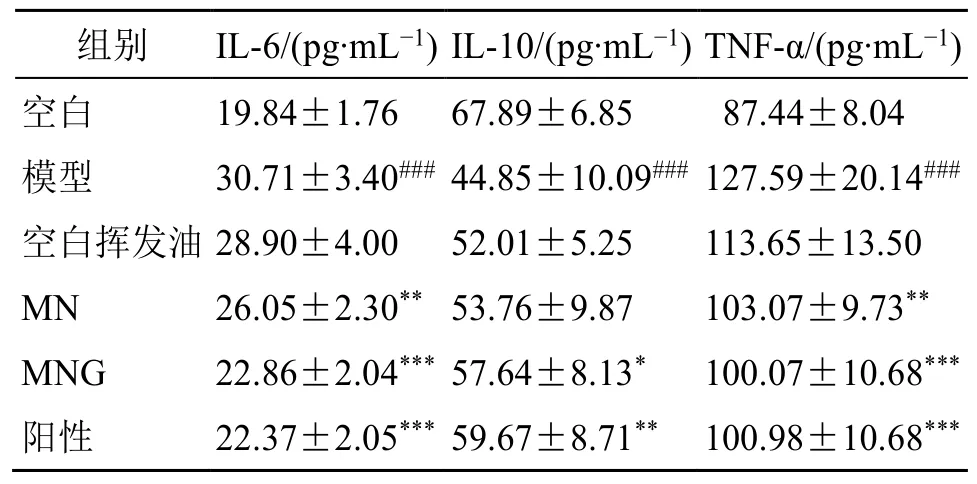
表5 各组小鼠结肠组织中TNF-α、IL-6、IL-10 含量(±s, n = 10)Table 5 Contents of TNF-α, IL-6 and IL-10 in colon tissue of mice in each group (±s, n = 10)
组别 IL-6/(pg·mL-1) IL-10/(pg·mL-1) TNF-α/(pg·mL-1)空白 19.84±1.76 67.89±6.85 87.44±8.04模型 30.71±3.40### 44.85±10.09### 127.59±20.14###空白挥发油 28.90±4.00 52.01±5.25 113.65±13.50 MN 26.05±2.30** 53.76±9.87 103.07±9.73**MNG 22.86±2.04*** 57.64±8.13* 100.07±10.68***阳性 22.37±2.05*** 59.67±8.71** 100.98±10.68***
2.7.9 免疫荧光法观察小鼠结肠组织中claudin-1 和ZO-1 蛋白的表达 取结肠组织石蜡切片脱蜡至水;柠檬酸盐缓冲液80 ℃修复抗原20 min,PBS 冲洗5 min×3;滴加山羊血清室温封闭20 min,PBS 冲洗5 min×3;滴加一抗claudin-1 和ZO-1,4 ℃冰箱孵育过夜,PBS 冲洗5 min×3,滴加对应二抗,37 ℃孵育30 min,PBS 冲洗5 min×3;滴加DAPI室温孵育10 min,PBS 冲洗5 min×3 后,使用抗荧光衰减封片剂进行封片,于荧光显微镜下观察并采集图像。
结果如图14 显示,空白组小鼠结肠组织中claudin-1 和ZO-1 蛋白在结肠黏膜呈连续性高表达,充满整个视野,模型组小鼠组织中claudin-1 和ZO-1 蛋白在结肠黏膜的表达呈间断性,荧光强度明显下降;与模型组相比,空白挥发油组和MN 组小鼠结肠组织紧密连接蛋白claudin-1 和ZO-1 表达范围增加,但荧光强度较弱,MNG 组和阳性组小鼠结肠组织紧密连接蛋白claudin-1 和ZO-1 在结肠荧光强度明显增加,荧光较强。结果表明,MNG 可以提高claudin-1、ZO-1 紧密连接蛋白的表达改善结肠黏膜屏障损伤。

图14 各组中claudin-1 和ZO-1 蛋白表达Fig.14 Expression of claudin-1 and ZO-1 proteins in each group
3 讨论
厚朴主要化学成分包括生物碱类、木脂素类、挥发油等,现代药理学研究表明厚朴挥发油具有明显的抗炎[18]、抗氧化[19]、抗菌[20]等生物活性,具有广阔的应用前景。但厚朴挥发油理化性质不稳定,遇光、氧气、高温会发生活性成分的降解、挥发现象,这与其所含主要活性成分倍半萜、萜烯及含氧衍生物[21]等有关。与此同时,口服递送厚朴挥发油受胃肠道pH 值、首过效应及在肠道代谢的影响,会降低其疗效,因此,如何提高厚朴挥发油稳定性并将其有效递送到炎症部位,成为利用厚朴挥发油治疗UC 亟待解决的关键问题。为改善挥发油理化性质稳定性差、易降解的问题,本实验将挥发油制成纳米乳,增加其稳定性和溶解度,外层用海藻酸钠和透明质酸制备了一层水凝胶,调控药物在结肠释放。透明质酸[22]是一种表面带负电荷的理想的结肠靶向药物递送材料,它可以通过静电吸附粘附在炎症粘膜上,提高纳米乳的黏附性,增强药物在结肠中的滞留;同时,海藻酸钠[23]是一种对酸敏感的天然多糖材料,可以将更多的药物递送到结肠部位,大大提高药物的生物利用度,实现局部、持续的药物释放作用。
在体外模拟胃肠道pH 值环境的药物释放结果表明,外层水凝胶的包裹能有效减少在胃和小肠的药物突释,并在结肠下持续释放药物。小动物活体成像实验证明了MNG 具有结肠靶向的趋势,提示外层水凝胶可以保护药物过早释放,并达到药物缓释作用。药效学等结果表明,MNG 能调节炎症因子的分泌,提高claudin-1、ZO-1 紧密连接蛋白的表达改善结肠黏膜屏障损伤。
综上,本实验制备的MNG 不仅制备简单、工艺成熟,解决厚朴挥发油易挥发、稳定性差的制剂难题的同时,可以增强了药物在胃肠道稳定性,实现结肠靶向释放,其缓释作用可使药物延长治疗结肠黏膜炎症的时间,因而赋予MNG 具有缓释与靶向的双重功能,为厚朴挥发油综合开发利用和抗UC 新药的开发提供解决候选方案。
利益冲突所有作者均声明不存在利益冲突

