阿托伐他汀钙通过抑制NLRP3炎症小体减轻大鼠心肌缺血再灌注损伤的实验研究







【摘要】 目的 探讨阿托伐他汀钙(Ator)对大鼠心肌缺血/再灌注(I/R)模型的影响及其作用机制。
方法 将SD大鼠随机分为三组:假手术组(n=9)、I/R组(n=9)和治疗组(n=9)。通过冠状动脉左前降支的中上段结扎,成功构建了I/R大鼠模型。采用HE染色法观察心肌细胞的病理学变化,并通过实时定量聚合酶链反应(RT-qPCR)、免疫组织化学法及Western Blot技术检测NLRP3炎症小体在大鼠心肌组织中的表达水平。
结果 (1)HE染色显示假手术组大鼠心肌结构保持完整,心肌纤维排列有序;而I/R组大鼠心肌细胞排列紊乱,细胞间质出现水肿,部分细胞发生坏死;治疗组大鼠心肌结构破坏程度较I/R组显著减轻。(2)RT-qPCR、免疫组织化学法及Western Blot检测结果表明,与假手术组相比,I/R组大鼠心肌组织中NLRP3的表达显著升高(P<0.01);治疗组与I/R组相比,NLRP3的表达显著降低(P<0.05)。
结论 阿托伐他汀钙预处理能够有效抑制NLRP3的表达,从而减轻大鼠心肌缺血再灌注损伤。
【关键词】 缺血再灌注损伤;阿托伐他汀钙;NLRP3炎症小体;大鼠
中图分类号:R542.2"" 文献标志码:A"" DOI:10.3969/j.issn.1003-1383.2024.12.003
Experimental study of atorvastatin calcium on the alleviation of myocardial
ischemia-reperfusion injury in rats by inhibiting NLRP3 inflammasome
[HJ2][HJ]
WEN Zhuomin1a, LIANG Limei1b, ZHOU Weijie2, LIANG Jiadong3a,
ZHANG Zhuohua3b, PAN Cunyu1a, JING Yuxin1a, LIN Guowu1a
(1a. Graduate School, 1b. School of Laboratory Medicine, Youjiang Medical" University for Nationalities, Baise 533000,
Guangxi, China;
2. Department of Medical Laboratory, the Affiliated Southwest Hospital of Youjiang
Medical University for Nationalities — Baise
People's Hospital, Baise 533000, Guangxi, China;
3a. Research Center for Life Sciences and Clinical Medicine, 3b. Department
of Cardiovascular Medicine,
Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
[HJ2][HJ]
【Abstract】 Objective To investigate the therapeutic effects and underlying mechanisms of atorvastatin calcium (Ator) in a rat model of myocardial ischemia/reperfusion (I/R).
Methods Sprague-Dawley (SD) rats were randomly divided into three groups: sham surgery group (n=9), I/R group (n=9), and treatment group (n=9). The pathological changes of cardiomyocytes were observed by HE staining, and the expression level of NLRP3 inflammasome in myocardial tissue of" rat was determined by real-time quantitative polymerase chain reaction (RT-qPCR), immunohistochemistry and Western Blot technology.
Results (1) HE staining revealed that the myocardial structure of rats in the sham surgery group was intact with orderly arranged myocardial fibers; in contrast, the myocardial cells in the I/R group showed disordered arrangement, interstitial edema, and partial cell necrosis; the degree of myocardial structural damage in the treatment group significantly reduced compared to the I/R group.(2) The results of RT-qPCR, immunohistochemistry and Western Blot detection showed that compared with the sham operation group, the expression of NLRP3 in the myocardial tissue of rats in the I/R group significantly increased (Plt;0.01); the expression of NLRP3 significantly reduced in the treatment group when compared to the I/R group (Plt;0.05).
Conclusion Pretreatment with atorvastatin calcium" can effectively inhibit the expression of NLRP3, and thus alleviating myocardial ischemia-reperfusion inyury in rats.
【Keywords】 ischemia-reperfusion inyury; atorvastatin calcium; NLRP3 inflammasome; rat
心肌梗死(myocardial infarction,MI)是一种严重威胁生命的心血管事件,在全球范围内具有较高的死亡率[1]。缺血/再灌注(ischemia/reperfusion,I/R)损伤发生在急性冠状动脉闭塞后,当血流重新恢复至缺血心肌时,组织损伤会加剧。I/R发生的主要病理机制包括自噬、氧化应激、炎症、凋亡和线粒体功能障碍等因素[2-3],其中炎症反应是I/R过程中的关键病理机制之一。研究表明,NLRP3炎性小体是细胞焦亡途径中的关键蛋白,属于NLRs家族[4]。它在多种刺激下发挥重要作用,不仅能够诱导细胞焦亡,还能促进炎症反应的发生[5]。特别是在心肌I/R模型中,NLRP3炎性小体的表达上调与心肌梗死面积的扩大紧密相关。这种上调不仅加剧了心肌损伤,还可能导致心脏重塑,对心脏功能产生不利影响。因此,NLRP3炎性小体的抑制表达可能有助于限制炎症反应,减少心肌损伤,从而成为心肌损伤和修复过程中的一个重要调控靶点。以往的研究发现,在心血管疾病和心肌病中,阿托伐他汀钙能够保护I/R大鼠心肌细胞。然而,其是否通过NLRP3炎性小体发挥作用仍需进一步研究以阐明其潜在机制。本研究通过建立I/R大鼠模型,探讨阿托伐他汀钙(Atorvastatin calcium,Ator)预处理通过NLRP3炎性小体对I/R大鼠心肌细胞的调控作用及其对心肌细胞损伤的保护作用,为临床治疗心肌细胞I/R损伤提供参考。
1 材料与方法
1.1 主要药物及试剂
Ator购自乐普药业股份有限公司。将Ator用DMSO配制成浓度为1 mg/mL的Ator混悬液,以备灌胃。电泳液和转膜液均由北京索莱宝科技有限公司供应。NLRP3抗体由武汉三鹰生物技术有限公司生产。甘油醛-3-磷酸脱氢酶(GAPDH)抗体及山羊抗兔IgG HRP均由生工生物工程(上海)股份有限公司提供。RIPA裂解液从兰杰柯科技有限公司购买。2×Q3 SYBR qPCR Master Mix试剂盒和逆转录试剂盒均由北京索莱宝科技有限公司供应。
1.2 实验动物
从北京维通利华动物实验有限公司购入6~8周龄、体重190~210 g之间的无特定病原体级SD雄性/雌性大鼠。动物合格证号为SCXK(粤)2022-0063,该证书所在地为中国广东。大鼠均饲养于(23±2) ℃,并采用适应性喂养水和食物的方式进行饲养,严格按照动物实验中心的要求进行实验操作。本实验已获得右江民族医学院实验动物伦理委员会批准(2023101301)。
1.3 方法
1.3.1 大鼠分组给药
实验动物分组将27只健康SD大鼠(13只雌性,14只雄性)采用双盲法随机分为三组:假手术组、I/R组和治疗组,每组9只。经过1周的基础饲料适应性喂养后,治疗组在建模前两周以20 mg/(kg·d)灌胃阿托伐他汀钙溶液,假手术组和I/R组给予生理盐水灌胃,共14次[6]。基线情况见表1。
1.3.2 I/R模型的建立
参考文献中描述的方法,构建I/R大鼠模型[7]。①对大鼠进行了腹腔注射戊巴比妥钠(剂量为每公斤体重45 mg)进行麻醉。②将大鼠置于仰卧位并固定,进行气管插管,并连接至小型动物呼吸机以维持呼吸,其中潮气量设置为每公斤体重15 mL,呼吸频率设定为每分钟70次。③剖开大鼠胸腔以显露心脏和冠状动脉,在第三与第四肋骨间隙切开心包膜暴露心脏,并使用6-0缝合线对前降支的中上段进行30分钟的结扎。当观察到结扎区域远端的心肌颜色变暗以及心电图ST段出现升高时,即表明心肌缺血成功实现。④在120分钟的再灌注后,如果ST段下降超过50%且缺血区域的心肌颜色恢复正常,则表示再灌注成功。⑤假手术组的大鼠(数量为9只)接受了相同的手术程序,但未进行结扎。⑥所有在建立缺血或再灌注过程中失败或在取材前死亡的大鼠均被排除在外。对于死亡的动物,采取措施防止疾病传播和环境污染,同时遵循动物福利和伦理的要求。
1.3.3 心电图监测
将动物数字心电图机的导联正确接至大鼠对应的肢体,记录大鼠心电图ST段的变化过程。
1.3.4 HE染色评价大鼠心肌组织形态
成功建立I/R模型后,①立即收集心肌组织样本,使用4%多聚甲醛进行固定。②将心肌组织进行石蜡包埋处理,并切成4 μm厚的切片。切片经过PBS洗涤以去除残留的石蜡,使用二甲苯进行脱蜡处理,然后通过梯度乙醇进行水化。③根据HE染色试剂盒的说明书进行组织学染色,以评价心肌组织的形态学特征。④将切片烤制,并按照特定程序进行苏木精和伊红染色处理,使用200倍的光学显微镜(OLYMPUS,日本)观察心肌形态学改变,并拍摄照片。
1.3.5 NLRP3 mRNA相对表达量检测
引物购于南宁捷尼斯生物科技有限公司,其序列见表2。①取50 mg大鼠心肌组织,使用Trizol法提取总RNA,参照厂商产品说明书。②将RNA酶水溶液注入RNA样品中,混匀后通过分光光度法测定其纯度和浓度。③根据转录试剂盒和2×Q3 SYBR qPCR Master Mix试剂盒说明书,建立反转录体系合成cDNA和实时荧光定量PCR反应体系。④使用荧光定量PCR仪进行95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个扩增循环。⑤以2-△△Ct方法分析NLRP3 mRNA的相对表达量。
1.3.6 Western Blot检测NLRP3的蛋白表达
完成I/R制备后,进行心脏分离并提取心肌梗死组织,并对组织进行Western Blot分析。①根据制造商的方案,采用RIPA裂解液提取各组大鼠心肌组织中的总蛋白,使用BCA蛋白测定法对总蛋白进行定量。②将各组蛋白煮沸变性,使用SDS-PAGE分离并转移至PVDF膜。③使用5%BSA进行封闭,然后将PVDF膜与NLRP3(1∶3000稀释)和GAPDH(1∶7500稀释)的一抗在4 ℃冰箱孵育过夜。次日用Tris-Buffered Saline Tween-20(TBST)洗膜(3×10分钟),随后与相应的二抗(1∶7500)在37 ℃孵育1小时。④再次用TBST洗膜(3×10分钟),在ECL荧光显示条带后进行显影,从而计算NLRP3蛋白的相对表达量。
1.3.7 免疫组织化学染色检测NLRP3蛋白的表达
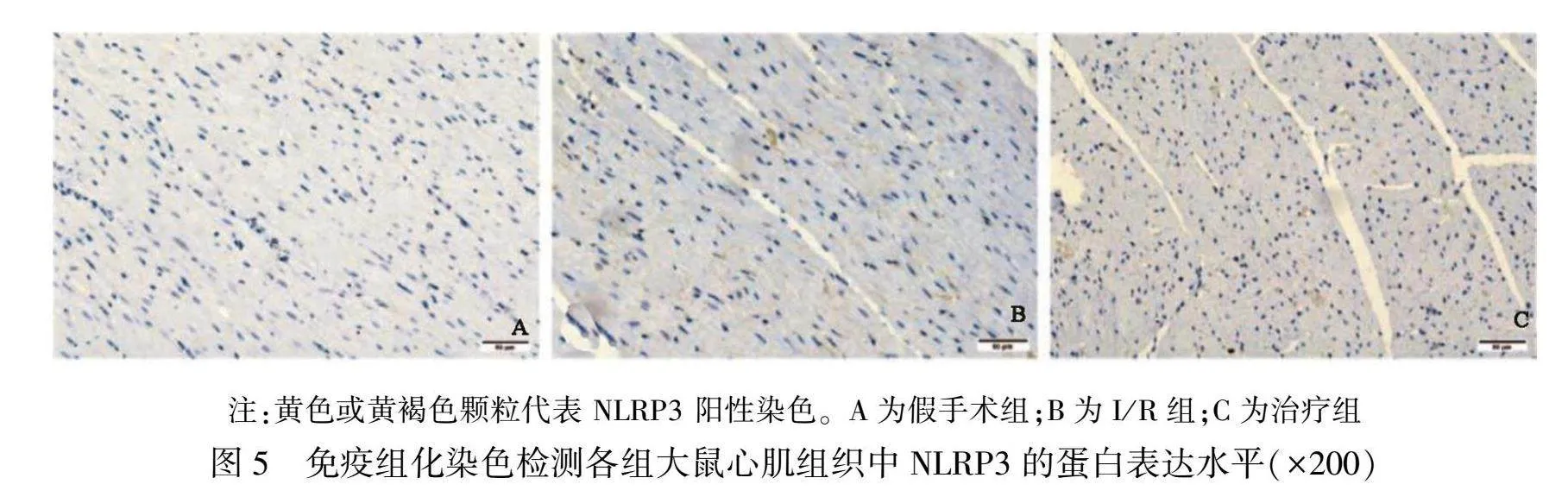
①从大鼠的左心室中提取石蜡样本,并进行脱蜡和抗原修复处理。②将抗体以1∶1000的比例稀释,并与兔抗鼠的NLRP3抗体混合,在4 ℃下培养一夜。③添加二抗(1∶1500的比例)进行培养,使用DAB显色,随后用苏木精进行复染,并用显微镜观察,NLRP3的阳性细胞呈现棕黄色。
1.4 统计学方法
使用SPSS 26.0和Graph pad Prism8对实验数据进行分析。计量资料符合正态分布,采用均数±标准差(±s)表示。组内多组数据及多组间数据比较,采用单因素方差分析。检验水准:α=0.05,双侧检验。
2 结" 果
2.1 大鼠I/R模型
共选取27只大鼠进行实验。其中,假手术组大鼠具有正常心电图;I/R组大鼠在冠状动脉前降支进行结扎30分钟后,心电图显示肢体导联Ⅱ的ST段明显抬高,提示急性心肌梗死模型制备成功。松开线后复血120分钟,心电图中观察到肢体导联Ⅱ的ST段下降超过1/2,说明再灌注成功[8]。见图1。
2.2 Ator对I/R大鼠心肌病理形态学的影响
经过HE染色后,通过光学显微镜观察各组大鼠的心肌病理形态学。结果显示:①假手术组大鼠心肌组织结构完整,心肌纤维排列整齐、无断裂,未见其他形态结构改变,组织中未见炎性细胞浸润;②I/R组大鼠心肌组织结构显示肌纤维结构不完整,细胞出现脂肪样变,细胞间质水肿及出血,部分细胞发生坏死,观察到部分炎性细胞的浸润;③治疗组大鼠心肌纤维结构较I/R组更完整,纤维排列更加整齐,细胞损伤减轻,心肌结构破坏程度显著降低,坏死细胞明显减少,同时观察到一些中性粒细胞浸润。见图2。
2.3 比较各组大鼠NLRP3 mRNA的相对表达水平
与假手术组相比,I/R组大鼠组织中NLRP3 mRNA的相对表达水平显著上升(P<0.01);与I/R组相比,治疗组大鼠主动脉组织中NLRP3 mRNA的相对表达水平显著降低(P<0.01)。见图3。
2.4 Ator对I/R大鼠心肌组织中NLRP3蛋白表达的影响
通过Western Blot技术分析,结果显示假手术组大鼠心肌组织中NLRP3蛋白表达水平较低,而I/R组大鼠心肌组织中NLRP3蛋白表达水平显著升高(P<0.01)。在给予Ator治疗后,治疗组大鼠心肌组织中NLRP3蛋白表达水平较I/R组有所降低(P<0.05)。详见图4与表3。免疫组化分析结果与Western Blot结果一致,与假手术组相比,I/R组大鼠心肌组织中棕色颗粒显著增多,表明NLRP3表达水平增加。而与I/R组相比,治疗组大鼠心肌组织中棕色颗粒减少,NLRP3表达水平降低。详见图5。
3 讨" 论
心肌梗死作为缺血性心脏病的一种典型临床表现,是全球范围内导致死亡的主要疾病之一[9]。冠状动脉的阻塞通常会导致心肌血流量的不足,进而引起心肌细胞的凋亡和坏死,对心脏功能产生负面影响[10]。在过去的数十年中,通过灌注治疗、溶栓或经皮冠状动脉介入治疗以及各种药物治疗,显著降低了急性期幸存者的住院死亡率并改善了长期预后[11]。其中,早期再灌注被认为是挽救缺血心肌组织的最佳策略[12]。然而,血液再灌注治疗在恢复血流的同时,也可能触发心肌缺血/再灌注损伤。深入理解心肌缺血再灌注损伤的机制,探索治疗靶点,可能为未来心肌梗死的治疗和预防提供新的策略。
持续性再灌注治疗可导致广泛炎症性损伤,影响高达50%的梗死区域。在受损心肌细胞中,细胞凋亡及炎症性损伤与NLRP3炎症小体的激活密切相关,进而加剧心肌损伤[13]。研究已证实,NLRP3炎症小体介导的caspase-1信号通路诱导的细胞焦亡在心肌缺血/再灌注(MI/R)损伤中扮演着关键角色[14]。心肌细胞遭受缺血再灌注损伤时,细胞内的损伤信号会触发NLRP3炎症小体的激活[15]。NLRP3炎症小体的激活受到多种因素的调控,包括氧化应激、内质网应激、线粒体功能和代谢物的变化等[16]。激活的NLRP3炎症小体能够促进caspase-1的活化,活化的caspase-1进一步将前体形式的炎症因子如白细胞介素-1β(pro-IL-1β)和白细胞介素-18(pro-IL-18)转化为活化形式,从而引发炎症反应[17]。此外,活化的caspase-1还参与了细胞焦亡(pyroptosis)的过程[18],而焦亡可导致炎性介质的大量产生和心肌细胞死亡。LUAN等人的研究首次验证了肉桂酸信号通路之间的强相关性,肉桂酸可减轻大鼠心肌I/R损伤,其机制可能是通过抑制NLRP3炎性小体的激活,抑制心肌细胞的焦亡[19]。BLEVINS等的研究表明,在MI/R期间,沉默NLRP3基因可以抑制NLRP3炎症小体的形成,NLRP3炎性小体的激活通过caspase-1介导炎症因子释放,导致细胞炎症和焦亡,并限制心肌梗死的大小[20]。体外实验表明,NLRP3炎性小体抑制剂和caspase-1抑制剂的应用显著减少了细胞炎症损伤和焦亡的发生。同样,在本研究中,NLRP3在大鼠I/R组组织中的表达明显高于假手术组。而阿托伐他汀钙预处理后,可以显著降低NLRP3的表达,因此,NLRP3可能是未来减轻MI/R损伤的潜在靶点。
他汀类药物已广泛应用于降低血清低密度脂蛋白胆固醇(LDL-C)水平及抑制肝脏胆固醇生物合成,以预防冠状动脉心脏病和中风[21]。先前的研究揭示了他汀类药物除了降低LDL-C外,还具有抗增殖、抗血栓、抗炎和抗动脉粥样硬化等多重效应。此外,阿托伐他汀亦被证实可减少心肌梗死面积及心肌细胞凋亡[22]。阿托伐他汀与依洛尤单抗的联合应用可能为需要更严格胆固醇控制的患者提供额外的心血管保护,但其具体作用机制尚未明确[23-24]。脱氢表雄酮可能通过抑制NLRP3炎症体途径,减少心肌缺血再灌注相关的炎症反应和细胞焦亡,为心肌梗死的治疗提供了新的策略[25]。进一步的研究显示,胃饥饿素通过调节内质网应激与NLRP3炎症小体的相互作用,并通过PI3K/AKT途径抑制心肌凋亡,在糖尿病心肌病中发挥保护作用[26],DAPA能有效减轻心肌细胞肥大、炎症和细胞应激,并通过PI3K/AKT信号通路发挥其心脏保护作用[27]。
随着NLRP3炎症小体在缺血再灌注损伤中的作用被揭示,本研究团队的研究表明,阿托伐他汀钙预处理能够抑制焦亡通路中NLRP3炎症因子在心肌I/R中的表达,从而减轻心肌I/R大鼠的心肌损伤。这些研究结果支持了NLRP3炎症小体在心肌损伤中的关键作用,并揭示了不同药物及药物联合通过抑制NLRP3炎症小体来发挥心脏保护作用的可能性,为心肌梗死的临床治疗提供了新的视角和潜在的治疗策略。
综上所述,虽然本研究在理论上提供了有价值的见解,但在实验设计和验证方面存在不足。未来的研究应考虑在细胞和临床层面进行更深入的探索,并考虑NLRP3炎症小体及焦亡通路及其他相关因子在心肌I/R中的作用,以期发现更为全面和有效的治疗策略[28-29]。
参 考 文 献
[1]" 卿平.CHA2DS2-VASc评分对急性心肌梗死患者院内及住院1年后结局事件的预测价值[D].北京:北京协和医学院,2022.
[2]" 常兴.通阳活血方调控β-tubulin骨架蛋白与线粒体稳态治疗病态窦房结综合征的机制研究[D].北京:中国中医科学院,2022.
[3]" LIU Y, ZHANG J, ZHANG D J, et al. Research progress on the role of pyroptosis in myocardial ischemia-reperfusion injury[J]. Cells,2022,11(20):3271.
[4]" 陈丰.尼可地尔通过TLR4/MyD88/NF-κB/NLRP3信号通路对大鼠心肌梗死后心肌细胞焦亡的影响[D].广西:广西医科大学,2021.
[5]" 向近杰,李颢.细胞焦亡在草酸钙肾结石形成机制中的研究进展[J].肾脏病与透析肾移植杂志,2023,32(2):168-173.
[6]" 赵灿,王永亮,沈絮华,等.阿托伐他汀预处理对心肌缺血再灌注损伤大鼠心室重构、炎症反应和氧化应激的影响[J].现代生物医学进展,2021,21(4):614-617.
[7]" 周尚,刘燕,罗文琳,等.不同浓度龙血竭总黄酮对大鼠MIRI 心肌细胞PI3K/AKT通路的影响[J].右江民族医学院学报,2023,45(2):218-223.
[8]" 黄兰松.基于Caspase-3/GSDME信号轴探讨龙血竭总黄酮对心肌缺血再灌注损伤的作用研究[D].百色:右江民族医学院,2022.
[9]" 唐映华.急性心肌梗死患者环状RNA生物信息学相关研究[D].广西:广西医科大学,2020.
[10]" 潘庆丽,高娟,王立旗.二丁酰环磷腺苷钙联合尼可地尔治疗急性ST段抬高型心肌梗死的临床研究[J].现代药物与临床,2018,33(7):1579-1582.
[11]" 徐运天. 经腹部CT计算身体成分与EICU脓毒症患者临床预后关系的研究[D].合肥:安徽医科大学,2021.
[12]" 辛克江.盐酸替罗非班在冠心病治疗中的研究进展[J].中国处方药,2018,16(5):13-14.
[13]" YUE R C, LU S Z, LUO Y, et al. Calpain silencing alleviates myocardial ischemia-reperfusion injury through the NLRP3/ASC/Caspase-1 axis in mice[J]. Life Sci,2019,233:116631.
[14]" 沈世淳.尿酸通过激活ROS/NLRP3焦亡信号通路加重心肌缺血再灌注损伤[D].合肥:安徽医科大学,2021.
[15]" 陈丰,彭秀达,费书珂.核苷酸结合寡聚化结构域样受体在肝内外缺血再灌注中的研究进展[J].肝胆胰外科杂志,2024,36(9):564-569.
[16]" CHEN L, MAO L S, XUE J Y, et al. Myocardial ischemia-reperfusion injury: the balance mechanism between mitophagy and NLRP3 inflammasome[J]. Life Sci,2024,355:122998.
[17]" ZHOU C, QIU S W, WANG F M, et al. Gasdermin D could be lost in the brain parenchyma infarct core and a pyroptosis-autophagy inhibition effect of Jie-Du-Huo-Xue decoction after stroke[J]. Front Pharmacol, 2024,15:1449452.
[18]" LIU Y, LI X, SUN T T, et al. Pyroptosis in myocardial ischemia/reperfusion and its therapeutic implications[J]. Eur J Pharmacol, 2024,971:176464.
[19]" LUAN F, RAO Z L, PENG L X, et al. Cinnamic acid preserves against myocardial ischemia/reperfusion injury via suppression of NLRP3/Caspase-1/GSDMD signaling pathway[J]. Phytomedicine, 2022,100:154047.
[20]" BLEVINS H M, XU Y M, BIBY S, et al. The NLRP3 inflammasome pathway:a review of mechanisms and inhibitors for the treatment of inflammatory diseases[J]. Front Aging Neurosci, 2022,14:879021.
[21]" YUE R Z, LI Y J, SU B H, et al. Atorvastatin reduces contrast media-induced pyroptosis of renal tubular epithelial cells by inhibiting the TLR4/MyD88/NF-κB signaling pathway[J]. BMC Nephrol, 2023,24(1):25.
[22]" 孙向华,杨菲.基于Nrf2/HO-1信号通路探讨阿托伐他汀对急性心肌梗死大鼠模型心肌细胞的影响[J].中西医结合心脑血管病杂志,2023,21(6):1042-1046.
[23]" 郝敬严,刘菁晶,杨瑞飞,等.阿托伐他汀联合依洛尤单抗治疗极高风险动脉粥样硬化心血管疾病患者效果的研究[J].中国医学创新,2024,21(9):10-15.
[24]" 司澳洋,元朝波,郭长磊.依洛尤单抗联合瑞舒伐他汀钙片对冠心病经皮冠状动脉介入术后患者疗效的影响[J].黑龙江医药科学,2023,46(6):81-83.
[25]" 祝松涛,任引刚.脱氢表雄酮通过抑制NLRP3炎症体减轻大鼠心肌缺血再灌注损伤[J].山西医科大学学报,2023,54(7):924-931.
[26]" WANG F, WANG J Z, LIANG X F, et al. Ghrelin inhibits myocardial pyroptosis in diabetic cardiomyopathy by regulating ERS and NLRP3 inflammasome crosstalk through the PI3K/AKT pathway[J]. J Drug Target, 2024,32(2):148-158.
[27]" ALSEREIDI F R, KHASHIM Z, MARZOOK H, et al. Dapagliflozin mitigates cellular stress and inflammation through PI3K/AKT pathway modulation in cardiomyocytes,aortic endothelial cells, and stem cell-derived β cells[J]. Cardiovasc Diabetol, 2024,23(1):388.
[28]" 江绍涛.RNA结合蛋白CPSF3通过PI3K/Akt/GSK-3β通路介导肝癌细胞周期抑制及其在肝癌患者临床特征和预后中的意义[D].广州:华南理工大学,2021.
[29]" RAO Z P, ZHU Y T, YANG P, et al. Pyroptosis in inflammatory diseases and cancer[J]. Theranostics, 2022,12(9):4310-4329.
(收稿日期:2024-07-15 修回日期:2024-11-14)
(编辑:梁明佩)
基金项目:百色市科学研究与技术开发计划课题(20211809)
第一作者简介:文卓敏,女,在读硕士研究生,研究方向:冠心病炎症机制。E-mail:2528396523@qq.com
通信作者:梁丽梅。E-mail:372549367@qq.com周伟杰。E-mail:zhouweijie1998@ymcn.edu.cn
[本文引用格式]文卓敏,梁丽梅,周伟杰,等.阿托伐他汀钙通过抑制NLRP3炎症小体减轻大鼠心肌缺血再灌注损伤的实验研究[J].右江医学,2024,52(12):1071-1078.

