关键生产工艺对鲜榨生菜汁品质的影响
张佳迪,程锦潇,李华林,李芝萱,唐选明,耿新丽 ,潘艳芳,
(1.中国农业科学院农产品加工研究所,北京 100193;2.天津科技大学食品科学与工程学院,天津 300457;3.新疆维吾尔自治区葡萄瓜果研究所,新疆吐鲁番 838200)
叶用莴苣(Lactuca sativaL.)俗称生菜,是最常见的生食叶菜,维生素和膳食纤维含量丰富,具有调节酸碱平衡、提高免疫力、润肠通便等功能[1]。但因其组织脆嫩、含水量高,采后极易失水萎蔫、黄化、腐烂变质,导致货架期短[2]。通过机械物理等技术手段开发生菜加工产品,不仅可以有效解决生菜产量过剩、采后腐烂等问题,还能丰富蔬菜加工制品种类[3]。鲜榨果蔬汁有“液体果蔬”之称,可作为即食新鲜果蔬的替代品。现行农业行业标准《非浓缩还原果蔬汁加工技术规程》(NY/T 3909-2021)[4]中明确,以水果、蔬菜为原料,通过机械方法直接制成的可发酵但未发酵的汁液制品为非浓缩还原(Not from concentrate,NFC)果蔬汁,而采用超高压等非热杀菌或巴氏杀菌的NFC 果蔬汁产品也可标注为“鲜榨果蔬汁”。当前市场以鲜榨水果汁为主,相比之下,鲜榨蔬菜汁具有低糖、低热量、高膳食纤维等独特优势,更符合未来消费者对天然风味和营养健康的需求[5]。
不同于果汁加工工艺,蔬菜膳食纤维含量高、出汁率低[6],且鲜榨加工过程中极易氧化褪绿,导致色泽等品质下降[7]。漂烫处理一方面软化蔬菜组织提高出汁率,另一方面可以钝化多酚氧化酶(Polyphenoloxidase,PPO)和过氧化物酶(Peroxidase,POD)等活性[8],抑制色素氧化,使色素更容易溶出,降低营养成分的损失[9-14]。蔬菜汁破碎制汁后含有果胶、蛋白质、膳食纤维等悬浮物质,相互作用后形成不溶性的絮状物质而产生沉淀,影响蔬菜汁的感官品质、贮藏性及商品性等。分离澄清技术可去除蔬菜汁中的果胶和悬浮物等,使得产品清透并且保持良好的感官品质。杀菌是鲜榨生菜汁加工的必要和关键环节,直接影响蔬菜汁的品质和货架期[15]。区别于传统温度较高或时间较长的热杀菌造成鲜榨汁色泽、风味、活性成分等的损失,超高压(Ultra-high pressure,UHP)技术将果蔬汁密封包装在密闭容器中,在100~1000 MPa的静压力下使果蔬制品中的细胞破碎、蛋白质变性、淀粉糊化,并达到杀菌效果[16],可最大程度保留产品原有的感官品质和营养价值[17]。黄瓜汁饮料在500 MPa/2 min 的高压处理后叶绿素含量与对照组无显著差异,而85 ℃/15 s 的热处理后叶绿素含量显著下降[18]。
然而,以绿色叶菜为来源的鲜榨蔬菜汁尤其是鲜榨生菜汁市场缺乏,关键生产工艺对其制汁特性、品质变化影响不明。因此,本实验以绿萝莎生菜为原料,探究漂烫、分离、杀菌三个关键生产工艺对鲜榨生菜汁色泽参数、理化指标、叶绿素含量、酶活性及抗氧化能力的影响,阐明不同加工工艺对鲜榨生菜汁感官及品质的影响,为鲜榨生菜汁规模化加工的质量控制和品质提升提供理论依据。
1 材料与方法
1.1 材料与仪器
绿萝莎水培生菜 采于北京创世大业科技有限公司工业园区,选取绿色新鲜、生长周期(25±1)d、重量为(120±5)g 的绿萝莎生菜,当天采摘2 h 内运回实验室,现采现用;平板计数琼脂、马铃薯葡萄糖琼脂 北京奥博星生物技术有限公司;无水乙醇、丙酮、浓硫酸、磷酸 国药集团化学试剂有限公司;牛血清白蛋白标准品、考马斯亮蓝G-250 北京索莱宝科技有限公司;植物可溶性糖、总酚含量试剂盒、过氧化氢酶试剂盒、多酚氧化酶试剂盒、超氧阴离子清除能力试剂盒、总抗氧化能力试剂盒、羟基自由基清除能力试剂盒 苏州科铭生物技术有限公司。
L12-P126 型高速破壁调理机 北京合千润科贸有限公司;JML 型胶体磨 温州市弘安机械有限公司;PAL-BX/ACID 5 型糖酸度计 日本爱拓公司;DigiEye 型电子眼 英国Verivide 公司;Sigma3k15台式高速冷冻分离机 上海斯高勒生物科技有限公司;FiveEasy Plus pH 计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 生菜汁的制备 鲜榨浊汁:选取无机械损伤的新鲜水培生菜,去根,清洗,沥干水分,切段,打浆,过胶体磨,静置1 h,2 层100 目过筛。
鲜榨清汁:将鲜榨生菜浊汁于6000×g 下4 ℃分离10 min,取上清,即得。漂烫浊汁:选取无机械损伤的新鲜水培生菜,去根,清洗,沥干水分,切段,沸水中漂烫2 min,过冷水,沥干水分,打浆,过胶体磨,静置1 h,2 层100 目过筛,即得。漂烫清汁:将漂烫生菜浊汁于6000×g 下4 ℃分离10 min,取上清,即得。杀菌浊汁:将漂烫生菜浊汁罐装于棕色瓶中,25 ℃下600 MPa 保压120 s,即得。杀菌清汁:将漂烫生菜清汁罐装于棕色瓶中,25 ℃下600 MPa 保压120 s,即得。
将加工过程中得到的六种生菜汁样品如图1 所示,将其罐装于棕色玻璃瓶中,一部分置于4 ℃冰箱,鲜样待测(不超过3 d)。另一部分生菜汁样品液氮速冻,置于-80 ℃待测。

图1 生菜汁样品Fig.1 Lettuce juice sample
1.2.2 微生物测定 根据(GB 4789.2-2016 和GB 4789.15-2016)[19-20]测定鲜榨生菜汁样品中的总好氧菌(Total aerobic bacteria,TAB)及酵母菌和霉菌(Yeasts and molds,Y&M),分别吸取1 mL 样品,平皿计数琼脂和马铃薯葡萄糖琼脂倾注平皿。总好氧菌于(36±1)℃培养箱中培养(48±2)h。霉菌和酵母菌于(28±1)℃培养箱中培养(5±2)d。结果以每毫升生菜汁菌落形成单位数的十进制对数表示,为lgCFU/mL。
1.2.3 色泽测定 采用电子眼测定生菜汁的色度值,吸取5 mL 生菜汁样品于35 mm 的培养皿中,电子眼拍照,分析生菜汁样品的L*(明/暗)、a*(红/绿)、b*(黄/蓝)、C*(Chroma,饱和度)和h(Hue angle,色调)值。
1.2.4 可溶性固形物(Total soluble solids,TSS)、酸度(Acid)、pH 测定 TSS、Acid 通过手持式糖酸度仪测量,pH 用pH 计检测。
1.2.5 叶绿素含量测定 参照Zhao 等[21]和El-nakhel等[22]方法检测生菜汁样品的叶绿素a、叶绿素b 和总叶绿素的含量。将500 mL 的生菜汁在10 mL 的丙酮(90%)中研磨,然后在3000×g 下离心10 min。收集上清液并再次加入丙酮(90%),直到达到25 mL的体积。用分光光度计在662、645 nm 的两波长度下分别测量叶绿素a 和b 的吸光度。总叶绿素被计算为叶绿素a 和b 的总和。叶绿素a 和b 的浓度用以下转换公式计算。
1.2.6 可溶性糖含量测定 依据植物可溶性糖含量试剂盒说明书测定样品的可溶性糖含量。
1.2.7 可溶性蛋白含量测定 牛血清白蛋白为标准蛋白,绘制标准曲线为y=0.0037x+0.0002,R2=0.9996。采用考马斯亮蓝法测定[23],计算可溶性蛋白含量。
可溶性蛋白含量(mg/100 g)=100(m′×V)/(Vs×m×1000)
式中:m′—标曲中查得的蛋白含量,µg;V—样品提取液体积,mL;Vs—测定时所取样品提取液体积,mL;m—样品质量,g。
1.2.8 总酚含量测定 依据总酚试剂盒说明书测定生菜汁样品的总酚含量。
1.2.9 POD、PPO、CAT 活性测定 将生菜汁样品液氮研磨并准确称取0.1 g,加入粗酶提取液(含1 mmoL PEG、4% PVPP 和1% Triton X-100)0.5 mL,在4 ℃下分离10 min,得上清液,依据试剂盒说明书测定POD、PPO、CAT 活性。
1.2.10 超氧阴离子自由基清除率、羟基自由基清除率和总抗氧化能力测定 依据试剂盒说明书测定超氧阴离子清除能力、羟基自由基清除能力、总抗氧化能力(DPPH 法)。
1.3 数据处理
所有实验进行3~6 次重复,数值为平均值±标准偏差,采用OriginPro 9.0 软件进行数据处理与绘图。采用SPSS 24.0 软件检验不同样品间差异显著性,小写字母不同表示在P<0.05 水平上有显著差异。
2 结果与分析
2.1 关键生产工艺对生菜汁微生物的影响
微生物指标是评价果蔬汁安全性的基础指标,食品安全国家标准《饮料》(GB 7101-2015)中微生物限量为:菌落总数≤2 lgCFU/mL、霉菌和酵母菌≤1.30 lgCFU/mL[24]。如图2 所示,未处理组鲜榨生菜汁的初始TAB 和Y&M 分别为4.83±0.05、4.15±0.06 lgCFU/mL,均在国标安全限量以上,存在较高的微生物安全风险。分离工艺对生菜汁的TAB 和Y&M 无显著影响(P>0.05)。漂烫工艺显著降低了生菜汁的TAB(P<0.05),而对Y&M 无显著影响(P>0.05),漂烫对微生物的影响源于高温导致蛋白质变性、代谢酶失活以及DNA 损伤而杀灭微生物[25]。经超高压杀菌工艺后,生菜汁的TAB 和Y&M 显著降低(P<0.05),达到商业无菌状态,该结果归因于超高压力使微生物代谢酶和蛋白质的失活变性及对微生物细胞形态及结构完整性的破坏[5]。

图2 鲜榨生菜汁的菌落总数、酵母和霉菌(n=3)Fig.2 TAB and Y&M of freshly-squeezed lettuce juice (n=3)
2.2 关键生产工艺对生菜汁色泽的影响
色泽直接影响鲜榨生菜汁的商品性和消费者的购买接受度。如图1 和表1 所示,漂烫、分离和杀菌三种工艺均对生菜汁的L*、a*、b*、C*和h值等造成不同程度的影响。分离后的鲜榨清汁L*、a*、b*和C*值均显著升高(P<0.05),清汁更加明亮、绿色变浅、黄色加深和饱和度升高,这主要是由于清汁中的果肉含量少,叶绿素主要存在于果肉中,分离使得显示绿色的叶绿素发生沉降,清汁中的叶绿素含量减少,绿色变浅而黄色加深。漂烫后生菜汁的L*、b*、C*和h值均升高,漂烫使得生菜汁更加明亮、黄色加深、颜色更加饱和且色调更加均匀,但是漂烫后生菜汁的a*值显著下降(P<0.05)。杀菌后生菜汁的a*值升高,表明杀菌使得生菜汁的绿色变浅。漂烫和杀菌使生菜汁的绿色更加浓郁,这可能是由于叶绿体中不同成分在高温高压下的分布变动,或者高温使得叶绿素蛋白复合体中的蛋白变性导致叶绿素与蛋白质分离生成游离叶绿素[26]。

表1 鲜榨生菜汁色泽参数变化Table 1 Changes of color parameters in freshly-squeezed lettuce juice
2.3 关键生产工艺对生菜汁理化指标的影响
TSS 由游离或组合形式的还原糖和非还原糖组成,酸度表示酚酸和有机酸等的含量,糖酸比直接影响生菜汁的口感和风味[27]。生菜汁中叶绿素降解包括酶促褐变和非酶促反应,其中非酶促反应中光、热、氧和pH 均会诱导叶绿素降解[28]。如图3 所示,三种工艺均对生菜汁的TSS 和Acid 影响较为显著(P<0.05),而对pH 的影响变化不大。图3(a)显示分离后鲜榨清汁的TSS 变化不大,漂烫和杀菌后生菜汁的TSS 显著下降(P<0.05),可能是由于漂烫和高压造成植物细胞壁和细胞膜破裂,导致细胞内溶物质释放[29-30]。图3(b)显示分离后鲜榨清汁的Acid 变化较小,漂烫和杀菌后生菜汁的Acid 显著下降(P<0.05),漂烫和杀菌显著影响生菜汁的Acid 含量。图3(c)显示,三种关键工艺对生菜汁pH 影响变化不明显,均在6 左右,表明加工过程对生菜汁的pH 影响较小,这与Helena 等[31]在菲油果汁加工中的研究结果一致。

图3 鲜榨生菜汁TSS、Acid 和pH 变化Fig.3 Changes of TSS,Acid and pH in freshly-squeezed lettuce juice
2.4 关键生产工艺对生菜汁叶绿素含量的影响
与其他果蔬汁相比,生菜汁色泽为绿色是该产品的一大亮点和特色,而叶绿素是影响鲜榨生菜汁颜色变化的主要指标之一[32]。如图4 所示,分离后的清汁叶绿素a、叶绿素b 和总叶绿素含量显著下降(P<0.05),其中鲜榨浊汁的总叶绿素含量从3.26±0.16 mg/100 g 下降到1.42±0.07 mg/100 g,表明分离对生菜汁叶绿素含量影响显著,主要原因是分离使叶绿体沉降,导致叶绿素含量减少。Xu 等[33]研究表明猕猴桃浊汁的叶绿素含量经分离工艺后降低了79.8%,与本研究结果一致。漂烫和杀菌后生菜浊汁的叶绿素a、叶绿素b 和总叶绿素含量均显著升高(P<0.05),漂烫和杀菌后浊汁的总叶绿素含量分别为4.46±0.04 mg/100 g 和4.13±0.10 mg/100 g,分别升高了36.81%和26.69%,这可能是由于高温高压使得细胞结构、细胞器膜等破坏,游离叶绿素溶出增加[34]。Sánchez 等[35]研究发现高压处理使西兰花叶绿素b 含量增加了20%、菠菜叶绿素a 含量增加了15%,与本研究结果一致。
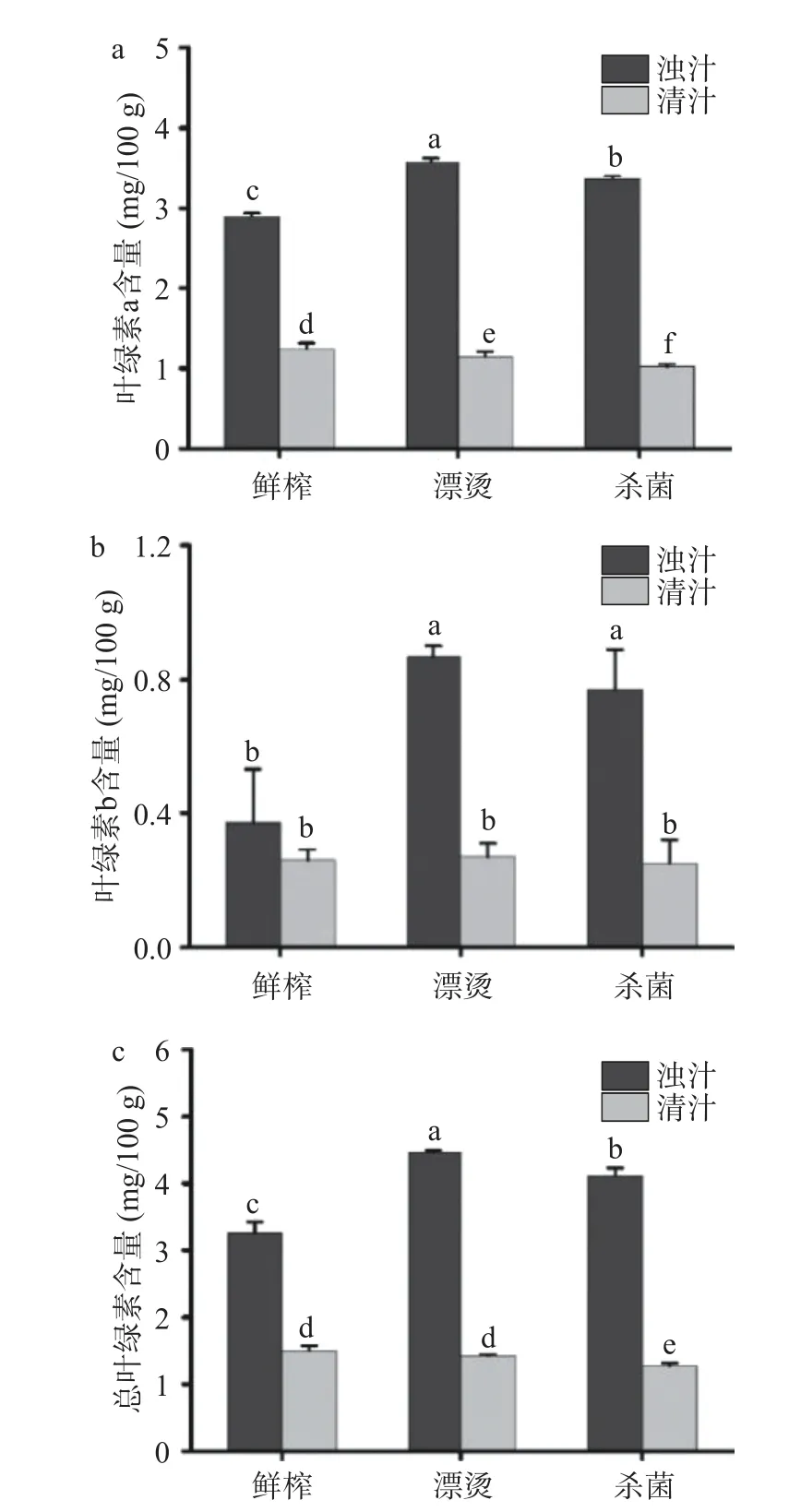
图4 鲜榨生菜汁叶绿素a、叶绿素b 和总叶绿素含量变化Fig.4 Changes of chlorophyll a,chlorophyll b and total chlorophyll content in freshly-squeezed lettuce juice
2.5 关键生产工艺对生菜汁可溶性糖、可溶性蛋白和总酚含量的影响
生菜汁可溶性糖、可溶性蛋白和总酚含量变化如图5 所示。图5(a)显示,分离后鲜榨清汁的可溶性糖无显著变化(P>0.05),清汁可溶性糖的保留率达到98.8%,因此分离对鲜榨生菜汁可溶性糖含量影响不显著。漂烫和杀菌后生菜浊汁的可溶性糖含量显著降低(P<0.05),保留率分别为91.24%和88.3%,可能是漂烫使得可溶性糖溶于漂烫液中以及高温高压使得糖结构发生变化。图5(b)显示,与鲜榨浊汁相比,分离后鲜榨清汁的可溶性蛋白含量显著降低(P<0.05),同时漂烫和杀菌后生菜浊汁的可溶性蛋白含量也显著降低(P<0.05)。漂烫浊汁和杀菌浊汁的可溶性蛋白的保留率分别为64.22%和60.60%,表明漂烫和杀菌显著影响生菜汁的可溶性蛋白含量,可能与高温高压使得可溶性蛋白变性或溶出于漂烫液中有关[36]。

图5 鲜榨生菜汁可溶性糖、可溶性蛋白和总酚含量变化Fig.5 Changes of soluble sugars,soluble proteins and total phenols content in freshly-squeezed lettuce juice
酚类化合物具有还原性、隔离活性氧、抗氧化和调节某些细胞酶活性等能力。图5(c)显示,分离对生菜汁总酚含量无显著影响(P>0.05),漂烫和杀菌后浊汁的总酚含量显著降低(P<0.05)。其中,漂烫使总酚含量从135.61±2.14 µg/mL 降低到63.31±0.78 µg/mL,降低了53.31%,杀菌使总酚含量从135.61±2.14 µg/mL 降低到59.28±1.71 µg/mL,降低了56.28%。先前研究表明,微波漂烫显著降低了芒果、苹果、香蕉和橙子的果皮总酚含量[37]。总酚含量的下降可能是漂烫和杀菌使通过醚、酯和碳-碳键与结构蛋白、纤维素和果胶等大分子结合酚类化合物的结合结构被破坏而释放、多酚类化合物降解转化,影响了酚类化合物的组成[38]。
2.6 关键生产工艺对生菜汁酶活性的影响
酶促褐变是造成生菜汁色泽变化的因素之一,主要由PPO 和POD 在氧气条件下将生菜汁中的酚类物质氧化为活性较强的醌类物质,并进一步发生褐变[39]。CAT 广泛存在于植物体中,用于去除过氧化氢,有利于生菜汁的抗氧化性。关键生产工艺对生菜汁PPO、POD 和CAT 酶活性的影响如图6 所示,分离后鲜榨清汁的PPO 活性无显著变化(P>0.05),表明PPO 主要存在于生菜汁溶液中,而分离后清汁的POD 和CAT 活性分别降低了8.16%和61.32%,表明POD 和CAT 主要存在于悬浮物质和果肉中,分离降低了二者活性。漂烫和杀菌后浊汁的PPO、POD 和CAT 三种酶活性显著降低(P<0.05),漂烫使PPO、POD 和CAT 的失活率分别达到83.76%、84.87%和90.80%,杀菌使PPO、POD 和CAT 的失活率分别为85.83%、99.10%和97.83%。漂烫和杀菌对生菜汁酶活性的作用显著,这是由于高温高压使酶结构改变、活性钝化。先前同样有研究报道漂烫工艺显著降低了甘蔗汁的PPO 和POD 活性[40]。
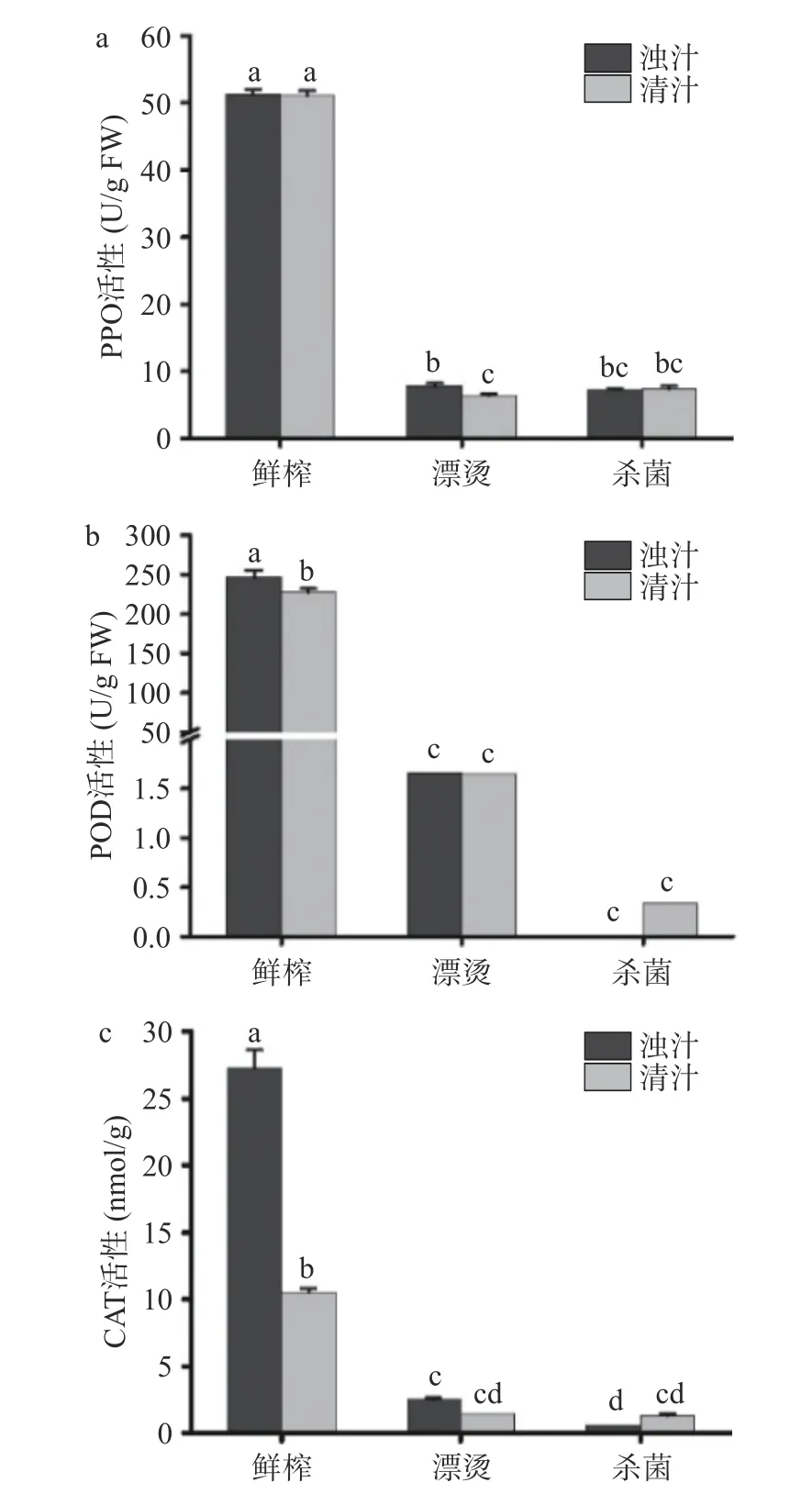
图6 鲜榨生菜汁PPO、POD 和CAT 活性变化Fig.6 Changes of PPO,POD and CAT activities in freshlysqueezed lettuce juice
2.7 关键生产工艺对生菜汁抗氧化能力的影响
关键生产工艺对生菜汁抗氧化能力的影响如图7 所示,分离对生菜汁的羟基自由基清除率无显著影响(P>0.05)。漂烫后浊汁的超氧阴离子清除率略有上升,而羟基自由基清除率显著升高(P<0.05),表明漂烫可以提高生菜汁的羟基自由基清除率。杀菌后浊汁的羟基自由基清除率和超氧阴离子清除率均显著上升(P<0.05)。鲜榨浊汁的抗氧化能力为0.23±0.02 µmol Trolox/mL,分离、漂烫和杀菌后生菜汁的抗氧化能力分别降低了34.78%、82.61%和73.91%,漂烫和杀菌均显著降低了生菜汁的抗氧化能力(P<0.05)。先前研究表明,超高压及高温短时处理均降低了菠萝果汁中的抗氧化能力[41],与本研究结果一致。生菜汁的抗氧化活性降低可能与酚类化合物的损失有关[42]。
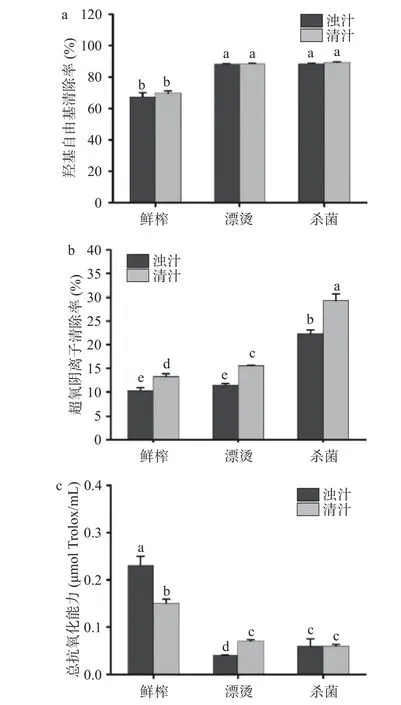
图7 鲜榨生菜汁羟基自由基清除率、超氧阴离子清除率和总抗氧化能力变化Fig.7 Changes of hydroxyl radical scavenging,superoxide anion scavenging and total antioxidant capacity in freshlysqueezed lettuce juice
3 结论
本研究从微生物、色泽参数、理化指标、营养物质等方面探究了漂烫(95 ℃/2 min)、分离(6000×g/10 min)、杀菌(600 MPa,25 ℃/2 min)三个关键生产工艺对鲜榨生菜汁品质的影响。结果表明,分离和漂烫后的生菜汁仍存在微生物安全风险,而经杀菌工艺后鲜榨生菜汁总好氧菌小于2 lgCFU/mL,霉菌和酵母菌小于1.3 lgCFU/mL,达到商业无菌状态。因此,杀菌是鲜榨生菜汁加工的必要环节。分离工艺显著影响生菜汁的色泽参数,鲜榨清汁色泽更加明亮、绿色变浅、饱和度升高,总叶绿素含量下降了56.44%。漂烫工艺对鲜榨生菜汁PPO、POD 和CAT 的失活率分别达到83.76%、84.87%和90.80%,a*值显著降低,绿色更加明亮。因此,漂烫主要通过钝化生菜内源性酶活性,保持生菜汁鲜绿色泽。此外,漂烫和杀菌工艺均显著影响了生菜汁的活性成分和抗氧化能力,总酚含量分别损失了53.31%和56.28%,抗氧化能力分别降低了82.61%和73.91%。本研究可为鲜榨生菜汁规模化加工的质量控制和品质提升提供理论依据,研究结果也可推广应用到其他叶类蔬菜加工。

