银耳多糖对人软骨细胞的增殖效应和抗炎作用
谭敏颖,戴川景,卢学敏,王毅刚,关 磊,程 勇,
(1.浙江理工大学生命科学与医药学院,浙江杭州 310018;2.浙江天草生物科技股份有限公司,浙江湖州 313399)
骨关节炎(Osteoarthritis,OA)是一种出现在关节结构中非常普遍的骨组织慢性[1]和退行性疾病,表现为关节组织的代谢异常,骨关节的磨损、撕裂[2]和滑膜液炎症因子的增加[3]。近年来发现髋关节和膝关节OA 是导致残疾的主要原因,人们普遍认为OA会日益增加人们生活的负担,这会导致医疗系统的压力不断增加。在全球范围内影响约5 亿人口且女性发病率高于男性[4]。它可以导致关节功能障碍、疼痛、僵硬,限制正常的组织功能,严重降低人们的生活质量[5]。关节炎的发生是多种潜在因素共同的作用结果[6],其中人口老龄化[7-8]、肥胖(BMI≥30 kg/m2)[8],或者骨组织异常负荷受损[9]、肌肉无力和关节松弛,频繁下蹲等都可能是骨关节炎发生的重要风险因素。巨噬细胞是维持组织稳态的关键媒介[10],在OA 关节中巨噬细胞受到球蛋白诱导后,会产生许多促炎细胞因子和生长因子,如白介素6(Interleukin-6,IL-6)[3]、单核化学吸引蛋白。促炎细胞因子会上调细胞外合成基质(Extracellular cartilage matrix,ECM)金属蛋白酶和蛋白聚合酶(MMP-3 和MMP-13,以及ADAMTS-4 和ADAMTS-5)来抑制细胞基质合成,从而破坏关节组织[3]。
目前对于骨关节炎的治疗大致可分为药理学、非药理学和手术干预。骨关节炎临床经济学会(European Society for Clinical and Economic Aspects of Osteoporosis,Osteoarthritis and Musculoskeletal Diseases,ESCEO)建议使用低剂量、短期的乙酰氨基酚、药用级氨基葡萄糖和硫酸软骨素用于缓解OA 带来的疼痛[11]。天然化合物硫酸软骨素和葡萄糖胺已经被多个研究证明具有抑制OA 的效果[12-13],并证明它有利于人类关节中蛋白聚糖合成,改善细胞外软骨基质的代谢紊乱[14]。其他常见的药理学手段包括使用非甾体抗炎药(NSAIDs)、扑热息痛(对乙酰氨基酚)[15]等,这些药物在治疗OA 中被频繁使用,并且其作用效果在临床中得到了验证[16]。但是非甾体抗炎药具有强烈的毒性,可导致胃出血,肾脏血流减少等风险[17],而除了非甾体类药物以外,还有内皮质类固醇注射[16]和关节内透明质酸的方式可以帮助患者减轻疼痛[18]。有研究表明,随着注射时间的增加,类固醇的效果会减小,而且可能会对软骨产生有害影响。此外,有研究者使用间充质干细胞在动物模型中治疗OA[19],但目前还没有在临床进行验证和治疗。目前,对于OA 的临床治疗面临着艰巨的挑战。
在这些治疗药物中大部分副作用强,服用后会产生胃出血溃疡等毒副作用。银耳多糖作为一种具有药用价值的食物,副作用小,是一种具有潜力的抗炎药材。银耳是一种真菌,通常被用来入药或者直接食用。其中的有效生物活性成分是银耳多糖,包括甘露糖、葡萄糖、半乳糖、酸性低聚糖和酸性杂多糖等[20]。研究者对银耳多糖的药用价值在不断挖掘,发现银耳多糖具有免疫调节[21]、抗氧化、降血糖、降血脂和抗肿瘤的作用,而且具有低副作用。银耳提取物可以抑制LPS 刺激引起的炎症反应[22]、双环素硫酸钠引起的结肠炎[23]、成纤维细胞损伤[24]等诸多炎症反应,并且可以促进抗炎因子白介素-2(Interleukin-2,IL-2)的增加[25],说明银耳多糖是一种有效的炎症抑制剂。但是对于在关节炎方面,银耳多糖的药用价值仍不明确。
本研究拟通过银耳多糖处理骨关节炎细胞模型—人软骨细胞T/C-28a2 后,检测银耳多糖对T/C-28a2 细胞的增殖效应和细胞毒作用,以及促炎因子IL-6、相关骨保护因子(Osteoprotegerin,OPG)、促凋亡蛋白Bax、细胞外信号调节激酶(Extracellularsignal-regulated kinases,ERK-MAPK)和核内转录因子κB(Nuclear factor-kappaB,NF-κB)的表达,进一步检测活性氧(Reactive oxygen species,ROS)的水平,以探究银耳多糖促进人软骨细胞T/C-28a2 的增殖、抑制骨关节炎的形成、保护软骨组织并抵抗细胞凋亡的作用,为开发银耳多糖作为抗炎药物提供一定的实验依据。
1 材料与方法
1.1 材料与仪器
脂多糖(Lipopolysaccharide,LPS)、活性氧(ROS)检测试剂盒、D-氨基葡萄糖、硫酸软骨素Sigma 公司;氨糖软骨素钙片 汤臣倍健;银耳多糖、硫酸化银耳多糖 分析纯,杭州天草生物公司;IL-6 ELISA 试剂盒 义翘神舟;胎牛血清(FBS)、胰酶消化液(0.25% Tryspin-EDTA(1×))、青-链霉素溶液 Gibco 公司;人软骨细胞T/C-28a2 ATCC、DMEM高糖培养基 Hyclone 公司;鼠抗体、兔抗体 Santa Cruz 公司;β-actin ERK-MAPK CST 公司;OPG NF-κB BAX 华安生物公司;噻唑蓝(MTT)、结晶紫 麦克林公司。
ELx800 多功能酶标分析仪 美国 Biotek 公司;4J1093 倒置荧光显微镜 Nikon 公司;Nu425-400e细胞生物安全柜 Nuair 公司;V6B5R3 流式细胞仪NovoCyte® Advanteon 公司。
1.2 实验方法
1.2.1 细胞培养 将软骨细胞T/C-28a2 培养于DMEM 高糖培养基中,培养基中补充10%的胎牛血清(FBS),以及培养基总体积1%的10000 unites/mL青霉素和10000 μg/mL 的链霉素,细胞在5%的CO2,37 ℃的恒温培养箱中培养。
1.2.2 MTT 法检测不同药物对软骨细胞存活率的影响 细胞以5×103个/孔的密度接种到96 孔板中,12 h 后每孔加入100 μL 浓度为0、1、10、100 μg/mL D-氨基葡萄糖,硫酸软骨素,银耳多糖,硫酸化银耳多糖和氨糖软骨素等的完全培养基并单独设置只加磷酸缓冲液的调零组分别刺激细胞。将处理后的细胞置于37 ℃,5% CO2培养箱里培养。分别在药物刺激1、3、6 d 后检测细胞存活率。采用MTT 测定法,每孔加入20 μL 的浓度为5 mg/mL 的噻唑蓝溶液,置于37 ℃培养箱中孵育4 h,吸尽上清,随后加入150 μL DMSO(分析纯)溶解甲臜结晶,摇床上600 r/min 振荡10 min,在酶标仪中测定OD490的数值。再根据以下公式计算细胞存活率,公式为:
1.2.3 结晶紫染色测定不同药物对软骨细胞增殖的影响 取对数生长期的T/C-28a2 软骨细胞,按1×104个细胞/孔铺于24 孔板中。细胞贴壁后,弃去旧培养基,加入含不同药物的完全培养基刺激细胞:D-氨基葡萄糖、氨糖软骨素钙片、硫酸软骨素、硫酸化银耳多糖和银耳多糖;每种药物设置浓度为1 μg/mL,同时设置仅含细胞不加任何药物的阴性对照组,每个组设3 个复孔。3 d 后去除原细胞培养基,后用PBS 轻柔地洗2 次,每孔加入200 μL 配制好的结晶紫溶液,室温静置15 min。将孔板浸入蒸馏水多次,清洗24 孔板直至水变成无色,再将24 孔板倒置于37 ℃生化培养箱中烘干水分。在光源充足的条件下将24 孔板置于白色卡纸上拍摄结晶紫染色结果照片。后加入33%的乙酸溶液溶解结晶紫,600 r/min 振荡10 min 后,使用酶标仪以490 nm 波长检测。
1.2.4 酶联免疫吸附法测定不同药物处理软骨细胞后的IL-6 表达 为了定量检测细胞因子表达水平,收集不同药物处理的细胞上清,样品制备方法如下:
无LPS 刺激细胞上清样品的制备:取对数生长期的T/C-28a2 软骨细胞,5×106个细胞/孔铺于6 孔板中。将细胞置于37 ℃,5% CO2培养箱里培养过夜。细胞贴壁后,弃去旧培养基,用PBS 清洗细胞2 次,随后分别在孔内加入使用无血清DMEM 稀释的1 μg/mL D-氨基葡萄糖、1 μg/mL 氨糖软骨素、1 μg/mL 硫酸软骨素、1 μg/mL 硫酸化银耳多糖和1 μg/mL 银耳多糖以及正常培养基。48 h 后,收集含不同药物刺激细胞的上清,7000 r/min 离心10 min,收取细胞上清液并将其分装到1.5 mL EP 管中,-20 ℃保存备用。
LPS 刺激细胞上清样品的制备:取对数生长期的T/C-28a2 软骨细胞,5×106个细胞/孔铺于6 孔板中。将细胞置于37 ℃、5% CO2培养箱中培养过夜,待细胞贴壁后,弃去旧培养基,用PBS 清洗细胞2 次,随后加入不含血清的DMEM 高糖培养基,饥饿培养24 h。除尽无血清培养基,用PBS 清洗2 次,分别在孔内加入使用无血清DMEM 稀释的1 μg/mL的LPS,培养24 h。除去含有LPS 的培养基,分别在孔内加入使用无血清DMEM 稀释的1 μg/mL 的D-氨基葡萄糖、氨糖软骨素、硫酸软骨素、硫酸化银耳多糖和银耳多糖及正常培养基,培养48 h。收集含不同药物刺激细胞的上清,7000 r/min 离心10 min,收取细胞上清液并将其分装到1.5 mL EP 管中,-20 ℃保存备用。
将收集的细胞上清稀释10 倍并储存于-80 ℃,使用ELISA 试剂盒测定IL-6(pg/mL)的浓度。具体为:将100 μL 一抗加入96 孔板,4 ℃孵育过夜,第二天使用pH7.5 的1×磷酸缓冲溶液冲洗3 次,每孔加入封闭液350 μL,室温孵育 120 min。孵育结束后进行洗板,分别将 100 μL 样品加入到相应的反应孔中,用封板膜封住反应孔并室温孵育120 min。洗板后每孔加入250 μL 二抗孵育90 min,用磷酸缓冲溶液冲洗3 次,每孔加入 150 μL 显色液。室温下避光孵育 27 min,使用酶标仪测定450 nm 波长的吸光度,绘制标准曲线并得到回归方程为Y=0.0108X+0.0792,(R2=0.9989),式中:Y 为样品在450 nm 波长吸光值;X 为样品IL-6 浓度(pg/mL)。
1.2.5 Western blot 检测不同药物处理后骨关节炎相关蛋白的表达 取对数生长期的人软骨细胞T/C-28a2,以5×106个细胞/孔铺于6 孔板中。置于37 ℃、5% CO2培养箱里培养过夜。细胞贴壁后,将培养基换成含有1 μg/mL 的D-氨基葡萄糖、氨糖软骨素、硫酸软骨素、硫酸化银耳多糖和银耳多糖的完全培养基以及无药物的完全培养基,培养48 h。弃去培养基,每孔加入150 μL 蛋白质裂解缓冲液(1×,静置3 min),用枪头顺时针搅动提取蛋白,收到的蛋白样品100 ℃金属浴10 min 使蛋白变性。配10%的分离胶,每孔15 μL 上样跑SDS-PAGE 电泳。将电泳凝胶转印至0.45 μm PVDF 膜,350 mA 2 h。5%脱脂奶粉室温封闭2 h,洗脱后孵育一抗4 ℃过夜,洗脱后孵育二抗2 h,清洗之后滴加ECL 显影液与化学发光成像仪曝光显影,使用Image J 对蛋白条带进行定量分析。
1.2.6 流式细胞术检测不同药物对ROS 释放的影响取对数生长期的T/C-28a2 软骨细胞,按3×106个细胞/孔铺于12 孔板中。将细胞置于37 ℃,5% CO2培养箱里培养过夜。去除细胞上清,用冰PBS 冲洗细胞2 次,按照活性氧(ROS)检测试剂盒说明,将试剂盒中Master Reaction Mix 以每孔450 μL 加入12孔板中,放置于5% CO2,37 ℃ 恒温培养箱中孵育1 h,每孔加入50 μL 含有DMEM 无血清培养基稀释的药物,使其终浓度为1 μg/mL。设空白对照加入对应量PBS 处理,5% CO2,37 ℃ 孵育2 h。最后收集细胞进行流式检测。
1.3 数据处理
每组试验重复3~5 次,采用Graphpad Prism 9软件绘图,数据以平均值±标准偏差(Mean±SD)表示,并进行单因素方差分析(One-way ANOVA),使用Waller-duncan(W)进行多重比较分析。P>0.05表示无显著性差异,P<0.05 表示差异有统计学意义,P<0.01 表示有显著性差异,P<0.001 表示极显著性差异。
2 结果与分析
2.1 银耳多糖促进人软骨细胞T/C-28a2 的增殖活性
分别用完全培养基稀释的0(对照组)、1、10、100 μg/mL D-氨基葡萄糖、氨糖软骨素、硫酸软骨素、硫酸化银耳多糖和银耳多糖刺激T/C-28a2 细胞,以及在孔板中只加入磷酸缓冲溶液(调零组),分别在第1、3、6 d 通过MTT 的方式检测药物对细胞增殖的影响。结果如图1 所示,加入上述5 种药物后,硫酸化银耳多糖对T/C-28a2 细胞有一定的细胞毒性作用,当药物浓度1 μg/mL 时银耳多糖能刺激T/C-28a2 细胞增殖。在处理3 d 后,银耳多糖和硫酸软骨素对T/C-28a2 细胞的增殖作用更加明显。药物浓度1 μg/mL 与10、100 μg/mL 相比,能明显促进细胞增殖,因此确定1 μg/mL 为实验浓度中相对合适作为进一步研究的浓度。
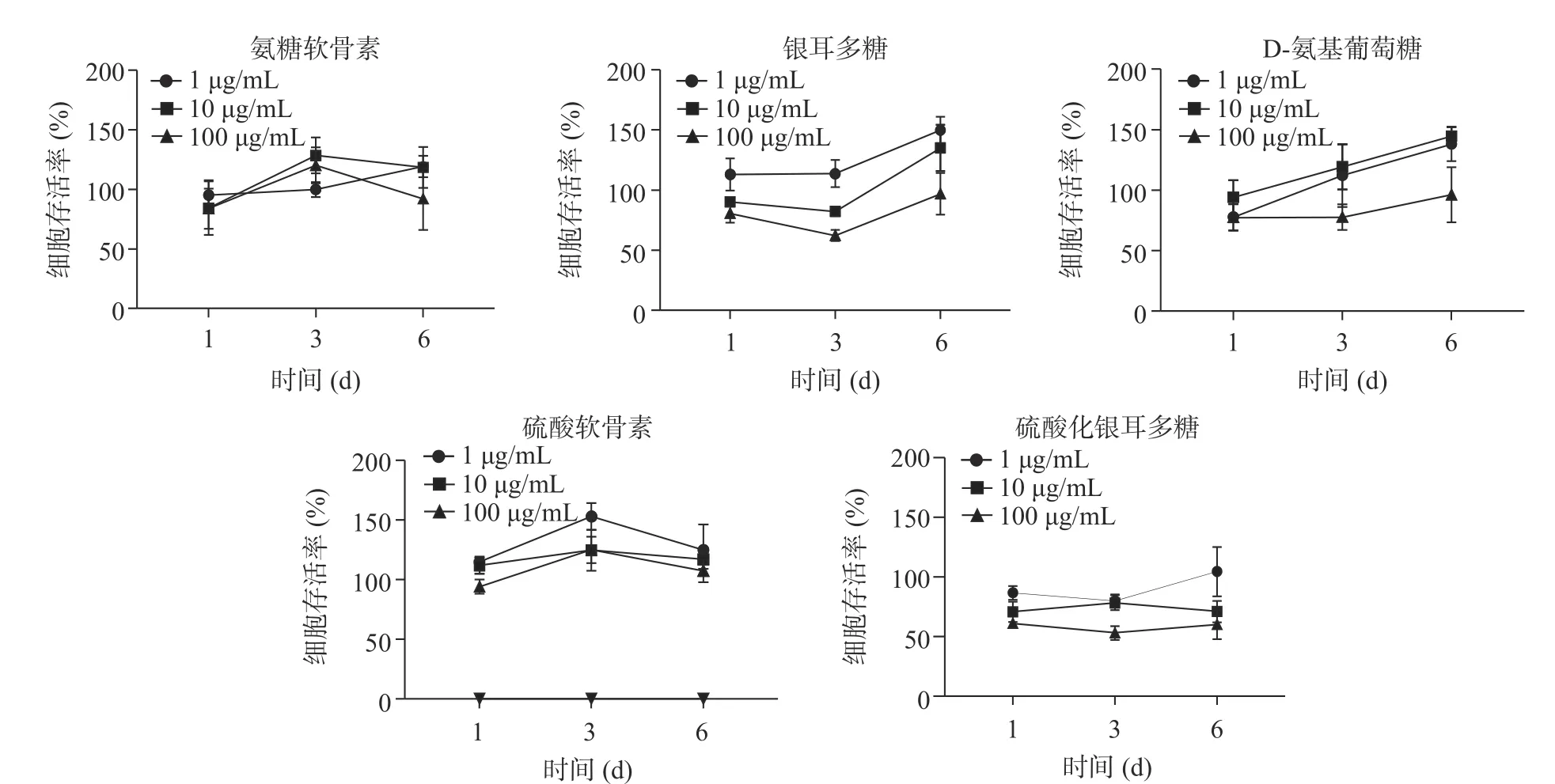
图1 不同药物在不同浓度作用下对人软骨细胞T/C-28a2 的增殖活性Fig.1 Effect of different drugs at different concentrations on human chondrocyte T/C-28a2 cell viability
2.2 银耳多糖对人软骨细胞T/C-28a2 的细胞毒性效应
由于硫酸软骨素对软骨细胞T/C-28a2 的增殖作用有助于修复软骨损伤。本实验通过结晶紫染色进一步探究1 μg/mL D-氨基葡萄糖、氨糖软骨素、硫酸软骨素、硫酸化银耳多糖和银耳多糖对软骨细胞的增殖作用,结果表明1 μg/mL 银耳多糖、D-氨基葡萄糖、硫酸软骨素、氨糖软骨素均能刺激软骨细胞T/C-28a2 的增殖(图2)。其中,硫酸软骨素(P<0.001)与银耳多糖(P<0.05)处理人软骨细胞,细胞增殖差异性更显著。

图2 银耳多糖对人软骨细胞T/C-28a2 的毒性效应Fig.2 Toxic effects of Tremella fuciformis polysaccharide on T/C-28a2 in human chondrocytes
2.3 银耳多糖抑制骨关节炎的炎症水平
据报道,硫酸软骨素(软骨素4,6-硫酸盐)已经用于治疗人骨关节炎(OA),并取得了较好的治疗效果[26-27]。研究显示,在没有加入脂多糖的情况下,所有药物的加入均使IL-6 表达水平与对照组相比差异不显著(P>0.05)(图3a),在LPS 处理组中,硫酸化银耳多糖(P<0.01)、氨糖软骨素(P<0.001)与硫酸软骨素处理组之间作用有显著性或极显著差异,银耳多糖和氨糖软骨素处理组之间有显著性差异(P<0.01)(图3b),这表明硫酸软骨素的抑制炎症的效果要高于以上几种药物。此外,银耳多糖和硫酸软骨素处理组之间IL-6 的表达没有统计学差异,说明银耳多糖和硫酸软骨素药效相近,而且银耳多糖相对于其他药物处理方式对于防止炎症反应的发生更有效,这与已有文献综述植源性多糖可以缓解炎症的发生[28]的结果一致。

图3 银耳多糖对炎症标志物IL-6 含量的影响Fig.3 Effect of Tremella fuciformis polysaccharide on the content of inflammatory marker IL-6
2.4 银耳多糖促进骨保护和抑制骨关节炎的机制分析
为进一步研究药物在分子水平上的作用机制、对骨组织的保护作用和药物刺激对细胞凋亡的影响,利用Western blot 技术检验了相关蛋白的表达水平(图4)。结果显示,银耳多糖和硫酸软骨素处理能增加骨保护因子OPG 的表达,表明银耳多糖和硫酸软骨素具有骨组织保护作用。进一步检测了NF-κB 和凋亡信号Bax 蛋白的表达量,发现使用银耳多糖和硫酸软骨素处理后它们的表达量相对对照组减少,这说明OA 发生发展中NF-κB 信号被抑制,且这两种药物可以有效的抑制细胞凋亡。

图4 银耳多糖对OA 相关蛋白表达的影响Fig.4 Effect of Tremella fuciformis polysaccharide on expression of OA-related proteins
2.5 银耳多糖抑制软骨细胞ROS 活性氧水平
为检测银耳多糖对软骨细胞的氧化损伤和药物安全性,进行了活性氧(ROS)释放实验[29]。结果表明,与无药物处理的对照组相比,药物处理组细胞的ROS 相对释放量更少,特别是银耳多糖(P<0.01)和硫酸软骨素(P<0.001)处理组(图5),这说明银耳多糖和硫酸软骨素可以阻碍大量ROS 产生,这可能进一步阻碍炎症的发展。

图5 银耳多糖处理人软骨细胞后ROS 的释放Fig.5 ROS release from human chondrocytes treated with Tremella fuciformis polysaccharide
3 讨论与结论
目前,骨组织在早期骨关节炎中的变化原因尚不完全清楚,当软骨细胞被内源或外源性的因素刺激时,通常会表现为软骨细胞的凋亡[30-31]、细胞内炎症因子的变化[32]和ECM 降解[33]等。本研究使用银耳多糖刺激软骨细胞发现,银耳多糖促进了软骨细胞的增殖,表现出了对软骨细胞活力的促进作用。此外,研究发现骨关节炎软骨细胞的凋亡与细胞凋亡因子Bax 上调有关[31],与本研究发现银耳多糖刺激软骨细胞Bax 表达下调一致,这表现出了银耳多糖的抗凋亡效应。更进一步地,ERK1/2-MAPK 和JNK 途径的激活会使细胞外基质(Extracellular cartilage matrix,ECM)的蛋白酶表达上调[31,34],骨微裂会刺激损伤区域的骨细胞产生NF-κB 信号[35]。当NF-κB 上调时,软骨细胞会无法补偿降解的ECM,导致细胞基质平衡障碍[36],细胞炎症和骨组织结构退化[31,37],从而促进炎症的发生。此外,当受体骨保护素OPG 失活时会导致骨吸收的发生[38-39]。本研究发现骨银耳多糖处理软骨细胞后,保护因子OPG 表达上调,而NF-κB、ERK1/2-MAPK 表达下调,因此推测银耳多糖对软骨细胞具有保护作用,并对骨关节炎具有抑制作用。
先前研究发现,退化软骨组织或软骨损伤环境中IL-6 水平增高,在IL-6/Stat3 模型中,IL-6 主要通过Stat3 信号诱导软骨细胞分解代谢和软骨细胞凋亡[40]。本实验通过在软骨细胞中加入LPS 模拟炎症环境,对比了炎症产生前后加入药物后促炎因子IL-6的变化,发现在非炎症环境下药物刺激软骨细胞产生的IL-6 水平没有显著性差异,而加入LPS 诱导后,硫酸软骨素和银耳多糖组与对照组相比IL-6 产生水平显著降低。这表明在没有发生炎症反应时,药物对细胞的作用相差不明显,当炎症发生时,银耳多糖可以通过下调炎症因子表达来发挥抗炎作用,因此推测银耳多糖具有良好的抗炎活性,有效减缓骨关节炎的炎症反应。
在OA 治疗中,银耳多糖对软骨再生和清除自由基具有重要意义。高水平的ROS 可能会阻碍炎症中骨软骨组织的自然再生过程[33]。此外,活性氧(ROS)水平可能导致广泛的氧化应激反应,高水平的ROS 可以导致细胞损伤[41]。本研究通过检测不同药物刺激下活性氧的变化,发现银耳多糖的ROS释放量显著降低(P<0.05),说明银耳多糖对软骨细胞清除自由基具有影响,具有高抗氧化性和低细胞损伤的效用,并可能进一步抑制炎症的发生。
综上,本研究探讨了银耳多糖对骨关节炎的潜在影响,发现银耳多糖具有抑制骨关节炎的效用,可以通过降低IL-6 产生的水平减少骨关节炎症反应,OPG 的增加表明银耳多糖可以在一定程度上保护软骨组织,抵抗细胞凋亡。本研究发现银耳多糖的抗炎作用及机制,为探索银耳多糖作为抗炎药物和OA治疗提供了新的思路。

