冻融循环对食用菌预制菌汤品质的影响
卢 琪,杨 德,薛淑静
(湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064)
预制菜以农产品为主要原料,经标准化加工、包装而成,简化了菜品制作流程,用餐方便快捷、营养卫生[1-2]。近年,受疫情防控的影响及冷链技术水平的逐步完善,预制食品在居家消费的推动下走俏市场[3]。据统计,2021 年我国预制菜市场规模超3000亿,预计到2025 年,预制菜市场规模将会达8000 亿元[4]。具有地方特色的预制菜工业化加工技术将成为该行业的核心竞争力。
食用菌风味独特、营养丰富,富含蛋白质、氨基酸、膳食纤维、维生素、矿物质、多糖、甾醇等营养成分,具有抗炎、抗肿瘤、抗氧化等功效[5-7]。此外,食用菌经加工、冷冻、复热后还能大幅度保持原有口感,是预制食品的优质原料[8-10]。“宁可食无肉,不可食无汤”,菌菇汤因其特有的营养、风味和口感,深受消费者欢迎。世界卫生组织也将菌菇汤列为六大保健饮品[11-12]。因此菌汤类食品的开发可进一步促进食用菌的精深加工,丰富预制菜品,满足市场需求。
低温冻藏是保障菌汤类预制食品品质的主要贮藏和流通方式。但是,在冷链转运或消费终端,冷冻菌汤在食用前可能出现反复冻融的情况。相关研究表明,冻融循环会造成肉制品、水产品和果蔬制品的色泽变化、风味衰减、品质劣变等不良后果。然而,冻融循环如何影响预制菌汤的品质尚未报道,冻融次数对菌汤品质影响的差异有待进一步对比[13-14]。因此,针对食用菌预制菌汤在消费终端可能出现的冻融情况,本研究以菌汤色泽、成分和风味为目标,评价冻融次数对预制菌汤的品质影响,为食用菌预制菌汤的终端消费提供食用参考。
1 材料与方法
1.1 材料与仪器
羊肚菌、鸡油菌、蛹虫草、雪山松茸、姬松茸、鹿茸菇 2022 年购于湖北伏龙山食品开发有限公司;DNS 试剂、游离氨基酸和核苷酸 北京索莱宝科技有限公司;考马斯亮蓝G250、Folin-Ciocalteu 试剂 源叶生物科技有限公司;微生物检测纸片 广东达元绿洲食品安全科技股份有限公司。
Multiskan GO 酶标仪 美国Thermo Fisher 公司;LC-20AT 液相色谱系统 日本Shimadzu 公司;PEN3 电子鼻 德国Airsense 公司;7890A-5975C 气质联用设备 美国Agilent 公司;CR-400 色差仪日本Minolta Camera 公司;WQC50A5 电高压锅美的公司。
1.2 实验方法
1.2.1 预制菌汤的制作 选取云南昭通市的六珍菌汤包为实验原料,根据菌汤包各种菌菇的商业配比,结合菌汤感官评价,最终确定预制菌汤的制作方案:羊肚菌1.6 g、鸡油菌12 g、蛹虫草12 g、雪山松茸12 g、姬松茸4.0 g、鹿茸菇16 g,混合,清洗后泡发1 h,沥干后加水2 L(盐0.4%)。用电高压锅1000 W处理30 min 后,开盖,漏勺过滤,终体积为1.99 L,铝箔分装(450 mL/袋),-18 ℃冻藏,备用。
1.2.2 菌汤冻融处理 -18 ℃冷冻状态菌汤置于4 ℃下解冻24 h,即为一次冻融样品,将解冻后的菌汤继续置于-18 ℃冷冻,重复上述操作,即为二次冻融,依此类推,共进行五次冻融处理。
1.2.3 菌汤基本指标分析 微生物计数分析:采用大肠菌群测试片和菌落总数测试片进行大肠杆菌和总菌落数的计数分析。取1 mL 菌汤,稀释,涂布于测试片,37 ℃培养24 h,计数。
菌汤色度分析:将100 mL 菌汤置于样品池中,经白板校准后,对菌汤进行L、a、b读数、测量[15]。
菌汤可溶性蛋白含量分析:采用考马斯亮蓝法检测菌汤可溶性蛋白含量,结果以每升菌汤中牛血清蛋白(BSA)当量计(g BSA/L)[16]。
菌汤还原糖含量分析:采用DNS 法检测菌汤还原糖含量,结果以每升菌汤中葡萄糖(Glu)当量计(g Glu/L)。
菌汤总酚含量分析:采用Folin-Ciocalteu 方法检测菌汤中的总酚含量(TPC),结果以每升菌汤中没食子酸(GAE)当量计(g GAE/L)[17]。
1.2.4 菌汤5'-核苷酸含量分析 采用HPLC 检测菌汤中5'-核苷酸含量。菌汤5000 r/min 离心10 min后,过0.22 μm 有机滤膜,进行HPLC 分析。参数设置为:流动相为A,20 mmol/L 磷酸盐缓冲液(pH5.9);流动相B,100%甲醇;两者以97:3 比例混合,等度洗脱。流速0.4 mL/min,进样量10 µL,在254 nm处检测。采用外标法定量分析,结果折算为每升菌汤中5'-核苷酸含量(mg/L)[18]。
1.2.5 菌汤氨基酸含量分析 采用HPLC 检测菌汤中衍生化的游离氨基酸含量。取样品或游离氨基酸标准品200 μL,分别加入三乙胺溶液100 μL 和异硫氰酸苯酯溶液100 μL,放置1 h,加入400 μL 正己烷,振荡,静置。取下相过滤后HPLC 进样,采用Sepax AAA(4.6 mm×250 mm,5 μm)氨基酸专用柱分析;流动相A:0.1 mol/L 醋酸钠(pH6.5):乙腈=93:7,流动相B:80%乙腈水溶液。梯度洗脱:0 min:100% A,15 min:85% A,18 min:76% A,25 min:60% A,30 min:60% A,30.1 min:0% A,35 min:0%A;流速:1.0 mL/min;254 nm 处检测;柱温:40 ℃;进样量:5 μL。采用外标法定量分析,结果折算为每100 毫升菌汤中游离氨基酸含量(mg/100 mL)[19]。
1.2.6 菌汤等鲜度计算 菌汤等鲜度(EUC),由鲜味氨基酸与5'-核苷酸之间的相互作用计算而得,结果表示为每100 g 菌汤中谷氨酸钠当量(g MSG/100 g)[20]:
式中:ai,鲜味氨基酸Glu 或Asp 的浓度(g/100 g);aj,5'-GMP,5'-AMP,5'-IMP 或5'-XMP 的浓 度(g/100 g);bi,鲜味氨基酸的相对鲜味浓度(Asp,0.077;Glu,1);bj,5’-核苷酸的相对鲜味浓度(5'-IMP,1;5'-GMP,2.3;5'-AMP,0.18;5'-XMP,0.61)。
1.2.7 菌汤挥发性成分分析 采用GC-MS 对菌汤挥发性成分进行分析,10 mL 菌汤置于40 mL 的顶空瓶中,40 ℃条件下水浴10 min,插入DVB/CAR/PDMS 50/30 μm 萃取头,顶空吸附35 min 后,插入GC 进样口,250 ℃下解吸5 min[21]。程序升温和质谱条件参考之前的研究[22]。列出与质谱数据库(Wiley 7.0 和NIST 05)匹配度大于80%的成分,各挥发性成分高低用其峰面积横向对比[23]。
1.3 数据处理
本文所涉及的实验均重复3 次,取平均值。IBM SPSS Statistics 20.0 用于样本数据差异性分析,XLSTAT 2014 用于主成分分析。
2 结果与分析
2.1 冻融循环对菌汤基本指标的影响
冻融循环过程中菌汤中微生物增殖、色泽变化、可溶性蛋白含量、还原糖含量及总酚含量等基本指标的变化如表1 所示。预制食品属新兴产业,预制菌汤类食品中大肠杆菌和总菌落数尚无标准限定。本研究中,菌汤反复冻融5 次过程中大肠杆菌均无检出,说明反复冻融不会引起菌汤大肠杆菌的增殖。细菌菌落总数在反复冻融3 次时,菌落总数微弱增加(3 CFU/mL),而冻融第5 次时菌落总数则高达22 CFU/mL,推测冻融循环过程中,菌汤温度波动,休眠状态的细菌得以繁殖,通过前4 次冻融,菌汤中细菌数量形成了一定的基数,到5 次冻融时菌汤中细菌数量飞速增长。

表1 冻融循环过程中菌汤的基本指标对比Table 1 Comparison of basic indicators of mushroom soup during repeated freezing-thawing cycle
L值代表样品的亮度,随着冻融次数的增加,菌汤L值逐渐增加,可能与冷冻澄清有关。a值代表样品的红绿色,菌汤a值在1 次冻融后显著增加(P<0.05),在随后菌汤反复冻融过程中(3~5 次)中,a值进一步增加,说明冻融循环增加了菌汤的红褐色。b值代表样品的黄蓝色,菌汤b值在首次冻融后显著升高(P<0.05),随后随着冻融次数的增加呈现逐渐减少的趋势,但至冻融终点时菌汤b值仍显著高于(P<0.05)鲜汤。总而言之,冻融能够增加菌汤亮度,同时也加深了菌汤色泽,可能归因于菌汤冷冻过程的氧化和羰基化合物的累积而造成菌汤褐变[24]。
菌汤中可溶性蛋白是菌菇中游离出来的能溶解于汤汁中的小分子蛋白,食用菌中蛋白质和氨基酸含量丰富,前2 次冻融,菌汤中可溶性蛋白含量没有显著变化,随后的冻融引起可溶性蛋白含量的显著降低(P<0.05)。首次冻融,显著降低(P<0.05)了菌汤还原糖和总酚含量,在此后的冻融过程中还原糖有微量增加,而总酚含量却无显著变化(P>0.05),说明酚类成分在菌汤2~5 次冻融循环过程中稳定存在。
2.2 冻融循环对菌汤5'-核苷酸含量的影响
菌汤中检测出5 种核苷酸,分别为5'-CMP、5'-XMP、5'-UMP、5'-GMP 和5'-AMP,对应标品和菌汤样品的液相图如图1 所示,菌汤冻融循环过程中各核苷酸的含量如表2 所示。5'-AMP 是菌汤中的主要核苷酸,约占核苷酸总含量的70%以上,此类成分与菌汤鲜甜的口感密不可分[25]。首次冻融造成此类成分的显著降低(P<0.05),在此后反复冻融过程中5'-AMP 的含量微弱波动,冻融循环5 次5'-AMP 含量较冻融1 次仅略有减少,说明首次冻融是降低此类成分的主要因素。另外两种增鲜核苷酸5'-XMP 与5'-GMP 含量在冻融循环过程中出现下降的趋势。菌汤中5'-CMP 与5'-UMP 的含量则在冻融2 次时达到最高,随后逐渐降低。菌汤中的核苷酸来源于核酸类成分的降解、游离,在冷冻和解冻过程中,核酸类成分的动态水解和降解决定了其中核苷酸含量的变化。据前人报道,猪肉在冷冻过程中5-脱氧-5-甲硫腺苷和烟酰胺的含量出现增加的情况,而烟酰胺腺嘌呤二核苷酸、次黄嘌呤、芥酰胺等核苷酸成分呈现降低的趋势[26],可能归因于不同核苷酸在食品冷冻中的游离程度和降解速率不同。本研究中总5'-核苷酸在鲜汤中含量最高,得益于其中高含量的5'-AMP 成分。总5'-核苷酸在2 次冻融菌汤中含量次之,得益于5'-CMP 与5'-UMP 的累积,此后随着冻融循环次数的增加,菌汤中总5'-核苷酸含量逐渐降低,冻融次数大于2 次将会造成总核苷酸类成分的减少。菌汤中鲜味核苷酸的含量随着冻融次数的增加逐渐降低。

图1 5'-核苷酸的标准品及菌汤样品的液相色谱图Fig.1 HPLC chromatogram of 5'-nucleotide standard and mushroom soup

表2 冻融循环过程中菌汤5'-核苷酸含量对比(mg/L)Table 2 Comparison of 5'-nucleotide content in mushroom soup during freezing-thawing cycle (mg/L)
2.3 冻融循环对菌汤氨基酸含量的影响
食品中常见的18 种氨基酸的标准品和菌汤样品的液相色谱图如图2 所示。菌汤中共检测出16 种氨基酸,其中半胱氨酸和精氨酸在菌汤中尚未检出。菌汤中各氨基酸的含量如表3 所示,色氨酸含量最高,占总氨基酸含量的11.78%。其次是亮氨酸(8.79%)和丙氨酸(8.38%),其中丙氨酸属于甜味氨基酸,对于菌汤口感具有一定的调和作用[27-28]。色氨酸在冻融循环过程中无显著变化(P>0.05),丙氨酸含量在2 次冻融时略高于首次冻融,此后逐渐降低。

图2 氨基酸标准品及菌汤样品的液相色谱图Fig.2 HPLC chromatogram of amino acid standard and mushroom soup
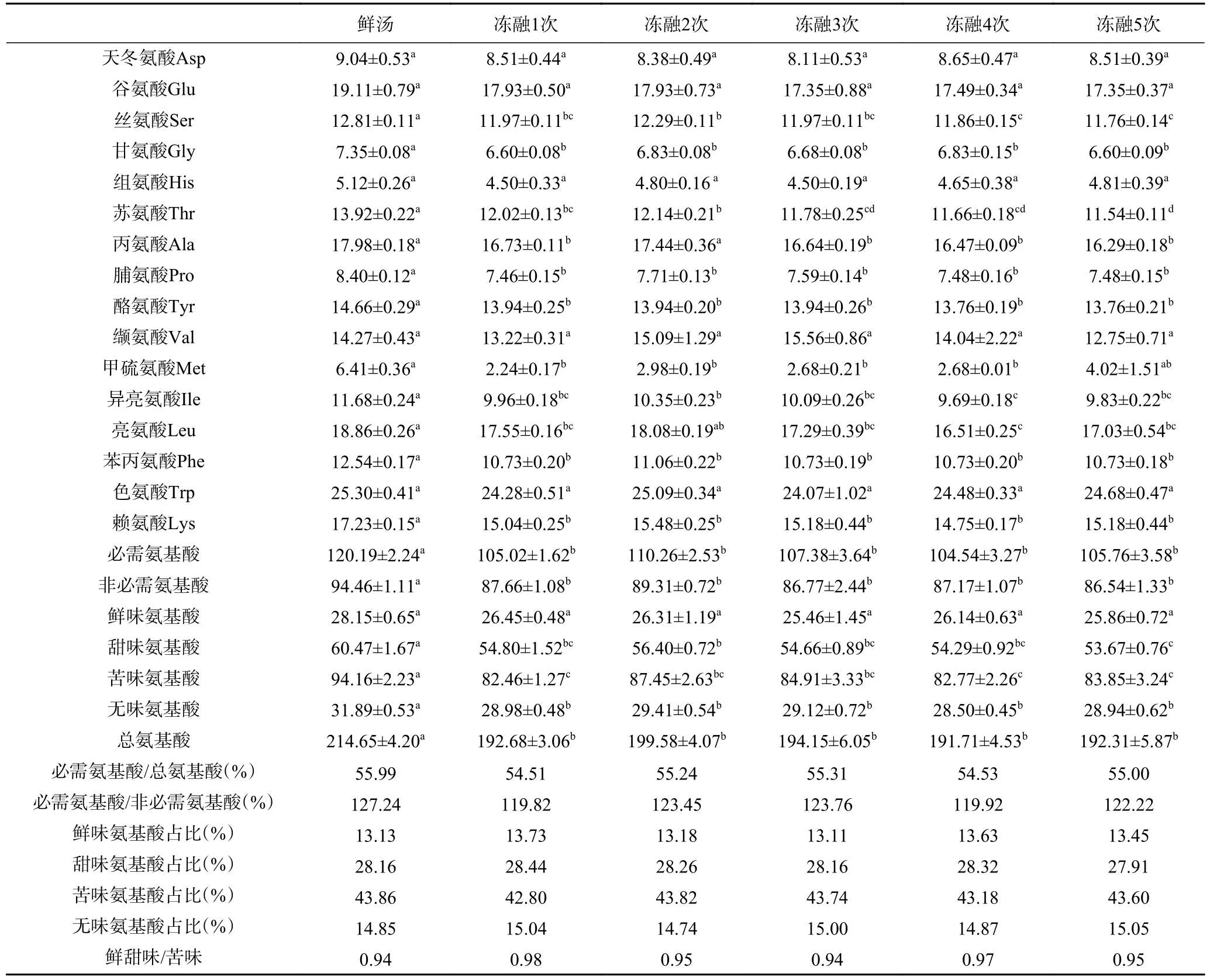
表3 冻融循环过程中菌汤氨基酸含量对比(mg/100 mL)Table 3 Comparison of the amino acid content in mushroom soup during freezing-thawing cycle (mg/100 mL)
各样品处理之间,必需氨基酸含量/总氨基酸(54.51%~55.99%)差异不大。必需氨基酸含量/非必需氨基酸含量值(119.82%~127.24%),冻融后必需氨基酸含量/非必需氨基酸含量值均存在不同程度的下降。据报道,理想的蛋白模式为必需氨基酸含量/氨基酸总量值为40%左右,必需氨基酸含量/非必需氨基酸含量值在60%以上[29],由表3 可知,各菌汤的氨基酸组成均能接近理想模式。鲜汤中总氨基酸含量最高,首次冻融后菌汤中氨基酸含量显著减少(P<0.05),但不同冻融次数之间的总氨基酸含量无显著差异(P>0.05)。冻融处理虽然降低了鲜味氨基酸、甜味氨基酸、苦味氨基酸、无味氨基酸等各类氨基酸的绝对含量,但多数冻融条件下降低了苦味氨基酸的相对含量,提升了鲜味和甜味氨基酸的相对含量,最终导致冻融菌汤中鲜甜味氨基酸含量/苦味氨基酸含量(0.94%~0.98%)大于或等于鲜汤(0.94%)。
2.4 冻融循环对菌汤等鲜度的影响
菌汤等鲜度取决于其中鲜味氨基酸(Glu 或Asp)与5'-核苷酸(5'-IMP、5'-GMP、5'-AMP、5'-XMP)成分含量,结果用100 g 样品中的谷氨酸钠(g MSG)当量表示[30-31]。鲜汤与冻融菌汤的等鲜度如图3 所示。鲜汤经冻融后等鲜度显著降低(P<0.05),且等鲜度随着冻融次数的增加逐渐减少,但冻融次数(1~5 次)对菌汤等鲜度的影响不明显。然而,反复冻融过程中等鲜度的最大降幅出现在第3 次,由1~2 次冻融的(0.441~0.450 g MSG/100 g)直接下降至0.407 g MSG/100 g,此后等鲜度降幅缓慢。由此,推测菌汤的冻融次数应控制在2 次内为宜。
2.5 冻融循环对菌汤挥发性成分的影响
通过GC-MS 分析,冻融菌汤挥发性成分相对含量如表4 所示。菌汤中共检测到48 种挥发性成分,对应挥发性风味峰面积为9.56×108~1.96×109,包括4 种胺类、8 种烃类、14 种醇类、8 种醛酮类、5 种醚类、4 种杂环化合物、3 种酯类、1 种羧酸类和1 种酚类物质(表4),由此可见菌汤中醇类物质最丰富。冻融后菌汤挥发性成分含量急剧下降,并伴随着冻融次数呈现逐渐降低的趋势,说明冻融直接减少了菌汤的挥发性成分。鲜汤中检测到挥发性成分30 种,冻融循环1~5 次菌汤中挥发性成分分别为20、22、24、24 和20 种,冻融处理减少了菌汤中挥发性成分个数。正己醇、1-辛烯-3-醇、八乙二醇、异戊醛、正己醛、苯甲醛、15-冠醚是菌汤中的主要挥发性成分,它们在各处理的菌汤中稳定存在,并且占总挥发性成分峰面积的55.93%~83.26%。
菌汤中挥发性成分主要源自:菌菇中原有风味的释放,如生长过程中合成的醇类、酯类、醛类等小分子成分;风味前体物质如氨基酸、核酸的热降解;氨基酸与还原糖发生美拉德反应生成的杂环类挥发性成分[32]。食用菌在加工过程中通过内源酶和过氧化物催化脂肪酸裂解生成小分子的醇、醛类成分,其中1-辛烯-3 醇是主要降解产物[25]。1-辛烯-3 醇在首次冻融时含量大幅下降,随后随着冻融次数的增加呈波动性上升的趋势,最终冻融5 次菌汤中1-辛烯-3 醇含量高于鲜汤,可能归因于前1~2 次的冻融处理造成了此类成分的减少,但随着冻融次数增加,逐渐加剧了菌汤内源酶和过氧化物对其中脂肪酸的降解,导致脂肪酸主要降解产物1-辛烯-3 醇的累积。同样,菌汤中主要成分正己醇、异戊醛、正己醛、苯甲醛、15-冠醚在菌汤冻融过程中也呈现出类似1-辛烯-3 醇的变化趋势。其它含量较低的挥发性成分,如六苷醇、五甘醇、3-糠醛、糠醛、12-冠醚等成分仅在部分处理样品中检测到,可能与脂肪裂解产物的聚合反应有关[33],具体原因有待进一步研究。
胺类和烃类成分在鲜汤中最为丰富,冻融处理后此类成分大幅挥发或降解,而酯类成分仅在冻融菌汤中检测到。蛋白质水解、糖酵解、脂肪氧化内源酶作用能够促进酯类成分形成[33]。此外,有机酸和醇类成分的缩合也是酯类化合物形成的重要途径,冻融循环过程中的温度波动和放置过程,可能为酯类的形成提供了条件。2,4-二叔丁基酚是一种天然化学成分,具有抗氧化活性、抗炎活性、抑菌特性等[34]。相较于鲜汤,此种成分在冻融过程中逐渐衰减,在5 次冻融的菌汤中无已法检测到。
冻融循环过程中菌汤的挥发性成分的主成分分析如图4 所示。本研究以冻融次数及挥发性成分为原始变量进行主成分分析,得到2 个独立的主成分,F1=47.43%,F2=21.92%,两组主成分的累计贡献率高达69.35%,可以绝大部分地反映原变量信息。由图4(a),挥发性成分吡啶、2-乙基己醇、2,4-二叔丁基酚、乙醇、环丁醇、邻二甲苯、18-冠醚、1,3-二叔丁基苯、2-庚酮、辛醇、草酰胺、仲丁胺、N-己基甲胺、异戊醇、甲苯、6-甲基-3-庚醇、4,6-二甲基-2-庚酮、乙基苯等分布在第四象限,与主成分1 正相关,与主成分2 负相关。由图4(b)可知,鲜汤位于第四象限与此类挥发性成分高度相关。冻融1 次和冻融2 次菌汤的挥发性成分类似,分布于第二、三象限,与F1 负相关,代表性的挥发性成分为正己醇、六甘醇、5-叔丁氧基噻吩-2-羧酸、十三烷和乙二醇乙烯醚等。冻融3 次和冻融4 次菌汤的挥发性成分类似,分布于第三象限,代表性的挥发性成分为3-酞酰亚胺基丙酸甲酯、N-甲基异丁基胺、乙酸异丙烯酯、2-甲基吡嗪、正戊醇、12-冠醚、3-辛酮、3,6,9,12-四氧十四烷-1-醇等。冻融5 次菌汤分布于第二象限与F2 正相关,代表性的挥发性成分为正己烷、呋喃、五甘醇、亚胺二乙酸二乙酯。通过冻融前后菌汤的挥发性成分分析,可将菌汤划分为四组:鲜汤、冻融1~2 次、冻融3~4 次和冻融5 次。
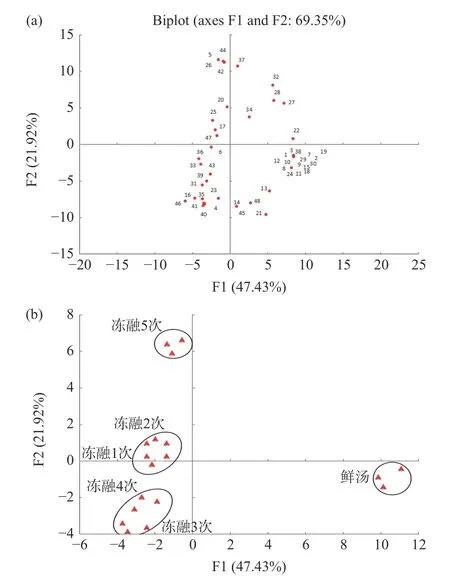
图4 冻融循环过程中菌汤挥发性成分主成分得分图(a)和变量图(b)Fig.4 Principal component score chart (a) and variable chart(b) of volatile components in mushroom soup during freezingthawing cycle
3 结论
本文研究结果表明,冻融循环次数能不同程度地影响菌汤的色泽、成分和风味。具体而言,随着冻融处理次数的增加能使汤色更加明亮,但也伴随着菌汤可溶性蛋白质含量逐渐降低,等鲜度和挥发性成分的减少。然而菌汤的成分指标(还原糖含量、总酚含量、总氨基酸含量)和风味指标(等鲜度、挥发性成分含量)均在首次冻融时出现大幅减少,而此后的冻融次数对上述指标影响相对微弱。进一步通过冻融次数的对比,发现反复冻融3 次时,菌汤中菌落总数开始检出,此后不断增加;反复冻融3 次时菌汤可溶性蛋白含量相较于冻融1~2 次显著降低(P<0.05),等鲜度由1~2 次冻融的0.441~0.450 g MSG/100 g 直接下降至0.407 g MSG/100 g,此后相对稳定,并且冻融3 次菌汤的挥发性风味成分也和1~2 次冻融菌汤存在较大差异。所以,本研究认为菌汤应鲜食为佳,若需冻融处理则应控制在2 次内为宜。目前尚无标准规定预制菌汤的微生物限度标准,按照GB 11671-2003,罐装果蔬食品微生物应符合商业无菌的要求,本研究中菌汤属于食用菌加工的软罐装食品,微生物检测也应达到商业无菌的要求。因此,若菌汤冻融次数大于2 次,可能需要充分复热后再食用。

