姜黄联合山楂对C57 肥胖小鼠的减肥作用及机制研究
李 强,李亚婷,徐华健,郝宗围,陈鹏浩,司雄元,汪雪雁,
(1.安徽农业大学茶与食品科技学院,安徽合肥 230036;2.安徽农业大学生物技术中心,安徽合肥 230036)
肥胖是一种复杂的慢性疾病。研究表明,目前我国城乡居民超重或肥胖人数已超过总人口一半,慢性病发病率显著上升[1]。显然膳食结构是引起肥胖和慢性病因素之一[2]。目前关于肥胖的定义有两种:一种是世界卫生组织所提倡的采用BMI 指数进行分类以定义肥胖等级[3],另一种是通过机器检测人体体脂率表明人体的肥胖程度[4]。研究表明,肥胖不仅通过影响人们的心理健康导致死亡率上升,也会引起人体疾病产生严重危害[5],如:非酒精性脂肪肝[6]、血脂异常、2 型糖尿病[7]、高血压[8]、生殖障碍[9],甚至引发相关器官组织的癌症病变[10]。当前可通过调节以下机制来治疗肥胖:调节体内神经肽Y 的激素水平可调节食欲,维持机体能量平衡[11];抑制糖类、脂类相关酶的活性。通过抑制脂肪酶、糖苷酶以及淀粉酶的活性减少胃肠道对食物的吸收,进而降低机体内的能量摄入[12];抑制前脂肪细胞分化和增殖。过氧化物酶体增殖物激活受体γ(PPARγ)在脂肪代谢过程中具有关键的调节作用,在调节前脂肪细胞的分化和增殖有重大作用,在此过程中还与CCAAT/增强子结合蛋白(C/EBP)共同调控[13]。
复方在中药的应用调节上有整体观念,其化学组成的多成分特性,药理作用的多靶点功效,相比单一的天然提取物或单一靶点的西药具有更明显的优势[14]。研究发现,姜黄(Curcuma longaL.)与山楂(Crataegus pinnatifidaBunge)联用可能具有协同增效的作用[15],但还未得到更进一步的证实以及机理方面的探讨。姜黄含有姜黄素、倍半萜、二萜、三萜、甾醇、生物碱等功能性成分[16]。姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素在抗氧化、抗炎和抗增殖作用有着不同的优势[17]。因此姜黄的抗氧化、抗炎、抗癌、抗衰老、止痛等作用也就更为明确[18-19]。姜黄素的生物利用率比较低。有研究显示,姜黄中的姜黄油可以提高姜黄素的生物利用度[20]。山楂为蔷薇科植物的干燥成熟果实,消食健胃、行气散瘀、化浊降脂。山楂含有丰富的类黄酮及其衍生物、多糖、有机酸类化合物、萜类化合物[21]。山楂由于在心血管治疗、抗氧化、抗菌等方面作用突出,成为了植物治疗和食品应用中非常受欢迎的草药[22]。
综上所述,虽然已有姜黄、山楂在降血脂、2 型糖尿病以及抗氧化方面的研究,但针对二者联合在治疗肥胖及机制上的研究还未见报道。山楂和姜黄同属药食同源类产品,其安全性能够保障。同时人们也倾向于天然、可持续的植物活性成分的药物,而此类药物多数兼具安全性、疗效性、高利用度和低成本等优势[23]。本文以姜黄和山楂为研究对象,探究姜黄和山楂对高脂饮食诱导的肥胖小鼠的减肥作用及可能机制,为后续药食同源产品的联用,以及姜黄-山楂产品的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
C57BL/6JNifdc 小鼠,SPF 级、雄性、5~6 周、32 只 由浙江维通利华实验动物技术有限公司提供,生产许可证号:SCXK(浙)2019-0001,动物合格证编号:No.20220316Abzz0600 000749;60%高脂饲料(TP23300)南通特洛菲饲料科技有限公司;维持饲料 江苏省协同医药生物工程有限责任公司;姜黄、山楂 北京同仁堂;多聚甲醛固定液 上海碧云天生物技术有限公司;脂肪固定液 上海源叶生物科技有限公司;二甲苯、中性树胶 国药集团化学试剂有限公司;无水乙醇(色谱纯)、HE 染液、分化液、返蓝液 Servicebio;总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、谷丙转氨酶(alanine aminotransferase,ALT/GOT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST/GOT)试剂盒 南京建成生物工程研究所;DNA 提取试剂盒、反转录试剂盒 赛默飞。
Allegra 64R 高速冷冻离心机 美国贝克曼库尔特有限公司;Multiskan FC 酶标仪 美国BIOTEK 公司;LF50 小动物组分分析仪 德国布鲁克公司;JJ-12J 脱水机 武汉俊杰电子有限公司;JB-P5包埋机 武汉俊杰电子有限公司;RM2255 切片机上海徕卡仪器有限公司组织;KD-Pll 摊片机 浙江省金华市科迪仪器设备有限公司;Ni-E 正置光学显微镜 日本尼康;ECLIPSE-Ti2 成像系统 日本尼康;GHC50023 电子秤 泊名臻品;580 血糖仪 鱼跃;VeritiPro PCR 仪 赛默飞。
1.2 实验方法
1.2.1 动物实验与分组处理 32 只雄性SPF 级C57BL/6J 小鼠(体质量18~22 g)饲养条件:动物房湿度40%~70%,温度(23±3)℃,压差10~30 Pa,光照黑暗各12 h,饲养于安徽省合肥市安徽农业大学国家重点实验室SPF 级动物房,自由摄取食物和饮水。适应性饲喂1 周,随机分为正常组、正常干预组、高脂组、高脂干预组,每组8 只。正常组饲喂基础饲料,高脂组饲喂高脂饲料。姜黄和山楂粉碎过60 目筛,制成粉末,纯水灌胃,各干预组按照姜黄、山楂各390 mg/kg 混合灌胃(剂量参照中国药典,灌胃溶液参照丸剂剂量),连续灌胃12 周,处死前禁食12 h,采用4%水合氯醛麻醉,摘眼球取血,颈椎脱臼处死,血液经2000 r/min 离心10 min,取上清备用。附睾脂肪保存于脂肪固定液。肝脏分别保存于多聚甲醛固定液、RNAlater 保存液、-80 ℃环境中。本研究动物实验获得安徽农业大学动物伦理委员会批准,伦理编号AHAU2022019。
1.2.2 小鼠体重检测 从小鼠适应一周开始,每周同一时间称量体重。
1.2.3 小鼠摄食饮水量的测定 每周同一时间更换小鼠垫料,同时统计小鼠饮水、摄食量。
1.2.4 小鼠体质成分的测定 将机器进行日常开机检验,用酒精将检测筒擦拭干净,同时在检测过程中及时清理小鼠产生的异物,避免沾染其它小鼠的气味对实验造成影响。每周同一时间测定小鼠体质成分。
1.2.5 小鼠随机血糖的测定 每隔两周在同一时间测定小鼠的随机血糖,采用尾尖取血,弃去第一滴血。
1.2.6 小鼠血清生化指标检测 以试剂盒测定小鼠TG、TC、HDL-C、LDL-C、AST、ALT 含量,测定方法严格按照说明书操作。
1.2.7 肝组织病理学检查 参照温永平等[24]的方法并稍作修改,取小鼠同部位的肝脏组织一小块,置于4%多聚甲醛固定液,固定48 h 以后,脱水浸蜡、包埋和切片后制成厚度为4 μm 的石蜡切片,经苏木素-伊红染色后,脱水封片,放置显微镜镜检,采集图像进行分析,过程中注意细胞核分化以及苏木素、伊红效价。
1.2.8 脂肪组织病理学检查 取同一部位小鼠附睾脂肪,置于脂肪固定液中固定48 h 后,参照1.2.7 肝脏组织病理学检查进行操作。
1.2.9 实时荧光定量PCR 法测定肝脏中脂质代谢通路中mRNA 相对表达量 参考沈海亮[25]的方法并稍作修改,提取各组小鼠肝组织的总RNA,测定其浓度和纯度,稀释浓度过高的RNA 使其最终浓度为100~500 ng/μL,随即使用反转录试剂盒将总RNA反转录为cDNA。采用qPCR 法测定胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、脂肪酸合酶(fatty acid synthase,FAS)、肝X 受体α(Liver X Receptorα,LXRα)、固醇调节元件结合蛋白2(Sterol Regulatory Element Binding Protein,SREBP2)、固醇调节元件结合蛋白1C(Sterol Regulatory Element Binding Protein,SREBP1C)、硬脂酰辅酶A 去饱和酶(Steary-coenzyme A dehydro-synthase-1,SCD1)的mRNA 相对表达量。反应体系:在0.2 mL 的PCR 管内加入,2×qPCR Mix(7.5 μL),2.5 μmol/L 上下游基因引物(1.5 μL),cDNA(2.0 μL),添Water Nuclease-Free(4.0 μL)。反应条件:95 ℃预变性30 s,40 个循环(95 ℃变性15 s,60 ℃延伸 30 s),溶解曲线选择在65~95 ℃,每升温0.5 ℃,采集一次荧光信号。选择GAPDH为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。引物序列如表1 所示。

表1 荧光qPCR 引物序列Table 1 Primer sequences for fluorescence qPCR
1.3 数据处理
采用SPSS 26.0 软件统计处理,各组数据以均数±标准差(Mean±SEM)表示,采用单因素ANOVA分析,P<0.05,P<0.01,P<0.001 表示差异具有统计学意义。
2 结果与分析
2.1 姜黄联合山楂对小鼠体重的影响
研究表明高脂饮食可以增加机体体质量[26],相比正常小鼠,体重超过20%可定义为肥胖[27]。由图1可知,在12 周的实验期间,各组小鼠体质量均呈现增长趋势,增长差异较大。随着时间的增加,高脂组与正常组相比,体重显著升高(P<0.05),当实验到达第六周时,相比高脂组,高脂干预组显著降低直至实验结束(P<0.05)。而在整个实验期间,相比正常组,正常干预组的体重没有显著差异,说明姜黄-山楂联合干预对正常组小鼠体重没有影响。在第12 周结束时,正常组小鼠平均体质量达到28.56 g,相比正常组,高脂组平均体质量增加46.88%,差异高度显著(P<0.001)。相比高脂组,高脂干预组平均体质量下降13.4%,差异极显著(P<0.01),说明姜黄-山楂联用可以有效减缓小鼠体质量的增加。图中可以看到,在最初的两周干预组平均体重上升比非干预组快,这可能是由于山楂的健胃消食作用。
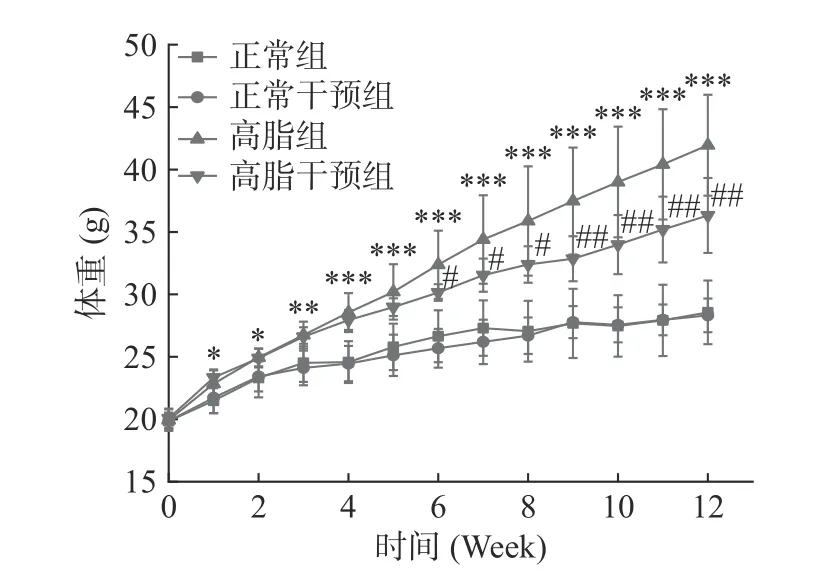
图1 姜黄-山楂联用对小鼠体质量的影响Fig.1 Effect of turmeric-hawthorn combination on body mass of mice
2.2 姜黄联合山楂对小鼠摄食、饮水的影响
如图2a、2b 所示,总体而言,相比正常组,正常干预组的摄食、饮水量差异不大。相比高脂组,高脂干预组的摄食、饮水量差异不大。说明姜黄-山楂联用,对小鼠的饮水、摄食量无影响。高脂组和高脂干预组摄食量和饮水量低于正常组和正常干预组。这可能是由于饮食结构的不同,维持饲料提供的能量远低于高脂饲料,这可能是导致高脂组摄食量减少的原因,此结果与夏海梅等[28]的研究一致。
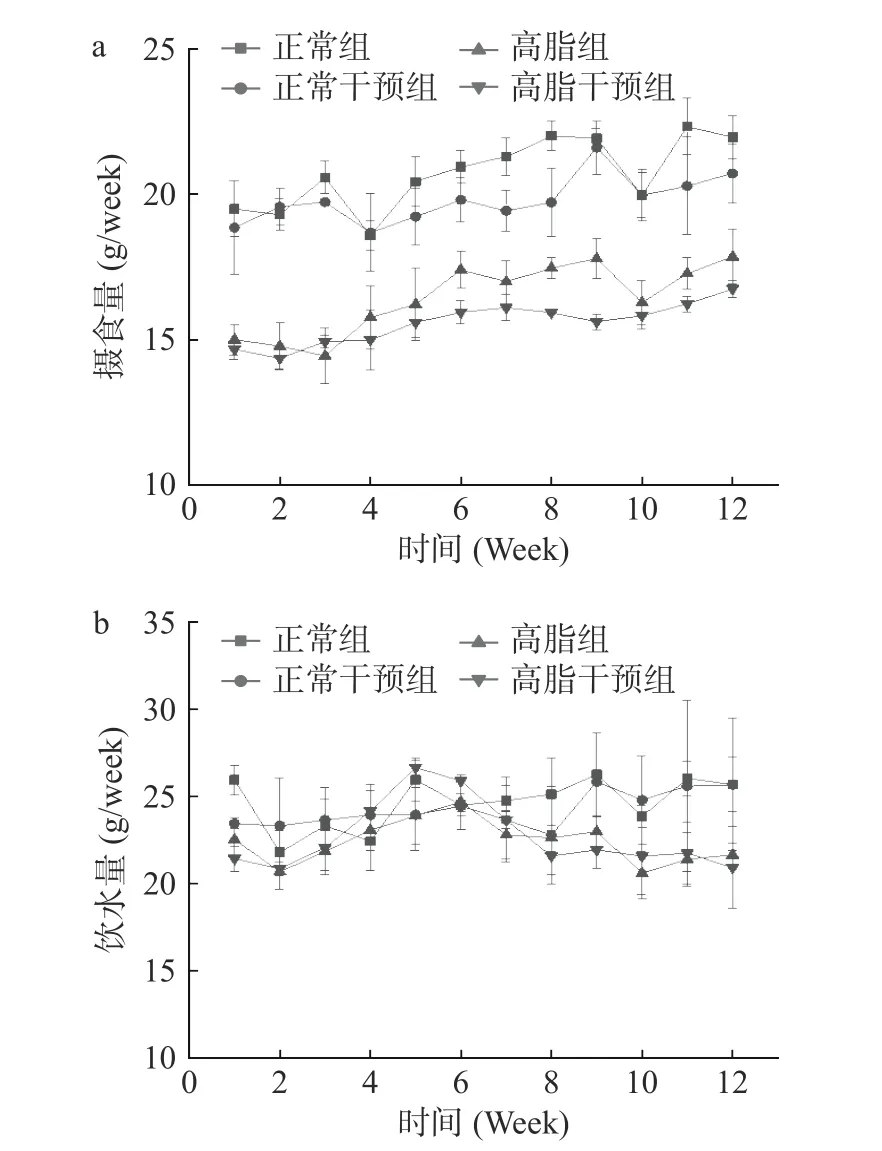
图2 姜黄-山楂联用对小鼠摄食、饮水的影响Fig.2 Effect of turmeric-hawthorn combination on feeding and drinking in mice
2.3 姜黄联合山楂对小鼠体质成分的影响
本实验将监测小鼠体质成分所得数据分为脂肪率(总脂肪含量/体重)和瘦肉率(总瘦肉含量/体重),目前,越来越多的人认为,脂肪含量和肥胖息息相关[29]。图3a 为监测所得各阶段小鼠脂肪率,正常干预组长期稳定在7%左右的脂肪率,正常组长期稳定在10%左右,实验结束最后一周差异不显著(P>0.05)。与正常组相比,实验第一周,高脂组脂肪率差异高度显著(P<0.001),随时间增加,高脂组脂肪率由10%上升至28%。相比于高脂组,高脂干预组脂肪率上升缓慢,由实验开始时10%上升至22%,差异显著(P<0.05),说明姜黄联合山楂能够抑制小鼠脂肪率的增加。研究表明,瘦肉率能够间接反映机体肥胖程度[30]。图3b 为监测所得小鼠瘦肉率。正常干预组长期稳定在70%左右的瘦肉率,正常组长期稳定在68%左右,实验结束时差异不显著(P>0.05)。实验第一周,正常干预组与正常组具有显著差异(P<0.05),说明姜黄-山楂联用能够调高小鼠体内瘦肉率的含量。与正常组相比,高脂组瘦肉率由开始时的70%下降至54%,实验结束时差异极显著(P<0.01)。相比高脂组,高脂干预组瘦肉率由70%下降至60%,实验结束时差异显著(P<0.05),说明姜黄-山楂联用,能够有效地减缓小鼠体内瘦肉含量的下降,因此,摄入姜黄和山楂能够减少小鼠体内脂肪含量,增加小鼠体内瘦肉的含量,从而起到预防肥胖的作用。

图3 姜黄-山楂联用对小鼠体质成分的影响Fig.3 Effect of turmeric-hawthorn combination on the body composition of mice
2.4 姜黄联合山楂对小鼠随机血糖的影响
研究表明,肥胖人群通常随机血糖也普遍较高[31]。实验为尽可能地保证小鼠生长周期减少外在环境的影响,进行了对小鼠12 周的随机血糖监测。如图4所示,除干预组外,各组小鼠血糖值相对稳定。高脂组血糖值最高,但都未达到11.1 mmol/L(高血糖标准)。相比正常组,高脂组小鼠血糖含量差异极显著(P<0.01)。除试验期间第四周外,相比高脂组,高脂干预组血糖极显著下降(P<0.01),有时甚至低于正常组,说明姜黄-山楂联用在控制小鼠随机血糖的水平上,具有较好的效果。这与LIU 等[32]、ADAB 等[33]的研究一致。

图4 姜黄-山楂联用对小鼠随机血糖的影响Fig.4 Effect of turmeric-hawthorn combination on random blood glucose in mice
2.5 姜黄联合山楂对小鼠血清生化指标的影响
如图5 a~d 所示,与正常组相比,高脂组血清中TC、TG、LDL-C、HDL-C 水平差异高度显著(P<0.001)。相比高脂组,高脂干预组能够高度显著降低高脂小鼠血清中TC、TG、LDL-C 水平(P<0.001),高度显著升高HDL-C 水平(P<0.001),这可能是姜黄-山楂参与了小鼠的脂代谢,降低了血清中TC、TG、LDL-C 含量,升高了HDL-C 含量。说明姜黄-山楂联用具有较好的降脂效果。图5e、5f 所示,与正常组相比,高脂组能够高度显著升高小鼠血清中AST、ALT 的含量(P<0.001)。相比高脂组,高脂干预组能够显著降低小鼠血清中AST、ALT 含量(P<0.001)。这与TAN 等[34]的研究结果一致。说明姜黄-山楂联用能够降低小鼠血清中总胆固醇、甘油三酯以及低密度脂蛋白胆固醇水平,升高血清中的高密度脂蛋白胆固醇水平,并且能够保护高脂饮食对肝脏带来的损伤。可能是姜黄中含有的姜黄素、姜黄油,以及山楂中的黄酮类等成分对机体产生的抗炎、降脂等作用[35-37],从而达到了预防肥胖的目的。
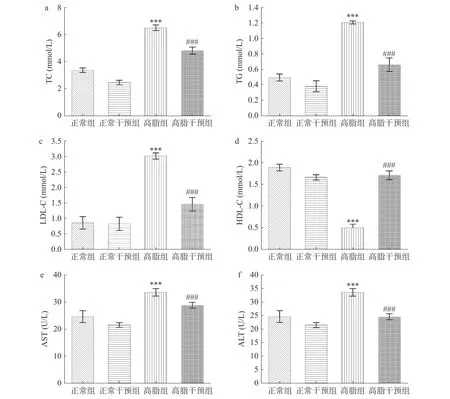
图5 姜黄-山楂联用对小鼠血清生化指标的影响Fig.5 Effect of turmeric-hawthorn combination on serum biochemical indexes of mice
2.6 肝脏病理学分析
如图6 所示,各组小鼠肝脏组织经HE 染色,可以看出正常组小鼠肝小叶结构紧密、分界清晰,组织结构无异常,细胞内未见明显脂滴,肝窦未见挤压或扩张。正常干预组肝细胞排列有序,未发现明显异常,表明姜黄-山楂无肝毒性。与正常组相比,高脂组细胞排列混乱,边界不清晰,肝质疏松。大量干细胞呈球状样变,间隙内含有较多脂肪空泡,核仁偏移。肝细胞坏死,炎性细胞浸润、血管周围肝细胞肿胀明显。与高脂组相比,高脂干预组边界模糊、脂肪空泡、核仁偏移改善明显,血管周围的脂质松散现象以及细胞肿胀有较大改善。说明姜黄-山楂能够改善肝脏脂肪病变。这同时与图5e、5f 中肝脏内AST、ALT 的降低互相佐证,姜黄-山楂能够起到对肝脏的保护作用。
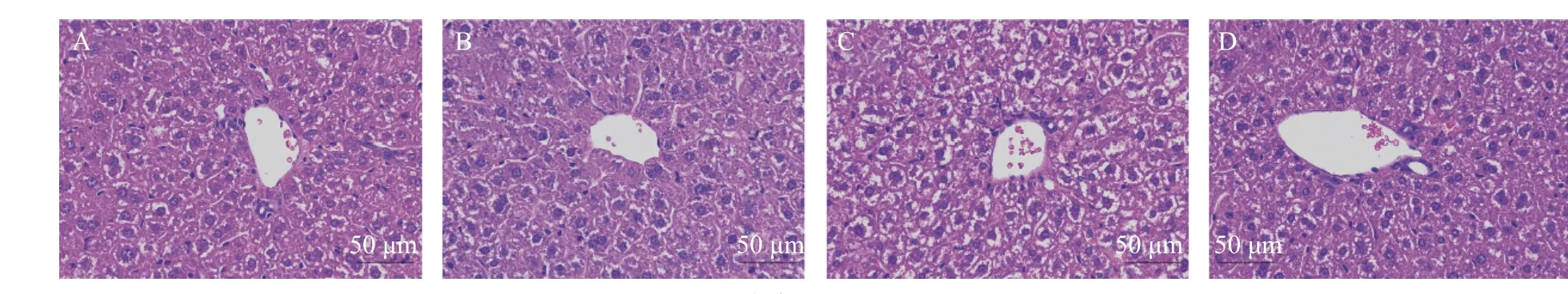
图6 肝脏病理学切片(×400)Fig.6 Pathological section of the liver(×400)
2.7 附睾脂肪病理学分析
如图7 所示,脂肪病理学切片显示,正常组小鼠附睾脂肪细胞排列整齐、大小均匀,细胞质充盈,未见明显异常。正常干预组,细胞无明显异常,细胞体积明显小于正常组细胞。与正常组相比,高脂组细胞体积明显增大,细胞质减少,排列散乱,细胞大小不一。与高脂组相比,高脂干预组在细胞形态有明显改善。虽然存在细胞大小不均的情况,但细胞质充盈,排列紧密,细胞有减小情况。

图7 附睾脂肪病理学切片(×200)Fig.7 Fat pathology section of epididymis(×200)
2.8 姜黄联合山楂对肝脏脂代谢相关信号通路的影响
胆固醇的相关基因是调节脂代谢至关重要的作用机制[38],研究表明,胆固醇被转移到高密度脂蛋白颗粒中,并返回肝脏主要通过限速酶胆固醇CYP7A1转化为胆汁酸[39]。胆固醇同时受胆汁酸分泌的影响,LXRα 调节胆汁酸的合成且能够调控SREBP1C基因的表达[40]。SREBP2、SREBP1C在胆固醇的代谢中发挥重要作用且表达量较高[41]。SCD1可介导脂肪的积累,SCD1的表达对脂代谢具有重要影响[42]。FAS异常表达会导致肝脏脂质累积[43]。由图8 实验结果可以看出,与正常组相比,高脂组肝脏中CYPTA1mRNA 表达水平高度显著下降(P<0.001),与高脂组相比,高脂干预组CYPTA1mRNA 表达水平显著上升(P<0.05)。与高脂组相比,高脂干预组LXRα和SREBP1CmRNA 表 达水平极显著下调(P<0.01)。与SREBP1C功能相似,姜黄-山楂的干预可调节SCDmRNA,降低SCDmRNA 表达水平,差异高度显著(P<0.001)。其中SREBP2表达水平无显著变化。此外本研究还测定了脂肪酸合成酶的相对表达量,与正常组相比,高脂组FASmRNA 表达水平高度显著上升(P<0.001),相比高脂组,高脂干预组FASmRNA 表达水平高度显著降低,差异具有统计学意义(P<0.001)。因此推测姜黄协同山楂减肥的作用机制可能和CYPTA1、LXRα、SREBP1C、SCD、FASmRNA 表达水平有关。
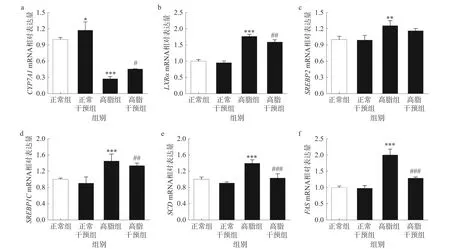
图8 肝脏组织中CYP7A1、LXRα、SREBP2、SREBP1C、SCD、FAS mRNA 水平Fig.8 CYP7A1,LXRα,SREBP2,SREBP1C,SCD,FAS mRNA levels in liver tissue
3 结论
姜黄-山楂联用能够有效减缓高脂饮食小鼠体质量的增加,抑制小鼠血清中脂质水平的升高,控制小鼠的随机血糖水平,能够有效减少体内的脂肪积累、提高瘦肉率的转化,从而达到预防肥胖的作用。其机制与姜黄-山楂联用上调CYPTA1mRNA 的表达量和下调LXRα、SREBP1C、SCD、FASmRNA 表达量有关。从生理生化、病理学以及肝脏组织中mRNA的测定结果表明,姜黄和山楂联用对C57 小鼠的减肥作用可能是调节脂代谢起到的作用,但机制的探索还需从蛋白水平以及转录组学等进行深入研究。关于中草药在动物实验中,多以提取物或已经工业化生产的制剂为研究对象,这可能会导致某些功能成分的损失。本实验采用的是全粉进行干预,这为开展以全药粉为加工工艺的工业化应用提供了依据,减少了加工过程中的原料损失。

