电致化学发光传感技术的种类及在食品分析中的研究进展
刘树萍 ,邢 珂,韩博林,关桦楠,
(1.哈尔滨商业大学旅游烹饪学院,黑龙江哈尔滨 150028;2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150028)
生物传感器是检测生物信号变化并通过传感器将其转换为可量化信号的设备,具有高灵敏度、高选择性和检测准确的特点[1]。生物传感器的种类繁多,可分为光学、温度、电化学和电致化学发光生物传感器等[2]。其中,电致化学发光(Electrochemiluminescence,ECL)也被称为电化学发光,是指带电物质之间的电子,基于电化学激发和高能级电子转移而发光的过程[3],于1964 年被首次提出[4]。与化学发光法和电化学法相比,ECL 能更好的控制发光时间,并具有更强的选择性。与光致发光法相比,ECL 不需要额外的光源,可实现几乎为零的背景噪声[5],这使它成为生物传感技术的有力工具。ECL 还具有操作简单、背景信号低和灵敏度高等优点[6],被认为是一种很有前景的生物分析技术,已广泛应用于免疫分析[7]、药品检测[8]以及环境监测[9]等领域。
ECL 机制大致可以分为两种,分别是湮灭和共反应物途径[10]。在湮没途径中,氧化和还原的发射物材料是在电极上通过电化学法生成,然后二者相互反应形成发射激发态。而在共反应物途径中,共反应物通过电化学氧化或还原产生活跃的中间体,该中间体可以与氧化或还原的发光体反应形成激发态发光。共反应物途径可以产生更稳定和更强的ECL 信号,这使其几乎主导了现代生物分析领域的ECL 应用[11]。影响共反应物途径ECL 的三个重要因素为发射物(或发光体)、共反应物和电极[12]。电致化学发光体系按照发射物性质的不同可大致划分为三类,包括最早出现的有机化合物发光体系、应用较为成熟的无机金属配合物发光体系和正在迅猛发展的纳米材料发光体系。经典ECL 体系主要包括有机化合物2,3-氨基邻苯二甲酰肼/过氧化氢体系(鲁米诺/H2O2)和无机金属发射物三(2,2'-联吡啶)氯化钌(Ⅱ)/三丙胺体系(Ru(bpy)32+/TPA)[13],其具有化学性质稳定、发光效率高等特点。但由于其在发展的过程中被发现存在检测仪器复杂和ECL 信号较弱等问题[14],因此基于纳米材料的新型ECL 发射物和共反应物成为了研究热点。近年来,研究较多的新型发射物和共反应物为金属纳米团簇(Metal nanoclusters,MNCs)、镉量子点(CdS)、硫量子点(SQDs)和碳量子点(CQDs)[15]。
本文以经典ECL 体系与新型ECL 发射物和共反应物的电致化学发光传感器为切入点,举例阐述ECL 传感器的结构和检测原理;并对近年来ECL 传感技术在检测食品中营养成分和污染物的研究进展进行综述,最后分析了ECL 传感技术面临的挑战并对未来发展趋势进行了展望。
1 电致化学发光传感技术
1.1 经典ECL 体系传感器
经典ECL 体系传感器主要包括两种体系,第一种为有机化合物鲁米诺/H2O2体系,第二种为无机金属发射物钌(Ⅱ)配合物Ru(bpy)32+/TPA 体系。鲁米诺作为典型的有机化合物发射物,具有无毒、价格低廉且发光效率高的优势[16],是ECL 中一种应用最为广泛的发射物。在鲁米诺中引入共反应物H2O2可以显著提高ECL 体系的发光效率,所形成的鲁米诺/H2O2体系是经典ECL 体系之一。与直接在检测溶液中加入鲁米诺的传感器相比,将鲁米诺固定在电极表面构建出固态核酸适配体ECL 传感器,不仅可以节省试剂,还能提高发光效率[17]。Cheng 等[18]选择银纳米粒子(AgNPs)催化鲁米诺/H2O2体系,构建了一种用于检测卡那霉素(Kanamycin,KAN)的ECL传感器。AgNPs 作为催化剂可以加速H2O2的分解并产生各种中间活性氧(ROS),从而提高体系的ECL 信号强度。在检测KAN 时,由于KAN 与核酸适配体之间存在特异性的相互作用,ECL 信号会出现明显下降的现象,以此来确定KAN 的浓度。该检测体系回收率在94.4%到105.17%之间。Jiang 等[19]以聚酰胺功能化的氧化锌纳米棒(ZNs-PAMAM)为载体,制备基于信号探针ZNs-PAMAM-鲁米诺-二抗(Secondary antibody,Ab2)的ECL 免疫传感器,用于检测糖抗原15-3(CA15-3)。在检测CA15-3 时,ZNs-PAMAM-鲁米诺-Ab2 以夹心式免疫反应修饰到电极上,这使得鲁米诺与电极表面的距离缩小,即可更为有效地发射ECL 信号。此外,ZNs 还可以加速分解H2O2,产生ROSs 加速鲁米诺的ECL 反应,增强ECL 信号强度,RSD 为95.9%~108.6%。大多数基于鲁米诺的研究都是在碱性介质中进行的。然而在碱性条件下,当鲁米诺没有共反应物与之共同参与反应时,ECL 信号会较弱甚至无法检测到。但H2O2作为共反应物存在不稳定、易分解和背景信号高的缺陷。因此需要开发更多稳定的共反应物,增强ECL信号并扩大鲁米诺的应用范围。
Ru(bpy)32+是一种传统的无机金属阳极ECL 发射物,因其在水相系统中具有更高的发光率和化学稳定性,且价格低廉[20],近年来被广泛应用于DNA 分析、免疫测定等领域中[21-22]。TPA 为通用共反应剂,可增强Ru(bpy)32+的ECL 信号强度[23],Ru(bpy)32+/TPA 体系也被称为经典的ECL 共反应体系。Li 等[24]在Ru(bpy)32+/TPA 体系中将金与二氧化硅纳米粒子修饰于玻碳电极(Au@SiO2/GCE)的表面,构建用于检测多巴胺(DA)的增强电致发光平台。经过研究得出,Au 局部表面发生等离子体共振会引起电磁场增强。在电磁场被增强的优势下,Au@SiO2/GCE 的ECL 信号强度相较于裸GCE 的信号提升了29 倍,相较于Au 修饰的GCE 信号提升了100 倍。该传感器检测限低至0.004 μmol/L,回收率在98%~104%之间。由于其优异的稳定性、水溶性以及对体系中可能存在干扰物质的抵抗力,Ru(bpy)32+/TPA是第一种也是唯一一种被正式投入商业实物应用的电致化学发光免疫传感器发光体系,在食品分析领域也同样具有的巨大潜力。
共反应物途径在现阶段的ECL 领域中起着主导作用,ECL 的共反应物也受到很多关注。由于TPA 存在毒性和在低浓度时灵敏度较低的不足的问题[25],研究人员致力于开发取代TPA 的ECL 共反应物。Kitte 等[26]将一种新的共反应物1-乙基-3-(3-二甲氨基丙基)碳二亚胺(1-Ethyl-3-(3-dimethylaminopropyl)-carbodiimide,EDC)引入Ru(bpy)32+电化学发光技术,并应用Ru(bpy)32+/EDC 体系对H2O2进行检测,检测限为0.33 μmol/L,检测范围为0.5~200 µmol/L。Yuan 等[27]通 过 二 丁 基 氨 基 乙 醇(DBAE)与丙烯酰氯的反应合成了一种新型ECL 共反应物丙烯酸2-(二丁基氨基)乙酯(DBAEA),并用Ru(bpy)32+/DBAEA 体系检测半胱氨酸(Cys),如图1所示。与TPA 和DBAE 相比,DBAEA 可显著提高铂(Pt)电极上Ru(bpy)32+的ECL 信号强度。经过研究得出,ECL 信号强度的增加归因于烯基与铂电极之间的相互作用,使得DBAEA 更容易被电氧化,检测限为1.15 μmol/L,回收率在93.5%~105.6%之间。

图1 在铂电极上基于Ru(bpy)32+/DBAEA 电化学发光检测Cys[27]Fig.1 ECL detection of Cys based on Ru(bpy)32+/DBAEA at a Pt electrode[27]
综上所述,将鲁米诺固定在电极上可以加快电子转移速率,缩短信号响应时间,但固定在电极上的同时不降低其ECL 信号强度却是一个巨大的挑战。同时,未来可引入更多共反应物代替H2O2或研发性能更优异的共反应促进剂,进一步提高用于食品分析的ECL 体系稳定性和信号强度。增强传统发射物的ECL 信号通常需要在溶液中加入多种共反应物[28],然而这就无法避免ECL 操作复杂化和试剂消耗快导致成本升高的问题。鉴于此,仍然需要继续寻找新的ECL 体系并持续围绕经典ECL 体系拓展应用的范围。
1.2 基于新型发射物和共反应物的ECL 传感器
由于纳米材料的研究发展,越来越多的相关研究者看到了其旷阔前景,遂将纳米材料引入ECL 发光体系。贵金属纳米团簇、铜纳米团簇、镉量子点、硫量子点和碳量子点等能增强信号强度的新型ECL 发射物和共反应物备受关注。金属纳米团簇是一种多功能纳米材料,具有介于金属原子和金属纳米粒子之间的性质[29]。MNCs 主要包括金纳米团簇(AuNCs)和银纳米团簇(AgNCs),其中金纳米团簇因具有稳定性高、生物相容性好等优势,已在生物成像[30]和电催化[31]领域中被广泛应用。但是,与经典的ECL 发射物相比,金属纳米簇的ECL 发光效率相对比较低。因此,采用不同策略来增强金属纳米簇的ECL 信号强度,提高其量子产率是目前的研究热点。Zhang 等[32]将金纳米团簇和二维过渡金属碳化物Ti3C2结合,形成异质结构AuNCs@Ti3C2,并将其作为发射物构建ECL 生物传感器,用于检测微小RNA-155(miRNA-155)。研究显示,AuNCs 通过氧原子牢固地锚定在Ti3C2表面,Au-O-Ti 连接起了AuNCs 和Ti3C2,改善了AuNCs 因尺寸较小不利于分离与固定的不足。此外,Ti3C2作为载体不仅导电性良好,还能增加AuNCs 的负载量。Huang 等[33]提出了一种基于金纳米团簇和过硫酸钾(AuNCs/K2S2O8)的ECL 传感体系,用于检测尼古丁(Nicotine)。通过高效液相色谱-质谱分析(High-performance liquid chromatography-mass spectrometry,HPLC-MS)研究了K2S2O8中尼古丁的变化,结果表明,K2S2O8会产生强氧化中间体SO4-·自由基阴离子。尼古丁分子的吡咯烷部分不仅很容易被氧化成烟酸,还会与SO4-·发生竞争性反应,导致ECL 信号下降,检测限低至7.0×10-7μmol/L。
铜是一种经济、高效且储量丰富的金属元素,也是人体必需的微量元素。铜纳米团簇(CuNCs)展现出的ECL 性能使其可应用在传感检测和成像分析等领域[34]。Zhao 等[35]将牛血清白蛋白保护的CuNCs作为发射物,肼作为共反应物构建ECL 传感器,用于检测DA。Zhuang 等[36]利用稀土元素铕(Eu)丰富的电子结构和显著的光学性能,提出了基于铕掺杂铜纳米团簇(Eu3+-CuNCs)的ECL 生物传感器,以实现灵敏检测多巴胺。Eu3+改变了CuNCs 的表面,并驱动合成Eu(Ⅲ)复合物,形成新的表面状态,以促进能量有效转移到Eu3+,从而大大增强了ECL 发射强度和CuNCs 的稳定性。该传感器具有很强的选择性,对DA 的检测限为1×10-11μmol/L。
量子点(Quantum dots,QDs)被称为胶体半导体纳米晶体,作为一种零维纳米材料,QDs 具有优异的光学、电学性能[37]。因此,量子点在光催化[38]和生物医学影像[39]等领域中受到了极大的关注。其中,硫化镉量子点(CdS)因表面易功能化和ECL 性质稳定,使其成为ECL 传感中发射物的理想选择[40]。Zhao 等[41]通过电沉积法合成硫化镉/硫化锌量子点(CdS/ZnS QDs),并基于CdS/ZnS QDs 的电致化学发光猝灭构建了一种灵敏检测Cu2+的ECL 传感器。研究结果表明,制备的CdS/ZnS QDs 表现出很好的溶解性和强而稳定的阴极电泳能力,Cu2+与Cd2+和Zn2+反应生成的硫化铜会使CdS/ZnS 量子点的结构被破坏,ECL 强度显著降低,即CdS/ZnS 量子点被Cu2+选择性淬灭。该传感器对Cu2+的检测限为9.5×10-4μmol/L,检测范围为2.5~200 nmol/L。
由于硫化镉量子点中包含重金属镉,其中存在不可避免的毒性,并对生物环境有着极大的威胁,所以近年来研究人员致力于开发无毒副作用或无重金属的量子点。其中硫量子点(SQDs)作为一种无金属量子点,且具有良好的化学稳定性、生物相容性和低毒性[42],被认为是有很潜力的绿色纳米材料。Hu 等[43]建立了一种以SQDs 作为发射物,K2S2O8为共反应物的电化学发光传感器,用于测定多巴胺。检测限达到2.5×10-5μmol/L,检测范围为1×10-10~1×10-3mol/L。Han 等[44]将硫量子点与H2O2结合形成H-SQDs,再复合二氧化锰(MnO2),制备了H-SQDs@MnO2/GCE 阳极增强型“off-on”ECL 生物传感器(图2),用于对谷胱甘肽(GSH)进行灵敏检测。MnO2被用作ECL 共振能量转移(Resonant energy transfer,RET)受体,也可作为识别单元来识别GSH。如图2C 所示,通过在MnO2上原位锚定H-SQDs 建立ECLRET 体系。H-SQDs@MnO2显示出几乎被猝灭的ECL 响应,处于“信号关闭”状态。GSH 则会特异性地将MnO2还原为Mn2+,并从H-SQDs@MnO2上标定下来H-SQDs,ECL 响应恢复为“信号开启”状态,从而实现GSH 的灵敏检测。研究表明,H-SQDs的ECL 性能和光学性质得到了显著改善,这是因为其表面形成高度钝化,并且合成H-SQDs 后再用H2O2进行蚀刻,电荷转移能力会增强。

图2 制备检测GSH 的“off-on”ECL-RET 的流程图[44]Fig.2 Flowchart for preparing “off-on” ECL-RET for detection of GSH[44]
碳量子点因其易于合成和修饰、高生物相容性和低毒性[45]的特点在光电催化[46]和生物成像[47]中表现出巨大潜力,有望替代重金属量子点。但CQDs量子产率低并且需要很高的激发电位,所以人们将其他元素掺杂进CQDs 中,以提高CQDs 的ECL 性能[48]。许多研究表明,氮掺杂是促进CQDs 的ECL发射的有效方法之一[49-50]。Li 等[51]采用一步水热法制备出氮掺杂碳量子点(N-CQDs),并结合丝网印刷技术开发了一种基于N-CQDs 的纸基ECL 传感器,用于检测自来水中的Cu2+。该传感器使用N-CQDs作为发射物,K2S2O8作为共反应物,Cu2+的检测限为0.12 μmol/L,检测范围为0.01~1000 μmol/L。研究表明,使用掺杂了N 的CQDs 会更容易将电子注入CQDs 中,并且N 原子会在QDs 表面产生更多的表面缺陷,在提高ECL 活性的同时提供了更多的化学活性位点。近年来,CQDs 成为一种很有前途的ECL 共反应材料,受到了广泛关注。
综上所述,新型ECL 发射物的生物传感器已经有了一定的发展,并在各个领域均具有良好的应用前景。Au、Ag 金属纳米团簇虽具有优异的光学性能但成本过高,而Cu 更廉价且同样具有高生物相容性,在食品分析领域备受关注。但由于Cu 存在易被氧化的问题,并且制备出稳定的CuNCs 较为困难,导致CuNCs 在ECL 传感分析中的应用相对滞后。预测今后研究人员会聚焦于研究CuNCs 的稳定制备及应用方面,CuNCs 有望用于构建更高效的ECL 传感器。量子点在生物分析领域的探索仍处于早期阶段,却已经在ECL 生物传感方面显示出巨大的潜力。目前基于碳量子点的ECL 研究主要集中在应用开发上,但较少对ECL 发射机制进行研究和说明。虽然开发高ECL 性能的量子点仍然是巨大的挑战,但这也会有效地促进ECL 传感器的持续创新发展,相信未来出现更多能够用于食品分析及各个领域的性能优异的新型发射物和共反应物。
2 电致化学发光传感技术在食品分析中的研究进展
2.1 在检测食品营养成分中的应用
食品中的营养成分包括维生素、碳水化合物和脂类等,从食品中获取需要的营养对人体健康有着不可替代的作用。因此,对食品中的营养成分进行检测十分重要。抗坏血酸(Ascorbic acid,AA)又称维生素C,是人体不可缺少的水溶性维生素,在调节各种氧化还原代谢反应中起着重要作用[52]。研究发现,缺乏AA 会导致坏血病和免疫力下降,但过量摄入AA 也可能会导致腹泻、皮疹等疾病[53]。因此,开发一种准确、灵敏的AA 检测方法对于食品安全具有重要意义。迄今为止,已经设计出各种传统的AA检测方法,包括高效液相色谱法、比色法和电泳法。但这些检测方法都存在设备昂贵、工艺复杂、耗时长等问题,在一定程度上受到限制。因此,电致化学发光法以其设备成本低、操作简单等优点而受到广泛关注。Wang 等[54]使用内标法构建了石墨氮化碳量子点(g-CNQDs)与双共反应物K2S2O8和四丁基溴化铵(TBAB)的ECL 传感器,用来检测人血清中的AA。在该传感器中,g-CNQDs 作为单一发射物,在两种共反应物存在下可以产生双ECL 信号,ECL 信号强度会随着AA 浓度的增加而降低,从而检测出AA 含量。Su 等[55]基于双增强Ru(bpy)32+/CQDs/AA 体系,结合磁场增强固相微萃取(MFE-SPME)技术开发了一种双峰ECL 传感器,可直接测定AA,如图3 所示。该传感器还将四氧化三铁(Fe3O4)、壳聚糖(CS)和氧化石墨烯(GO)结合,制备出磁性纳米复合材料Fe3O4@CS@GO,并将其作为磁性吸附剂,在磁性玻碳电极(MGCE)的外磁场作用下提取AA。Fe3O4@CS@GO 减少了GO 的聚集,增加了CS 溶解度,还提高了萃取性能。研究表明,ECL 传感器出现双峰是因Ru(bpy)32+和CQDs 之间的相互作用引起的。此外,在Ru(bpy)32+/CQDs 体系中加入AA后,双峰ECL 的信号强度明显增加,说明AA 可以增强Ru(bpy)32+/CQDs 体系的ECL 信号强度,也进一步表明CQDs 可以加速Ru(bpy)32+的电化学反应速率。该检测体系回收率为87.2%~104.0%,RSD 为3.12%~4.71%。
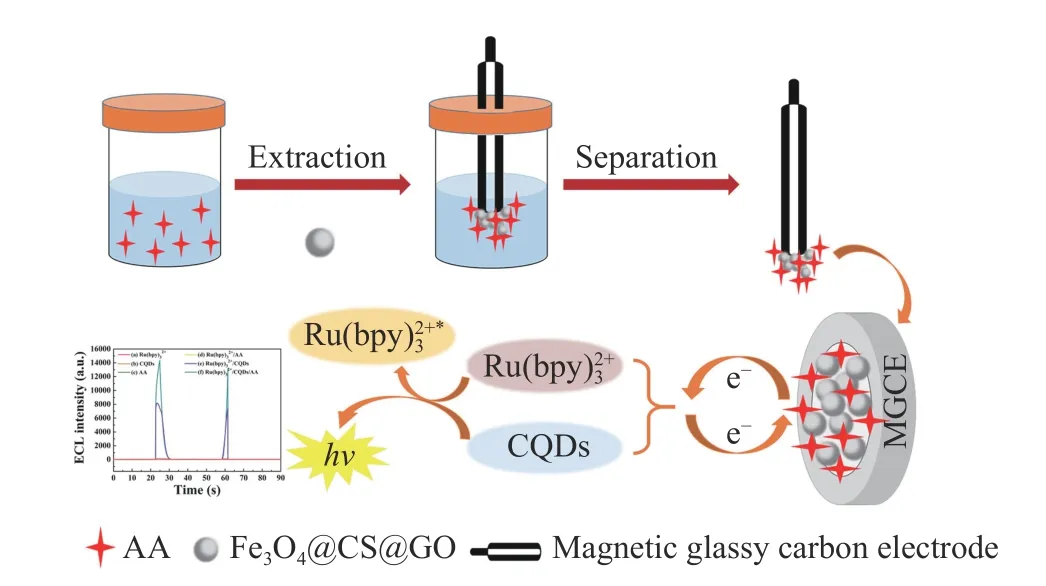
图3 双增强体系检测AA 的ECL 传感器示意图[55]Fig.3 The schematic diagram of the ECL sensor for AA detection in the dual enhancement system[55]
葡萄糖(Glucose)是碳水化合物的主要成分,也是生命活动必不可缺的物质之一[56]。血液中的葡萄糖水平是临床医学中的一个重要参数,高血糖浓度会导致糖尿病,而糖尿病会诱发肾衰竭、心脏病或失明等许多疾病[57]。所以快速、准确、便捷的检测葡萄糖尤为重要。Lu 等[58]使用氧化钴掺杂氧化银(Co3O4@Ag2O)和卟啉锌(TMPP-Zn)修饰电极,并构建了一种用于测定葡萄糖的增强型ECL 传感器。该传感器首先使用多壁碳纳米管(MWNTs)将Ru(bpy)32+固定在GCE 电极表面,然后依次将Co3O4@Ag2O 和TMPP-Zn 两种复合物修饰到玻碳电极表面,最终形成TMPP-Zn/Co3O4@Ag2O/Ru(bpy)32+/MWNTs/GCE修饰电极。Co3O4@Ag2O 和TMPP-Zn 的协同作用增强了系统的ECL 性能,检测限为3.3×10-3μmol/L,回收率在96.8%~104.4%之间。Zhang 等[59]选择碲化镉(CdTe)、沸石咪唑骨架材料(ZIF-7)、羧化多壁碳纳米管(MWCNTs)、全氟磺化阳离子交换聚合物(Nafion)和葡萄糖氧化酶(GOD)修饰电极(Nafion/ZIF-7-GOD/CdTe@MWCNTs-GO/GCE),制备出用于测定血清中葡萄糖的ECL 传感器。研究结果显示,电极表面覆盖的CdTe 和ZIF-7 作为共反应促进剂可以通过协同作用放大ECL 信号;与此同时,MWCNTs 和GO 具有大比表面积,可作为量子点的载体以增强ECL 信号强度;负载能力强的ZIF-7 会固定GOD,而GOD 与葡萄糖反应会产生H2O2,H2O2分解也可增强ECL 信号,诸多因素共同促使ECL 传感器表现出了良好的灵敏度和精确度,检测限为6.7×10-4μmol/L。
胆固醇(Cholesterol)是血脂的一种,也是类固醇激素、胆汁酸和维生素D 的主要前体物质[60]。健康人血清中总胆固醇(游离胆固醇和胆固醇酯的总和)的水平约为2.86~5.98 mmol/L,胆固醇含量过高会增加患心脏病的风险[61]。检测胆固醇的方法有比色法和荧光光谱法等,ECL 相较于传统光谱技术的优势是可控制反应的空间和时间,同时信噪比和选择性得到改善,因此是检测胆固醇的有力工具。Yang等[62]以牛血清白蛋白(BSA)为保护剂,制备固定胆固醇氧化酶(ChOx)的Ag-BSA-MnO2纳米片,成功构建出了一种用于检测胆固醇的ECL 传感器。研究表明,BSA 是一种非导电蛋白,但在体系中加入AgNPs 时会促进电子转移并增加纳米片的生物相容性。ChOx 可以催化胆固醇生成H2O2并形成鲁米诺-H2O2体系;AgNPs 与MnO2的协同作用提高了催化效率,从而有效放大了鲁米诺-H2O2体系的ECL 信号,检测限为0.07 μmol/L。
ECL 技术除了能够检测上述营养成分之外,也有研究报道显示其可以检测食品中的其他营养成分,如表1 所示。尽管高效液相色谱、比色法和分光光度法等检测方法已用于测定食品中的营养成分,但它们存在样品制备步骤复杂并且分析时间相对较长的问题。因此,电致化学发光法凭借响应时间短、操作简单、以及成本效益高的优点,为开发低成本和高灵敏度的检测食品中营养成分的传感器奠定了基础。

表1 ECL 传感技术在检测食品营养成分中的应用进展Table 1 Progress in the application of ECL sensing technology in the detection of nutrient content of food
2.2 在检测食品化学污染物中的应用
一般来说,食品中的化学污染物主要包含三个方面,分别是自然环境中存在的污染物、农药和兽药的残留污染物和非法添加剂。邻苯二酚(Catechol)常在合成染料、橡胶制品等被用作反应中间体,是环境中常见的有机污染物[76]。但邻苯二酚有剧毒,属于2B 类致癌物,易通过皮肤或黏膜进入人体,即使浓度很低也会对人体的多个系统造成损害[77]。许多方法已被用于检测邻苯二酚,如分光光度法、气相色谱法和高效液相色谱法。但由于这些方法存在所需仪器复杂、污染环境等问题。电致化学发光法不仅可以节省发光试剂,还可以实现ECL 仪器的小型化和现场快速检测。Peng 等[78]以CdTe 量子点为前驱体,通过离子交换法合成碲化银(Ag2Te)量子点,并以K2S2O8为共反应物,形成ECL 传感器检测邻苯二酚,检测限为3.1×10-4μmol/L,检测范围为1~1000 nmol/L。Liu 等[79]制备基于Ru(bpy)32+和g-CNQDs 的ECL 传感器,用于检测茶叶中的邻苯二酚。g-CNQDs 具有较大的比表面积和显著的催化作用,还在体系中起到共反应物的作用。研究结果显示,g-CNQDs 与Ru(bpy)32+结合后进行电化学性质研究,出现Ru(bpy)32+的氧化峰电流增加而还原峰电流降低的现象,这意味着Ru(bpy)32+会诱导g-CNQDs进行催化氧化,从而使ECL 信号增强。该传感器对邻苯二酚的检测限为2.5×10-3μmol/L,相对标准偏差为4.6 和5.1,表明ECL 法对邻苯二酚的测定是可靠、有效的。环保型Ag+在替代有毒Cd+在量子点中的应用时,会使其毒性降低,因此未来有望成为ECL生物传感器在食品领域的候选材料。
丙溴磷(Profenofos,PFF)是一种广泛使用的有机磷农药,可有效防治棉花和甘蓝等多种蔬菜作物的害虫[80-81]。然而,PFF 残留物会通过抑制乙酰胆碱酯酶活性对水生动物和人类产生毒性,并堆积在各个器官中,从而严重损害神经系统[82]。目前检测有机磷农药的方法主要有电化学法、比色法和荧光法等。在这些方法中,电致化学发光法具有灵敏度高、易于控制、测试时间短等优势,是检测实际样品中有机磷农药必不可少的方法。Shi 等[83]使用多壁碳纳米管修饰的金纳米粒子(AuNPs@MWCNTs)来增强鲁米诺-H2O2的ECL 传感体系,该ECL 传感器可灵敏检测蔬菜中的丙溴磷。AuNPs@MWCNTs 用于提供大比表面积以负载更多发光基团并实现ECL 信号的首次放大;另合成在体系中起到催化剂作用的Au@AgNPs,加速H2O2的分解并提高电化学发光反应的效率,从而实现了输出ECL 信号的二次放大。所提出的ECL 传感器对丙溴磷的检测限为1.66×10-5nmol/L,并具有3.2×10-4~3.2×103nmol/L 的良好检测范围。
腐霉利(Procymidone,PCM)作为一种有机氯农药,主要用于预防蔬菜和水果中的菌核病和灰霉病[84],长期食用PCM 残留超标的蔬菜会对人体健康产生不利影响[85]。Zhang 等[86]结合分子印迹技术(Molecularly imprinted polymer,MIP)和ECL 技术,制备了一种检测腐霉利的MIP-ECL 传感器。在该传感器中,采用一步法合成Ru(bpy)32+@ZIF-7 复合材料用于ECL 信号识别,ZIF-7 由于孔隙率高,比表面积大,可以吸附更多的Ru(bpy)32+,并且二者协同作用还能提高ECL 信号强度,Ru(bpy)32+@ZIF-7/GCE 修饰电极的ECL 信号相比裸GCE 提升了29.1倍,对腐霉利的检测限为20 μmol/L,检测范围为1.0×10-10~1.0×10-6mol/L,回收率为89.0%~105.5%。
除上述应用外,ECL 传感技术还被用于检测其他食品污染物,如有机磷农药马拉硫磷、甲基对硫磷和毒死蜱[87]、兽药残留物苯乙醇胺A[88]和动物饲料中的非法添加剂溴布特罗[89]。基于电致化学发光传感技术仪器简单、背景信号低、灵敏度高和可快速进行检测的独特优势,如今已成为一种强大的分析技术。ECL 传感技术在食品污染物分析中显示出了巨大的潜力,为未来快速检测食品中的污染物提供了新的研究方向。
3 结论和展望
电致化学发光传感技术是生物技术领域中的一种重要分析检测方法。作为新兴的检测技术之一,电致化学发光传感技术可以很好地解决传统检测方法成本较高、使用条件相对苛刻、稳定性较差等问题。虽然ECL 技术已取得巨大进展,但对于食品分析的实际应用而言,已开发的ECL 传感器仍存在着一些问题。a.现有用于食品分析的ECL 发射物存在环境安全隐患并且其信号强度仍有提高的空间。因此,有必要继续寻找新的高效、无毒的发射物和共反应物来提高ECL 生物传感器的灵敏度和生物相容性,使其可以安全的用于食品分析。b.目前,基于新型发射物的检测方法大多只能检测一种分析物。因此,开发可同时检测多种分析物的基于新型发射物ECL 传感器可以作为发展ECL 技术的新方向。c.目前用于食品分析的发射物和共反应物无法满足构建稳定、经济的ECL 生物传感器的需求。应继续研发不同激发电位、不同激发强度和不同激发波长的新型发射物和共反应物。也可引入其他设备或技术,进一步扩展ECL 应用范围。综上,随着对电致化学发光传感技术的不断探索,其优势和潜力也不断显现出来。希望ECL 技术可以引起更多研究人员的关注,设计和合成更多新型ECL 生物传感器,开拓更多应用领域。

