欧李果渣原花青素提取工艺优化及其体外抗氧化和降糖活性评价
张晓冰,张羽师,王 雨,赵锦江,王笑雪,刘舒鹏,李卫东
(北京中医药大学中药学院,北京 102488)
欧李(Cerasus humilis(Bge.)Sok.)是蔷薇科樱属小灌木,其果肉中含有多酚、维生素、氨基酸与多肽以及多种矿物质,具有很高的营养价值[1]。本团队前期研究表明,京欧系列欧李果富含多酚类成分,欧李鲜果肉中四大类主要多酚类成分,即总酚、总黄酮、总原花青素和总花青素含量分别可达1899 mg/100 g FW、1861 mg/100 g FW、1082 mg/100 g FW和39.3 mg/100 g FW[2]。近年来,随着欧李产品开发研究的进一步扩大,欧李果汁、果酒等多种食品加工逐步形成产业化,但加工过程中,欧李果肉榨汁后产生的大量欧李果渣作为废弃物被丢弃,造成了资源浪费。研究发现,葡萄皮渣和花生红衣一类的加工副产品富含原花青素,具有作为原花青素新来源的潜力[3]。同时,对此类副产品的利用符合循环经济理念,即副产品在被作为废物丢弃之前被尽可能多的再利用和提取[4],但有关欧李果渣资源回收开发的研究仍为空白。
原花青素是由不同数量的儿茶素或表儿茶素缩合而成的聚合物,又称缩合单宁[5]。原花青素在植物的根、茎、叶、花、果实、种子中均有分布,具有抗氧化、抗炎、抗糖尿病、抗衰老[6-11]等多种药理作用,其在体内的抗氧化活性是VC的20 倍、VE的50 倍[12-13]。此外,原花青素还可以通过与葡萄糖转运蛋白结合和竞争性抑制消化酶而发挥降血糖作用[14]。原花青素已经成为食品、医药、化妆品和工业生产等领域的研究热点[15-16]。原花青素提取主要以紫甘蓝、蓝靛果、蔓越莓等为原材料,采用有机溶剂萃取法、酶提取法、微波、超声辅助[17-19]等方法。田争福[20]采用响应面法对欧李鲜果原花青素的超声辅助提取法进行了优化,欧李果渣中可能也具有较高含量和良好活性的原花青素,但目前对于欧李果渣原花青素的含量、提取工艺和活性研究尚处空白。
本研究采用超声波辅助提取法提取欧李果渣中的原花青素,以原花青素得率为评价指标,采用单因素和正交试验得出最佳提取工艺,并进一步考察欧李果渣原花青素的体外抗氧化和降血糖活性。本研究旨在促进欧李产业副产物的合理利用,进一步拓展欧李资源综合开发并提升市场价值。
1 材料与方法
1.1 材料与仪器
欧李果渣 取自宁夏林业研究院股份有限公司;原花青素B1(批号:PS010162,HPLC 含量≥97.0%)成都普思生物科技股份有限公司;抗坏血酸(批号:20211011)天津市光复科技发展有限公司;2,2-联苯基-1-苦基肼基(DPPH,批号:C143 57523)、2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,批号:C14003395),2,4,6-三吡啶基三嗪(TPTZ,批号:C14194535)上海麦克林生化科技有限公司;过硫酸钾(批号:20210116)、无水乙醇(分析纯)福晨(天津)化学试剂有限公司;三氯化铁六水合物(批号:C1518022)、醋酸-醋酸钠缓冲液(pH3.7)
国家化学试剂质检中心;阿卡波糖(批号:S25 M11X109783)、PBS 溶液(pH6.8)、α-葡萄糖苷酶(活力≥50 units/mg protein,批号:N25HS202422)上海源叶生物科技有限公司;PBS 溶液(pH7.2~7.4,批号:0824A21)北京雷根生物技术有限公司;无水碳酸钠 分析纯,北京化工厂;娃哈哈水 杭州娃哈哈集团有限公司;盐酸 分析纯,北京市通广精细化工公司。
BT25S 型1/100000 电子分析天平 赛多利斯科学仪器北京有限公司;RE-52 型旋转蒸发器、SHZ-Ⅲ型真空泵 上海亚荣生化仪器厂;FD-2A 型真空冷冻干燥机 北京博医康实验仪器有限公司;KQ-400KDE 型高功率数控超声波清洗器 昆山市超声仪器有限公司;BY-G20 型高速离心机 北京白洋医疗器械有限公司;Synergy2 多功能酶标仪 美国BioTek 公司。
1.2 实验方法
1.2.1 欧李果渣原花青素提取工艺流程 取欧李果渣样品,剪刀剪碎,准确称取欧李果渣2.00 g,在超声功率500 W 的条件下,以一定的乙醇浓度、超声时间、超声温度和液料比进行超声波辅助提取,5163×g 离心力离心5 min,取上清液,即为欧李果渣原花青素提取液。
1.2.2 单因素实验设计
1.2.2.1 乙醇浓度对欧李果渣原花青素得率的影响在液料比为1:30 g/mL,超声温度为50 ℃,超声时间为40 min,乙醇浓度分别为40%、50%、60%、70%、80%的条件下,考察乙醇浓度对欧李果渣原花青素得率的影响。
1.2.2.2 超声温度对欧李果渣原花青素得率的影响在液料比为1:30 g/mL,乙醇浓度为60%,超声时间为40 min,超声温度分别为30、40、50、60、70 ℃的条件下,考察超声温度对欧李果渣原花青素得率的影响。
1.2.2.3 超声时间对欧李果渣原花青素得率的影响在液料比为1:30 g/mL,超声温度为50 ℃,乙醇浓度为60%,超声时间分别为20、30、40、50、60 min的条件下,考察超声时间对欧李果渣原花青素得率的影响。
1.2.2.4 料液比对欧李果渣原花青素得率的影响在乙醇浓度为60%,超声温度为50 ℃,超声时间为40 min,料液比分别为1:20、1:25、1:30、1:35、1:40 g/mL 的条件下,考察料液比对欧李果渣原花青素得率的影响。
1.2.3 正交试验设计 根据单因素实验结果,对每个因素选择合适的水平,应用正交表(表1),开展L9(34)正交试验,根据得率得出欧李果渣原花青素的最佳提取工艺。

表1 正交试验因素水平表Table 1 Factor levels for orthogonal tests
1.2.4 原花青素标准曲线的绘制 精密吸取50 μL原花青素B1 梯度稀释溶液(0、0.01、0.05、0.1、0.15、0.2、0.25、0.3 mg/mL)于96 孔板中,加入用无水乙醇:水:浓盐酸=6:1:1 的酸化乙醇配制的浓度为0.1%的4-二甲基氨基肉桂醛(DMAC)200 μL,静置20 min 后在640 nm 波长处测定吸光度。以原花青素B1 浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,回归方程为Y=7.223X+0.0439(0~0.3 mg/mL,R2=0.9999)。
1.2.5 原花青素含量测定 取原花青素提取液,稀释5 倍。按1.2.4 方法进行显色并测定样品的吸光度,根据标准曲线方程计算提取液中原花青素的浓度,再计算出得率,即每克欧李果渣中提取的原花青素质量。计算公式如下:
式中:W 为欧李果渣原花青素得率,mg/g;C 为根据吸光度度计算出的原花青素浓度,mg/mL;V 为原花青素提取液体积,mL;f 为稀释倍数;M 为欧李果渣取样量,g。
1.2.6 抗氧化活性测定 按照最佳提取工艺得到欧李果渣原花青素提取液,经AB-8 大孔树脂法和明胶沉淀法纯化,冻干可得到纯度为≥98.1%的原花青素粉末,取冻干样品配制成1 mg/mL 的样品溶液并进行梯度稀释,用于活性测定。
1.2.6.1 DPPH 自由基清除率的测定 参考缪园欣等[21]的方法,称取0.1984 g DPPH 用无水乙醇溶解并定容至50 mL,配制成0.1 mmol/L 的DPPH 储备液,取0.05、0.15、0.25、0.35、0.45、0.55 mg/mL 的样品溶液各100 µL 和等体积的0.1 mmol/L 的DPPH无水乙醇溶液加入96 孔板,充分混匀避光反应30 min,于517 nm 波长处测定吸光度。用VC作阳性对照,每种样品测定3 次,根据公式计算DPPH 自由基清除率:
式中:A1为样品吸光度;A2为样品本底的吸光度;A0用无水乙醇代替样品测定的吸光度。
1.2.6.2 ABTS+自由基清除率的测定 参考王晗等[22]的方法,将7.5 mmol/L 的ABTS 溶液与2.5 mmol/L的K2S2O8溶液等体积混合,室温避光放置12~16 h,形成ABTS 储备液。用0.1 mmol/L 的磷酸盐缓冲液(pH7.4)稀释ABTS 储备液,使其在734 nm 处的吸光度为0.70±0.02,将150 µL 的ABTS 稀释液分别与5、15、25、35、45、55 µg/mL 的样品溶液各50 µL混合,室温避光反应6 min 后测定734 nm 处的吸光度。用VC作阳性对照,每种样品测定3 次,根据公式计算ABTS+自由基清除率:
式中:A1为样品吸光度;A2为样品本底的吸光度;A0用水代替样品测定的吸光度。
1.2.6.3 FRAP 法对铁离子还原能力的测定 参考李新原等[23]的方法,配制10 mmol/L 的TPTZ 溶液、20 mmol/L 的三氯化铁溶液低温避光备用。按照10:1:1 的比例混合醋酸缓冲液(pH3.7)、10 mmol/L TPTZ 溶液和20 mmol/L 三氯化铁溶液配制FRAP工作液,现配现用。将样品溶液稀释至6 个不同质量浓度:0.01、0.02、0.03、0.04、0.05、0.06 mg/mL。于96 孔板中加入50 μL 不同质量浓度的待测溶液,再加入200 μL FRAP 工作液。室温避光反应20 min,测定593 nm 处的吸光度。用VC作阳性对照,每个样本重复3 次。
用去离子水将100 mmol/L FeSO4·7H2O 溶液梯度稀释,取50 µL 不同浓度的Fe2+标准溶液于96 孔板中,加入FRAP 工作溶液200 µL,室温下避光反应20 min,测定593 nm 处的吸光度。每个浓度重复3 次。以FeSO4的浓度(mmol/L)为自变量,以扣除空白对照的吸光度为因变量作图,并进行线性拟合,得到FeSO4标准曲线,回归方程为Y=3.4094X+0.0091(0~0.5 mmol/L,R2=0.9995)。根据回归方程计算出对应的FeSO4浓度,即为FRAP 值,此值越大,表明其铁离子还原能力越强。
1.2.7 抑制α-葡萄糖苷酶的活性测定 参考孙美玲等[24]的方法,取0.02、0.04、0.06、0.08、0.10、0.12 mg/mL 的样品溶液各10 µL 分别与等体积的α-葡萄糖苷酶(8.335 nkat/mL)均匀混合,于37 ℃下保温15 min。然后加入20 µL 的pNPG(5 mmol/L,溶解于pH 为6.8 的0.1 mol/L 磷酸盐缓冲液中)在37 ℃反应30 min,添加150 μL Na2CO3(1 mol/L)终止反应,在405 nm 处测定吸光度。以阿卡波糖为阳性对照,等体积磷酸盐缓冲液(0.1 mol/L,pH 为6.8)代替α-葡萄糖苷酶溶液作对照组,抑制率公式如下:
式中:W 为样品溶液或阿卡波糖对α-葡萄糖苷酶的抑制率;A 为样品的吸光度;A0为对照组的吸光度;A1为PBS 和pNPG 溶液与酶溶液混合反应的吸光度;A2为PBS 和pNPG 溶液混合反应的吸光度。
1.3 数据处理
本实验结果采用3 次平行数据进行分析,均使用平均数±标准差表示,使用Microsoft Office Excel 2019 进行实验数据分析;使用GraphPad Prism8 软件进行绘图、IC50值计算和基于Turkey 多重检验的单因素ANOVA 分析。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇浓度对欧李果渣原花青素得率的影响如图1 所示,欧李果渣中原花青素得率随着乙醇浓度的提高呈现先升高后下降的趋势,当乙醇浓度为60%时,原花青素得率最大。当乙醇浓度高于60%后,原花青素的得率下降。这是由于乙醇浓度的增大,脂溶性成分溶出增加,导致原花青素得率下降[25]。也有可能与不同浓度的乙醇极性或者高浓度乙醇对原花青素分子破坏有关[26]。根据实验结果,在正交试验设计中,乙醇浓度选取50%~70%。

图1 乙醇浓度对欧李果渣原花青素得率的影响Fig.1 Effect of ethanol concentration on the yield of proanthocyanidins from Cerasus humilis pomace
2.1.2 超声温度对欧李果渣原花青素得率的影响如图2 所示,欧李果渣中原花青素得率在30~50℃范围内随着温度升高而增加,已有研究证明酚类物质释放速率和物质的量随温度升高而增加[27]。当温度高于50 ℃后,原花青素得率不断降低。高温会导致原花青素稳定性降低[28],原花青素的结构被破坏,高温下其他成分也可能溶出,以致原花青素的含量下降。根据实验结果,在正交试验设计中,超声温度选取40~60 ℃。
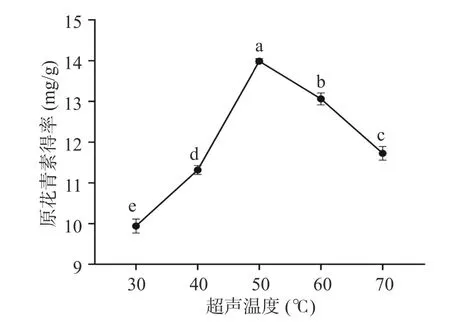
图2 超声温度对欧李果渣原花青素得率的影响Fig.2 Effect of sonication temperature on the yield of proanthocyanidins from C.humilis pomace
2.1.3 超声时间对欧李果渣原花青素得率的影响如图3 所示,超声时间为40 min 时,原花青素得率最大,超声时间多于40 min 时,随着超声时间的延长,原花青素的得率逐渐降低。当时间低于40 min 时,原花青素可能溶出还不够充分,但时间过长原花青素可能会与空气中的氧气发生氧化反应[29],导致得率下降。根据实验结果,在正交试验设计中,超声时间选取30~50 min。
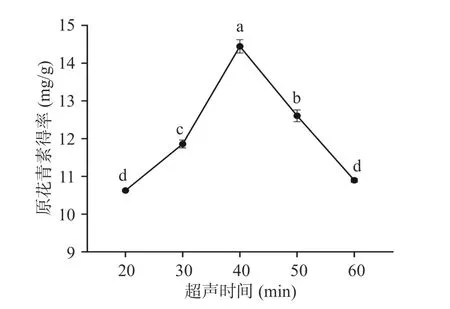
图3 超声时间对欧李果渣原花青素得率的影响Fig.3 Effect of sonication time on the yield of proanthocyanidins from C.humilis pomace
2.1.4 料液比对欧李果渣原花青素得率的影响 如图4 所示,料液比在1:20~1:30 g/mL 范围内,原花青素得率呈明显上升趋势,当料液比超过1:30 g/mL后,原花青素得率呈下降趋势。这可能是因为在料液比为1:30 g/mL 时,原花青素已经基本溶出,因此随着溶剂体积的增加,其他成分可能会溶出,与原花青素反应或干扰原花青素稳定性,导致原花青素的得率反而降低[30]。根据实验结果,在正交试验设计中,料液比选取1:25~1:35 g/mL。
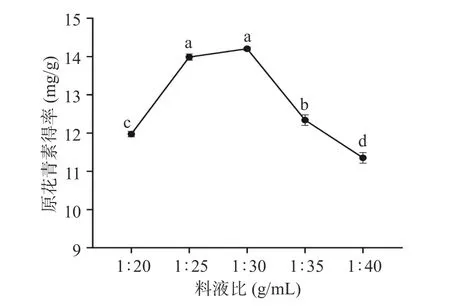
图4 料液比对欧李果渣原花青素得率的影响Fig.4 Effect of material-liquid ratio on the yield of proanthocyanidins from C.humilis pomace
2.2 正交试验优化工艺
在单因素实验结果的基础上,对乙醇浓度、超声温度、超声时间、料液比4 个因素进行四因素三水平的正交试验,正交试验结果如表2 所示。

表2 欧李果渣原花青素提取工艺正交试验结果Table 2 Results of orthogonal tests on the extraction process of proanthocyanidins from C.humilis pomace
由表2 可知,4 个因素对欧李果渣中原花青素提取得率的影响顺序为:超声温度>料液比>超声时间>乙醇浓度,最佳提取工艺为A3B3C2D2,即乙醇浓度70%,超声温度60 ℃,超声时间40 min,料液比1:30 g/mL,在此条件下进行欧李果渣中原花青素提取,原花青素得率为15.37 mg/g,高于实验中所有结果,该工艺条件稳定可靠。
2.3 欧李果渣原花青素体外抗氧化活性
2.3.1 DPPH 自由基清除能力 欧李果渣原花青素和VC的DPPH 自由基清除能力测定结果如图5 所示。欧李果渣原花青素和VC溶液对DPPH 自由基的清除率随着浓度增加而升高。在浓度为0.05~0.55 mg/mL 的浓度范围内,欧李果渣原花青素的DPPH 自由基清除率从38.43%增加到74.87%,VC的DPPH 自由基清除率从16.07%增加到57.84%。欧李果渣原花青素和Vc 的IC50值分别为0.10 和0.35 mg/mL,欧李果渣原花青素的IC50值显著低于Vc 的IC50值(P<0.05)。结果表明,欧李果渣原花青素比VC具有更强的DPPH 自由基清除能力。
2.3.2 ABTS+自由基清除能力 欧李果渣原花青素和VC的ABTS+自由基清除能力测定结果如图6 所示。欧李果渣原花青素和VC溶液对ABTS+自由基的清除率随着浓度增加而升高,在浓度为5~55 µg/mL的浓度范围内,欧李果渣原花青素的ABTS+自由基清除率从43.36%增加到99.78%,VC的ABTS+自由基清除率从14.87%增加到98.68%。欧李果渣原花青素和VC的IC50值分别为7 和26 µg/mL,欧李果渣原花青素的IC50值显著低于VC的IC50值(P<0.05)。结果表明,欧李果渣原花青素比VC具有更强的ABTS+自由基清除能力。

图6 欧李果渣原花青素对ABTS+自由基的清除作用Fig.6 Scavenging of ABTS+· by proanthocyanidins from C.humilis pomace
2.3.3 FRAP 法测铁离子还原能力 欧李果渣原花青素和VC的铁离子还原能力测定结果如图7 所示。欧李果渣原花青素和VC溶液的FRAP 值随着浓度增加而升高。在浓度为0.01~0.06 mg/mL 的浓度范围内,欧李果渣原花青素的FRAP 值从0.07 mmol/L增加到0.40 mmol/L,VC的FRAP 值从0.04 mmol/L增加到0.36 mmol/L,欧李果渣原花青素的FRAP 值显著高于VC的FRAP 值(P<0.05)。结果表明,在相同浓度下,欧李果渣原花青素比VC具有更强的铁离子还原能力。
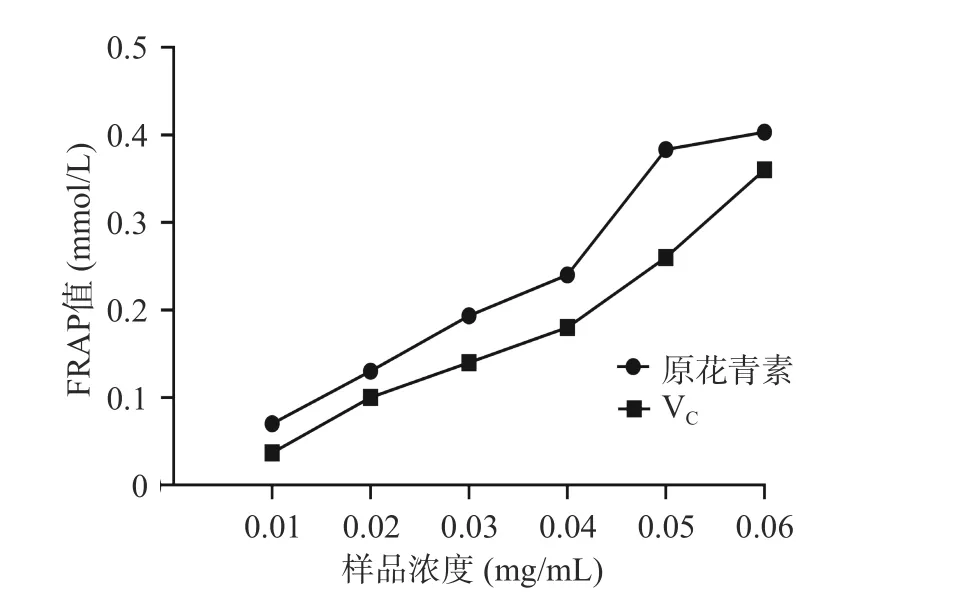
图7 欧李果渣原花青素的铁离子还原能力Fig.7 Iron ion reducing power of proanthocyanidins from C.humilis pomace
2.4 欧李果渣原花青素体外降糖活性
欧李果渣原花青素和阿卡波糖对α-葡萄糖苷酶的活性抑制测定结果如图8 所示。欧李果渣原花青素和阿卡波糖溶液随着浓度增加对α-葡萄糖苷酶抑制率升高。在浓度为0.02~0.12 mg/mL 的浓度范围内,欧李果渣原花青素对α-葡萄糖苷酶抑制率从23.24%增加到87.92%,阿卡波糖对α-葡萄糖苷酶抑制率从27.06%增加到97.48%。欧李果渣原花青素和阿卡波糖的IC50值分别为0.056 和0.046 mg/mL。结果表明,欧李果渣原花青素具有一定的降糖效果,但弱于阿卡波糖,其可视为一种有效的α-葡萄糖苷酶抑制剂。

图8 欧李果渣原花青素的α-葡萄糖苷酶活性抑制作用Fig.8 Inhibition of α-glucosidase activity by proanthocyanidins from C.humilis pomace
3 结论
本研究采用超声波辅助溶剂方式对欧李果渣原花青素提取工艺进行优化,通过单因素和正交试验得到最佳工艺条件:乙醇浓度70%,超声温度60 ℃,超声时间40 min,料液比1:30 g/mL,在此条件下,欧李果渣原花青素得率为15.37 mg/g。通过对纯化后的欧李果渣原花青素进行体外抗氧化和降糖实验发现其对自由基的清除能力和抗氧化活性均显著强于VC,也具有良好的α-葡萄糖苷酶抑制能力,但其抗氧化和降血糖能力综合评价仍需要动物实验进一步验证。本研究为欧李果渣原花青素的产品开发以及欧李果渣的资源利用提供一定的理论依据,具有较好的应用前景。

