蜜环菌Am-07-22 发酵对玉米赤霉烯酮降解效果影响及机理初探
王泽贤,赵宇楠,贾丹丹,纪晚唐,许 丁,向杨玲,蔡 丹,刘景圣
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程研究中心,吉林长春 130118)
玉米赤霉烯酮(Zearalenone,ZEN)是一种非甾体雌激素真菌毒素,又称为F-2 毒素,是一种主要由镰刀菌属真菌产生的次级代谢产物,主要存在于被污染的玉米、小麦、大米、大豆等谷物中[1]。ZEN 会通过多种途径污染谷物,食品和饲料等,严重威胁人类健康和生命安全,其化学结构与许多类雌激素具有相似的特性,会激活雌激素受体,引起农产动物的流产、死胎、畸形胎等生殖障碍[2]。另外ZEN 还会通过食物链进入人体,造成免疫损伤[3]、肝脏损伤[4]、具有遗传毒性[5]、诱发癌症[6]等危害。ZEN 的污染及毒性危害较大,因此寻找到高效降解ZEN 的方法变得尤为重要。
常见的降解玉米赤霉烯酮的方法包括物理方法、化学方法和生物方法[7]。物理方法主要通过热处理、紫外线辐射或γ射线照射、吸附剂吸附等[8-9]。化学方法包括氨化法、碱法、臭氧处理、氧水处理等[10]。但物理化学方法具有降解效率较低,破坏营养成分,引入其他化学物质等不利因素等限制。而生物方法因其具有高效性、高特异性、污染少逐渐成为真菌毒素降解的聚焦热点,研究表明玉米赤霉烯酮的生物降解主要来自以下两类:微生物降解和酶降解[11]。迄今为止,大量研究成果显示微生物具有显著的脱除玉米赤霉烯酮的作用,种类主要涉及乳酸菌、芽孢杆菌、曲霉菌和酵母菌等[12-13]。Zhao 等[14]和 Xu 等[15]研究发现芽孢杆菌可有效降解 ZEN。González 等[16]测试了11 种已经能证明降解 AFB1 的芽孢杆菌降解 ZEN 的能力,结果发现所有菌株在 30 ℃ 下培养72 h 内均能降解 ZEN。另外 Sun 等[17]从发酵大豆中分离出的食品级黑曲霉 FS10 在 PDB 培养基中能有效去除 ZEN,菌丝体和培养滤液也可降低 43.10%和 68.16% 的 ZEN。
尽管现阶段对细菌及相关酶降解ZEN 的相关研究较为普遍,但大型食用真菌降解ZEN 及相关机理的研究依然较少,国内外学者研究发现大型食用真菌能够代谢产生漆酶,并且漆酶在降解真菌毒素方面有着良好的应用[18]。Loi 等[19]研究杏鲍菇漆酶Ery4和漆酶介体体系(LMSs)对多种真菌毒素及毒素联合使用的降解能力,结果对AFB1、FB1、OTA、ZEN 和T-2 毒素均有不同程度的降解效果。Song 等[20]在毕赤酵母X33 中表达了来自秀珍菇的漆酶基因Lac2,结果表明Lac2-ABTS 和 Lac2-AS 两种体系在pH4~8 及温度40~60 ℃范围内均为降解玉米赤霉烯酮的有效体系。
实验室前期研究发现蜜环菌Am-07-22 具有能够降解真菌毒素的潜力,因此本试验在此基础上以玉米赤霉烯酮(ZEN)为研究对象,蜜环菌Am-07-22 为试验菌株,通过生物发酵降解的技术,研究蜜环菌Am-07-22 对ZEN 的降解特性和相关机理,为玉米赤霉烯酮生物脱毒提供新的菌株资源,为食用菌应用于真菌毒素防控奠定理论基础。
1 材料与方法
1.1 材料与仪器
菌种 蜜环菌Am-07-22(Armillaria mellea)由小麦和玉米深加工国家工程研究中心保藏;玉米赤霉烯酮ZEN 固体标准品(纯度>99%)购于青岛普瑞邦(Pribolab)生物工程有限公司,固体标准品用色谱级甲醇溶液溶解稀释,配制成浓度为100 μg/mL 的ZEN 标准储备液,于-20 ℃避光保存;蛋白酶K(≥30 units/mg protein)、SDS 上海阿拉丁生化科技股份有限公司;蜜环菌Am-07-22 固体斜面培养基为12°Bé麦芽汁琼脂培养基;蜜环菌Am-07-22 液体培养基 马铃薯20%、蚕蛹粉0.5%、葡萄糖1%、蔗糖1%、酵母浸粉2%、磷酸二氢钾 0.15%、七水合硫酸镁0.075%、维生素B10.001%,pH 自然,121 ℃灭菌20 min。
1200 型高效液相色谱仪 美国Agilent 公司;JY 92-IIN 超声波细胞破碎仪(配备φ6 变幅杆)宁波新芝生物科技股份有限公司;Allegra X-30R 高速离心机 美国Beckman 公司;DSX-18L-I 手提式高压蒸汽灭菌锅 上海申安医疗器械厂;Stab S2 振荡培养箱 上海润度生物科技有限公司;HH-S4 数显恒温水浴锅 常州市金坛友联仪器研究所;BSA2245电子分析天平 Sartorious(北京)有限公司。
1.2 实验方法
1.2.1 菌种活化 参考何音华[21]的方法对菌种进行活化,将保藏的蜜环菌Am-07-22 菌种转接至12°Bé新鲜麦芽汁琼脂斜面培养基中,并放置于培养箱,在27 ℃条件下培养至第12 d 备用。
将活化好的蜜环菌Am-07-22 菌株从固体斜面培养基中取8 块1 cm3的菌体接种至30 mL 液体培养基中,于27 ℃恒温摇床中振荡培养6 d,摇床转速为160 r/min,培养结束即为制得的一级种子液,于4 ℃的条件下保存。再将一级种子液打碎,以8%的接种量接种至200 mL 的液体种子培养基中,于27 ℃、160 r/min 的培养条件下再次振荡培养6 d,得到二级种子液。二级种子液也于4 ℃条件下保存。
1.2.2 ZEN 的检测 参考骆翼[22]的高效液相色谱的ZEN 检测条件并加以改进,具体的检测条件如下:
色谱柱:Extend-C18柱,柱长150 mm,内径4.6 mm,粒度5 μm。流动相:甲醇:水=70:30、柱温:25 ℃、流速:0.6 mL/min、进样量:20 μL、紫外吸收波长:236 nm。
吸取适量的ZEN 标准储备液,用甲醇溶液稀释,配制成15、10、5、2、1、0.5、0.2 μg/mL 的不同浓度ZEN 工作液,于4 ℃避光保存。标准工作液经过0.22 μm 滤膜过滤后,使用高效液相色谱仪进行检测。以ZEN 浓度为横坐标,以高效液相色谱检测ZEN 的峰面积为纵坐标绘制标准曲线。
1.2.3 蜜 环 菌Am-07-22 降 解ZEN 效 果 及ZEN 回收率的测定 将制备好的蜜环菌Am-07-22 二级种子培养液(菌种浓度为75 g/L)破碎处理后,接种至ZEN 含量为5 μg/mL 的10 mL 液体培养基中,接种量为10%,然后将反应体系在27 ℃,160 r/min 的恒温摇床中振荡避光反应7 d。取1 mL 上清液加入1 mL 甲醇溶液进行ZEN 的提取,然后在10000 r/min的条件下低温离心10 min,取上清再经过0.22 μm滤膜过滤后,使用高效液相色谱仪检测ZEN 的含量,并计算ZEN 的降解率。ZEN 降解率计算公式如下:
式中,ZEN 对照组:ZEN 含量为5 μg/mL 未接种蜜环菌Am-07-22 的液体培养基。
同时对该提取方法进行加标回收率的计算,分别添加0.5、2、10 μg/mL 浓度的ZEN 标准工作液,采用上述方法提取与检测,每个浓度3 个平行。
1.2.4 ZEN 浓度对蜜环菌Am-07-22 降解的影响将打碎的蜜环菌Am-07-22 二级种子液接种至含有ZEN 浓度分别为2、5、7.5、10、15 μg/mL 的10 mL液体培养基中,接种量为10%,每个菌种3 个平行,然后将反应体系在27 ℃,160 r/min 的恒温摇床中振荡避光反应7 d。提取ZEN 后使用高效液相色谱仪检测玉米赤霉烯酮的含量,每组3 个平行,并计算ZEN 的降解率和降解量。
1.2.5 培养时间、温度、初始pH 和接种量对蜜环菌Am-07-22 降解ZEN 的影响 将打碎的蜜环菌Am-07-22 二级种子液接种至含有ZEN 浓度分别为5 μg/mL 的10 mL 初始pH 分别为4、5、6、7、8、9 的液体培养基中,接种量分别为2.5%、5%、7.5%、10%、12.5%、15%,然后将反应体系在18、21、24、27、30、33 ℃,160 r/min 的恒温摇床中振荡避光分别反应4、5、6、7、8、9 d。其中单因素固定条件为培养时间7 d、培养温度27 ℃、初始pH 自然、接种量10%。使用高效液相色谱仪检测玉米赤霉烯酮的含量,每组3 个平行,并计算ZEN 的降解率。
1.2.6 蜜环菌Am-07-22 降解ZEN 活性部位的检测
将蜜环菌Am-07-22 重新接种于液体种子培养基中,在27 ℃恒温摇床中以160 r/min 转速的条件下振荡培养6 d。培养结束后用4 层滤布过滤,收集所得到的菌丝体及发酵上清液,对降解ZEN 的菌体种子发酵液活性部位进行检测,共分3 组进行,以含有浓度为5 μg/mL 的ZEN 作为对照组,每组取3 个重复样品进行试验。
参考金博文[23]的方法对不同组进行处理,A 组(发酵上清液):取过滤后的上层发酵液,在4 ℃,10000 r/min 的条件下低温离心10 min,收集上清液1 mL。B 组(菌丝体组):称取过滤后的下层菌丝体1 g,用PBS 缓冲液轻轻漂洗3~5 次。C 组(细胞破碎组):称取过滤后的下层菌丝体1 g,用PBS 缓冲液轻轻漂洗3~5 次,进行细胞超声破壁处理2 h(200 W,工作5 s,间歇5 s),然后在10000 r/min 的条件下低温离心10 min,收集胞内液1 mL。将制备后的实验组加入稀释后的ZEN 标准储备液(见1.1),体系中ZEN 的浓度为5 μg/mL,反应体系在27 ℃、160 r/min条件下避光振荡培养7 d。
1.2.7 蜜环菌Am-07-22 降解ZEN 活性物质性质的初步分析 参考景思源[24]的处理方法对活性物质进行分析,分3 组处理:1 组(蛋白酶K 组):取5 mL 发酵上清液,加入250 μL 蛋白酶K(终浓度为0.1 mg/mL),55 ℃处理2 h。2 组(SDS 组):取5 mL 发酵上清液,加入250 μL SDS(终浓度为0.5 mg/mL),55 ℃处理2 h。3 组(蛋白酶K+SDS 组):取5 mL 发酵上清液,加入250 μL 蛋白酶K(终浓度为0.1mg/mL)和250 μL SDS(终浓度为0.5 mg/mL),55 ℃处理2 h。4 组(100 ℃沸水浴组):取5 mL 发酵上清液,在100 ℃条件下沸水浴处理20 min。
将不同处理后的4 组发酵上清液用0.22 μm 滤膜过滤后,向其中加入ZEN 储备液,体系中ZEN 的浓度为5 μg/mL,反应体系在27 ℃、160 r/min 条件下避光振荡培养7 d。结束后使用高效液相色谱仪检测ZEN 含量并计算降解率。同时用初始浓度为5 μg/mL ZEN 的发酵上清液作为对照组。
1.2.8 蜜环菌Am-07-22 产漆酶酶活测定 参考刘天睿等[25]的方法并加以改进,从发酵上清液中取样测定蜜环菌Am-07-22 第1 d 至第10 d 产漆酶的酶活力,采用ABTS 法测定漆酶酶活,以ABTS 为底物,通过酶标仪测定漆酶活力。在200 μL 酶活反应体系中先加入50 μL 0.5 mmol/L 的ABTS 及100 μL 0.2 mol/L 柠檬酸钠缓冲溶液(pH4.0),混合均匀,再加入稀释10 倍后的酶液50 μL 启动反应,每隔1 min记录420 nm 吸光度值的变化,在符合线性关系处求出斜率并换算出酶活力。漆酶酶活性的定义为以每分钟氧化1 μmol ABTS 所需要的漆酶量作为1 个酶的活力单位,酶活的单位为U/L。漆酶活力计算公式:
式中,ε为ABTS 的摩尔吸光系数为36000 L/(mol·cm),N 代表稀释倍数,V 总代表酶活测定体系中的反应液的总体积,V 酶代表反应添加的酶液体积。
1.2.9 发酵时间、pH、金属离子对蜜环菌Am-07-22发酵上清液降解ZEN 的影响 参考韦锦范[26]的方法并加以改进,按照上述方法收集蜜环菌Am-07-22的发酵上清液,向其中加入浓度为5 μg/mL ZEN 标准溶液,于27 ℃,160 r/min 的条件下振荡反应。单因素固定条件为反应时间7 d、pH 自然、未添加金属离子。分别在反应时间为1、2、3、4、5、6、7、8、9、10 d 取样测定反应体系中ZEN 含量的变化,并计算降解率。分析不同时间对蜜环菌Am-07-22 发酵上清液降解ZEN 的影响。另外再取发酵上清液分别调节pH 为3、4、5、6、7、8、9、10,以及向其中加入浓度为10 mmol 的Na+、K+、Mg2+、Zn2+、Cu2+、Fe2+、Fe3+、Mn2+金属离子,向其中加入浓度为5 μg/mL ZEN 标准溶液,于27 ℃,160 r/min 的条件下振荡反应,以不添加金属离子的发酵上清粗酶液反应7 d 作为对照,每组三个重复。反应结束后取1 mL 反应液加入等体积甲醇溶液进行玉米赤霉烯酮的提取,充分摇匀后在10000 r/min 的条件下低温离心10 min,再经过0.22 μm 滤膜过滤后,使用高效液相色谱仪检测玉米赤霉烯酮的含量,并计算ZEN 的降解率。分析不同pH 与不同金属离子对蜜环菌Am-07-22 发酵上清液降解ZEN 的影响。
1.3 数据处理
所有试验数据均为一式三份,并用“平均值±标准差”的形式表示。采用SPSS 23 进行数据的显著性分析,P<0.05 表示具有显著性差异。使用Pearson相关性分析法来分析ZEN 降解率与漆酶酶活之间的相互关系。最后使用Origin 2019 软件进行数据处理与图像绘制。
2 结果与分析
2.1 蜜环菌Am-07-22 对ZEN 的降解效果
通过高效液相色谱法对不同浓度的ZEN 进行测定,最终得到的标准标准曲线线性回归方程:y=150.13x+5.0423,其中R²=0.9999,表明线性关系良好。通过向培养基中添加5 μg/mL 的ZEN,并利用蜜环菌Am-07-22 菌株进行发酵降解,由图1 的高效液相色谱图可知蜜环菌Am-07-22 对5 μg/mL ZEN的降解效果良好,降解率可达73.83%。另外通过添加0.5、2、10 μg/mL 浓度的ZEN,回收率测定分别为96.38%±1.28%、98.64%±0.37%、97.63%±0.95%。表明此方法对ZEN 的回收率较高,准确性良好,符合检测标准。

图1 菌株Am-07-22 降解ZEN 的液相色谱图Fig.1 Liquid chromatogram of strain Am-07-22 degrading ZEN
2.1.1 ZEN 浓度对蜜环菌Am-07-22 降解效果的影响 如图2 所示,蜜环菌Am-07-22 对不同浓度ZEN的降解率有所不同,当初始浓度为2 μg/mL 时降解率可达97.32%,ZEN 浓度为5 μg/mL 时具有73.83%±1.34%(图1 中的液相色谱图出自此次实验)的降解率,而当ZEN 的浓度升至10 μg/mL 和 15 μg/mL 时,降解率则更低分别为49.47%和32.55%。由此可见降解率随着ZEN 浓度的升高而下降。但从图3 中可以看出当初始浓度为2 μg/mL 时对ZEN 的降解量为19.46 μg,初始浓度为5 μg/mL 时对ZEN 的降解量为36.5 μg,而在初始浓度为10 μg/mL 和15 μg/mL时可降解ZEN 的量则均超过了48.82 μg,并且差异不显著(P>0.05),因此蜜环菌Am-07-22 对ZEN 的降解量逐渐升高且趋于稳定。在低浓度时,初始ZEN的含量本身较低,尽管降解率很高但最终的降解量依然较低,而在高浓度时初始ZEN 的含量则较高,即使降解率有所下降,但降解量却不断增高,最后逐渐稳定达至降解上限。菌株对ZEN 浓度为2 μg/mL 的降解率已经超过97%,降解效果较好,为了节省成本,后续选择初始浓度为5 μg/mL 的 ZEN 进行实验。

图2 ZEN 初始浓度对Am-07-22 降解ZEN 降解率的影响Fig.2 Effect of initial ZEN concentration on the degradation rate of ZEN by Am-07-22
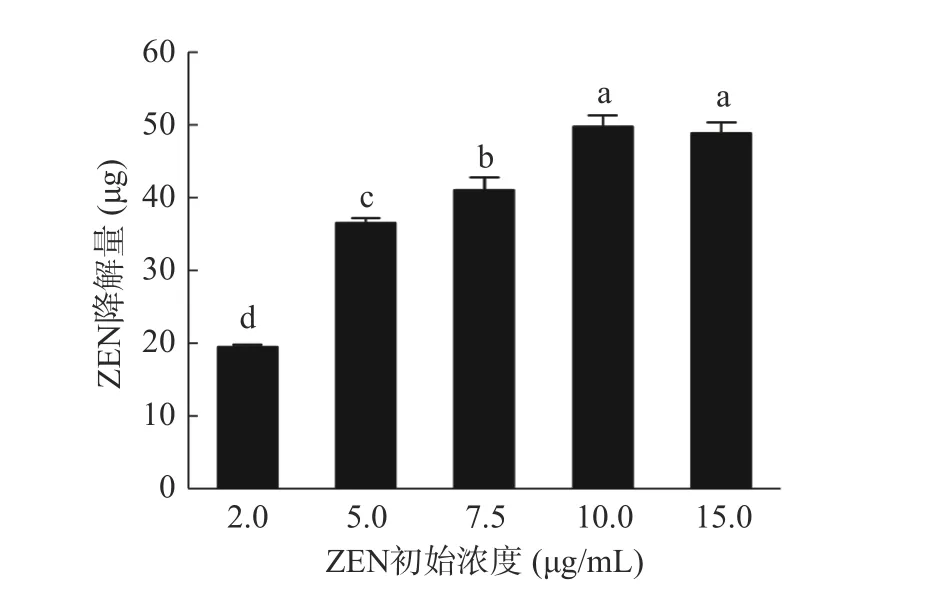
图3 ZEN 初始浓度对Am-07-22 降解ZEN 降解量的影响Fig.3 Effect of initial ZEN concentration on the degradation content of ZEN by Am-07-22
2.1.2 培养时间对蜜环菌Am-07-22 降解ZEN 的影响 由图4 可知,蜜环菌Am-07-22 对ZEN 的降解率会随着培养时间的延长而逐渐增大(P<0.05),从最开始的第4 d 降解率为52.64%上升至第7 d 的72.08%。而第8、9 d 的降解率升至77.41%和77.23%,此时降解率的差异不显著(P>0.05),表明第8~9 d 的降解率最高并已趋于稳定。这可能是因为8 d 为蜜环菌Am-07-22 的最佳生长时间,此时菌种活力最强,对ZEN 的降解率也达到最大,即使延长培养时间,ZEN的降解率也不会有显著变化,这与Wang 等[27]的研究结论相符。因此最佳的培养时间为第8 d。
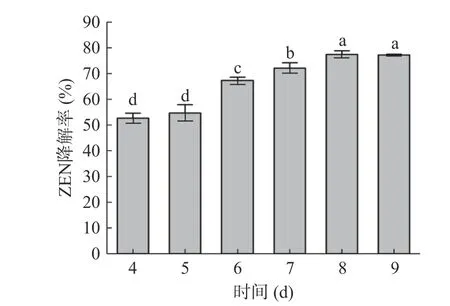
图4 时间对Am-07-22 降解ZEN 降解率的影响Fig.4 Effect of time on the degradation rate of ZEN by Am-07-22
2.1.3 培养温度对蜜环菌Am-07-22 降解ZEN 的影响 由图5 可知,在18~27 ℃的范围内蜜环菌Am-07-22 对ZEN 的降解率随温度的升高而显著增大(P<0.05),从18 ℃时39.92%的降解率升高至27 ℃时的73.94%。而在27~33 ℃的条件下,降解率反而随温度升高而显著下降(P<0.05),其中在33 ℃时对ZEN 降解率为45.52%。这表明过高或过低的温度对蜜环菌Am-07-22 降解ZEN 的影响均较大,在不适宜的温度条件下蜜环菌的生长环境变差,因此对ZEN 的降解率也会降低,这一结果与Xu 等[15]的研究相符,因此最佳的培养温度为27 ℃。

图5 温度对Am-07-22 降解ZEN 降解率的影响Fig.5 Effect of temperature on the degradation rate of ZEN by Am-07-22
2.1.4 初始pH 对蜜环菌Am-07-22 降解ZEN 的影响 由图6 可知,在pH4.0~9.0 范围内随着pH 的增大,蜜环菌Am-07-22 对ZEN 的降解率呈现先升高后降低的趋势(P<0.05),pH 为7.0 时的降解率最高可达75.22%。而pH 为4.0 及9.0 时的降解率仅为45.89%和61.97%。这说明在过酸或过碱的环境下,降解效果均会受到影响。在pH 为7.0~8.0 的环境中降解效果最佳,降解率达到最高(自然pH 为6.2,蜜环菌Am-07-22 在此条件下的生长状态最好,但不是最佳的降解ZEN 的初始pH),这与Tan 等[28]的研究结果相近。因此选择初始pH 为7.0 作为降解ZEN最佳的初始pH。

图6 初始pH 对Am-07-22 降解ZEN 降解率的影响Fig.6 Effect of initial pH on the degradation rate of ZEN by Am-07-22
2.1.5 菌液接种量对蜜环菌Am-07-22 降解ZEN 的影响 由图7 可知,随着蜜环菌Am-07-22 菌液接种量的增加,对ZEN 的降解率逐渐升高(P<0.05)。最终在接种量为10%~15%时趋于恒定,此时的降解率均高于73%。这表明了蜜环菌Am-07-22 在此时的生长环境中已然达到最大的生长量,接种量的增加也不会表现出对ZEN 降解率的升高。为节省蜜环菌Am-07-22 菌种用量,选择接种量10%作为最佳降解ZEN 的接种量。最终选择的降解条件为培养时间8 d,培养温度27 ℃,初始pH7.0,接种量10%,此时对ZEN 的降解率最佳为78.72%。

图7 菌液接种量对Am-07-22 降解ZEN 降解率的影响Fig.7 Effect of the added amount of fungal liquid on the degradation rate of ZEN by Am-07-22
2.2 蜜环菌Am-07-22 对ZEN 的降解机理初探
2.2.1 蜜环菌Am-07-22 降解ZEN 的活性部位 从图8 中可以看出蜜环菌Am-07-22 不同组分对ZEN的降解效果差异较为明显(P<0.05)。其中发酵上清液对ZEN 的降解率最高为47.42%,而Am-07-22 菌体细胞的降解率为37.05%,破碎后的菌体细胞对ZEN 的降解率最低仅为13.08%。由此可以推断,蜜环菌Am-07-22 对ZEN 的清除作用不是单一的一种方式,存在多种途径。最主要的清除作用为发酵上清液对ZEN 的降解作用,而菌体细胞对ZEN 也有一定程度的吸附作用。

图8 菌株Am-07-22 的不同组分对ZEN 的降解率Fig.8 Degradation rate of ZEN by different components of Am-07-22
2.2.2 蜜环菌Am-07-22 降解ZEN 活性物质的分析
由图9 可知,通过对蜜环菌发酵上清液进行蛋白酶K、SDS、沸水浴等处理,发现以上几种处理方式对ZEN 降解有显著的影响(P<0.05)。蛋白酶K 和SDS 处理后的降解率分别为12.65%和22.89%,蛋白酶K+SDS 共同处理的降解效果与蛋白酶单独处理的降解效果差异则不显著(P>0.05)。而沸水浴后对ZEN 的降解率仅为5.55%,降解能力明显下降。推测在蜜环菌分泌的多种活性成分中,发酵上清液中存在的某种酶类会降解ZEN,蛋白酶K 和沸水浴会破坏这种酶的结构导致酶活力下降,对ZEN 的降解率由此下降,这与Imade 等[29]的研究结果相符。而蜜环菌具有良好地产生漆酶的特点,Banu 等[30]也研究发现漆酶对ZEN 具有降解潜力。
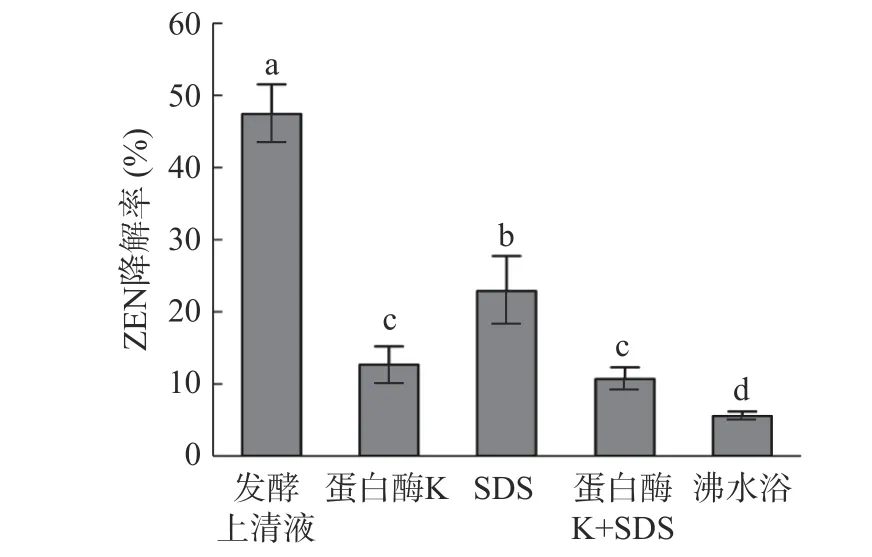
图9 菌株Am-07-22 发酵上清液经不同处理后对ZEN 的降解率Fig.9 Degradation rate of ZEN by fermentation supernatant of strain Am-07-22 after different treatment
2.2.3 发酵时间对蜜环菌Am-07-22 发酵上清液降解ZEN 影响及产漆酶酶活测定 考察了发酵第1 d至第10 d 蜜环菌Am-07-22 发酵上清液中漆酶酶活力的变化及对ZEN 降解效果的影响并侧重对两者之间的相关性进行分析。由图10 可知,随着发酵时间的延长蜜环菌Am-07-22 发酵上清液对ZEN 的降解率逐渐增大(P<0.05),从第1 d 21.69%的降解率上升至第10 d 62.50%的降解率,而蜜环菌产漆酶的酶活力也随着发酵时间的延长逐渐升高(P<0.05),由第1 d 的酶活仅为169.26 U/L,到第10 d 的酶活则上升至521.11 U/L,这与ZEN 的降解率升高保持一致。通过Pearson 相关性来分析ZEN 降解率与漆酶酶活之间的相互关系,结果证实在0.05 的显著性水平上ZEN 降解率与漆酶酶活之间存在着显著关联,其相关性为正且r=0.973。由此可以推测蜜环菌Am-07-22 产生的漆酶可能在降解ZEN 中起主要作用,这与Banu 等[30]的研究结果相符。
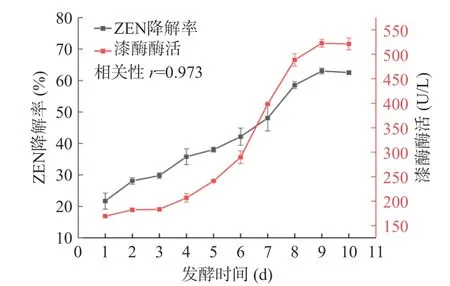
图10 不同发酵时间下Am-07-22 上清液对ZEN 的降解率和漆酶酶活的变化规律Fig.10 Change rule of degradation rate of ZEN and laccase activity of Am-07-22 supernatant under different fermentation time
2.2.4 不同pH 对蜜环菌Am-07-22 发酵上清液降解ZEN 的影响 由图11 可以看出不同pH 对蜜环菌Am-07-22 发酵上清液对ZEN 的降解率影响较大。其中在pH 为6.0~7.0 时,ZEN 的降解率最高为46.98%和51.84%。两者与不调节pH 的发酵上清液对照组没有显著性差异(P>0.05)。而在酸性及碱性条件下,对ZEN 的降解率显著降低(P<0.05),在pH 为3.0 和10.0 时仅有8.29%和11.22%的降解率。表明了在过酸或过碱的条件下,发酵上清液中产生的漆酶会受环境影响结构被破坏,对ZEN 的降解作用因此下降,因此在不适宜的pH 条件下,漆酶无法有效地降解ZEN,致使对ZEN 的降解率降低。在pH 为6.0~7.0 的范围内,均为降解ZEN 的适宜条件,这与白长胜等[31]的研究结果相符。

图11 不同pH 对Am-07-22 发酵上清液对ZEN 降解率的影响Fig.11 Effect of different pH on the degradation rate of ZEN by the fermentation supernatant of Am-07-22
2.2.5 不同金属离子对蜜环菌Am-07-22 发酵上清液降解ZEN 的影响 由图12 可知,不同金属离子对蜜环菌Am-07-22 发酵上清液降解ZEN 的影响效果不尽相同,其中Na+、K+和Fe2+的添加对发酵上清液降解ZEN 的效果与未添加金属离子时的降解效果差异不明显。Zn2+、Fe3+的添加对ZEN 降解率有一定的抑制作用(P<0.05),降解率分别为42.09%和37.76%,Fe3+的抑制效果最明显较对照降低了9.66%。而Cu2+、Mg2+、Mn2+的添加对发酵上清液降解ZEN的效果得到显著增强(P<0.05),添加Mg2+和Mn2+对ZEN 的降解率分别为55.57%和57.80%,而添加Cu2+对发酵上清液降解ZEN 的降解效果提升最高为63.37%,较未添加金属离子的对照组提高了15.95%。由此可以推断Cu2+会显著增强漆酶的酶活力,这与祝嫦巍等[32]的研究结果一致,推测原因可能与漆酶本身的结构有关,漆酶为含四个铜离子的多酚氧化酶,属于铜蓝氧化酶类,因此Cu2+存在的环境中会增强漆酶的活性。
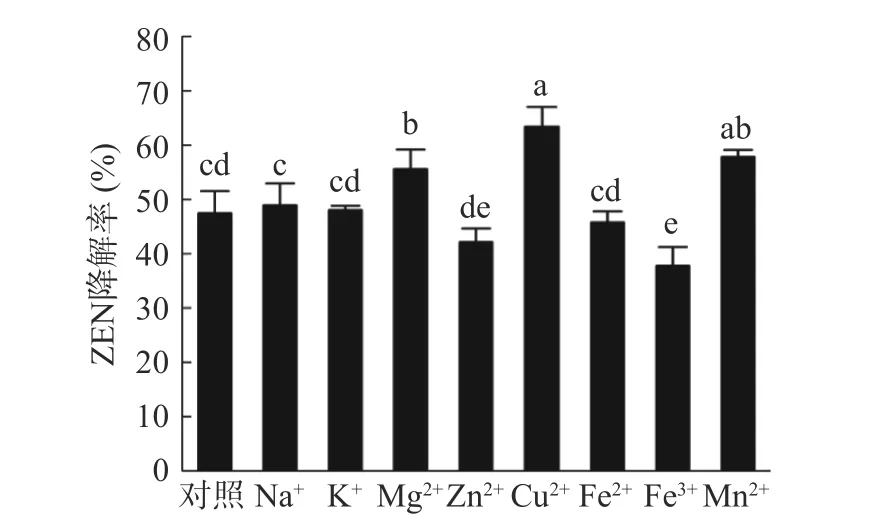
图12 不同金属离子对Am-07-22 发酵上清液对ZEN 降解率的影响Fig.12 Effect of different metal ions on the degradation rate of ZEN by the fermentation supernatant of Am-07-22
3 结论
本研究以蜜环菌Am-07-22 为试验菌株,采用真菌生物发酵的方式降解玉米赤霉烯酮(ZEN)。其对5 μg/mL ZEN 的降解率可达78.72%,最适的降解条件为培养时间8 d,培养温度27 ℃,初始pH7.0,接种量10%。蜜环菌Am-07-22 发酵上清液中的活性成分是降解ZEN 的主要方式,菌体细胞对ZEN 也有一定的吸附作用。另外发酵上清液对ZEN 的降解率与漆酶酶活的相关性较高,而且Cu2+对发酵上清液降解ZEN 具有最佳的促进作用。因此可推断出蜜环菌Am-07-22 发酵上清液中产生的漆酶在降解ZEN 中起主要作用。本研究结果表明蜜环菌Am-07-22 具有降解玉米赤霉烯酮的能力,为玉米赤霉烯酮的防治提供了新的研究思路。

