基于AMPK/SIRT1/SREBP1信号通路探究膜肾颗粒对膜性肾病大鼠蛋白尿的治疗作用
王含香,林 威,崔师妍,徐荣佳,徐鹏昊,黄诗琦,李雨琛,戴欣晴,姜 晨*
1.天津中医药大学第一附属医院,国家中医针灸临床医学研究中心,天津 300381
2.厦门市中医院,福建 厦门 361001
膜性肾病(membranous nephropathy,MN)是一种非炎症性自身免疫性疾病,其特征是免疫复合物沉积于肾小球基底膜上皮细胞下,最终导致足细胞损伤,产生大量蛋白尿,进一步可发展为肾衰竭[1]。据调查研究显示,近年来我国各地区MN 的发病率均显著增加[2-4],截止到2018 年,华中地区MN 发病率高达24.09%,已超过免疫球蛋白A 肾病(immunoglobulin A nephropathy,IgAN)成为成人最常见的原发性肾小球肾炎[4]。
慢性肾脏疾病中普遍存在脂质代谢异常,脂质积累是导致肾脏病快速进展的重要因素[5]。沉默信息调节因子1(silent information regulator 1,SIRT1)可通过过氧化物酶体增生物激活受体γ 辅激活子-1α ( peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)的去乙酰化参与控制能量代谢,是肝脏脂质和胆固醇稳态的重要因素[6],SIRT1 还可以通过激活单磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)抑制脂肪酸合成酶(fatty acid synthase,FAS)的表达和脂质积累[7]。研究显示,可以通过抑制SIRT1 介导的甾醇调节元件结合蛋白 1(sterol regulatory element-binding protein 1,SREBP1)信号通路调节足细胞脂质代谢[8]。SIRT1 是AMPK/SREBP1 信号传导连接的关键介质[9]。研究表明,通过抑制AMPK 和SIRT1 表达,介导SREBP1 信号传导可以调节足细胞脂质合成[10]。
膜肾方是天津中医药大学第一附属医院杨洪涛教授创制出治疗MN 的经验方剂,由生黄芪、炒白术、枸杞、杜仲、蝉衣、青风藤、鬼箭羽、穿山龙、败酱草、金樱子、车前子、五味子、土元、当归14味药组成,具有健脾益肾、祛风通络之效,据此研制的膜肾颗粒使临床用药更加方便快捷。前期研究发现膜肾方联合基础治疗可有效降低患者蛋白尿水平,并且对调节血脂有辅助疗效,膜肾颗粒不仅可以减轻MN 大鼠肾小球足细胞损伤,还可有效调节MN 大鼠血脂水平。故本研究将基于AMPK/SIRT1/SREBP1 信号通路观察膜肾颗粒对MN 大鼠蛋白尿的影响,进一步揭示膜肾颗粒治疗MN 的作用机制,为MN 的治疗提供思路和方法。
1 材料
1.1 动物
80 只SPF 级雄性SD 大鼠,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010。动物饲养于天津市中西医结合医院动物实验室,动物实验方案经过天津市南开医院实验动物伦理委员会审查,伦理编号为NKYY-DWLL-2021-001。
1.2 药品与试剂
膜肾颗粒(批号20220603,20.5 g/袋)按GMP标准由江苏九旭药业有限公司生产,方药采用免煎颗粒剂,每克膜肾颗粒含生药5.75 g;环孢素(cyclosporin A,CsA)软胶囊(国药准字H10960122)购自杭州中美华东制药有限公司;阳离子化牛血清白蛋白(cationic bovine serum albumin,C-BSA,批号10711454001)购自德国默克公司;苏木素-伊红(HE)染色试剂盒(批号G1120)购自北京索莱宝科技有限公司;基底膜六胺银染色液(periodic acidsilver methenamine,PASM,批号DG0090)购自北京雷根生物技术有限公司;尿蛋白定量(urinary protein quantity,UTP)测试盒(批号C035-2-1)、胆固醇(total cholesterol,TC)试剂盒(批号A111-1-1)、三酰甘油(triglyceride,TG)试剂盒(批号A100-1-1)、尿素氮(blood urea nitrogen,BUN)试剂盒(批号C013-2-1)、血肌酐(serum creatinine,Scr)试剂盒(批号C011-2-1)购自南京建成生物有限公司;AMPKα 兔抗(批号2532)、p-AMPKα 兔抗(批号50081)购自美国CST 公司;Nephrin 兔抗(批号ab216692)、SREBP1兔抗(批号ab28481)购自英国Abcam 公司;SIRT1兔抗(批号MA5-27217)购自美国Invitrogen 公司;β-actin 鼠抗(批号UM4001)购自天津优抗生物技术有限公司;HRP 标记的羊抗兔IgG 二抗(批号bs-0295G-HRP)、HRP 标记的羊抗小鼠IgG 二抗(批号bs-0296G-HRP)购自Bioss 公司。
1.3 仪器
Micro17 型低温高速离心机(美国Thermo Fisher Scientific 公司);全自动生化分析仪(日本Olympus公司);E100 型正置光学显微镜(日本Nikon 公司);PowerPac HC 型电泳仪、Trans-Blot SD 型转膜仪(美国Bio-Rad 公司);SpectraMaxM5 型酶标仪(美国Molecular Devices 公司);TS-200 型脱色摇床(海门市其林贝尔仪器制造有限公司);Tanon 5200 型全自动化学发光图像分析系统(上海天能科技有限公司)。
2 方法
2.1 造模、分组与给药
80 只大鼠适应性喂养1 周后,收集24 h 尿液测定24 h-UTP,蛋白尿阴性,随机分为空白组15 只和造模组65 只。按照改良Border 法[11]采用尾iv CBSA 制备MN 大鼠模型。预免疫1 周后正式免疫,将质量浓度为2 mg/L 的C-BSA 与等量PBS 充分混匀后进行尾iv,每次0.5 mL,空白组注射等体积生理盐水,隔日1 次,连续4 周。注射结束后,随机抽取造模组大鼠2 只,于光镜下观察肾脏病理学改变,同时以24 h-UTP≥20 mg 确认造模成功。造模成功的大鼠随机分为模型组、CsA(9 mg/kg)组和膜肾颗粒低、高剂量(1.85、7.38 g/kg,分别相当于临床剂量的0.5、2 倍)组,每组15 只,给药前将研磨成细粉的药物溶于蒸馏水,按10 mL/kg ig 给药,空白组及模型组ig 等体积蒸馏水,1 次/d,连续给药4 周。
2.2 标本采集
造模前、造模后、给药结束后分别收取大鼠24 h尿液。末次留取尿液后,以2%戊巴比妥钠麻醉大鼠,取腹主动脉采血约5 mL,离心后取血清置于−80 ℃冰箱保存;摘取右肾置于冻存管中,−80 ℃保存;将左肾置于10%中性缓冲福尔马林中固定。
2.3 24 h-UTP 及血清生化指标检测
严格按照试剂盒要求使用全自动生化分析仪检测血清各指标,包括BUN、Scr、TC、TG;采用双缩脲比色法检测24 h-UTP。
2.4 肾组织病理形态学观察
将固定在10%中性缓冲福尔马林的大鼠肾脏组织取出,乙醇梯度脱水,经石蜡包埋后制成4 μm 的切片,进行HE 染色及PASM 染色,光学显微镜观察肾小球变化。
2.5 Western blotting 检测大鼠肾脏相关蛋白表达
在无菌离心管中将肾组织研磨均匀后加入RIPA 裂解液,提取肾组织总蛋白,BCA 法进行蛋白定量。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,室温封闭2 h,分别加入Nephrin(1∶1 000)、AMPKα(1∶1 000)、p-AMPKα(1∶500)、SIRT1(1∶1 000)、SREBP1(1∶1 000)、β-actin(1∶2 000)抗体,4 ℃孵育过夜,TBST 洗膜;加入二抗(1∶3 000),室温孵育2 h,TBST 洗涤3 次,扫描条带,用Image Pro Plus 6.0软件分析条带灰度值。
2.6 统计学分析
3 结果
3.1 大鼠一般情况
造模开始前,大鼠各方面情况良好;造模结束后,空白组大鼠精神状态及活动性良好,皮毛有光泽,进食如常;造模组大鼠死亡3 只,其余大鼠出现不同程度精神不佳、倦怠懒动、皮毛颜色发黄且光泽度下降、进食减少等情况。经药物干预后,各治疗组大鼠精神状态、毛色、活动性、饮食情况均有所改善。
3.2 膜肾颗粒对MN 大鼠24 h-UTP 的影响
如表1 所示,造模前各组大鼠24 h-UTP 无明显差异,造模后大鼠24 h-UTP 均明显升高(P<0.01),提示造模成功。给药结束后,与模型组比较,各给药组大鼠24 h-UTP 均明显降低(P<0.01);与膜肾颗粒低剂量组比较,膜肾颗粒高剂量组和CsA 组24 h-UTP 均明显降低(P<0.01);与CsA 组比较,膜肾颗粒高剂量组24h-UTP 有明显差异(P<0.01)。
表1 膜肾颗粒对MN 大鼠24 h-UTP 的影响 (±s, n = 15)Table 1 Effect of Moshen Granules on 24 h-UTP of MN rats (±s , n = 15)

表1 膜肾颗粒对MN 大鼠24 h-UTP 的影响 (±s, n = 15)Table 1 Effect of Moshen Granules on 24 h-UTP of MN rats (±s , n = 15)
与空白组比较:**P<0.01;与模型组比较:△△P<0.01;与膜肾颗粒低剂量组比较:▲▲P<0.01;与CsA 组比较:##P<0.01,下表同。**P < 0.01 vs blank group; △△P < 0.01 vs model group; ▲▲P < 0.01 vs Moshen Granules low-dose group; ##P < 0.01 vs CsA group, same as below tables.
组别 剂量/(g·kg−1) 24 h-UTP/(mg·24 h−1)造模前 造模后 给药结束后空白 — 6.27±0.57 6.60±0.64 8.08±0.81模型 — 6.66±0.50 84.30±0.53** 92.02±1.59**CsA 0.00 9 6.42±0.68 84.08±0.91** 53.02±1.17△△▲▲膜肾颗粒 1.85 6.28±0.66 84.24±0.51** 65.18±1.17△△7.38 6.37±0.63 84.38±0.46** 55.16±1.22△△▲▲##
3.3 膜肾颗粒对MN 大鼠肾功能的影响
如表2 所示,各组大鼠BUN、Scr 水平无明显差异。
表2 膜肾颗粒对MN 大鼠肾功能的影响 (±s, n = 15)Table 2 Effect of Moshen Granules on kidney function of MN rats (±s , n = 15)

表2 膜肾颗粒对MN 大鼠肾功能的影响 (±s, n = 15)Table 2 Effect of Moshen Granules on kidney function of MN rats (±s , n = 15)
组别 剂量/(g·kg−1) BUN/(mmol·L−1) Scr/(μmol·L−1)空白 — 6.44±0.11 38.84±1.93模型 — 6.54±0.09 39.44±1.30 CsA 0.009 6.49±0.11 38.77±1.40膜肾颗粒 1.85 6.49±0.08 39.55±1.56 7.38 6.47±0.11 38.75±1.56
3.4 膜肾颗粒对MN 大鼠肾脏病理变化的影响
如图1 所示,空白组大鼠肾小球的形态未见明显改变;模型组大鼠肾小球体积明显增大,肾小球毛细血管基底膜弥漫性增厚,可见空泡样变性形成;与模型组比较,各给药组大鼠肾小球体积增大不明显,肾小球毛细血管基底膜增厚不显著,仅有少量空泡样变性形成,病理改变均较模型组明显减轻。

图1 各组大鼠肾组织病理变化 (×400)Fig.1 Pathological changes of kidney tissue of rats in each group (× 400)
3.5 膜肾颗粒对MN 大鼠血脂的影响
如表3 所示,与空白组比较,模型组TC、TG水平明显升高(P<0.01);与模型组比较,各给药组TC、TG 水平均明显降低(P<0.01);与CsA 组比较,膜肾颗粒低剂量组TC、TG 水平有明显差异(P<0.01)。
表3 膜肾颗粒对MN 大鼠血脂的影响 (±s , n = 15)Table 3 Effect of Moshen Granules on blood fat of MN rats (±s , n = 15)

表3 膜肾颗粒对MN 大鼠血脂的影响 (±s , n = 15)Table 3 Effect of Moshen Granules on blood fat of MN rats (±s , n = 15)
组别 剂量/(g·kg−1) TC/(mmol·L−1) TG/(mmol·L−1)空白 — 1.19±0.03 0.50±0.03模型 — 2.00±0.03** 1.02±0.05**CsA 0.009 1.60±0.02△△ 0.70±0.03△△膜肾颗粒 1.85 1.81±0.05△△## 0.76±0.04△△##7.38 1.59±0.03△△ 0.69±0.05△△
3.6 膜肾颗粒对MN 大鼠肾组织Nephrin 蛋白表达的影响
如图2 所示,与空白组比较,模型组肾组织Nephrin 蛋白表达水平显著降低(P<0.01);与模型组比较,膜肾颗粒高剂量组和CsA 组Nephrin 蛋白表达水平均显著升高(P<0.01)。
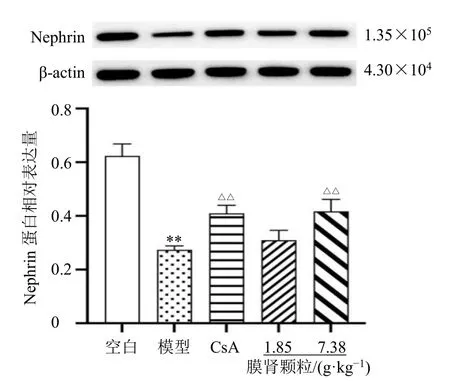
图2 膜肾颗粒对MN 大鼠肾组织Nephrin 蛋白表达的影响 (±s , n = 3)Fig.2 Effect of Moshen Granules on Nephrin protein expression in renal tissue of MN rats (±s , n = 3)
3.7 膜肾颗粒对MN 大鼠肾组织AMPK/SIRT1/SREBP1 通路相关蛋白表达的影响
如图3 所示,各组肾组织AMPKα 蛋白表达水平无显著差异。与空白组比较,模型组肾组织p-AMPKα、p-AMPKα/AMPKα 和SIRT1 蛋白表达水平均显著降低(P<0.01),SREBP1 蛋白表达水平均显著升高(P<0.01);与模型组比较,CsA 组和膜肾颗粒高剂量组p-AMPKα、p-AMPKα/AMPKα 和SIRT1 蛋白表达水平均显著升高(P<0.05、0.01),各给药组SREBP1 蛋白表达水平均显著降低(P<0.01);与CsA 组比较,膜肾颗粒低剂量组p-AMPKα/AMPKα 有明显差异(P<0.05);与膜肾颗粒低剂量组比较,CsA 组和膜肾颗粒高剂量组SREBP1 蛋白表达水平有明显差异(P<0.05)。
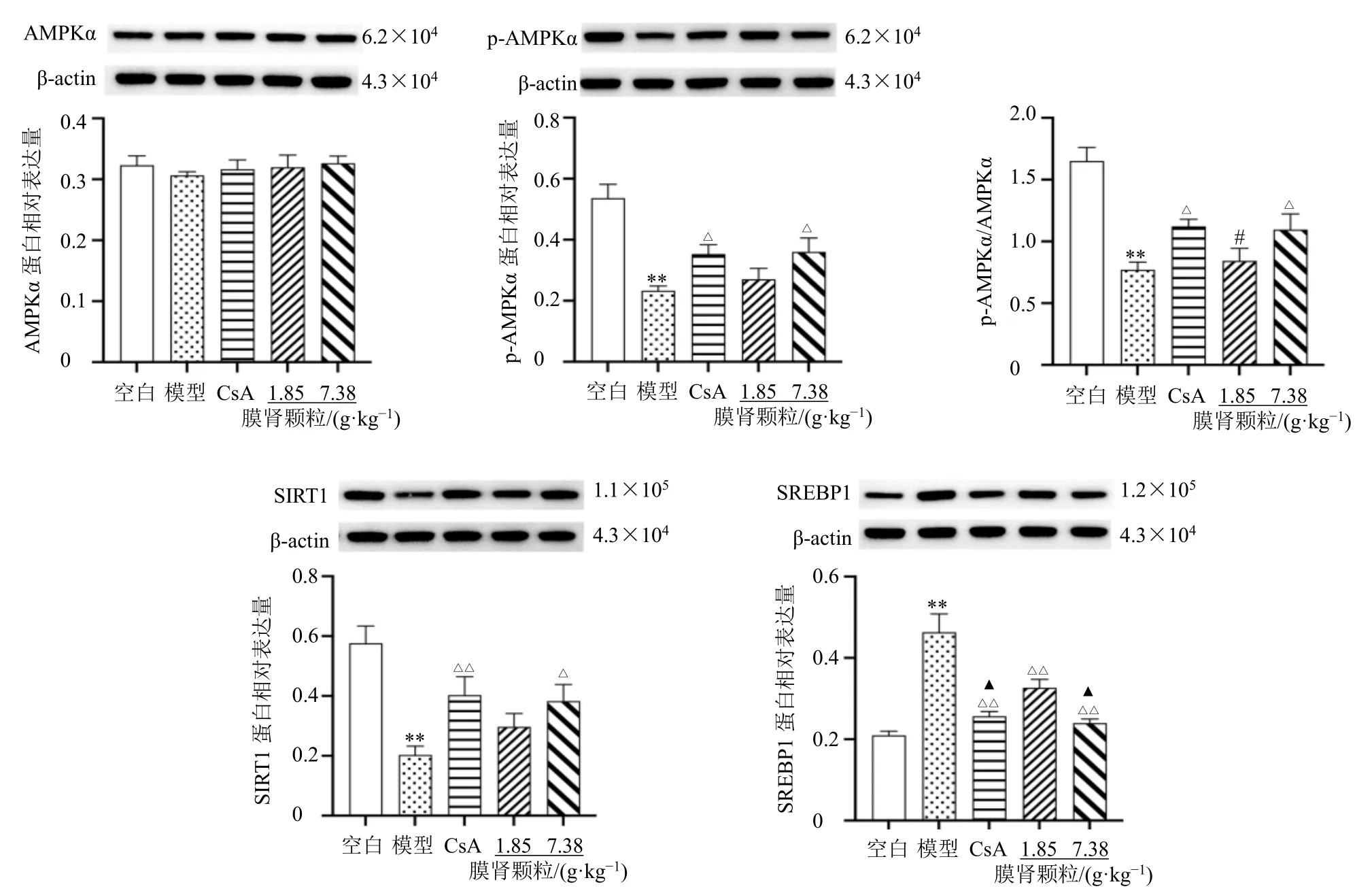
图3 膜肾颗粒对MN 大鼠肾组织AMPK/SIRT1/SREBP1 通路相关蛋白表达的影响 (±s, n = 3)Fig.3 Effect of Moshen Granules on AMPK/SIRT1/SREBP1 pathway-related protein expressions in renal tissue of MN rats(±s, n = 3)
4 讨论
MN 属中医学“水肿”“尿浊”范畴,杨洪涛教授将MN 的病机归为脾肾亏虚、风湿瘀毒。脾虚则运化升清失调,痰浊内生,加之风邪扰动,水湿瘀阻肾络,导致肾脏功能损伤,故创立膜肾方治以健脾益肾、祛风通络。膜肾颗粒原方中生黄芪、炒白术健脾益气,枸杞、杜仲滋补肝肾,4 药共为君药,以补为固,填精固精,兼利水饮,故能降尿蛋白水平、利尿消肿;蝉蜕、青风藤祛风通络除湿,当归、鬼箭羽、土鳖虫、穿山龙活血养血、祛瘀通络,六味共为臣药;金樱子与五味子收敛固涩,车前子利水消肿,此“三子”可助芪术增强固精利水之功,共为佐药;败酱草以其清热祛瘀兼解药毒为使药;诸药合用共奏健脾益肾、祛风通络之效。现代医学研究结果显示黄芪甲苷可以调节细胞骨架和丝裂原活化蛋白激酶减轻补体膜攻击复合物诱导的足细胞损伤[12];枸杞多糖可升高2 型糖尿病患者高密度脂蛋白胆固醇水平[13];当归主要有效成分之一阿魏酸可以通过调节MN 大鼠氧化应激、血管生成、免疫反应减轻足细胞损伤[14];五味子苷B 可减轻氯化汞诱导的肾小管损伤和线粒体氧化应激[15];车前子提取液可调节大鼠脂代谢紊乱[16]。本研究结果显示膜肾颗粒可以减轻MN 大鼠肾脏病理学变化,减少蛋白尿,降低MN 大鼠血清TC、TG 水平。
慢性肾脏病中普遍存在的脂质积累是造成肾小球损伤重要原因[5]。足细胞损伤是MN 主要病理表现,而脂质代谢异常导致肾组织内胆固醇积累或细胞内游离脂肪酸水平升高,促使足细胞线粒体功能障碍诱导损伤[17]。本研究发现膜肾颗粒能促进足细胞特异性蛋白Nephrin 表达,减轻足细胞损伤,维持滤过屏障稳定,减少蛋白尿。AMPK 和SIRT1 是在真核细胞中共同存在的燃料感应分子[18]。当细胞能量状态降低,AMPK 通过促进脂肪酸氧化,抑制TG 和蛋白质合成及细胞增殖来恢复能量平衡[19]。当能量过剩,下调的AMPK 导致脂肪酸氧化减少以及脂质和蛋白质合成增加[20]。SIRT1 亦可对能量增加或减少做出反应[21-22],同时SIRT1 和AMPK 可以相互正向调节[7,23]。研究发现钠-葡萄糖协同转运蛋白2(sodium-dependent glucose transporters 2,SGLT2)抑制剂在脂肪细胞中诱导AMPK 和SIRT1表达升高,可改善脂质代谢和脂肪酸氧化[24]。本研究模型组大鼠较空白组肾脏组织 p-AMPKα/AMPKα 降低,SIRT1 表达显著减少,提示MN 大鼠肾脏中存在脂质代谢紊乱;经膜肾颗粒高剂量治疗后大鼠肾脏p-AMPKα/AMPKα、SIRT1 表达升高,提示膜肾颗粒可能诱导AMPK 和SIRT1 表达升高改善MN 大鼠肾脏脂质代谢及脂肪酸氧化。SREBP1是重要的脂代谢转录因子,上调其水平可优先激活下游脂肪酸合成相关基因[25],使脂质合成增加,其中乙酰辅酶A 羧化酶1(acetyl-CoA carboxylase 1,ACC1)、脂肪酸合成酶(fatty acid synthase,FASN)为脂肪酸合成的关键限速酶,硬脂酰辅酶A 去饱和酶(steaoryl-CoA desaturase promoter,SCD)为单不饱和脂肪酸合成的限速酶。研究发现,SIRT1 能够去乙酰化SREBP1[26],降低其脂化活性,p-AMPK 亦可抑制 SREBP1 蛋白水解成熟[27],从而抑制SREBP1 依赖性脂肪生成。本研究结果显示模型组大鼠较空白组肾脏组织SREBP1 表达显著升高,提示在MN 大鼠肾脏中SREBP1 介导的脂质合成增多;经高剂量膜肾颗粒治疗后大鼠肾脏SREBP1 表达降低,提示其介导的脂质合成也减少。研究结果提示膜肾颗粒可能通过上调AMPK/ SIRT1 抑制SREBP1 对脂肪酸合成的促进作用,影响足细胞脂代谢重编程,减轻足细胞损伤,从而达到降低蛋白尿水平、治疗MN 的目的。
综上,膜肾颗粒对MN 具有显著治疗效果,可减少MN 大鼠蛋白尿,减少足细胞脂质合成,减轻足细胞损伤,维持肾小球滤过功能,这可能与AMPK/SIRT1/SREBP1 信号通路有关。
利益冲突所有作者均声明不存在利益冲突