骆驼刺化学成分及其抗宫颈癌细胞活性研究
鲍 爽,宋海龙,热依兰木·买赛地,凯撒·苏来曼,马国需,4,石磊岭,张 晶,韩莉莉*
1.吉林农业大学中药材学院,吉林 长春 130118
2.新疆维吾尔自治区人民医院 妇科,乌鲁木齐 830001
3.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002
4.中国医学科学院 北京协和医学院药用植物研究所,北京 100193
骆驼刺AlhagisparsifoliaShap 为豆科(Leguminosae)蝶形花亚科(Papilionoideae)骆驼刺属AlhagiGagneb 的半灌木,7、8 月份果成熟时采集地上部分,晒干,是维吾尔医用传统药材[1-2]。其性温,味甘、酸,具有滋补强壮、涩肠止痛、止渴、除烦等功效,在民间常用于治疗腹痛、腹泻、痢疾等症[3-4]。骆驼刺属植物全世界共有7 种,我国有3种,包括吉尔吉斯骆驼刺、骆驼刺和疏叶骆驼刺,主要集中在南疆塔木河、孔雀河、东疆吐鲁番、哈密和七角井盆地,主产区是新疆。骆驼刺含有黄酮类、木脂素类、生物碱类等化学成分,具有抗炎抗菌、抗肿瘤、治疗腹泻等生物活性,常被应用于维药、中成药[3,5]。为探索骆驼刺的物质基础,以新疆产骆驼刺地上部分为实验材料,从其95%乙醇提取物二氯甲烷部位中分离得到12 个化合物,分别鉴定为 (2S,3S)-methylhexahydro-3H-pyrrolo[NH,2-a]imidazol-1-one(1)、5,6-二羟基-7-甲氧基黄酮(neglectein,2)、汉黄芩素(wogonin,3)、2-亚乙基-3-甲基琥珀酸(2-ethylidene-3-methyl-butanedioic acid,4)、3,4′-二羟基-3′-甲氧基苯丙酮(3,4′-dihydroxy-3′-methoxyphenylacetone,5)、calendin(6)、N-苯乙基乙酰胺(N-phenylethyl acetamide,7)、对甲氧基苯甲酸(p-methoxybenzoic acid,8)、黄芩新素Ⅱ(skullcaflavone Ⅱ,9)、4-羟基苯乙醇(4-hydroxyphenethyl alcohol,10)、3′-甲氧基大豆苷元(3′-methoxydaidzein,11)、松脂素(pinoresinol,12)。其中,化合物1 为新化合物,命名为骆驼刺碱(alhagine),化合物2~11 为首次从该植物中分离得到;活性筛选结果表明,化合物1、3、9、11 具有抗宫颈癌细胞活性。
1 仪器与材料
R-1005 型双回流旋转蒸发仪(方圆仪器科技有限公司);Bruker AvanceIII600 型NMR(德国布鲁克公司);KH-700DB 台式数控超声波清洗器(苏州安源仪器有限公司);BYLABUVIII 紫外灯(诺雷信达科技有限公司);DLSB-5/10 低温冷却液循环泵(郑州长城科工贸有限公司);半制备型液相色谱仪(硅仪生化科技有限公司);RY C18-A 型半制备色谱柱(250 mm×10 mm,5 μm,北京中科恩源科技有限公司);柱色谱硅胶(创益化工有限公司);薄层色谱硅胶HF254(永德茂科技有限公司);Rp-C18(北京谱朋科技有限公司);纯净水(福万家纯净水有限公司)。
人宫颈癌HeLa 细胞(中国科学院上海细胞研究所);5-氟尿嘧啶(5-FU,Adamas,批号P1378516)。
药材-骆驼刺2022 年8 月采自新疆吐鲁番高昌区园艺镇,经新疆中药民族药研究所王果平研究员鉴定为豆科蝶形花亚科骆驼刺属植物骆驼刺A.sparsifoliaShap,凭证标本号(652101190529002 LY)保存于新疆维吾尔自治区中药民族药研究所标本室。
2 提取与分离
取骆驼刺干燥地上部分100 kg,阴干粉碎后,用10 倍量95%乙醇加热回流提取3 次,每次1.5 h,合并提取液,减压浓缩干燥后得到总浸膏。总浸膏加水混悬后,用等体积石油醚进行萃取,得到石油醚部位90 L 和水层。将水层用HCl 调至pH 值为1~2,再用等体积的进行萃取,得到醋酸乙酯部位39 L 和水层。再将水层用NaOH 调至pH 值为9~10 碱性,用等体积的二氯甲烷进行萃取,得到二氯甲烷部位52 L(43 g)。
取二氯甲烷部位43 g 经硅胶(200~300 目)柱色谱分离,依次用二氯甲烷-甲醇(100∶0~0∶100)梯度洗脱,合并后得到10 个组分Fr.1~10。Fr.1(7.1 g)经硅胶(200~300 目)柱色谱分离,石油醚-醋酸乙酯(10∶1~5∶1)以及二氯甲烷-甲醇(100∶1~0∶1)梯度洗脱,析出黄色针状结晶化合物2(3.1 mg),合并相似洗脱液后得到7 个组分Fr.1-1~1-7。Fr.1-2(673.6 mg)经硅胶(300~400 目)柱色谱分离,石油醚-醋酸乙酯(10∶1)以及二氯甲烷-甲醇(100∶1~0∶1)梯度洗脱,合并相似洗脱液后得到7 个组分Fr.1-2-1~1-2-7。Fr.1-2-3(317.5 mg)经硅胶(200~300 目)柱色谱分离,石油醚-醋酸乙酯(10∶1~5∶1)以及二氯甲烷-甲醇(100∶1~0∶1)梯度洗脱,合并相似洗脱液后得到5 个组分Fr.1-2-3-1~1-2-3-5。Fr.1-2-3-3(80.2 mg)刮板得到化合物3(2.7 mg);Fr.2(2.9 g)经硅胶(300~400 目)柱色谱分离,二氯甲烷-甲醇(1∶0~0∶1)梯度洗脱,合并相似洗脱液后得到4 个组分Fr.2-1~2-4。Fr.2-1(1.6 g)经ODS 柱色谱分离,甲醇-水(30∶70~100∶0)梯度洗脱,得到7 个组分Fr.2-1-1~2-1-7。Fr.2-1-1(481.2 mg)经半制备液相色谱(甲醇-水20∶80)分离纯化得化合物4(6.8 mg);Fr.2-1-2(451.6 mg)经半制备液相色谱(甲醇-水20∶80)分离纯化得化合物5(2.5 mg)、6(7.0 mg)和7(3.6 mg);Fr.2-1-3(174.9 mg)经半制备液相色谱(甲醇-水45∶55)分离纯化得化合物12(1.3 mg);Fr.2-1-4(151.1 mg)经半制备液相色谱(甲醇-水55∶45)分离纯化得化合物8(2.5 mg)和9(7.2 mg);Fr.3(3.2 g)经ODS 柱色谱分离,甲醇-水(30∶70~100∶0)梯度洗脱,得到6 个组分Fr.3-1~3-6,Fr.3-1(2.3 g)经半制备液相色谱(甲醇-水30∶70)分离纯化得化合物10(2.6 mg);Fr.3-2(352.3 mg)经半制备液相色谱(甲醇-水50∶50)分离纯化得化合物11(5.3 mg);Fr.5(1.4 g)经半制备液相色谱(甲醇-水20∶80)分离纯化得化合物1(5.9 mg)。
3 结构鉴定
化合物1:HR-ESI-MSm/z: 141.102 1 [M+H]+,分子式为C7H12N2O,不饱和度为3。1H-NMR (600 MHz, DMSO-d6) 谱(表1)中包括1 个活泼氢信号δ8.17 (1H, s,N-H), 2 个次甲基氢信号 [δ4.16 (1H,ddd,J= 9.0, 7.1, 1.3 Hz, H-3), 4.08 (1H, m, H-2)], 3 个亚甲基氢信号 [δ3.36 (2H, t,J= 4.0 Hz, H-6), 2.11(1H, m, H-4), 1.84 (3H, m, H-4, H-5)] 和1 个甲基氢信号δ1.21 (3H, d,J= 6.9 Hz, H-7)。13C-NMR (150 MHz, DMSO-d6) 结合HMBC 和HSQC 谱共解析出7个碳信号,其中包括1个内酰胺羰基碳信号δ166.6(C-1), 5 个脂肪碳信号 [δ58.7 (C-3), 50.1 (C-2), 44.9(C-6), 27.7 (C-4), 22.4 (C-5)],1 个甲基碳信号δ15.3(C-7)。

表1 化合物1 的核磁数据 (600/150 MHz, DMSO-d6)Table 1 NMR data for compound 1 (600/150 MHz,DMSO-d6)
1H-1H COSY 谱(图1)中,H-2 与N-H,H-3与N-H 相关,证实存在C-2-NH-C-3 连接片段,结合HMBC 谱中H-2 与C-1 相关,N-H 与C-1/C-2/C-3 相关,结合以上信息确定该化合物含有结构片段1-氧取代吡咯烷酮。HMBC 谱中,H-7 与C-1/C-2 相关,1H-1H COSY 谱中,H-7 与H-2 相关,确定在2号位存在甲基。同理,1H-1H COSY 谱中,H-3 与H-4,H-4 与H-5 以及H-5 与H-6 相关,证实存在C-3-C-4-C-5-C-6 连接片段,结合HMBC 谱中,H-6 与C-1/C-3/C-4/C-5 相关,H-4 与C-3/C-5/C-6 相关,由此推得化合物1 的平面结构(图1)。
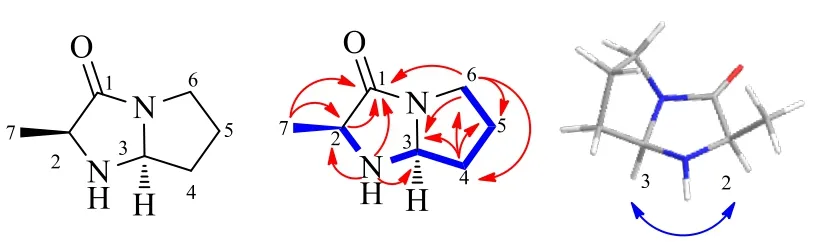
图1 化合物1 的结构和主要的1H-1H COSY ()、HMBC ()、NOESY () 相关Fig.1 Structure and main 1H-1H COSY (), HMBC() and NOESY() correlations of compound 1
从NOESY 谱中提出了化合物1 的相对构型(图1)。在NOESY 谱图上观察到H-2 与H-3 的NOESY远程相关信号,表明H-2 和H-3 处于同一平面。为了进一步确定其绝对构型,采用计算ECD 与实验ECD 相结合的方法来确定化合物1 的绝对构型。首先对化合物1 进行构象搜索、优化、激发态展宽、波尔兹曼拟合后,其计算得到的构型为2S,3S的ECD 曲线与实验的ECD 曲线显示出很好的吻合性(图2),从而确定了1 的绝对构型为2S,3S。综上,化合物1 鉴定为 (2S,3S)-methylhexahydro-3H-pyrrolo[NH,2-a]imidazol-1-one,命名为骆驼刺碱。

图2 化合物1 的实验ECD 和计算ECD 图谱Fig.2 Experimental and calculated ECD spectra of compound 1
化合物2:黄色粉末,ESI-MSm/z: 285.08 [M+H]+,分子式为C16H12O5。1H-NMR (600 MHz, DMSOd6)δ: 12.94 (1H, s, 5-OH), 10.85 (1H, s, 6-OH), 8.08(2H, dd,J= 7.0, 1.6 Hz, H-2′, 6′), 7.59 (3H, m, H-3′~5′), 6.99 (1H, s, H-3), 6.64 (1H, s, H-8), 3.75 (3H,s, 7-OMe);13C-NMR (150 MHz, DMSO-d6)δ: 182.3(C-4), 163.3 (C-7), 157.7 (C-2), 152.8 (C-5), 152.6 (C-9), 132.1 (C-1′), 131.5 (C-4′), 130.8 (C-6), 129.2 (C-3′,5′), 126.5 (C-2′, 6′), 104.7 (C-10), 104.4 (C-3), 94.5 (C-8),60.0 (7-OMe)。以上数据与文献报道波谱数据基本一致[6],故鉴定化合物2 为5,6-二羟基-7-甲氧基黄酮。
化合物3:黄色颗粒状结晶(甲醇),ESI-MSm/z:285.08 [M+H]+,分子式为C16H12O5。1H-NMR (600 MHz, DMSO-d6)δ: 12.52 (1H, s, 5-OH), 8.08 (2H, m,H-2′, H-6′), 7.62 (3H, m, H-3′~5′), 7.00 (1H, s, H-3),6.29 (1H, s, H-6), 3.85 (3H, s, 8-OMe);13C-NMR (150 MHz, DMSO-d6)δ: 182.0 (C-4), 162.9 (C-2), 156.3 (C-5), 149.6 (C-9), 132.1 (C-1′), 130.9 (C-4′), 129.3 (C-3′,5′), 127.9 (C-8), 126.3 (C-2′, 6′), 105.0 (C-3), 103.6 (C-10), 99.3 (C-6), 61.0 (8-OMe)。以上数据与文献报道波谱数据基本一致[7],故鉴定化合物3 为汉黄芩素。
化合物4:黄色固体,ESI-MSm/z: 159.07 [M+H]+,分子式为C7H10O4。1H-NMR (600 MHz, DMSOd6)δ: 7.25 (1H, m, 1-OH), 6.61 (1H, dd,J= 7.3, 2.2 Hz,4-OH), 3.36 (1H, s, H-5), 2.12 (1H, m, H-3), 1.84 (3H,dd,J= 7.3, 1.3 Hz, H-6), 1.27 (3H, d,J= 7.5 Hz, H-7);13C-NMR (150 MHz, DMSO-d6)δ: 179.4 (C-4),170.2 (C-1), 133.8 (C-2), 132.7 (C-5), 37.7 (C-3), 15.1(C-7), 14.4 (C-6)。以上数据与文献报道波谱数据基本一致[8],故鉴定化合物4 为2-亚乙基-3-甲基琥珀酸。
化合物5:白色粉末,ESI-MSm/z: 197.08 [M+H]+,分子式为C10H12O4。1H-NMR (600 MHz, DMSOd6)δ: 7.50 (1H, dt,J= 8.3, 1.4 Hz, H-6′), 7.43 (1H, d,J= 2.0 Hz, H-2′), 6.85 (1H, d,J= 8.2 Hz, H-5′), 3.81(3H, s, 3′-OMe), 3.74 (2H, m, H-3), 3.04 (2H, t,J= 6.4 Hz, H-2);13C-NMR (150 MHz, DMSO-d6)δ: 197.2 (C-1), 152.0 (C-4′), 147.9 (C-3′), 128.7 (C-1′), 123.2 (C-6′),114.9 (C-2′), 111.0 (C-5′), 57.3 (C-3), 55.6 (3′-OMe), 40.9(C-2)。以上数据与文献报道波谱数据基本一致[9],故鉴定化合物5 为3,4′-二羟基-3′-甲氧基苯丙酮。
化合物6:白色粉末,ESI-MSm/z: 197.12 [M+H]+,分子式为C11H16O3。1H-NMR (600 MHz, DMSOd6)δ: 5.78 (1H, s, H-3), 4.08 (1H, t,J= 3.5 Hz, H-6),2.29 (1H, dt,J= 13.3, 2.6 Hz, H-7a), 1.86 (1H, dt,J=14.1, 2.6 Hz, H-5), 1.66 (3H, d,J= 0.8 Hz, 7a-Me),1.62 (1H, dd,J= 13.3, 4.0 Hz, H-7b), 1.41 (1H, dd,J=14.1, 3.7 Hz, H-5), 1.37 (3H, s, H-9), 1.19 (3H, s, H-10);13C-NMR (150 MHz, DMSO-d6)δ: 183.1 (C-3a),171.1 (C-2), 112.2 (C-3), 86.6 (C-7a), 64.9 (C-6), 46.6(C-5), 45.3 (C-7), 35.7 (C-4), 30.5 (C-8), 26.9 (C-10),26.2 (C-9)。以上数据与文献报道波谱数据基本一致[9],故鉴定化合物6 为calendin。
化合物7:无色胶状物,ESI-MSm/z: 164.11[M+H]+,分子式为C10H13NO。1H-NMR (600 MHz,DMSO-d6)δ: 7.94 (1H, t,J= 5.8 Hz, N-H), 7.29 (2H,m, H-2′, 6′), 7.20 (3H, m, H-3′~5′), 3.23 (2H, ddd,J=8.5, 7.4, 5.8 Hz, H-3), 2.69 (2H, t,J= 7.5 Hz, H-4), 1.77(3H, s, H-1);13C-NMR (150 MHz, DMSO-d6)δ: 169.1(C-2), 139.6 (C-1′), 128.7 (C-3′, C-5′), 128.4 (C-2′, C-6′), 126.1(C-4′), 40.3 (C-3), 35.3 (C-4), 22.7 (C-1)。以上数据与文献报道波谱数据基本一致[10],故鉴定化合物7 为N-苯乙基乙酰胺。
化合物8:白色粉末,ESI-MSm/z: 153.05 [M+H]+,分子式为C8H8O3。1H-NMR (600 MHz, DMSOd6)δ: 7.50 (2H, d,J= 8.8 Hz, H-2, 6), 6.99 (2H, d,J=8.8 Hz, H-3, 5), 3.78 (3H, s, 4-OMe);13C-NMR (150 MHz, DMSO-d6)δ: 174.6 (C-7), 158.9 (C-1), 130.1 (C-2, 6), 124.3 (C-4), 113.6 (C-3, 5), 55.2 (4-OMe)。以上数据与文献报道波谱数据基本一致[11],故鉴定化合物8 为对甲氧基苯甲酸。
化合物9:黄色片状结晶(甲醇),ESI-MSm/z:175.11 [M+H]+,分子式为C19H18O8。1H-NMR (600 MHz, DMSO-d6)δ: 12.64 (1H, s, 5-OH), 10.33 (1H, s,2′-OH), 7.32 (1H, t,J= 8.3 Hz, H-4′), 6.62 (2H, dd,J=8.5, 1.5 Hz, H-3′, 5′), 6.34 (1H, s, H-3), 4.00, 3.82, 3.79,3.75 (3H×4, s, 6, 7, 8, 6′-OMe);13C-NMR (150 MHz,DMSO-d6)δ: 182.6 (C-4), 162.5 (C-2), 158.3 (C-7),156.8 (C-5), 152.6 (C-6′), 148.6 (C-9), 146.3 (C-2′),135.8 (C-6), 132.6 (C-8, 4′), 112.0 (C-3′), 108.9 (C-1′),108.8 (C-3), 106.3 (C-10), 102.2 (C-5′), 61.8, 61.6,60.7, 55.9 (6, 7, 8, 6′-OMe)。以上数据与文献报道波谱数据基本一致[12],故鉴定化合物9 为2′,5-二羟基-6,6′,7,8-四甲氧基黄酮,即黄芩新素Ⅱ。
化合物10:无色针晶(甲醇),ESI-MSm/z:139.08 [M+H]+,分子式为C8H10O2。1H-NMR (600 MHz, DMSO-d6)δ: 6.98 (2H, d,J= 8.4 Hz, H-2, 6),6.65 (2H, d,J= 8.4 Hz, H-3, 5), 3.50 (2H, td,J= 7.3,4.9 Hz, H-8), 2.59 (2H, t,J= 7.3 Hz, H-7);13C-NMR(150 MHz, DMSO-d6)δ: 155.5 (C-4), 129.7 (C-2, C-6),129.5 (C-1), 115.0 (C-3, 5), 62.7 (C-8), 40.1 (C-7)。以上数据与文献报道波谱数据基本一致[13],故鉴定化合物10 为4-羟基苯乙醇。
化合物11:黄色粉末,ESI-MSm/z: 285.08 [M+H]+,分子式为C16H12O5。1H-NMR (600 MHz, DMSOd6)δ: 8.24 (1H, s, H-2), 7.90 (1H, d,J= 8.6 Hz, H-5),7.04 (1H, d,J= 1.8 Hz, H-2′), 6.95 (1H, d,J= 8.5 Hz,H-6), 6.93 (1H, d,J= 1.9 Hz, H-8), 6.87 (1H, d,J= 8.6 Hz, H-6′), 6.78 (1H, s, H-5′), 3.78 (3H, s, 3′-OMe);13C-NMR (150 MHz, DMSO-d6)δ: 174.5 (C-4), 157.6(C-7), 154.8 (C-9), 152.9 (C-2), 147.5 (C-3′), 146.0 (C-4′), 127.1 (C-5), 124.9 (C-3), 123.2 (C-1′), 120.9 (C-6′),120.4 (C-10), 119.7 (C-5′), 116.5 (C-6), 111.9 (C-2′),102.1 (C-8), 55.7 (3′-OMe)。以上数据与文献报道波谱数据基本一致[14],故鉴定化合物11 为3′-甲氧基大豆苷元。
化合物12:白色固体,ESI-MSm/z: 359.15 [M+H]+,分子式为C20H22O6。1H-NMR (600 MHz, DMSOd6)δ: 6.88 (2H, d,J= 1.9 Hz, H-2, 2′), 6.75 (2H, dd,J= 8.1, 1.9 Hz, H-6, 6′), 6.72 (2H, d,J= 8.1 Hz, H-5,5′), 4.60 (2H, d,J= 4.1 Hz, H-7, 7′), 4.11 (1H, dd,J=8.9, 6.8 Hz, H-9a), 3.79 (1H, m, H-9′a), 3.76 (6H, s, 3,3′-OCH3), 3.71 (2H, dd,J= 9.2, 3.3 Hz, H-9b, 9′b), 3.03(2H, d,J= 5.8 Hz, H-8, 8′);13C-NMR (150 MHz,DMSO-d6)δ: 147.5 (C-3, 3′), 145.9 (C-4, 4′), 132.2 (C-1, 1′), 118.7 (C-6, 6′), 115.1 (C-5, 5′), 110.4 (C-2, 2′),85.2 (C-7, 7′), 70.9 (C-9, 9′), 55.6 (3, 3′-OCH3), 53.6 (C-8, 8′)。以上数据与文献报道波谱数据基本一致[15],故鉴定化合物12 为松脂素。
4 活性筛选
采用MTT 法测试化合物1~12 对宫颈癌细胞株HeLa 的体外抑制作用,以5-FU 为阳性对照药。取对数生长期的HeLa 细胞株,胰酶消化,稀释成浓度6×104个/mL 的单细胞悬液,各浓度均设置3个复孔,以每孔100 μL 置于96 孔板中,在37.0 ℃培养箱内培养24 h,分别加入配制好的化合物1~12 和5-FU,培养24 h,每孔加入10 μL MTT 试剂染色,孵育5.0 h,弃去上层培养液,每孔加入100 μL DMSO,轻轻摇动均匀,用酶标仪检测570 nm 波长下的吸光度(A)值,根据公式 [抑制率=(A对照-A实验)/(A对照-A空白)] 计算细胞抑制率,采用SPSS 22.0 软件对所得数据进行分析,计算各化合物的半数抑制浓度(median inhibition concentration,IC50)值。结果表明,化合物1、3、9、11 对HeLa 细胞株具有较强的体外抑制作用,其IC50值分别为20.20、35.25、49.11、48.73 μmol/L,见表2。
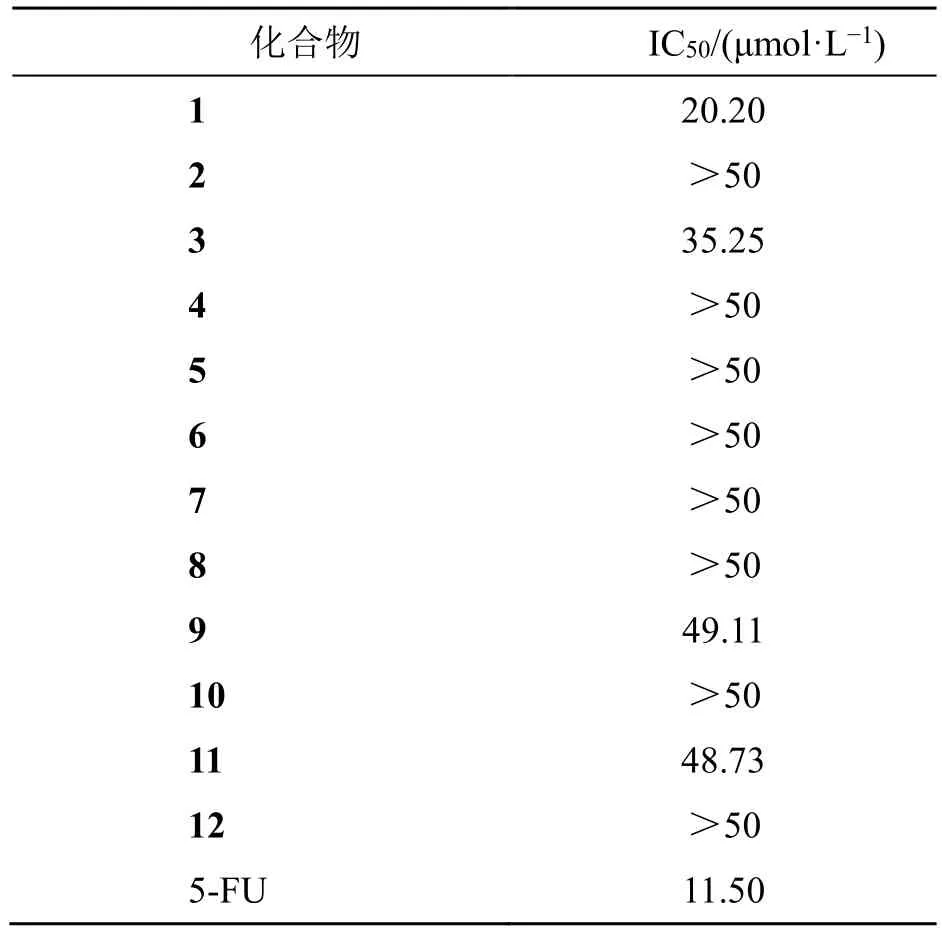
表2 化合物1~12 对HeLa 细胞的抑制作用Table 2 Inhibitory effects of compounds 1—12 on HeLa cells
5 结论
本实验对骆驼刺地上部分进行化学成分研究,从乙醇提取物二氯甲烷部位中分离得到12 个化合物,包括2 个生物碱类化合物、4 个黄酮类化合物、2 个苯丙素类化合物、1 个降碳倍半萜类化合物、3个酚酸类化合物。其中,化合物1 为新化合物,且化合物1~11 为首次从该植物中分离得到。采用MTT 法对所分得化合物进行抗宫颈癌细胞活性筛选,结果表明,化合物1、3、9、11 对HeLa 细胞具有抑制作用。通过分析发现化合物3、9、11 具有较强的抗肿瘤活性,且骨架均由C6-C3-C6构成,可以推测骆驼刺化学成分中黄酮类化合物具有较强的抗肿瘤活性。因为化合物2 也由C6-C3-C6构成,且抗肿瘤活性不显著,因此可以推测甲氧基和羟基基团的连接位置是影响抗肿瘤活性强弱的原因。本研究丰富了骆驼刺化学成分与抗宫颈癌细胞活性之间的关系,为其活性筛选和资源的开发利用奠定了物质基础。
利益冲突所有作者均声明不存在利益冲突