覆盆子化学成分的分离鉴定及其新型大麻素2 型受体激动剂的筛选和抗骨质疏松作用评价
陈昌伦,胡思婧,朱丽丽,姚璐蒙,王星星,张安娜,张巧艳,秦路平,吴建军
浙江中医药大学药学院,浙江 杭州 311402
《中国药典》2020 年版规定覆盆子为蔷薇科植物华东覆盆子(亦称为掌叶覆盆子)RubuschingiiHu.的干燥果实。覆盆子作为一种药食两用植物,在中国已有1 500 多年的用药历史,并且常被作为补肾中药广泛用于中医临床上,其性微温,味甘酸,具有补肝明目、补肾固精、缩尿的功效。近年来,从覆盆子中以分离出245 个化合物,包括黄酮类[1-3]、萜类[1-3]、生物碱类[1-2]、甾体类[1-2]、有机酸类[1-2]等。中医理论中认为肾主骨、藏精、生髓[4],骨质疏松症的主要病机是肾精亏虚、骨髓减少。因此,从补肾中药覆盆子出发寻找有效的抗骨质疏松活性化合物是一条有效的途径。
大麻素2 型受体(cannabinoid receptor type 2,CB2R)蛋白具有多种药理活性,包括镇痛、抗炎、抗纤维化以及抗骨质疏松[5-8]。骨质疏松症是一种以成骨细胞形成新骨和破骨细胞对骨吸收代谢失衡所引起的以单位体积骨量减少、骨的微观结构退化为特征的全身性疾病。有研究表明CB2R 与骨质疏松症有一定的联系[9]。Ofek 等[10]使用了一种合成特异性激动CB2R 的激动剂HU-308,并在去卵巢骨质疏松小鼠模型中评估该CB2R 特异性激动剂在减少骨质丢失方面的潜力。
因此,本研究以CB2R 为靶点进行活性导向分离,得到 24 个化合物,分别鉴定为山柰酚(kaempferol,1)、木犀草苷(luteolin-7-O-glucoside,2)、银椴苷(tiliroside,3)、金丝桃苷(hyperoside,4)、橙皮素(hesperetin,5)、刺芒柄花素(formononetin,6)、槲皮素(quercetin,7)、对羟基苯甲酸(4-hydroxybenzoic acid,8)、迷迭香酸(rosmarinic acid,9)、对羟基苯甲酸乙酯(ethyl 4-hydroxybenzoate,10)、水杨酸(salicylic acid,11)、没食子酸(gallic acid,12)、咖啡酸(caffeic acid,13)、原儿茶酸(protocatechuic acid,14)、鞣花酸(ellagic acid,15)、香草酸(vanillic acid,16)、loliolide(17)、对羟基苯甲酸甲酯(methyl 4-hydroxybenzoate,18)、ethyl dioxindole-3-acetate(19)、苦莓苷F1(niga-ichigoside F1,20)、科罗索酸(corosolic acid,21)、委陵菜酸(tormentic acid,22)、山楂酸(maslinic acid,23)、野鸦椿酸(euscaphic acid,24)。通过双荧光素酶筛选体系、cAMP 积聚水平、CB2R蛋白表达来对分离得到的单体化合物进行进一步筛选和评价它们对CB2R 的激动活性,并评估筛选的化合物对破骨细胞的调控作用,为进一步开发掌叶覆盆子提供科学依据。
1 材料
1.1 药材
覆盆子购买自浙江省磐安县,经浙江中医药大学药学院秦路平教授鉴定为蔷薇科植物掌叶覆盆子R.chingiiHu.的干燥未成熟果实,样品标本(20201201RBC)存放于浙江中医药大学药学院中药鉴定与品质评价实验室。
1.2 细胞
人胚胎肾细胞HEK293(GNHu43)、小鼠单核巨噬细胞RAW264.7(TCM13)购自中国科学院上海生科院细胞资源中心。HEK293-CB2 细胞和HEK293-EGFP 细胞分别为转染稳定表达CB2R 和绿色荧光蛋白的细胞,由课题组前期实验研究获得,具体转染流程参考课题组前期实验研究[11]。
1.3 试剂
DMEM 培养基(批号8117161,美国Gibco 公司)、青霉素-链霉素(批号15140-122,美国Gibco公司)、FBS 胎牛血清(批号10091-148,美国Gibco公司)、CCK-8 增殖检测试剂盒(ab228554,中国Biosharp)、Western 及IP 细胞裂解液(P0013,上海碧云天生物科技有限公司)、增强型BCA 蛋白定量试剂盒(P0010,上海碧云天生物科技有限公司)、双荧光素酶报告基因检测试剂盒(RG028,上海碧云天生物科技有限公司)、腺苷酸环化酶激活剂forskolin(S1612)、人环磷酸腺苷(cyclic adenosine monophosphate,cAMP)检测试剂盒(MM-0006H1,酶免生物有限公司)、CB2R 激动剂 HU308(ab254226,英国Abcam公司)、CB2R抑制剂AM630(GC10147,美国GLPBIO 公司)、Anti-rabbit IgG,HRP-linked Antibody(7074S,美国CST 公司)、Beta-Tubulin Rabbit Ab(2146S,美国CST 公司)、Anti-Cannabinoid Receptor Ⅱ(ab3561,英国Abcam 公司)。
1.4 仪器
半制备高效液相色谱仪(1200,Agilent 科技有限公司);二氧化碳培养箱(美国Thermo Fisher Scientific 公司);双垂直电泳仪、凝胶成像系统(美国Bio-Rad 公司);多功能酶标仪(美国Bio-Tec 公司);倒置荧光显微镜(日本Nikon 公司)。
2 方法
2.1 提取与分离
掌叶覆盆子未成熟果实(10 kg)粉碎后,过100目筛网,使用95%的乙醇加热回流提取3 次(每次3 h),合并3 次的醇提液并将醇提液浓缩至无醇味以获得浸膏。将浸膏(302.51 g)用1 L 水使之悬浮,用等量的石油醚、二氯甲烷、醋酸乙酯、正丁醇依次萃取,得到石油醚层浸膏(15.20 g)、二氯甲烷层浸膏(34.60 g)、醋酸乙酯层浸膏(39.20 g)和正丁醇层浸膏(57.30 g)。取醋酸乙酯层浸膏35.00 g 经100~200 目正相硅胶柱色谱,以石油醚-醋酸乙酯(30∶1~5∶1)和二氯甲烷-甲醇(70∶1~0∶1)梯度洗脱得到7 组流分Fr.1~7。Fr.7(4 579.62 mg)再经300~400 目硅胶柱色谱,以石油醚-醋酸乙酯(3∶1~1∶1)梯度洗脱,得到9 组流分Fr.7-1~7-9,其中Fr.7-6(99.10 mg)、Fr.7-8(12.35 mg)、Fr.7-9(171.82 mg)经半制备液相分离。Fr.7-6 通过半制备高效液相色谱,以甲醇-水(60∶40)等度洗脱得到化合物1(23.62 mg,tR=13.5 min)。
Fr.7-8 通过半制备高效液相色谱,以甲醇-水(45∶55)等度洗脱,得到化合物2(2.82 mg,tR=9.3 min)。Fr.7-9 通过半制备高效液相,以甲醇-水(40∶60)等度洗脱,得到化合物3(6.82 mg,tR=7.2 min)和4(10.52 mg,tR=19.8 min)。Fr.7-5(159.40 mg)经300~400 目硅胶柱色谱,以石油醚-醋酸乙酯(5∶1~2∶1)梯度洗脱得到3 组流分Fr.7-5-1~7-5-3。其中Fr.7-5-1(29.50 mg)通过以异丙醇-水混合体系进行重结晶得到化合物5(7.93 mg)。Fr.7-5-3(95.5 mg)通过300~400 目正相硅胶,以石油醚-醋酸乙酯(3∶1~1∶1)洗脱得到Fr.7-5-3-1(21.74 mg)和Fr.7-5-3-2(16.25 mg)。Fr.7-5-3-1 经半制备高效液相色谱,以甲醇-水(55∶45)等度洗脱得到化合物6(3.94 mg,tR=24.7 min)。再将组分Fr.7-5-3-2 经半制备高效液相,以甲醇-水(40∶60)等度洗脱得到化合物7(5.27 mg,tR=21.4 min)。Fr.7-3(75.3 mg)通过Sephadex LH-20 凝胶柱色谱,以甲醇-水(20∶80~100∶0)为体系进行梯度洗脱,得到化合物8(12.73 mg)。
取二氯甲烷萃取层浸膏33.00 g,通过100~200目硅胶柱,以石油醚-醋酸乙酯(30∶1~2∶1)和二氯甲烷-甲醇(70∶1~0∶1)梯度洗脱共得到9 组流分为Fr.1~9。Fr.4(686.30 mg)经300~400 目硅胶柱色谱,以石油醚-醋酸乙酯(8∶1、6∶1)梯度洗脱得到3 组流分Fr.4-1~4-3。其中Fr.4-2(261.20 mg)通过半制备高效液相色谱,以甲醇-水(50∶50)等度洗脱得到化合物9(7.10 mg,tR=13.7 min)和10(4.27 mg,tR=26.5 min)。Fr.4-1(109.70 mg)溶于适量甲醇中,通过Sephadex LH-20 凝胶柱色谱,以二氯甲烷-甲醇(50∶50~0∶100)为流动相梯度洗脱,得到化合物11(17.92 mg)和12(14.26 mg)。Fr.4-3(136.71 mg)通过300-400 目硅胶柱,以石油醚-醋酸乙酯(6∶1、4∶1、2∶1)梯度洗脱得到3 组流分Fr.4-3-1~4-3-3。其中Fr.4-3-3(36.82 mg)通过半制备型高效液相,以甲醇-水(55∶45)等度洗脱得到化合物13(5.28 mg,tR=31.7 min)。
Fr.5(180.10 mg)经300~400 目正相硅胶柱,以石油醚-醋酸乙酯(10∶1、6∶1、4∶1)梯度洗脱得到5 组流分Fr.5-1~5-5。其中Fr.5-2(58.00 mg)再经300~400 目硅胶柱,以石油醚-醋酸乙酯(7∶1、4∶1)梯度洗脱得到2 组流分Fr.5-2-1~5-2-2,将Fr.5-2-2(25.17 mg)通过半制备型高效液相,以甲醇-水(60∶40)等度洗脱,得到化合物14(4.92 mg,tR=16.4 min)。Fr.5-5(95.70 mg)通过300~400 目正相硅胶柱,以石油醚-醋酸乙酯(4∶1、1∶1)梯度洗脱,得到3 组流分Fr.5-5-1~5-5-3。将Fr.5-5-2(38.27 mg)继续通过300~400 目正相硅胶柱,以二氯甲烷-甲醇(7∶1、4∶1)梯度洗脱,得到化合物15(3.82 mg)。
Fr.6(1 356.00 mg)通过300~400 目正相硅胶柱,以石油醚-醋酸乙酯(6∶1、4∶1)梯度洗脱,得到7 组流分Fr.6-1~6-7。取Fr.6-4(344.40 mg)在经300~400 目正相硅胶柱,以石油醚-醋酸乙酯(7∶1、5∶1)梯度洗脱,得到2 组流分Fr.6-4-1~6-4-2,将Fr.6-4-2(284.40 mg)继续通过300-400目正相硅胶柱,以石油醚-醋酸乙酯(6∶1、4∶1)梯度洗脱,得到3 组流分Fr.6-4-2-1~6-4-2-3。再将Fr.6-4-2-3(63.92 mg)通过半制备型高效液相色谱,以甲醇-水(45∶55)等度洗脱,得到化合物16(6.30 mg,tR=15.7 min)。Fr.6-6(158.40 mg)经300~400 目正相硅胶柱色谱,以石油醚-醋酸乙酯(7∶1)等度洗脱得到3 组流分Fr.6-6-1~6-6-3。Fr.6-6-3(83.30 mg)通过300~400 目正相硅胶,以石油醚-醋酸乙酯(5∶1、2∶1)梯度洗脱,得到3 组流分Fr.6-6-3-1~6-6-3-3。Fr.6-6-3-2(41.43 mg)通过Sephadex LH-20 凝胶柱色谱,以甲醇-水(50∶50~0∶100)梯度洗脱得到2 组流分Fr.6-6-3-2-1~6-6-3-2-2。将Fr.6-6-3-2-2(18.51 mg)通过半制备型高效液相色谱,以甲醇-水(40∶60)等度洗脱得到化合物17(6.50 mg,tR=29.4 min)。
Fr.7(1 936.00 mg)通过300~400 目正相硅胶柱色谱,以石油醚-醋酸乙酯(5∶1、3∶1、2∶1)梯度洗脱,得到8 组流分Fr.7-1~7-8。Fr.7-2(107.60 mg)经300~400 目正相硅胶柱色谱分离,以石油醚-醋酸乙酯(6∶1)等度洗脱,得到2 组流分Fr.7-2-1~7-2-2,将组分Fr.7-2-2(31.90 mg)通过半制备型高效液相色谱,以甲醇-水(48∶52)等度洗脱,得到化合物18(7.24 mg,tR=34.3 min)。将Fr.7-6(272.90 mg)经300~400 目正相硅胶柱分离,以石油醚-醋酸乙酯(4∶1、2∶1)梯度洗脱,得到3 组流分Fr.7-6-1~7-6-3。将Fr.7-6-3(179.40 mg)通过300~400 目正相硅胶柱,以二氯甲烷-甲醇(5∶1、2∶1)梯度洗脱得到4 组流分Fr.7-6-3-1~7-6-3-4。再将Fr.7-6-3-4(123.90 mg)继续通过300~400 目正相硅胶柱,以二氯甲烷-甲醇(4∶1、2∶1)梯度洗脱得到2 组流分Fr.7-6-3-4-1(36.31 mg)、Fr.7-6-3-4-2(52.92 mg)。将Fr.7-6-3-4-2(52.92 mg)通过半制备高效液相,以甲醇-水(35∶65)等度洗脱,得到化合物19(5.10 mg,tR=42.7 min)。
将Fr.7-7(232.00 mg)通过300~400 目正相硅胶柱,以石油醚-醋酸乙酯(4∶1、2∶1)梯度洗脱,得到3 组流分Fr.7-7-1~7-7-3。取Fr.7-7-3(123.90 mg)继续通过300~400 目正相硅胶柱分离,以二氯甲烷-甲醇(6∶1、3∶1)梯度洗脱得到4 组流分Fr.7-7-3-1~7-7-3-4。将Fr.7-7-3-3(59.46 mg)通过Sephadex LH-20 凝胶柱色谱,以甲醇-水(45∶55~0∶100)梯度洗脱得到2 组流分Fr.7-7-3-3-1 和Fr.7-7-3-3-2。将组分Fr.7-7-3-3-2(15.38 mg)通过半制备型高效液相,以乙腈-水(36∶64)等度洗脱,得到化合物20(4.28 mg,tR=39.6 min)。
Fr.8(1 345.00 mg)通过D101 大孔树脂,以甲醇-水(0∶100~100∶0)梯度洗脱,得到5 组流分Fr.8-1~8-5。Fr.8-4(583.38 mg)通过300~400 目正相硅胶柱分离,以二氯甲烷-甲醇(4∶1、2∶1)梯度洗脱,得到4 组流分Fr.8-4-1~8-4-4。Fr.8-4-3(182.30 mg)经300~400 目正相硅胶柱色谱分离,以石油醚-醋酸乙酯(5∶1、2∶1)梯度洗脱,得到3组流分Fr.8-4-3-1~8-4-3-3。Fr.8-4-3-3(31.73 mg)在通过Sephadex LH-20 凝胶柱色谱,以甲醇-水(40∶60~0∶100)梯度洗脱,得到化合物21(4.72 mg)。
Fr.8-4-4(208.20 mg)经300~400 目正相硅胶柱分离,以石油醚-醋酸乙酯(4∶1、2∶1)梯度洗脱,得到3 组流分Fr.8-4-4-1~8-4-4-3。将Fr.8-4-4-2(35.96 mg)通过半制备型高效液相色谱,以乙腈-水(42∶58)等度洗脱得到化合物22(3.95 mg,tR=34.6 min)。Fr.8-4-4-3(110.14 mg)通过300~400 目正相硅胶柱,以石油醚-醋酸乙酯(3∶1)等度洗脱得到2 组流分Fr.8-4-4-3-1~8-4-4-3-2。继续将Fr.8-4-4-3-2(63.73 mg)通过Sephadex LH-20 凝胶柱色谱,以甲醇-水(80∶20)等度洗脱得到2 组流分Fr.8-4-4-3-2-1~8-4-4-3-2-2。再将Fr.8-4-4-3-2-2(31.79 mg)通过半制备型高效液相,以甲醇-水(45∶55、30∶70)梯度洗脱得到化合物23(3.72 mg,tR=26.7 min)和24(4.18 mg,tR=11.4 min)。
2.2 细胞培养
人胚胎肾细胞HEK293 和小鼠单核巨噬细胞RAW264.7 均使用含10% FBS 和1%青霉素-链霉素双抗的DMEM 培养基,于37 ℃、5% CO2的细胞培养箱中培养。
破骨细胞由RANKL 诱导液刺激RAW264.7 细胞分化获得,RANKL 诱导液的配制为每1 mL 培养液加入5 μL RANKL(5 ng/mL)。向RAW264.7 细胞中加入RANKL 诱导液培养5 d 来获得破骨细胞。
2.3 具有特异性激动CB2R 活性化合物的筛选
2.3.1 CCK-8 检测细胞活性 将分离得到的24 个化合物用二甲基亚砜(DMSO)配制成母液(质量浓度为100 μg/μL),在用培养基稀释为不同质量浓度的药液(25、50、100 μg/mL),DMSO 在药液中的终体积分数在0.1%以下。将HEK293-CB2 细胞以3×103的密度接种于96 孔板中培养24 h,贴壁后加入不同质量浓度的药液培养48 h 后用CCK-8法检测细胞活性,使用多功能酶标仪在450 nm 波长下测定吸光度(A)。
2.3.2 阳性细胞筛选 将HEK293-CB2 细胞以3×104的密度接种于48 孔板上,待细胞贴壁后饥饿培养24 h。加入1 μmol/L 的CB2R 激动剂HU308 和不同质量浓度的24 个单体化合物药液处理细胞6 h,以正常加入培养基组为对照组,HU308 为阳性对照组,24 个不同质量浓度单体化合物为实验组。使用双荧光素酶报告基因检测试剂盒检测药物对HEK293-CB2 细胞内CB2R 的激活情况,通过计算相对发光值来定量表示CB2R 激动水平。
2.3.3 阴性细胞筛选 为了消除假阳性化合物的干扰,将上一步中筛选得到的化合物用未转染CB2R 的HEK293-EGFP 阴性细胞进一步筛选。将HEK293-EGFP 细胞以3×104的密度接种于48 孔板上,贴壁后饥饿培养24 h,用1 μmol/L HU308 和不同质量浓度的5 个单体化合物处理细胞6 h,通过计算相对发光值来确定CB2R 的表达水平。
2.3.4 筛选的化合物对CB2R 激动作用的特异性检测 使用CB2R 抑制剂AM630 验证化合物对CB2R的特异性激活作用。HEK293-CB2 细胞接种于48 孔板(3×104个/孔)。贴壁后饥饿24 h,用1 μmol/L AM630 和上一步筛选得到的2 个单体化合物(橙皮素和对羟基苯甲酸甲酯)处理细胞6 h,通过计算相对发光值来确定细胞内CB2R 的激动情况。
2.4 橙皮素和对羟基苯甲酸甲酯对CB2R 的激动作用分析
2.4.1 细胞内cAMP 水平的测定 将HEK293-CB2细胞以5×105个/孔的密度接种于6 孔板中,待细胞贴壁后用forskolin(腺苷酸环化酶激活剂)刺激HEK293-CB2 细胞内cAMP 含量增加,并饥饿处理24 h,分别加入1 μmol/L HU308 和不同质量浓度(0、25、100、200、400、800 μg/mL)的橙皮素和对羟基苯甲酸甲酯培养细胞6 h,细胞用PBS 洗涤2 次后,加入细胞裂解液于冰上裂解细胞30 min,收集细胞裂解液以3 000 r/min 离心20 min,取上清液。按照说明书用cAMP 试剂盒测定细胞上清液中的cAMP 水平。
2.4.2 Western blotting 检测CB2R 蛋白表达 设置对照组、给药组(100 μg/mL)和给药+抑制剂(1 μmol/L)组。将HEK293-CB2 细胞接种于6 孔板中(5×105个/孔)。待细胞贴壁后饥饿处理24 h,给予细胞100 μg/mL 的橙皮素和对羟基苯甲酸甲酯处理6 h。提取HEK293-CB2 细胞总蛋白,用BCA 试剂盒对蛋白进行定量,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并转移到PVDF 膜上。用封闭液封闭PVDF 膜2 h 后,加入CB2R 抗体(1∶500)和β-Tubulin 抗体(1∶1 000)在4 ℃下孵育过夜。用洗涤液清洗膜3 次(每次10 min),然后与相应二抗(1∶1 000)在室温下孵育1 h,清洗3 次后加入BeyoECL 显影剂,用Monad QuickChemi 5100 化学发光仪分析蛋白条带并用Image J 软件处理。
2.4.3 药物对细胞自身荧光的激活分析 使用已转染绿色荧光增强蛋白的HEK293-CB2 细胞,观察橙皮素和对羟基苯甲酸甲酯对细胞的激活作用,细胞正常培养贴壁后给予药物处理6 h,吸弃培养基,用PBS 洗涤细胞3 次,将细胞置于荧光显微镜下观察细胞自身发出的绿色荧光。
2.5 橙皮素和对羟基苯甲酸甲酯对破骨细胞的作用
2.5.1 破骨细胞活力和TRAP 活性与染色测定 将RAW264.7 细胞接种于96 孔板(6×103个/孔)中,孵育24 h,再用橙皮素和对羟基苯甲酸甲酯(100 μg/mL)处理细胞48 h,用CCK-8 法检测细胞活力。
另外将RAW264.7 细胞接种于96 孔板(1×104个/孔),分为对照组、给药组(100 μg/mL)和给药+抑制剂(1 μmol/L)组。用化合物(橙皮素和对羟基苯甲酸甲酯)和RANKL 诱导液共处理细胞5 d 后,按照TRAP 活性实验步骤检测破骨细胞的TRAP 活性。
TRAP 反应液的制备:将40 mg 对硝基苯基磷酸二钠和0.2 g 酒石酸钾钠混合均匀,用1 mol/L 盐酸调节pH 至3.5 后,溶解于15 mL 无菌水中,在加入无菌水定量至20 mL。
按照上述种板方法进行TRAP 染色,以鉴定破骨细胞,并在正置显微镜下观察药物对破骨细胞分化的影响。
2.5.2 破骨细胞F-肌动蛋白环(F-actin)的免疫荧光染色 将RAW264.7 细胞以5×104个/孔的密度接种到直径35 mm 的激光共聚焦培养皿中培养24 h,设置对照组、给药组(100 μg/mL)和给药+抑制剂(1 μmol/L)组。用RANKL 诱导液稀释药物(100 μg/mL)和抑制剂AM630,并给予细胞共培养5 d。细胞用PBS 清洗2 次,在室温下用4%多聚甲醛固定30 min。去掉多聚甲醛后,用PBS 洗涤2 次,在室温下用0.2% Triton X-100 处理5 min,细胞用PBS洗涤2 次,加入5 μg/mL 的鬼笔环肽染液,于37 ℃下孵育30 min,再次用PBS 洗涤2 次,DAPI 染液染色5 min,细胞继续用PBS 洗涤2 次后,每皿加入200 μL PBS 使细胞浸润,于激光共聚焦显微镜下观察破骨细胞的F-actin 环结构。
2.5.3 破骨细胞骨吸收的测定 将牛皮质骨片浸泡在含1%双抗的PBS 溶液中。每小时更换1 次PBS,重复浸泡3 次,将骨片于紫外线下照射1 h 并按照48 孔板孔径剪成圆形,置于48 孔板中。RAW264.7 细胞接种于48 孔板(5×104个/孔),培养贴壁。用RANKL 诱导液将待测化合物(橙皮素和对羟基苯甲酸甲酯)稀释至100 μg/mL,给予细胞培养9 d,期间每隔3 d 更换1 次培养液。取出骨切片,用PBS 清洗2 次,用2.5%戊二醛固定10 min,在用0.25 mol/L 氨水超声清洗3 次(每次5 min),于室温下晾干。用1%甲苯胺蓝染料染色15 min,用超纯水清洗直到不再褪色,于显微镜下观察骨切片表面,并拍照记录。
2.6 数据分析
3 结果
3.1 结构鉴定
化合物1:黄色粉末,易溶于甲醇,ESI-MSm/z287.05 [M+H]+,相对分子质量 286,分子式C15H10O6。1H-NMR (600 MHz, Methanol-d4)δ: 8.07(2H, d,J= 8.8 Hz, H-2′, 6′), 6.89 (2H, d,J= 8.9 Hz, H-3′, 5′), 6.37 (1H, d,J= 2.1 Hz, H-8), 6.16 (1H, d,J=2.1 Hz, H-6);13C-NMR (150 MHz, Methanol-d4)δ:177.3 (C=O), 165.5 (C-7), 162.4 (C-9), 160.5 (C-4′),158.2 (C-5), 148.0 (C-2), 137.1 (C-3), 130.7 (C-2′, 6′),123.7 (C-1′), 116.3 (C-3′, 5′), 104.5 (C-10), 99.3 (C-6),94.5 (C-8)。以上数据与文献报道基本一致[12],故鉴定化合物1 为山柰酚。
化合物2:黄色粉末,易溶于甲醇和乙醇,ESIMSm/z471.10 [M+Na]+,相对分子质量448,分子式C21H20O11。1H-NMR (600 MHz, DMSO-d6)δ: 12.99(1H, s, 5-OH), 7.45 (1H, dd,J= 8.4, 2.4 Hz, H-6′), 7.42(1H, d,J= 2.2 Hz, H-2′), 6.91 (1H, d,J= 8.4 Hz, H-5′),6.79 (1H, d,J= 2.2 Hz, H-8), 6.75 (1H, s, H-3), 6.45(1H, d,J= 2.2 Hz, H-6), 5.08 (1H, d,J= 7.5 Hz, H-1′′),3.70 (1H, d,J= 10.3 Hz, H-2′′), 3.50~3.42 (2H, m, H-3′′, 5′′), 3.32~3.23 (2H, m, H-6′′), 3.17 (1H, t,J= 9.0 Hz, H-4′′)。13C-NMR (151 MHz, DMSO-d6)δ: 181.8(C-4), 164.4 (C-2), 162.9 (C-7), 160.9 (C-5), 156.9 (C-9), 149.7 (C-4′), 145.7 (C-3′), 121.5 (C-1′), 119.2 (C-6′), 115.9 (C-5′), 113.5 (C-2′), 105.4 (C-10), 103.3 (C-3), 99.9 (C-1′′), 99.5 (C-6), 94.8 (C-8), 77.2 (C-3′′),76.3 (C-5′′), 73.1 (C-2′′), 69.5 (C-4′′), 60.5 (C-6′′)。以上数据与文献报道基本一致[13],故鉴定化合物2 为木犀草苷。
化合物3:淡黄色结晶(乙醇-水),易溶于甲醇,分子式C30H26O13。1H NMR (600 MHz, Methanol-d4)δ: 7.98 (2H, d,J= 8.8 Hz, H-2′,6′), 7.40 (1H, d,J= 15.9 Hz, H-7′′), 7.30 (2H, d,J= 8.6 Hz, H-2′′′,6′′′), 6.80 (4H,dd,J= 15.5, 8.7 Hz, H-3′,5′), 6.30 (1H, d,J= 2.1 Hz,H-8), 6.12 (1H, d,J= 2.1 Hz, H-6), 6.07 (1H, d,J=15.9 Hz, H-8′′′), 5.25 (1H, d,J= 7.4 Hz, H-1′′), 4.30(1H, dd,J= 11.8, 2.3 Hz, H-6′′a), 4.19 (1H, dd,J= 11.8,6.7 Hz, H-6′′b);13C-NMR (150 MHz, Methanol-d4)δ:179.4 (C-4), 168.8 (C-9′′′), 165.9 (C-7), 162.9 (C-5),161.5 (C-4′), 161.2 (C-4′′), 159.4 (C-9), 158.4 (C-2),146.5 (C-7′′′), 135.2 (C-3), 132.2 (C-2′, 6′), 131.2 (C-2′′′, 6′′′), 127.1 (C-1′′′), 122.7 (C-1′), 116.8 (C-3′′′, 5′′′),116.0 (C-3′, 5′), 114.8 (C-8′′′), 105.6 (C-1′′), 103.9 (C-10), 99.9 (C-6), 94.8 (C-8), 78.0 (C-5′′), 75.8 (C-2′′),75.7 (C-3′′), 71.7 (C-4′′), 64.3 (C-6′′)。以上数据与文献报道基本一致[14],故鉴定化合物3 为银椴苷。
化合物4:黄色粉末,易溶于甲醇、乙醇,ESIMSm/z465.10 [M+H]+,相对分子质量464,分子式C21H20O12。1H-NMR (600 MHz, DMSO-d6)δ: 7.67(1H, dd,J= 8.5, 2.3 Hz, H-6′), 7.52 (1H, s, H-2′), 6.81(1H, d,J= 8.5 Hz, H-5′), 6.41 (1H, s, H-8), 6.20 (1H,s, H-6), 5.38 (1H, d,J= 7.7 Hz, H-1), 5.16 (1H, d,J=4.7 Hz, 4-OH), 4.89 (1H, d,J= 5.6 Hz, 2-OH), 4.51~4.42 (1H, m, H-4′′), 3.64 (1H, dd,J= 5.9, 3.4 Hz, H-3′′), 3.56 (1H, qd,J= 7.0, 3.2 Hz, H-6′′), 3.45 (1H, ddt,J= 7.8, 5.9, 3.8 Hz, H-2′′, 5′′), 3.36 (4H, d,J= 13.7 Hz,H-4′), 3.33 (1H, t,J= 6.0 Hz, H-2), 3.28 (1H, ddd,J=10.5, 8.0, 5.6 Hz, H-3′);13C-NMR (150 MHz, DMSOd6)δ: 177.5 (C-4), 164.1 (C-7), 161.2 (C-5), 160.9 (C-2), 156.3 (C-9),148.4 (C-4′),144.8 (C-3′), 133.5 (C-3),121.9 (C-1′), 121.1 (C-6′), 115.9 (C-5′), 115.2 (C-2′),103.9 (C-10), 101.8 (C-1′′), 98.6 (C-6), 93.5 (C-8), 75.8(C-5′′),73.2 (C-3′′), 71.2 (C-2′′), 67.9 (C-4′′), 60.1 (C-6′′)。以上数据与文献报道基本一致[15],故化合物4鉴定为金丝桃苷。
化合物5:无色针状晶体(甲醇),易溶于甲醇、乙醇,分子式C16H14O6。1H-NMR (600 MHz, Methanold4)δ: 6.94 (1H, d,J= 2.0 Hz, H-2′), 6.93 (1H, d,J= 8.3 Hz, H-5′), 6.90 (1H, dd,J= 8.3, 2.0 Hz, H-6′), 5.90 (1H,d,J= 2.1 Hz, H-6), 5.88 (1H, d,J= 2.2 Hz, H-8), 5.30(1H, dd,J= 12.8, 3.1 Hz, H-2), 3.86 (3H, s, -OCH3),3.05 (1H, dd,J= 17.1, 12.7 Hz, H-3a), 2.70 (1H, dd,J= 17.1, 3.1 Hz, H-3b);13C-NMR (150 MHz,Methanol-d4)δ: 197.6 (C=O), 168.3 (C-7), 165.4 (C-5),164.7 (C-9), 149.3 (C-3′), 147.8 (C-4′), 133.1 (C-1′),118.9 (C-6′), 114.5 (C-2′), 112.6 (C-5′), 97.1 (C-10),96.2 (C-8), 80.3 (C-2), 56.4 (-OCH3), 44.1 (C-3)。以上数据与文献报道基本一致[16],故鉴定化合物5 为橙皮素。
化合物6:褐色粉末状,易溶于甲醇、乙醇,难溶于水,分子式C16H12O4。1H-NMR (600 MHz,DMSO-d6)δ: 8.33 (1H, s, H-1), 7.97 (1H, d,J= 8.8 Hz,H-5), 7.50 (2H, d,J= 8.8 Hz, H-2′, 6′), 6.98 (2H, d,J=8.7 Hz, H-3′, 5′), 6.94 (1H, dd,J= 8.7, 2.2 Hz, H-6),6.87 (1H, d,J= 2.2 Hz, H-8), 3.78 (3H, s, -OCH3);13C-NMR (150 MHz, DMSO-d6)δ: 174.6 (C-4), 162.5(C-7), 158.9 (C-4′), 157.4 (C-9), 153.1 (C-2), 130.0 (C-2′, 6′), 127.3 (C-5), 124.2 (C-1′), 123.2 (C-3), 116.6 (C-10), 115.1 (C-6), 113.6 (C-5′, C-3′), 102.1 (C-8), 55.1(-OCH3)。以上数据与文献报道基本一致[17],故化合物6 鉴定为刺芒柄花素。
化合物7:黄色粉末,不溶于水,难溶于甲醇,易溶于二甲基亚砜,ESI-MSm/z303.05 [M+H]+,相对分子质量302,分子式C15H10O7。1H-NMR (600 MHz, DMSO-d6)δ: 12.48 (1H, s, 5-OH), 7.68 (1H, d,J= 2.2 Hz, H-2′), 7.54 (1H, dd,J= 8.4, 2.2 Hz, H-6′),6.89 (1H, d,J= 8.5 Hz, H-5′), 6.41 (1H, d,J= 2.0 Hz,H-8′), 6.19 (1H, d,J= 2.0 Hz, H-6);13C-NMR (151 MHz, DMSO-d6)δ: 175.8 (C=O), 163.8 (C-7), 160.5(C-5), 156.2 (C-9), 147.6 (C-4′), 146.8 (C-2), 144.9 (C-3′), 135.7 (C-3), 122.1 (C-1′), 120.1 (C-6′), 115.6 (C-5′), 115.1 (C-2′), 103.1 (C-10), 98.1 (C-6), 93.4 (C-8)。以上数据与文献报道基本一致[18],故化合物7 鉴定为槲皮素。
化合物8:白色结晶(甲醇-水),微溶于水,易溶于二甲基亚砜,分子式C7H6O3。1H-NMR (600 MHz, Methanol-d4)δ: 7.88 (2H, d,J= 8.7 Hz, H-2, 6),6.82 (2H, d,J= 8.7 Hz, H-3, 5);13C-NMR (150 MHz,Methanol-d4)δ: 170.1 (C-7), 163.3 (C-4), 133.0 (C-2,6), 122.7 (C-1), 116.0 (C-3, 5)。以上数据与文献报道基本一致[19],故鉴定化合物8 为对羟基苯甲酸。
化合物9:黄白色粉末,易溶于水、甲醇、乙醇,分子式C18H16O8。1H-NMR (600 MHz, CD3OD)δ: 7.55 (1H, d,J= 15.9 Hz, H-7), 7.04 (1H, d,J= 2.1 Hz, H-2), 6.95 (1H, dd,J= 8.2, 2.1 Hz, H-6), 6.78 (1H,d,J= 8.1 Hz, H-5′), 6.61 (1H, dd,J= 8.1, 2.1 Hz, H-5), 6.27 (1H, d,J= 15.9 Hz, H-8), 5.18 (1H, dd,J= 8.5,4.2 Hz, H-8′), 3.10 (1H, dd,J= 14.3, 4.2 Hz, H-7′α),3.00 (1H, dd,J= 14.4, 8.5 Hz, H-7′β);13C-NMR (150 MHz, CD3OD)δ: 173.8 (C-9′), 168.5 (C-9), 149.7 (C-4′), 147.7 (C-7), 146.8 (C-3′), 146.2 (C-4), 145.3 (C-3),129.4 (C-1′), 127.7 (C-1), 123.1 (C-6), 121.8 (C-5),117.6 (C-2′), 116.5 (C-5′), 116.3 (C-6′), 115.2 (C-2),114.2 (C-8), 74.8 (C-8′), 37.97 (C-7′)。以上数据与文献报道基本一致[20],故鉴定化合物9 为迷迭香酸。
化合物10:无色晶体(乙醇),易溶于甲醇、乙醇,分子式C9H10O3。1H-NMR (600 MHz, Methanold4)δ: 7.87 (2H, d,J= 8.8 Hz, H-3, 5), 6.82 (2H, d,J=8.8 Hz, H-2, 6), 4.30 (2H, q,J= 7.1 Hz, -OCH2), 1.36(3H, t,J= 7.1 Hz, -CH3);13C-NMR (150 MHz,Methanol-d4)δ: 168.3 (-CO-), 163.4 (C-4), 132.7 (C-2,6), 122.5 (C-1), 116.1 (C-3, 5), 61.7 (-OCH2-), 14.6 (-CH3)。以上数据与文献报道基本一致[21],故鉴定化合物10 为对羟基苯甲酸乙酯。
化合物11:白色结晶(甲醇),易溶于甲醇、乙醇,分子式C7H6O3。1H-NMR (600 MHz, Methanold4)δ: 7.85 (1H, dd,J= 7.9, 1.8 Hz, H-6), 7.46 (1H, ddd,J= 8.7, 7.2, 1.7 Hz, H-4), 6.93~6.86 (2H, m, H-3, 5);13C NMR (150 MHz, Methanol-d4)δ: 173.5 (-COOH),163.2 (C-2), 136.6 (C-4), 131.5 (C-6), 120.0 (C-5),118.1 (C-3), 113.9 (C-1)。以上数据与文献报道基本一致[22],故鉴定化合物11 为水杨酸。
化合物12:白色结晶粉末,易溶于热水、甲醇,分子式C7H6O5。1H-NMR (600 MHz, Methanol-d4)δ:7.06 (2H, s, H-2, 6);13C-NMR (150 MHz, Methanold4)δ: 168.9 (-COOH), 145.0 (C-3, 5), 138.2 (C-4),120.6 (C-1), 108.9 (C-2, 6)。以上数据与文献报道基本一致[23],故化合物12 鉴定为没食子酸。
化合物13:黄色结晶粉末,易溶于甲醇、乙醇,分子式C9H8O4。1H-NMR (600 MHz, Methanol-d4)δ:7.53 (1H, d,J= 15.9 Hz, H-7), 7.04 (1H, d,J= 2.0 Hz,H-2), 6.93 (1H, dd,J= 8.2, 2.1 Hz, H-6), 6.78 (1H, d,J= 8.2 Hz, H-5), 6.22 (1H, d,J= 15.8 Hz, H-8);13CNMR (150 MHz, Methanol-d4)δ: 171.0 (C-9), 149.4(C-3), 147.0 (C-7), 146.8 (C-4), 127.8 (C-1), 122.8 (C-6), 116.5 (C-8), 115.5 (C-5), 115.1 (C-2)。以上数据与文献报道基本一致[24],故化合物13 鉴定为咖啡酸。
化合物14:白色近棕褐色粉末,易溶于水、甲醇、乙醇,ESI-MSm/z155.03 [M+H]+,相对分子质量154,分子式C7H6O4。1H-NMR (600 MHz,Methanol-d4)δ: 7.43 (3H, s, H-6), 7.42 (1H, d,J= 2.1 Hz, H-2), 6.79 (2H, d,J= 8.0 Hz, H-5);13C-NMR (150 MHz, Methanol-d4)δ: 170.2 (C-7), 151.5 (C-4), 146.1(C-3), 123.9 (C-6), 123.1 (C-1), 117.7 (C-2), 115.8 (C-5)。以上数据与文献报道基本一致[25],故鉴定化合物14 为原儿茶酸。
化合物15:灰黄色粉末,易溶于甲醇,分子式C14H16O8。1H-NMR (600 MHz, DMSO-d6)δ: 7.47 (2H,s, H-5, 5′);13C-NMR (150 MHz, DMSO-d6)δ: 159.2(C-7, 7′), 148.0 (C-4, 4′), 139.5 (C-3, 3′), 136.4 (C-2,2′), 112.4 (C-1, 1′), 110.3 (C-5, 5′), 107.8 (C-6, 6′)。以上数据与文献报道基本一致[26],故鉴定化合物15 为鞣花酸。
化合物16:白色结晶性粉末,易溶于甲醇、乙醇,分子式C8H8O4。1H-NMR (600 MHz, Methanold4)δ: 7.56 (2H, dd,J= 6.0, 1.9 Hz, H-2,H-6), 6.84 (1H,d,J= 8.8 Hz, H-5), 3.89 (3H, s, -OCH3);13C-NMR(150 MHz, Methanol-d4)δ:170.0 (-COOH), 152.7 (C-4), 148.7 (C-3), 125.3 (C-6), 123.1 (C-1), 115.8 (C-5),113.8 (C-2), 56.4 (-OCH3)。以上数据与文献报道基本一致[27],故鉴定化合物16 为香草酸。
化合物17:黄色油状液体,易溶于甲醇,分子式C11H16O3。1H-NMR (600 MHz, Methanol-d4)δ: 5.75(1H, s, H-7), 4.22 (1H, s, H-3), 2.42 (1H, d,J= 13.3 Hz, H-4a), 1.99 (1H, d,J= 14.4 Hz, H-2a), 1.76 (3H, s,H-11), 1.47 (3H, s, H-9), 1.28 (3H, s, H-10);13C-NMR(150 MHz, Methanol-d4)δ: 185.7 (C-6), 174.5 (C-8),113.3 (C-7), 88.9 (C-5), 67.2 (C-3), 47.9 (C-4), 46.5 (C-2), 37.2 (C-1), 31.0 (C-10), 27.4 (C-11), 26.9 (C-9)。以上数据与文献报道基本一致[28],故鉴定化合物17 为loliolide。
化合物18:白色结晶粉末,易溶于甲醇,微溶于水,分子式C8H8O3。1H-NMR (600 MHz, Methanold4)δ: 7.86 (2H, d,J= 8.9 Hz, H-2, 6), 6.82 (2H, d,J=8.8 Hz, H-3, 5), 3.84 (3H, s, -COOCH3);13C-NMR(150 MHz, Methanol-d4)δ: 168.7 (C-7), 163.5 (C-4),132.7 (C-2, 6), 122.2 (C-1), 116.1 (C-3, 5), 52.2 (-OCH3)。以上数据与文献报道基本一致[29],故鉴定化合物18 为对羟基苯甲酸甲酯。
化合物19:淡黄色油性粉末,易溶于甲醇,分子式C12H13ON。1H-NMR (600 MHz, Methanol-d4)δ:7.35 (1H, d,J= 7.4 Hz, H-4), 7.25 (1H, td,J= 7.7, 1.3 Hz, H-6), 7.05~7.00 (1H, m, H-5), 6.88 (1H, d,J= 7.7 Hz, H-7), 3.89 (2H, d,J= 7.0 Hz, H-10), 3.09 (1H, d,J= 15.2 Hz, H-8), 3.02 (1H, d,J= 15.2 Hz, H-8), 1.00(3H, s, H-11);13C-NMR (150 MHz, Methanol-d4)δ:180.8 (C-2), 170.4 (C-9), 143.6 (C-7a), 131.7 (C-3a),130.9 (C-4), 125.2 (C-6), 123.5 (C-5), 111.2 (C-7), 74.8(C-3), 61.6 (C-10), 42.9 (C-8), 14.1 (C-11)。以上数据与文献报道基本一致[30],故鉴定化合物19 为ethyl dioxindole-3-acetate。
化合物20:白色粉末状,易溶于甲醇,分子式C36H58O11。1H-NMR (600 MHz, Methanol-d4)δ: 5.32(1H, d,J= 8.3 Hz, H-1′), 1.34 (3H, s, H-27), 1.21 (3H,s, H-29), 1.04 (3H, s, H-25), 0.93 (3H, d,J= 6.7 Hz, H-30), 0.78 (3H, s, H-26), 0.70 (3H, s, H-24);13C-NMR(150 MHz, Methanol-d4)δ: 178.6 (C-28), 139.8 (C-13),129.5 (C-12), 95.8 (C-1′), 78.6 (C-3′), 78.4 (C-5′), 78.3(C-3), 73.9 (C-2′), 73.7 (C-19), 71.2 (C-4′), 69.7 (C-2),66.5 (C-23), 62.5 (C-6′), 54.9 (C-18), 48.3 (C-5), 47.9(C-9, C-17), 44.1 (C-4), 42.9 (C-14), 42.8 (C-20), 41.3(C-8), 39.0 (C-10), 38.3 (C-22), 33.5 (C-7), 29.6 (C-15), 27.2 (C-29), 27.1 (C-21), 26.5 (C-16), 24.8 (C-27),24.7 (C-11), 19.3 (C-6), 17.7 (C-25), 17.6 (C-30), 16.6(C-26), 13.9 (C-24)。以上数据与文献报道基本一致[31],故鉴定化合物20 为苦莓苷F1。
化合物21:白色粉末,易溶于甲醇,难溶于水,分子式C30H48O4。1H-NMR (600 MHz, DMSO-d6)δ:11.97 (1H, s, -COOH), 5.13 (1H, brs) 为环内双键质子信号, 1.07 (3H, s, H-23), 0.70 (3H, s, H-24), 0.85(3H, s, H-25), 0.68 (3H, s, H-26), 1.28 (3H, s, H-27),0.89 (3H, s, H-29), 0.84 (3H, s, H-30) 为7 个甲基质子信号;13C-NMR (150 MHz, DMSO-d6)δ: 178.2 (C-28), 138.2 (C-13), 124.5 (C-12), 82.2 (C-3), 67.1 (C-2),54.7 (C-5), 52.3 (C-18), 47.0 (C-1, 9), 46.9 (C-17), 46.8(C-14), 41.7 (C-8), 38.9 (C-4), 38.5 (C-20), 38.4 (C-19), 37.5 (C-10), 36.3 (C-22), 32.6 (C-7), 30.2 (C-21),28.8 (C-23), 27.5 (C-15), 23.7 (C-27), 23.2 (C-11), 22.9(C-16), 21.0 (C-30), 17.9 (C-6), 17.1 (C-24), 16.9 (C-26), 16.9 (C-29), 16.4 (C-25)。以上数据与文献报道基本一致[32],故鉴定化合物21 为科罗索酸。
化合物22:灰色粉末,易溶于醇,分子式C30H48O5。1H-NMR (600 MHz, Methanol-d4)δ: 1.34(1H, s, H-27), 1.19 (1H, s, H-29), 1.01 (2H, d,J= 7.0 Hz, H-23);13C-NMR (150 MHz, Methanol-d4)δ: 182.2(C-28), 140.1 (C-13), 129.3 (C-12), 84.6 (C-3), 73.6 (C-19), 69.5 (C-2), 56.7 (C-5), 55.1 (C-18), 48.2 (C-1, 9),43.1 (C-20), 42.7 (C-14), 41.1 (C-17), 40.5 (C-8), 39.2(C-4, 22), 38.9 (C-10), 34.1 (C-7), 29.6 (C-23), 29.3 (C-15), 27.3 (C-21), 27.1 (C-29), 26.6 (C-16), 24.8 (C-27),24.7 (C-11), 19.7 (C-6), 17.5 (C-24), 17.4 (C-26), 17.0(C-25), 16.6 (C-30)。以上数据与文献报道基本一致[33],故鉴定化合物22 为委陵菜酸。
化合物23:白色晶体(甲醇-水),易溶于甲醇、乙醇,分子式 C30H48O4。1H-NMR (600 MHz,Methanol-d4)δ: 5.25 (1H, s, H-12), 1.17 (1H, s, 23),1.01 (2H, d,J= 5.3 Hz, H-27), 0.95 (1H, s, H-24), 0.91(1H, s, H-26), 0.81 (2H, d,J= 4.8 Hz, H-30, 25);13CNMR (150 MHz, Methanol-d4)δ: 181.8 (C-28), 145.4(C-13), 123.5 (C-12), 84.5 (C-3), 69.5 (C-2), 56.7 (C-5), 48.1 (C-9), 47.6 (C-8), 47.3 (C-19), 42.9 (C-1), 42.7(C-17), 40.6 (C-14), 40.5 (C-18), 39.3 (C-10), 34.9 (C-4), 33.9 (C-21), 33.8 (C-29), 33.6 (C-7), 31.6 (C-22),29.3 (C-20), 28.8 (C-23), 26.4 (C-15), 24.6 (C-27), 24.1(C-11), 23.9 (C-30), 19.6 (C-16), 17.7 (C-6), 17.4 (C-24), 17.1 (C-25)。以上数据与文献报道基本一致[34],故鉴定化合物23 为山楂酸。
化合物24:白色粉末,可溶于甲醇,分子式C30H48O5。1H-NMR (600 MHz, Methanol-d4)δ: 5.30(1H, t,J= 3.7 Hz, H-12), 1.35 (1H, s, H-27), 1.20 (1H,s, H-25), 0.99 (2H, s, H-23), 0.93 (1H, d,J= 6.7 Hz, H-30), 0.87 (1H, s, H-26), 0.79 (1H, s, H-24);13C-NMR(150 MHz, Methanol-d4)δ: 182.3 (C-28), 140.1 (C-13),129.4 (C-12), 80.1 (C-3), 73.6 (C-19), 67.2 (C-2), 55.1(C-18), 48.2 (C-5), 43.1 (C-17), 42.8 (C-9), 42.5 (C-1),41.3 (C-14, 20), 39.5 (C-8), 39.4 (C-4), 39.1 (C-10, 22),34.1 (C-7), 29.6 (C-23), 29.2 (C-15), 27.3 (C-21), 27.1(C-29), 26.6 (C-16), 24.9 (C-27), 24.7 (C-11), 22.4 (C-24), 19.3 (C-6), 17.5 (C-26), 16.9 (C-30), 16.6 (C-25)。以上数据与文献报道基本一致[35],故鉴定化合物24为野鸦椿酸。
3.2 活性化合物的筛选
采用CCK-8 法检测待测化合物(25、50、100 μg/mL)作用HEK293-CB2 细胞6 h 后的细胞活力。与对照组相比,分离得到的24 个化合物对HEK293-CB2 细胞的活性没有显著影响。
如表1 所示,以HU308(1 μmol/L,CB2R 的特异性激动剂)为参照,评价化合物对HEK293-CB2细胞的激动作用。从24 个化合物中初步筛选出5 个对HEK293-CB2 细胞有激动作用的化合物,分别为槲皮素、橙皮素、山柰酚、对羟基苯甲酸甲酯和对羟基苯甲酸乙酯。其中槲皮素和山柰酚对HEK293-CB2 细胞的刺激作用最强,其最小给药质量浓度(25 μg/mL)已超过HU308 对CB2R 的激动作用。其余3 种化合物的最大给药质量浓度(100 μg/mL)对CB2R 的激动作用与阳性药物HU308 相同。因此,选择槲皮素、橙皮素、山柰酚、对羟基苯甲酸甲酯和对羟基苯甲酸乙酯进行后续分析。
表1 24 个化合物通过双荧光素酶筛选体系对CB2R 的激活活性 (±s, n = 5)Table 1 CB2R activity of 24 isolated compounds screened using double luciferase screening system (±s, n = 5)
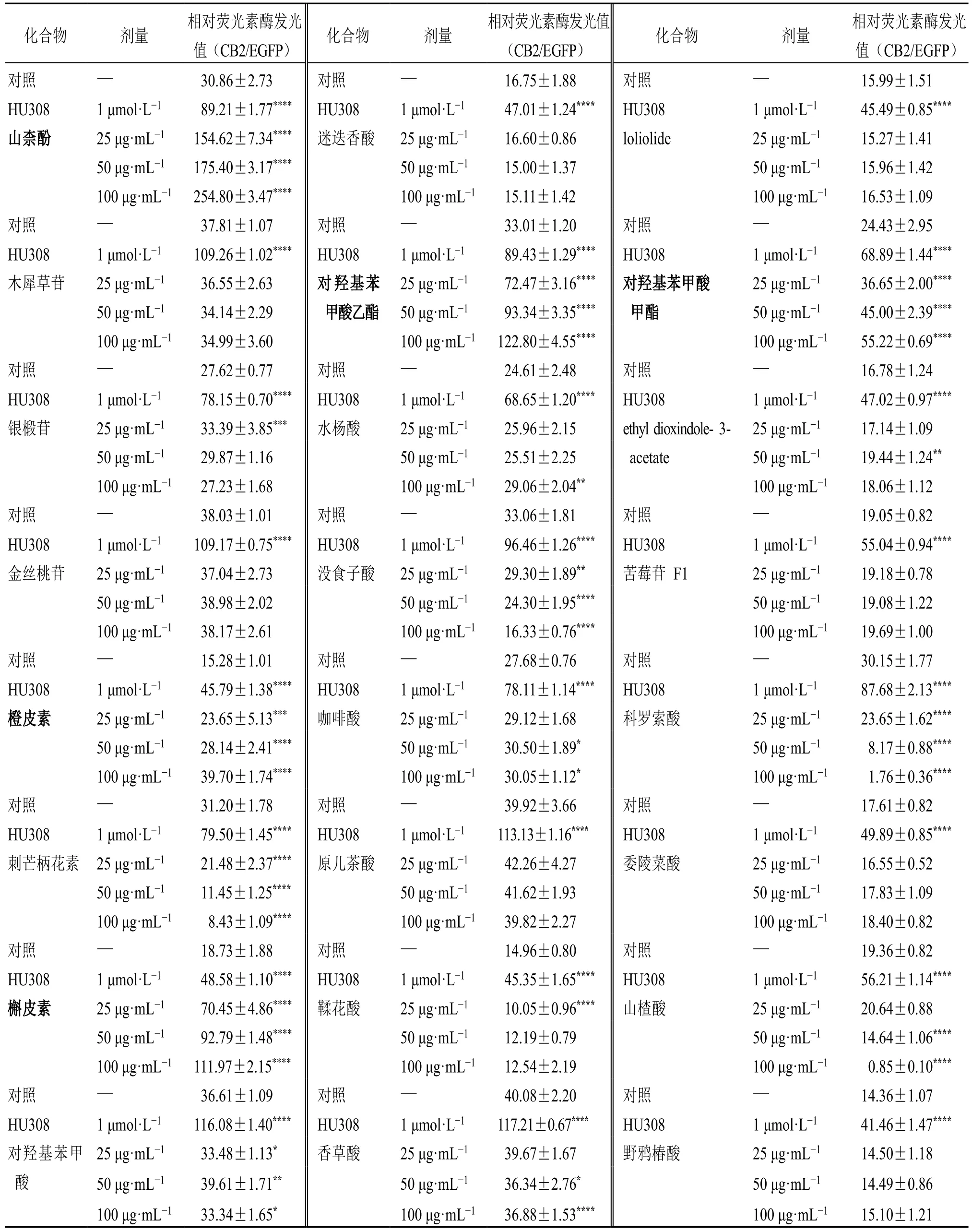
表1 24 个化合物通过双荧光素酶筛选体系对CB2R 的激活活性 (±s, n = 5)Table 1 CB2R activity of 24 isolated compounds screened using double luciferase screening system (±s, n = 5)
加粗表示有活性;与对照组比较:*P<0.05 **P<0.01 ***P<0.001 ****P<0.000 1。bold indicates activity; *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.000 1 vs control group.
化合物 剂量 相对荧光素酶发光值(CB2/EGFP) 化合物 剂量 相对荧光素酶发光值(CB2/EGFP) 化合物 剂量 相对荧光素酶发光值(CB2/EGFP)对照 — 30.86±2.73 对照 — 16.75±1.88 对照 — 15.99±1.51 HU308 1 μmol·L−1 89.21±1.77**** HU308 1 μmol·L−1 47.01±1.24**** HU308 1 μmol·L−1 45.49±0.85****山柰酚 25 μg·mL−1 154.62±7.34**** 迷迭香酸 25 μg·mL−1 16.60±0.86 loliolide 25 μg·mL−1 15.27±1.41 50 μg·mL−1 175.40±3.17**** 50 μg·mL−1 15.00±1.37 50 μg·mL−1 15.96±1.42 100 μg·mL−1 254.80±3.47**** 100 μg·mL−1 15.11±1.42 100 μg·mL−1 16.53±1.09对照 — 37.81±1.07 对照 — 33.01±1.20 对照 — 24.43±2.95 HU308 1 μmol·L−1 109.26±1.02**** HU308 1 μmol·L−1 89.43±1.29**** HU308 1 μmol·L−1 68.89±1.44****木犀草苷 25 μg·mL−1 36.55±2.63 对羟基苯甲酸乙酯25 μg·mL−1 36.65±2.00****50 μg·mL−1 34.14±2.29 50 μg·mL−1 93.34±3.35**** 50 μg·mL−1 45.00±2.39****25 μg·mL−1 72.47±3.16**** 对羟基苯甲酸甲酯100 μg·mL−1 34.99±3.60 100 μg·mL−1 122.80±4.55**** 100 μg·mL−1 55.22±0.69****对照 — 27.62±0.77 对照 — 24.61±2.48 对照 — 16.78±1.24 HU308 1 μmol·L−1 78.15±0.70**** HU308 1 μmol·L−1 68.65±1.20**** HU308 1 μmol·L−1 47.02±0.97****银椴苷 25 μg·mL−1 33.39±3.85*** 水杨酸 25 μg·mL−1 25.96±2.15 ethyl dioxindole- 3-acetate 25 μg·mL−1 17.14±1.09 50 μg·mL−1 29.87±1.16 50 μg·mL−1 25.51±2.25 50 μg·mL−1 19.44±1.24**100 μg·mL−1 27.23±1.68 100 μg·mL−1 29.06±2.04** 100 μg·mL−1 18.06±1.12对照 — 38.03±1.01 对照 — 33.06±1.81 对照 — 19.05±0.82 HU308 1 μmol·L−1 109.17±0.75**** HU308 1 μmol·L−1 96.46±1.26**** HU308 1 μmol·L−1 55.04±0.94****金丝桃苷 25 μg·mL−1 37.04±2.73 没食子酸 25 μg·mL−1 29.30±1.89** 苦莓苷 F1 25 μg·mL−1 19.18±0.78 50 μg·mL−1 38.98±2.02 50 μg·mL−1 24.30±1.95**** 50 μg·mL−1 19.08±1.22 100 μg·mL−1 38.17±2.61 100 μg·mL−1 16.33±0.76**** 100 μg·mL−1 19.69±1.00对照 — 15.28±1.01 对照 — 27.68±0.76 对照 — 30.15±1.77 HU308 1 μmol·L−1 45.79±1.38**** HU308 1 μmol·L−1 78.11±1.14**** HU308 1 μmol·L−1 87.68±2.13****橙皮素 25 μg·mL−1 23.65±5.13*** 咖啡酸 25 μg·mL−1 29.12±1.68 科罗索酸 25 μg·mL−1 23.65±1.62****50 μg·mL−1 28.14±2.41**** 50 μg·mL−1 30.50±1.89* 50 μg·mL−1 8.17±0.88****100 μg·mL−1 39.70±1.74**** 100 μg·mL−1 30.05±1.12* 100 μg·mL−1 1.76±0.36****对照 — 31.20±1.78 对照 — 39.92±3.66 对照 — 17.61±0.82 HU308 1 μmol·L−1 79.50±1.45**** HU308 1 μmol·L−1 113.13±1.16**** HU308 1 μmol·L−1 49.89±0.85****刺芒柄花素 25 μg·mL−1 21.48±2.37**** 原儿茶酸 25 μg·mL−1 42.26±4.27 委陵菜酸 25 μg·mL−1 16.55±0.52 50 μg·mL−1 11.45±1.25**** 50 μg·mL−1 41.62±1.93 50 μg·mL−1 17.83±1.09 100 μg·mL−1 8.43±1.09**** 100 μg·mL−1 39.82±2.27 100 μg·mL−1 18.40±0.82对照 — 18.73±1.88 对照 — 14.96±0.80 对照 — 19.36±0.82 HU308 1 μmol·L−1 48.58±1.10**** HU308 1 μmol·L−1 45.35±1.65**** HU308 1 μmol·L−1 56.21±1.14****槲皮素 25 μg·mL−1 70.45±4.86**** 鞣花酸 25 μg·mL−1 10.05±0.96**** 山楂酸 25 μg·mL−1 20.64±0.88 50 μg·mL−1 92.79±1.48**** 50 μg·mL−1 12.19±0.79 50 μg·mL−1 14.64±1.06****100 μg·mL−1 111.97±2.15**** 100 μg·mL−1 12.54±2.19 100 μg·mL−1 0.85±0.10****对照 — 36.61±1.09 对照 — 40.08±2.20 对照 — 14.36±1.07 HU308 1 μmol·L−1 116.08±1.40**** HU308 1 μmol·L−1 117.21±0.67**** HU308 1 μmol·L−1 41.46±1.47****对羟基苯甲酸25 μg·mL−1 33.48±1.13* 香草酸 25 μg·mL−1 39.67±1.67 野鸦椿酸 25 μg·mL−1 14.50±1.18 50 μg·mL−1 39.61±1.71** 50 μg·mL−1 36.34±2.76* 50 μg·mL−1 14.49±0.86 100 μg·mL−1 33.34±1.65* 100 μg·mL−1 36.88±1.53**** 100 μg·mL−1 15.10±1.21
通过HEK293-EGFP 阴性细胞进一步验证以确定5 个化合物是否具有特异性激动CB2R 作用。结果表明,只有橙皮素和对羟基苯甲酸甲酯对HEK293-EGFP 细胞没有激活作用(图1-A~E),说明这2 个化合物是通过CB2R 发挥激动作用。
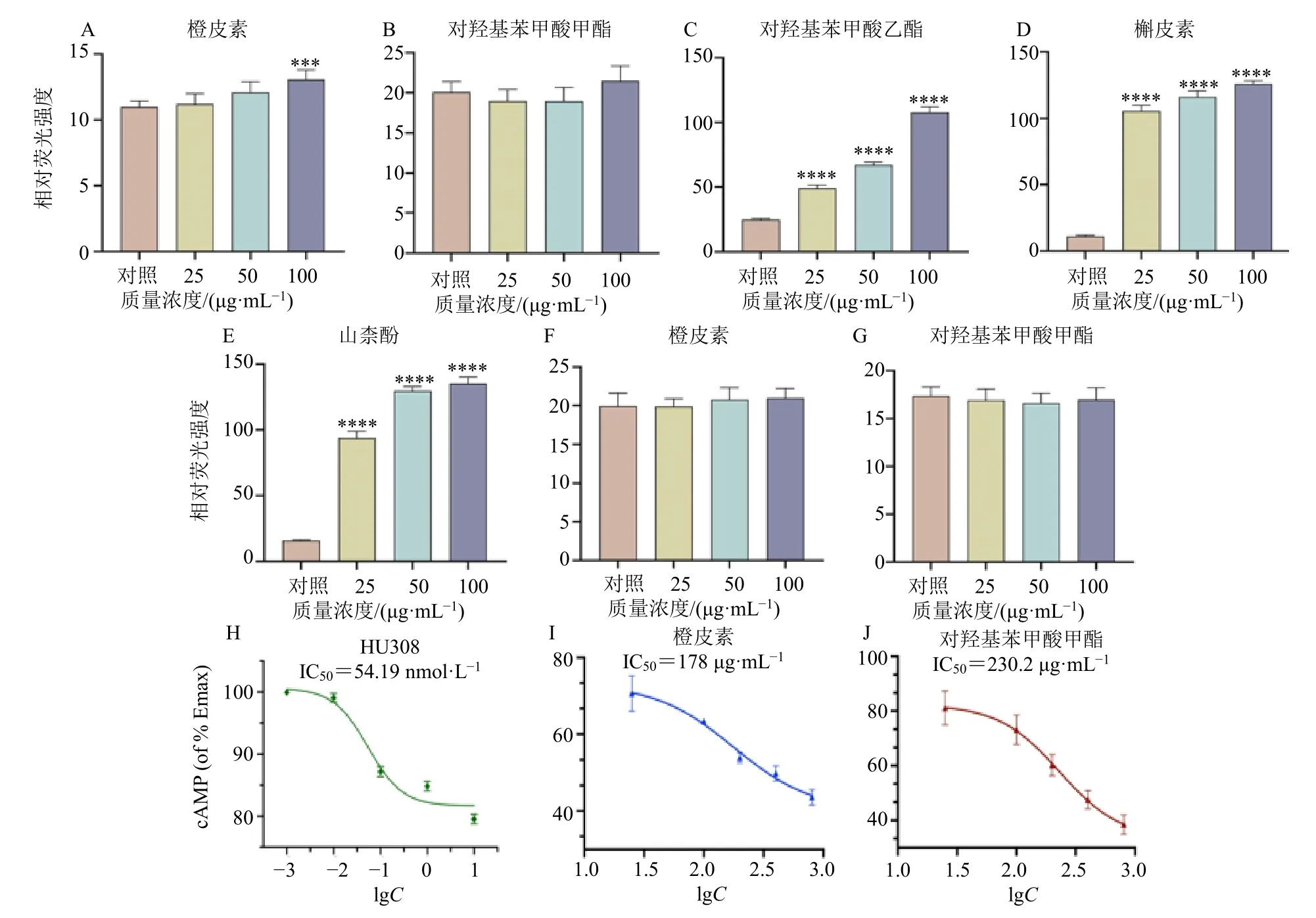
图1 通过双荧光素酶筛选的化合物对CB2R 的激动作用 (±s, n = 5)Fig.1 Agonist effect of compounds screened by double luciferase on CB2R (±s, n = 5)
为了进一步筛选出对CB2R 具有特异性激活作用的化合物,将橙皮素和对羟基苯甲酸甲酯分别与CB2R 抑制剂AM630(1 μmol/L)混合后给予HEK293-CB2 细胞共培养。结果显示,加入抑制剂 AM630 后,橙皮素和对羟基苯甲酸甲酯对HEK293-CB2 细胞的激活作用完全消失,与对照组相比无统计学差异(图1-F、G),说明它们对CB2R 的激动作用被AM630 拮抗。进一步表明,橙皮素和对羟基苯甲酸甲酯通过特异性激活CB2R 发挥作用。
3.3 橙皮素和对羟基苯甲酸甲酯对HEK293-CB2细胞内cAMP 表达水平的影响
G 蛋白偶联受体偶联的CB2R 可通过抑制细胞内腺苷酸晚期环化酶的活性来减少cAMP 的产生。如图1-H~J 所示,橙皮素和对羟基苯甲酸甲酯组的cAMP 含量随着药物浓度的增加而降低,表明这2 个化合物可显著激动CB2R 并抑制细胞内cAMP 的产生。HU308、橙皮素和对羟基苯甲酸甲酯的半数抑制浓度(median inhibition concentration,IC50)分别为54.19 nmol/L、178 μg/mL 和230.2 μg/mL。
3.4 橙皮素和对羟基苯甲酸甲酯对CB2R 蛋白的影响
给药组CB2R 蛋白表达明显高于对照组(图2-A),与给药组相比,加入CB2R 特异性抑制剂AM630 可拮抗化合物对CB2R 蛋白的激动,并减弱CB2R 蛋白的表达。此外,对羟基苯甲酸甲酯对CB2R 蛋白的激活作用强于橙皮素。
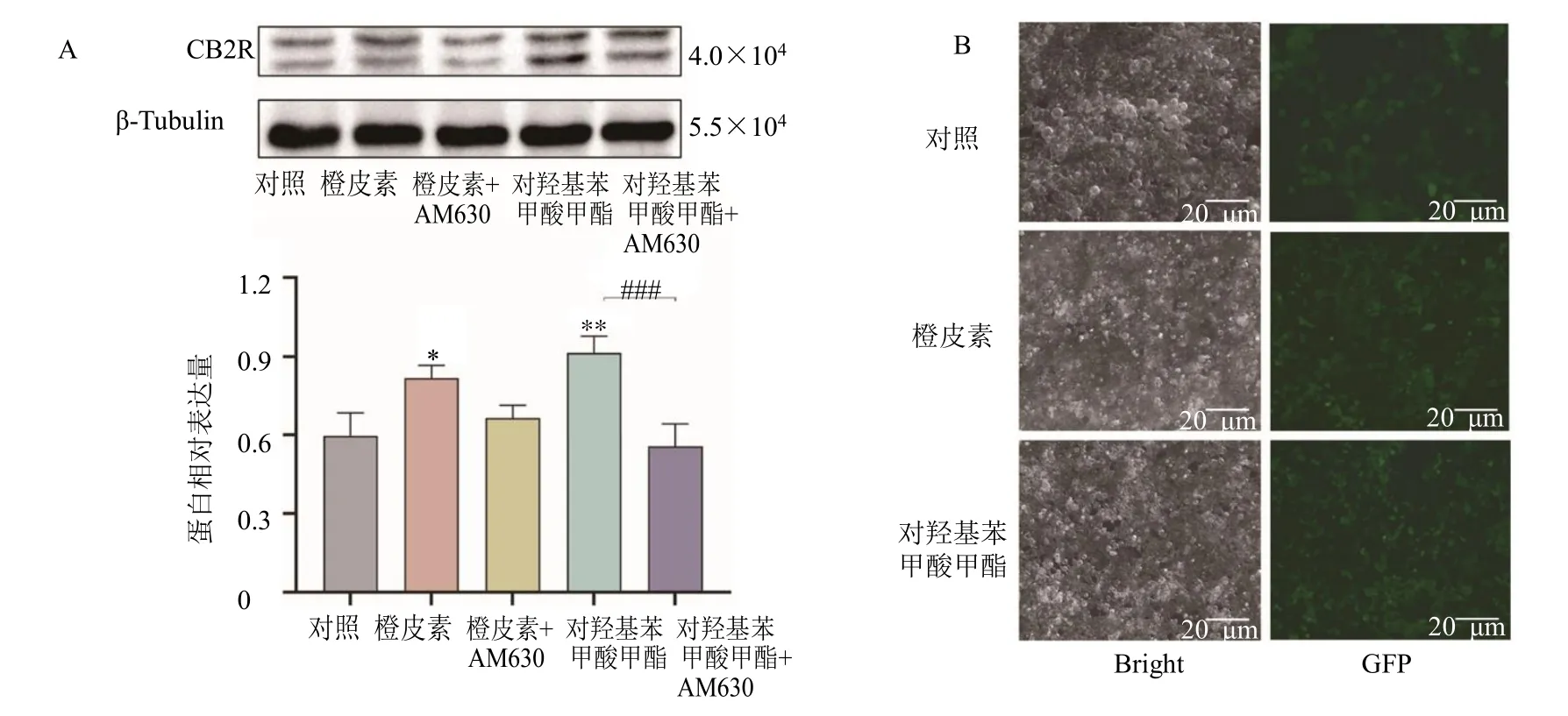
图2 筛选的化合物对HEK293-CB2 细胞内CB2R 蛋白的激动水平 (±s , n=3)Fig.2 Activation level of CB2R by selected compounds in HEK293-CB2 cells (±s , n=3)
由于HEK293-CB2 细胞同时也转染了增强型绿色荧光蛋白(EGFP),它们可通过CB2R 被激活而发出绿色荧光,其荧光强度反映了CB2R 的激活程度。用体视显微镜观察对羟基苯甲酸甲酯和橙皮素对CB2R 的激动作用。结果表明橙皮素和对羟基苯甲酸甲酯组的荧光强度和发光细胞数均高于对照组(图2-B)。
3.5 橙皮素和对羟基苯甲酸甲酯可抑制破骨细胞TRAP 酶活性
如图3-A 所示,100 μg/mL 的给药质量浓度对RAW264.7 细胞的活力没有显著影响。TRAP 酶是破骨细胞骨吸收的标志物[36]。破骨细胞的细胞核可以通过TRAP 染色进行观察。如对照组橙色箭头所示,破骨细胞具有3 个以上的细胞核,这证明RANKL 成功诱导RAW264.7 细胞分化为破骨细胞(图3-C)。与对照组相比,橙皮素和对羟基苯甲酸甲酯显著抑制RANKL 诱导的破骨细胞分化,并且这种抑制作用可被AM630 逆转(图3-C)。TRAP 活性测定显示,橙皮素和对羟基苯甲酸甲酯显著抑制破骨细胞的活性,在加入抑制剂AM630 后,破骨细胞TRAP 活性回到正常值(图3-B)。结果表明,橙皮素和对羟基苯甲酸甲酯对破骨细胞活性的抑制作用依赖于CB2R。

图3 化合物对来源于RAW264.7 细胞的破骨细胞TRAP 活性及TRAP 染色后AM630 对其活性的逆转作用 (±s, n = 12)Fig.3 Effects of selected compounds on TRAP activity of osteoclasts derived from RAW264.7 cells and reversal effect of AM630 on osteoclasts based on TRAP staining (±s , n = 12)
3.6 橙皮素和对羟基苯甲酸甲酯可破坏破骨细胞F-actin 的完整性
F-actin 环不仅是破骨细胞的微管和微丝结构,也是破骨细胞伪足的主要骨架蛋白。如图4 所示,通过比较在AM640 存在和不存在条件下对破骨细胞F-actin 环的影响,分析对照组破骨细胞的F-actin环为完整的圆形且细胞数量较多。给药组破骨细胞的F-actin 环面积减少,环破损且环的厚度也减少甚至消失。与给药组相比,抑制剂组破骨细胞的F-actin 环完整性较好,表明抑制剂AM630 可逆转橙皮素和对羟基苯甲酸甲酯对破骨细胞F-actin 环完整性的影响。

图4 筛选的化合物 (100 μg·mL−1) 对破骨细胞F-actin 环的影响 (±s , n = 5)Fig.4 Effects of selected compounds (100 μg·mL−1) on osteoclasts based on F-actin ring staining (±s , n = 5)
3.7 橙皮素和对羟基苯甲酸甲酯可抑制破骨细胞的骨吸收
破骨细胞骨吸收是骨质疏松症发生最主要的原因之一[37-38]。如图5-A 所示,在对照组的骨切片中观察到较多的骨吸收陷窝,而在给药组中观察到的骨吸收陷窝较少。然而,在加入抑制剂AM630 后,骨片表面形成了更多的骨吸收陷窝。通过Image J 计算骨吸收陷窝的面积,以对照组为定值归一化处理后结果如图5-B 所示。结果表明,橙皮素和对羟基苯甲酸甲酯可通过激活CB2R 而抑制破骨细胞的骨吸收,但这种抑制作用可被AM630 逆转。
4 讨论
本研究从中药覆盆子醋酸乙酯和二氯甲烷部分中分离鉴定了24 个化合物,其中黄酮类化合物7个、有机酸类化合物7 个、萜类化合物6 个、木脂素类化合物1 个、其他类化合物3 个。筛选鉴定了2 种新的CB2R 激动剂(橙皮素和对羟基苯甲酸甲酯)可以通过激活CB2R 以增加其蛋白表达,并抑制HEK293-CB2 细胞中cAMP 的积累,并且橙皮素和对羟基苯甲酸甲酯以CB2R 依赖的方式影响破骨细胞功能的正常发挥(图6)。

图6 本研究整体示意图Fig.6 Graphic abstract of this study
植物来源的大麻素因其高效和低毒成为治疗各种慢性病的首选化合物之一[39]。CB2R 的特异性激动剂具有良好的前景,因为它们在骨丢失中发挥着有益的调节作用,并且对中枢神经系统没有不良反应。成骨细胞和破骨细胞之间的平衡失调是导致骨质疏松发生的主要原因之一。成骨细胞和破骨细胞表面均存在CB2R,当细胞表面的CB2R 被激活时,可以通过调节成骨细胞和破骨细胞之间的平衡来维持正常的骨代谢,从而防止骨质疏松的发生。
基于上述实验结果,本研究筛选鉴定了2 个新的可特异性激动CB2R 的化合物(橙皮素和对羟基苯甲酸甲酯)。橙皮素属于二氢黄酮,其主要药理作用包括抗氧化、抗炎和调血脂作用。现有研究表明,橙皮素可以通过减少破骨细胞的数量和血清中Ⅰ型胶原C 端交联肽的水平来改善去卵巢小鼠的骨丢失并调节骨代谢[40]。对羟基苯甲酸甲酯主要用作食品和化妆品中的抗菌防腐剂,但其抗骨质疏松作用尚无报道。本研究为以CB2R 为靶点治疗骨质疏松的药物来源提供了参考,并为揭示了掌叶覆盆子的抗骨质疏松作用与其补肾作用的关系提供。
利益冲突所有作者均声明不存在利益冲突