北柴胡根部的化学成分研究
贾云鹏,杨晓军*,王 超,任火冰,杨海珍
1.延安大学化学与化工学院,陕西 延安 716000
2.陕西援康中药产业发展有限公司,陕西 绥德 718000
3.陕西华西牧业有限责任公司,陕西 榆林 719000
柴胡为伞形科柴胡属植物,其中北柴胡BupleurumchinenseDC.被列为药用上品之一[1]。现代药理研究证明柴胡具有清热解毒、保肝利胆及其抗肿瘤等作用[2-3]。为进一步明确北柴胡中的保肝有效成分,本研究主要报道对其化学成分进行分离与结构鉴定,从北柴胡醇提取物中共分离得到19 个成分,分别鉴定为蛇床子素(isthole,1)、欧前胡素(imperatorin,2)、异补骨脂素(isopsoralen,3)、对甲氧基桂皮酸乙酯(4-methoxycinnamic acid ethyl ester,4)、反式-对羟基桂皮酸(trans-4-hydroxycinnamic acid,5)、反式-3′,4′-亚甲二氧基桂皮酸(trans-3′,4′-methylenedioxy cinnamic acid,6)、反式-阿魏酸(trans-ferulic acid,7)、伞形花内酯(umbelliferone,8)、七叶内酯(esculetin,9)、迷迭香酸(labiatenic acid,10)、紫花前胡苷(marmesinin,11)、紫丁香苷(syringoside,12)、5,7,3′,4′-四甲氧基黄酮(5,7,3′,4′-tetramethoxyflavone,13)、5,7,4′-三羟基-6-异戊烯基异黄酮(5,7,4′-trihydroxy-6-isopentenyl isoflavone,14)、芹菜素(apigenin,15)、木犀草素(luteolin,16)、槲皮素(quercetin,17)、牡荆素(vitexin,18)和金丝桃苷(hyperin,19)。其中化合物3~6、8、10~14 和18~19 首次从该植物中分离得到。初步评价了单体化合物对人肝癌HepG2 细胞的增殖抑制作用。
1 仪器与材料
X-4 型显微熔点仪(上海科学仪器有限公司);Bruker Micro TOF QII 质谱仪(瑞士Bruker 公司),JNM-ECZ400S 型核磁共振仪(日本JEOL 株式会社),TMS 为内标;RE-6000E 型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-D(Ⅲ)型水循环真空泵(巩义市英峪高科仪器厂);Sephadex LH-20(Pharmacia产品);柱色谱硅胶(200~300、300~400 目,青岛海洋化工厂);硅胶GF254薄层板(50 mm×100 mm,0.20~0.25 mm,青岛海洋化工厂);硅胶GF254薄层板(100 mm×50 mm,0.20~0.25 mm,青岛海洋化工厂);四甲基偶氮唑盐溶液(MTT)试剂(Sigma公司);阳性对照品 10-羟基喜树碱(批号H42022734,黄石飞云制药有限公司);人肝癌细胞株HepG2(上海美轩生物科技有限公司)。
北柴胡根于2020 年5 月采集自陕西省绥德县,经延安大学生命科学院白重炎研究员鉴定为伞形科柴胡属植物北柴胡B.chinenseDC.的根,标本(编号CH20200517)存放于延安大学天然产物化学实验室。石油醚、二氯甲烷、三氯甲烷、醋酸乙酯、丙酮、乙醇、甲醇等普通试剂均为分析纯(探索试剂平台官网)。
2 方法
2.1 提取与分离
将所采集的北柴胡根洗净晒干后粉碎,称取2.0 kg 装入渗滤筒中,室温下用3 倍量95%乙醇提取3次,提取液减压浓缩后得浸膏300 g。将浸膏用水分散后,依次用石油醚和醋酸乙酯各萃取5 次,每次所用溶剂的体积为800 mL,萃取液经减压浓缩后得石油醚部位浸膏55 g、醋酸乙酯部位浸膏107 g。
石油醚部位浸膏经硅胶柱色谱(200~300 目)分离,用石油醚-二氯甲烷(20∶1~0∶20)梯度洗脱,TLC 检测,主成分相同的合并后得到18 个馏分(Fr 1B~18B)。Fr 10B(1 050 mg),继续硅胶柱色谱(200~300 目)分离,用二氯甲烷-醋酸乙酯(15∶1~0∶8)梯度洗脱,TLC 检测,合并后得到4 个馏份(Fr 10B1~10B4)。Fr 10B1(102.1 mg)和Fr 10B2(87.4 mg)用石油醚反复重结晶分别得到化合物1(20.3 mg)和2(19.0 mg);Fr 10B3(75.5 mg)经Sephadex LH-20 凝胶柱分离,洗脱剂为石油醚-二氯甲烷(1∶1),洗脱得到化合物3(10.5 mg);Fr 10B4(51.1 mg)经Sephadex LH-20 凝胶柱分离,二氯甲烷洗脱得到化合物4(15.3 mg)。
醋酸乙酯部位浸膏经硅胶柱色谱分离(200~300 目),用石油醚-醋酸乙酯(15∶1~0∶15)梯度洗脱,TLC 检测,主成分相同的合并后得到20 个馏份(Fr 1A~20A),然后继续用醋酸乙酯-乙醇(15∶1~0∶15)梯度洗脱,又得到7 个馏份(Fr 21A~27A)。Fr 1A(120.1 mg)经硅胶(300~400目)柱色谱分离,用石油醚-醋酸乙酯(15∶1~0∶15)梯度洗脱,TLC 检测,合并后得到4 个馏分(Fr 1A1~1A4)。Fr1A1 经醋酸乙酯重结晶得到化合物5(19.6 mg),Fr 1A2(60.7 mg)经硅胶(300~400目)柱色谱分离,用石油醚-醋酸乙酯-丙酮(150∶10∶5~50∶10∶5)梯度洗脱,得到化合物6(15.2 mg)。Fr 2A 经石油醚-丙酮中反复重结晶得到化合物7(35.0 mg)。Fr 4A(270.3 mg)经硅胶(300~400 目)柱色谱分离,用石油醚-醋酸乙酯-丙酮(200∶10∶5~40∶10∶5)梯度洗脱得到化合物8(26.5 mg)和9(13.3 mg)。Fr 7A(502.1 mg)经硅胶(300~400 目)柱色谱分离,用二氯甲烷-醋酸乙酯(14∶1~1∶14)梯度洗脱,TLC 检测,合并后得到3 个馏份(Fr 7A1~7A3)。Fr 7A2(96.8 mg)经硅胶(300~400 目)柱色谱分离,用石油醚-醋酸乙酯-丙酮(110∶10∶5~30∶10∶5)梯度洗脱,得到化合物10(18.5 mg);Fr 7A3(87.5 mg)经Sephadex LH-20 凝胶柱分离,甲醇作为洗脱剂,得到化合物11(10.5 mg)和12(14.3 mg)。Fr 16A(423.2 mg)经硅胶(300~400 目)柱色谱分离,用石油醚-丙酮(10∶1~0∶10)梯度洗脱,TLC 检测,合并后得到4 个馏分(Fr 16A1~16A4)。Fr 16A1(31.2 mg)经硅胶(300~400 目)柱色谱分离,用二氯甲烷-甲醇(14∶1)进行洗脱纯化,得到化合物13(15.1 mg)和14(13.8 mg);Fr 16A2(79.1 mg)经硅胶(300~400 目)柱色谱分离,用氯仿-丙酮(10∶1~0∶10)梯度洗脱得到化合物15(32.3 mg)和16(31.2 mg);Fr 16A3(46.7 mg)经Sephadex LH-20 凝胶柱分离,甲醇作为洗脱剂,分离纯化得到化合物17(11.4 mg)和18(10.9 mg);Fr 16A4(33.6 mg)经硅胶(300~400 目)柱色谱分离,用醋酸乙酯-甲醇(15∶1)洗脱,得到化合物19(18.2 mg)。
2.2 细胞毒活性[4]
取对数生长期的HepG2 细胞,配成细胞密度为1×104个/mL 的单细胞悬液,按1 000 个/孔接种于96 孔板中,每组设3 个复孔。待细胞贴壁后,每孔加入10 μL 不同浓度(600、300、150、75、37.5、18.75 μmol/L)的含药样品溶液,同时设对照组和阳性对照组(10-羟基喜树碱)。置于37 ℃、5% CO2培养箱中孵育48 h 后,每孔加入10 μL MTT 溶液(5 mg/mL),继续孵育4 h。除去上清液,加入100 μL DMSO 振荡混匀,490 nm 波长下测吸光度(A)值,按以下公式计算细胞生长抑制率。
细胞生长抑制率=(A对照-A给药)/A对照
以样品浓度为横坐标(X),抑制率为纵坐标(Y),利用Origin 7.0 软件绘制出浓度-抑制率曲线图。根据回归曲线方程计算出抑制率为50%时对应样品的浓度即为半数抑制浓度(median inhibition concentration,IC50)值。
3 结果
3.1 结构鉴定
化合物1:白色棒晶(石油醚),mp 79.8~82.4 ℃。ESI-MSm/z: 245.31 [M+H]+,分子式C15H16O3。1H-NMR (400 MHz, DMSO-d6)δ: 7.96 (1H,d,J= 10.8 Hz, H-4), 7.55 (1H, d,J= 9.6 Hz, H-5), 7.04(1H, d,J= 10.0 Hz, H-6), 6.26 (1H, d,J= 9.6 Hz, H-3), 5.11 (1H, dd,J= 14.4, 7.2 Hz, H-2′), 3.88 (3H, s, 7-OCH3), 3.38 (2H, dd,J= 14.4, 7.2 Hz, H-1′), 1.76 (3H,s, H-5′), 1.60 (1H, s, H-4′);13C-NMR (100 MHz,DMSO-d6)δ: 160.8 (C-2), 160.2 (C-7), 152.6 (C-9),145.3 (C-4), 132.4 (C-3′), 127.7 (C-5), 121.7 (C-2′),116.6 (C-8), 113.2 (C-10), 112.8 (C-3), 108.5 (C-6),56.8 (7-OCH3), 26.0 (C-4′), 22.0 (C-1′), 18.2 (C-5′)。以上数据与文献报道基本一致[5-6],故鉴定化合物1为蛇床子素。
化合物2:白色针晶(石油醚),mp 100.3~102.1 ℃。ESI-MSm/z: 299.39 [M+H]+,分子式C19H22O3。1H-NMR (400 MHz, DMSO-d6)δ: 8.12 (1H,d,J= 13.2 Hz, H-2′), 7.67 (1H, d,J= 13.2 Hz, H-4),7.08 (1H, s, H-5), 6.42 (1H, d,J= 9.2 Hz, H-3′), 5.49(1H, dd,J= 14.8, 8.0 Hz, H-2″), 4.90 (2H, d,J= 6.0 Hz, H-1″), 1.68 (3H, s, H-4″), 1.63 (3H, s, H-5″);13CNMR (100 MHz, DMSO-d6)δ: 160.3 (C-2), 152.2 (C-7), 148.4 (C-2′), 148.2 (C-7), 145.9 (C-4), 143.7 (C-9),139.6 (C-8), 131.0 (C-3″), 126.2 (C-6), 120.2 (C-2″),116.9 (C-10), 114.7 (C-3), 114.6 (C-5), 107.6 (C-3′),69.8 (C-1″), 26.0 (C-4″), 18.3 (C-5″)。以上数据与文献报道基本一致[7],故鉴定化合物2 为欧前胡素。
化合物3:白色针晶(二氯甲烷),mp 129.6~130.9 ℃。ESI-MSm/z: 209.15 [M+Na]+,分子式C11H6O3。1H-NMR (400 MHz, CD3Cl)δ: 7.81 (1H, d,J= 9.6 Hz, H-4), 7.68 (1H, d,J= 2.4 Hz, H-2′), 7.42(1H, d,J= 8.4 Hz, H-6), 7.39 (1H, d,J= 8.4 Hz, H-8),7.14 (1H, d,J= 2.8 Hz, H-3′), 6.38 (1H, d,J= 9.6 Hz,H-3);13C-NMR (100 MHz, CD3Cl)δ: 161.0 (C-2),157.4 (C-7), 148.6 (C-9), 146.0 (C-2′), 144.6 (C-4),123.9 (C-8), 117.0 (C-5), 114.2 (C-3), 113.6 (C-10),109.0 (C-6), 104.2 (C-3′)。以上数据与文献报道基本一致[8],故鉴定化合物3 为异补骨脂素。
化合物4:无色晶体(二氯甲烷),mp 47.1~48.4 ℃。ESI-MSm/z: 229.23 [M+Na]+,分子式C12H14O3。1H-NMR (400 MHz, DMSO-d6)δ: 7.66 (2H,dd,J= 6.8, 3.2 Hz, H-2′, 6′), 7.59 (1H, d,J= 16.0 Hz,H-3), 6.96 (2H, dd,J= 6.8, 3.2 Hz, H-3′, 5′), 6.47 (1H,d,J= 15.6 Hz, H-2), 4.16 (2H, q,J= 21.2 Hz, H-1′′),1.22 (3H, t,J= 14.4 Hz, H-2′′), 3.78 (3H, s, 4′-OCH3);13C-NMR (100 MHz, DMSO-d6)δ: 167.0 (C-1), 161.6(C-4′), 144.7 (C-3), 130.7 (C-1′), 127.2 (C-2′, 6′), 115.9(C-2), 114.9 (C-3′, 5′), 60.3 (C-1′′), 55.8 (4′-OCH3),14.8 (C-2′′)。以上数据与文献报道基本一致[9],故鉴定化合物4 为对甲氧基桂皮酸乙酯。
化合物5:白色粉末,mp 213.5~214.9 ℃。ESIMSm/z: 165.16 [M+H]+,分子式C9H8O3。1H-NMR(400 MHz, DMSO-d6)δ: 11.58 (1H, brs, H-1), 9.98,(1H, brs, 4′-OH), 7.55 (2H, d,J= 8.8 Hz, H-2′, 6′), 7.49(1H, d,J= 14.4 Hz, H-3), 6.77 (2H, d,J= 8.8 Hz, H-3′, 5′), 6.28 (1H, d,J= 16.0 Hz, H-2);13C-NMR (100 MHz, DMSO-d6)δ: 168.5 (C-1), 161.5 (C-4′), 147.7(C-3), 130.6 (C-2′, 6′), 125.8 (C-1′), 116.3 (C-3′, 5′),115.8 (C-2)。以上数据与文献报道基本一致[10],故鉴定化合物5 为反式-4-羟基桂皮酸。
化合物6:白色粉末,mp 240.1~242.5 ℃。ESIMSm/z: 193.18 [M+H]+, 分子式C10H8O4。1H-NMR(400 MHz, DMSO-d6)δ: 11.49 (1H, brs, H-1), 7.49(1H, d,J= 16.0 Hz, H-3), 7.36 (1H, s, H-2′), 7.14 (1H,d,J= 7.6 Hz, H-6′), 6.93 (1H, d,J= 7.6 Hz, H-5′), 6.38(1H, d,J= 16.0 Hz, H-2), 6.05 (2H, s,O-CH2-O);13CNMR (100 MHz, DMSO-d6)δ: 168.4 (C-1), 149.6 (C-3′), 148.5 (C-4′), 144.4 (C-3), 129.2 (C-1′), 125.2 (C-6′), 117.6 (C-2), 109.0 (C-5′), 107.2 (C-6′), 102.1 (OCH2-O)。以上数据与文献报道基本一致[11],故鉴定化合物6 为反式-3′,4′-亚甲二氧基桂皮酸。
化合物7:白色粉末,mp 170.2~172.8 ℃。ESIMSm/z: 217.18 [M+H]+,分子式C10H10O4。1H-NMR(400 MHz, DMSO-d6)δ: 12.16 (1H, brs, H-1), 9.56(1H, brs, 4′-OH), 7.47 (1H, d,J= 16.0 Hz, H-3), 7.26(1H, s, H-2′), 7.07 (1H, dd,J= 6.4, 2.0 Hz, H-6′), 6.77(1H, d,J= 7.6 Hz, H-5′), 6.35 (1H, d,J= 16.0 Hz, H-2), 3.81(3H, s, -OCH3);13C-NMR (100 MHz, DMSOd6)δ: 168.6 (C-1), 149.6 (C-3′), 148.4 (C-4′), 145.1(C-3), 126.3 (C-1′), 123.4 (C-6′), 116.1(C-2), 116.0 (C-5′),111.6 (C-6′), 56.2 (-OCH3)。以上数据与文献报道基本一致[12],故鉴定化合物7 为反式-阿魏酸。
总之,音乐是情感艺术,“乐”由情起,这说明音乐由情感引起。情感教育在小学音乐教学中无处不在。在小学音乐教学实践中我们应以情感教育为核心,牢牢地把握情感教育原则,不时点燃学生的情感火花,使情感教育在小学音乐教学中真正实现其教育功能,在素质教育中发挥其应有的作用。
化合物8:淡黄色片晶(丙酮),mp 224.6~225.8 ℃。ESI-MSm/z: 185.13 [M+Na]+,分子式C9H6O3。1H-NMR (400 MHz, CD3OD)δ: 10.58 (1H,brs, 7-OH), 7.92 (1H, d,J= 9.2 Hz, H-4), 7.51 (1H, d,J= 8.4 Hz, H-5), 6.73 (1H, d,J= 8.4 Hz, H-6), 6.67(1H, s, H-8), 6.19 (1H, d,J= 9.2 Hz, H-3);13C-NMR(100 MHz, CD3OD)δ: 161.8 (C-2), 161.0 (C-7), 156.0(C-9), 145.1(C-4), 130.3 (C-5), 113.7 (C-6), 111.9 (C-3), 111.8 (C-10), 102.7 (C-8)。以上数据与文献报道基本一致[13],故鉴定化合物8 为伞形花内酯。
化合物9:淡黄色针晶(丙酮),mp 271.8~273.9 ℃。ESI-MSm/z: 179.15 [M+H]+,分子式C9H6O4。1H- NMR (400 MHz, DMSO-d6)δ: 7.83 (1H,d,J= 9.2 Hz, H-4), 6.93 (1H, s, H-5), 6.69 (1H, s, H-8), 6.13 (1H, d,J= 10.0 Hz, H-3);13C-NMR (100 MHz,DMSO-d6)δ: 161.3 (C-2), 150.9 (C-7), 149.0 (C-9),145.0 (C-4), 143.4 (C-4), 112.8 (C-5), 112.0 (C-3),111.2 (C-10), 103.1 (C-8)。以上数据与文献报道基本一致[14],故鉴定化合物9 为七叶内酯。
化合物10:淡黄色晶体(丙酮),mp 170.1~173.4 ℃。ESI-MSm/z: 383.29 [M+Na]+,分子式C18H16O8。1H-NMR (400 MHz, CD3OD)δ: 7.91 (1H,d,J= 16.0 Hz, H-3), 7.43 (1H, s, H-2′), 7.32 (1H, s, H-2‴), 7.16 (2H, dd,J= 8.4, 2.8 Hz, H-6′, 6‴), 7.04 (2H,dd,J= 8.0, 2.4 Hz, H-5′, 5‴), 6.65 (1H, d,J= 16.0 Hz,H-2), 5.48 (1H, dd,J=13.2, 3.4 Hz, H-2′′), 3.71 (1H, d,J= 6.0 Hz, H-3a′′), 3.71 (1H, d,J= 17.2 Hz, H-3b′′);13C-NMR (100 MHz, CD3OD)δ: 177.0 (C-1′′), 168.4(C-1), 148.7 (C-3), 146.1 (C-4′, 4‴), 145.9 (C-3′, 3‴),145.3 (C-3), 144.1 (C-4‴), 130.5 (C-1‴), 127.3 (C-1′),122.2 (C-6‴), 121.0 (C-6′), 116.8 (C-5′), 115.7 (C-5‴),115.5 (C-2), 114.9 (C-2‴), 114.4 (C-2′), 77.0 (C-2′′),38.1 (C-3′′)。以上数据与文献报道基本一致[15],故鉴定化合物10 为迷迭香酸。
化合物11:白色晶体(甲醇),mp 216.8~218.3 ℃。ESI-MSm/z: 409.41 [M+H]+,分子式C20H24O9。1H-NMR (400 MHz, DMSO-d6)δ: 7.93 (1H,d,J= 10.0 Hz, H-4), 7.48 (1H, s, H-5), 6.82 (1H, s, H-8), 6.21 (1H, d,J= 9.2 Hz, H-3), 4.87 (1H, dd,J= 8.4,4.4 Hz, H-2′), 4.36 (1H, d,J= 7.2 Hz, β-D-Glu-H-1),3.64, 3.33 (2H, d,J= 12.8 Hz, β-D-Glu-H-6), 3.25 (1H,d,J= 8.0 Hz, H-3′), 3.11 (1H, dt,J= 7.6 Hz, β-D-Glu-H-5), 3.08 (1H, dt,J= 7.6 Hz, β-D-Glu-H-2), 2.99 (1H,dd,J= 9.2 Hz, β-D-Glu-H-4), 2.87 (1H, dt,J= 7.6 Hz,β-D-Glu-H-3), 1.23 (3H, s, H-5′), 1.08 (3H, s, H-6′);13C NMR (100 MHz, DMSO-d6)δ: 163.6 (C-7), 161.0(C-2), 155.5 (C-9), 145.2 (C-4), 126.0 (C-6), 124.5 (C-5), 112.8 (C-3), 111.9 (C-10), 97.7 (β-D-Glu-C-1), 97.4(C-8), 90.6 (C-2′), 77.6 (C-4′), 77.4 (β-D-Glu-C-5),77.2 (β-D-Glu-C-2), 74.0 (β-D-Glu-C-3), 70.8 (β-DGlu-C-4), 61.7 (β-D-Glu-C-6), 29,7 (C-3′), 23.7 (C-5′),21.2 (C-6′)。以上数据与文献报道基本一致[16],故鉴定化合物11 为紫花前胡苷。
化合物12:白色粉末,mp 191.2~192.5 ℃。ESI-MSm/z: 373.37 [M+H]+,分子式C17H24O9。1HNMR (400 MHz, DMSO-d6)δ: 6.72 (2H, s, H-3, 5),6.46 (1H, d,J= 16.0 Hz, H-1′), 6.35 (1H, dt,J= 10.0,5.0 Hz, H-2′), 4.91 (1H, d,J= 7.6 Hz, β-D-Glu-H-1),4.17 (2H, d,J= 5.0 Hz, H-3′), 3.76 (6H, s, 2, 6-OCH3),3.42 (2H, d,J= 9.6 Hz, β-D-Glu-H-6), 3.35 (1H, dt,J= 7.6 Hz, β-D-Glu-H-5), 3.16~3.20 (3H, m, β-DGlu-H-2~4);13C-NMR (100 MHz, DMSO-d6)δ:152.8 (C-2, 6), 133.9 (C-1), 132.7 (C-4), 130.3 (C-1′),128.5 (C-2′), 104.5 (C-3, 5), 102.6 (β-D-Glu-C-1), 77.3(β-D-Glu-C-5), 76.6 (β-D-Glu-C-3), 74.3 (β-D-Glu-C-2), 70.0 (β-D-Glu-C-4), 61.0 (β-D-Glu-C-6), 61.6 (C-3′), 56.4 (2, 6-OCH3)。以上数据与文献报道基本一致[17-18],故鉴定化合物12 为紫丁香苷。
化合物13:棕色针晶(甲醇),mp 191.3~192.6 ℃。ESI-MSm/z: 343.35 [M+H]+,分子式C19H18O6。1H-NMR (400 MHz, DMSO-d6)δ: 7.63 (1H,dd,J= 8.8, 3.0 Hz, H-6′), 7.52 (1H, d,J= 3.0 Hz, H-2′), 7.10 (1H, d,J= 8.8 Hz, H-5′), 6.87 (1H, d,J= 3.0 Hz, H-6), 6.77 (1H, s, H-3), 6.49 (1H, d,J= 3.0 Hz, H-8), 3.89 (3H, s, 3′-OCH3), 3.87 (3H, s, 5-OCH3), 3.83(3H, s, 4′-OCH3), 3.82 (3H, s, 7-OCH3);13C-NMR (100 MHz, DMSO-d6)δ: 176.3 (C-4), 164.2 (C-7), 160.7 (C-2), 160.2 ( C-5), 159.7 (C-9), 152.1 (C-3′), 149.5 (C-4′), 123.6 (C-1′), 119.8 (C-6′), 112.1 (C-5′), 109.5 (C-2′), 108.8 (C-10), 107.6 (C-3), 96.7 (C-8), 93.9 (C-6),56.6 (3′-OCH3), 56.5 (5-OCH3), 56.4 (4′-OCH3), 56.2(7-OCH3)。以上数据与文献报道基本一致[19],故鉴定化合物13 为5,7,3′,4′-四甲氧基黄酮。
化合物15:淡黄色粉末,mp 346.8~348.1 ℃。ESI-MSm/z: 271.25 [M+H]+,分子式C15H10O5。1HNMR (400 MHz, DMSO-d6)δ: 12.96 (1H, brs, 5-OH),10.84 (1H, brs, 4′-OH), 10.37 (1H, brs, 7-OH), 7.92(2H, d,J= 8.8 Hz, H-2′, 6′), 6.90 (2H, d,J= 8.8 Hz, H-3′, 5′), 6.78 (1H, s, H-3), 6.48 (1H, s, H-8), 6.18 (1H, s,H-6);13C-NMR (100 MHz, DMSO-d6)δ:182.3 (C-4),164.7 (C-2), 164.3 (C-7), 162.0 (C-9), 161.7 (C-5),157.8 (C-4′), 129.0 (C-2′, 6′), 121.7(C-1′), 116.5 (C-3′,5′), 104.2 (C-3), 103.3 (C-10), 99.3 (C-6), 94.5(C-8)。以上数据与文献报道基本一致[22],故鉴定化合物15为芹菜素。
化合物16:棕色粉末,mp 322.6~323.7 ℃。ESI-MSm/z: 287.26 [M+H]+,分子式C15H10O6。1HNMR (400 MHz, DMSO-d6)δ: 12.94 (1H, brs, 5-OH),10.82 (1H, brs, 7-OH), 9.91 (1H, brs, 4′-OH), 9.38 (1H,brs, 3′-OH), 7.39(1H, dd,J= 8.0, 2.4 Hz, H-6′), 7.35(1H, d,J= 2.4 Hz, H-2′), 6.85 (1H, d,J= 8.0 Hz, H-5′),6.64(1H, s, H-3), 6.40 (1H, d,J= 2.0 Hz, H-8), 6.15(1H, d,J= 2.0 Hz, H-6);13C-NMR (100 MHz, DMSOd6)δ: 182.2 (C-4), 164.6 (C-2), 164.4 (C-7), 162.0 (C-5), 157.8 (C-9), 150.2 (C-4′), 146.2 (C-3′), 122.0 (C-1′),119.5 (C-6′), 116.5 (C-5′), 113.9 (C-2′), 104.2 (C-10),103.4 (C-3), 99.3 (C-6), 94.4 (C-8)。以上数据与文献报道基本一致[23],故鉴定化合物16 为木犀草素。
化合物17:黄色粉末,mp 312.4~313.7 ℃。ESI-MSm/z: 303.27 [M+H]+,分子式C15H10O7。1H-NMR (400 MHz, DMSO-d6)δ: 12.51 (1H, brs, 5-OH), 10.73 (1H, brs, 7-OH), 9.65 (1H, brs, 3′-OH),9.39 (1H, brs, 3-OH), 9.34 (1H, brs, 4′-OH), 7.74(1H, d,J= 2.4 Hz, H-2′), 7.63 (1H, dd,J= 8.0, 2.0 Hz, H-6′), 6.84 (1H, d,J= 8.0 Hz, H-5′), 6.36 (1H,d,J= 2.0 Hz, H-8), 6.14 (1H, d,J= 2.0 Hz, H-6);13C-NMR (100 MHz, DMSO-d6)δ: 176.3 (C-4),165.5 (C-7), 161.2 (C-9), 156.6 (C-5), 148.2 (C-4′),147.3 (C-2), 145.6 (C-3′), 136.3 (C-3), 122.5 (C-1′),120.5 (C-6′), 116.1 (C-5′), 115.5(C-2′), 103.5 (C-10),98.7 (C-6), 93.9 (C-8)。以上数据与文献报道基本一致[24-25],故鉴定化合物17 为槲皮素。
化合物18:黄色粉末,mp 134.3~135.7 ℃。ESI-MSm/z: 462.38 [M+Na]+,分子式C21H20O10。1H-NMR (400 MHz, DMSO-d6)δ: 13.17 (1H, brs, 5-OH), 10.91 (1H, brs, 7-OH), 10.36 (1H, brs, 4′-OH),8.01 (2H, d,J= 8.8 Hz, H-2′, 6′), 6.87 (2H, d,J= 8.8 Hz, H-3′, 5′), 6.78 (1H, d,J= 2.0 Hz, H-3), 6.26 (1H,d,J= 2.0 Hz, H-6), 4.69 (1H, d,J= 11.6 Hz, H-1″),3.82 (1H, d,J= 10.5 Hz, H-6″a), 3.76 (1H, d,J= 3.6 Hz, H-6″b), 3.15~3.50 (4H, m, H-2″~5″);13C-NMR(100 MHz, DMSO-d6)δ: 182.6 (C-4), 164.4 (C-2),162.7 (C-7), 161.1 (C-4′), 160.9 (C-5), 156.5 (C-9),129.5 (C-2′, 6′), 122.1 (C-1′), 116.3 (C-3′, 5′), 105.1 (C-8), 104.5 (C-10), 102.9 (C-3), 98.7 (C-6), 82.4 (C-5″),79.1 (C-1″), 73.9 (C-2″), 71.3 (C-3″), 71.0 (C-4″), 61.8(C-6″)。以上数据与文献报道基本一致[26],故鉴定化合物18 为牡荆素。
化合物19:黄色粉末,mp 333.1~334.5 ℃。ESI-MSm/z: 487.37 [M+Na]+,分子式C21H20O12。1H-NMR (400 MHz, DMSO-d6)δ: 12.63 (1H, brs, 5-OH), 10.81 (1H, brs, 7-OH), 9.72 (1H, brs, 3′-OH), 9.14(1H, brs, 4′-OH), 7.67 (1H, dd,J= 8.8, 2.2 Hz, H-6′),7.51 (1H, d,J= 2.2 Hz, H-2′), 6.79 (1H, d,J= 8.8 Hz,H-5′), 6.39 (1H, d,J= 2.0 Hz, H-8), 6.19 (1H, d,J=2.0 Hz, H-6), 5.36 (1H, d,J= 7.6 Hz, β-D-Gal-H-1),5.15 (1H, d,J= 4.8 Hz, β-D-Gal-H-1a), 4.88 (1H, d,J= 5.0 Hz, β-D-Gal-H-1b), 3.29~3.65 (4H, m, β-DGal-H-2″~5″);13C-NMR (100 MHz, DMSO-d6)δ:178.0 (C-4), 164.7 (C-7), 161.7 (C-5), 156.8 (C-9),156.7 (C-2), 149.0 (C-4′), 145.4 (C-3′), 133.9 (C-3),122.5 (C-6′), 121.6 (C-1′), 116.4 (C-2′), 115.7 (C-5′),104.4 (C-10), 102.2 (β-D-Gal-C-1), 98.7 (C-6), 94.0(C-8), 76.4 (β-D-Gal-C-5), 73.7 (β-D-Gal-C-3), 71.7(β-D-Gal-C-2), 68.4 (β-D-Gal-C-4), 60.6 (β-D-Gal-C-6)。以上数据与文献报道基本一致[27],故鉴定化合物19 为金丝桃苷。
3.2 活性测试结果
通过对柴胡中所分离得到的19 个化合物进行细胞毒活性测试,测试结果见表1,结果表明19 个化合物均有抑制人肝癌HepG2 细胞的增殖作用,其中化合物2、8~11、16 和18 对HepG2 细胞具有显著的细胞毒活性,IC50<50 μmol/L,特别值得一提的是化合物8 对HepG2 的细胞毒活性与临床用药10-羟基喜树碱注射液相当,因此,就该化合物的生物活性及其作用机制有待于进一步深入研究,为其在保肝方面的应用提供科学依据。
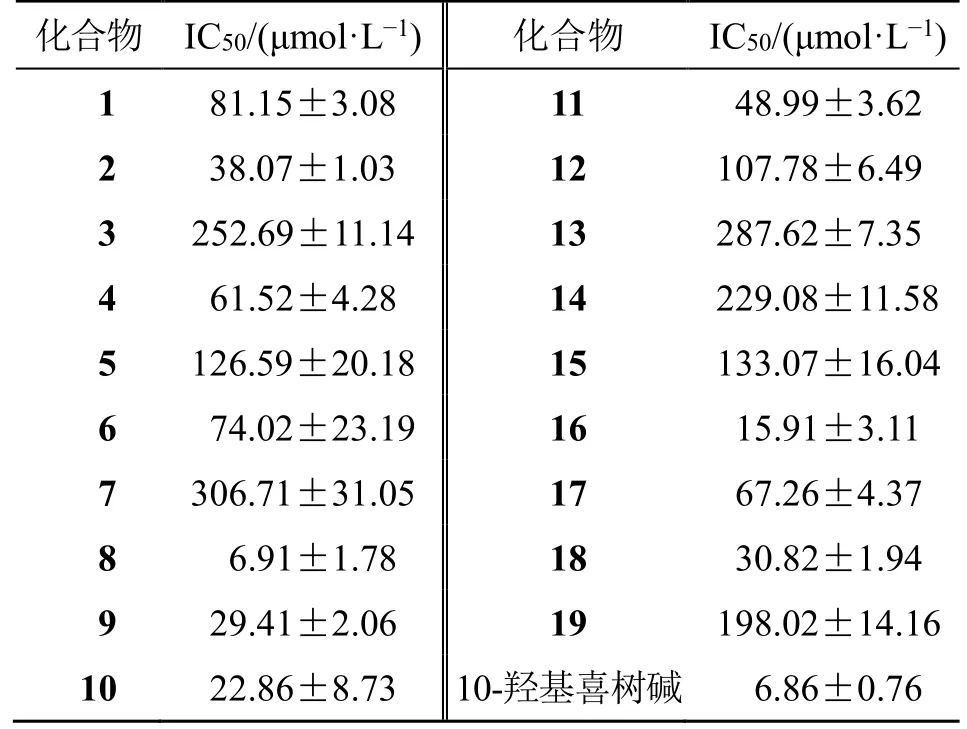
表1 化合物1~19 对人肝癌细胞HepG2 的细胞毒活性Table 1 Cytotoxicity of compounds 1—19 against HepG2
4 讨论
本研究主要报道了从北柴胡根部中分离得到的两类化合物,其中1~12 为苯丙素类化合物,13~19 为黄酮类化合物;化合物3~6、8、10~14 和18~19 为首次从该植物中分离得到。据文献报道,香豆素和黄酮类化合物均具有对多种肿瘤细胞的增殖有抑制作用[28-29]。本研究活性测试结果也证明了这一结论。
另外,本实验活性筛选结果还发现,香豆素类化合物的C-6、C-7、C-8 位取代基的变化对抑制人肝癌细胞HepG2 的增殖有着密切的关系,其中C-7位上有羟基取代基时活性最强(化合物8 的IC50为6.91 μmol/L),其次是C-6、C-7 位上有取代基,当取代基的位置在C-7、C-8 位上时活性进一步减弱。这一发现也与已有对香豆素构效分析结果基本一致[30-31]。综上研究结果不仅丰富了北柴胡的植物化学信息及化合物的结构类型,同时通过初步分析了香豆素的构效关系,在一定程度上可为该类成分的结构修饰和抗肿瘤药物的研究提供参考,为北柴胡的进一步开发利用奠定基础。
利益冲突所有作者均声明不存在利益冲突