留萼木叶中2 个新的萜类化合物
杨长水,张 悦,虞 婕,普智琳,冒浩羽,孔淑静,徐海荣,2,董小耘,2*
1.扬州大学医学院(转化医学研究院),江苏 扬州 225009
2.江苏省中西医结合老年病防治重点实验室,江苏 扬州 225009
3.国家中医药管理局胃癌毒邪论治重点研究室,江苏 扬州 225009
留萼木Blachiapentzii(Müll.Arg.) Benth.为大戟科留萼木属BlachiaBaill.植物,该属约10 种,分布于亚洲热带地区,我国有4 种,主要分布于广东南部和海南,生于山谷、河边的林下或灌木丛中[1]。具有生物多样性的大戟科植物[2],在不同地域气候环境下产生了化学结构多样的代谢产物[3-4],且表现出生物活性多样性[5],诸多物种已是常用中药或药用植物[6],特殊生境的大戟科植物资源值得深入研究。鉴于本课题组前期对海南产三宝木属[7-10]和宿萼木属[11-12]植物的调查和研究,发现同地域同科近缘属植物代谢产物类别相似性高[13-14],尤其在海南高温、高湿环境下,留萼木或许同近缘的宿萼木一样,也能产生结构近似及新奇的天然产物[15],具有开发前景的药用价值。因此,亟待对该属植物资源进行全面系统的化学研究,为留萼木属植物资源的开发利用提供科学依据。
本实验对海南产留萼木的叶子95%乙醇提取物部位进行了化学成分研究,从中分离鉴定了2 个新的萜类化合物(图1),分别命名为留萼木素A(blapenin A,1)和3β-乙酰基多花独尾草-8-烯-17-酸(3β-acetylmultiflora-8-en-17-oic acid,2),分别属于降倍半萜类和三萜类。细胞活性测试显示化合物2 对胃癌细胞具有一定的增殖抑制作用。
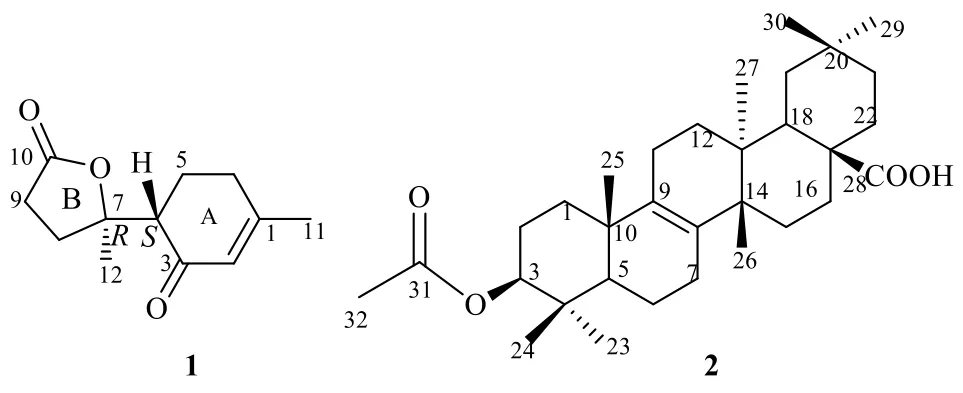
图1 化合物1 和2 的化学结构Fig.1 Structures of compounds 1 and 2
1 仪器与材料
AVANCE 600 MHz 型核磁共振仪(德国Bruker公司);maXis 型超高分辨飞行时间质谱仪(戴安公司);J-810 型圆二色散光谱仪(日本JASCO 分光公司);U-3900 型紫外光谱仪(日本SHIMADZU 公司);IRAffinity-1 型红外光谱仪(日本SHIMADZU公司);WZZ-2B 型自动旋光仪(上海精科仪器公司);LC3000 型半制备高效液相色谱仪(北京创新通恒科技有限公司);HPLC 色谱柱为YMC-Pack ODS-A(250 mm×10 mm,5 µm);DHG-9246A 型电热干燥箱(上海精宏实验设备有限公司);SMZD (III)循环水式多用真空泵(巩义市予华仪器有限公司);RE 52-99 型旋转蒸发仪(上海亚荣仪器厂);KQ-500DE 型数控超声波清洗器(昆山禾创超声仪器有限公司型号);SW-CJ-1F 型单人双面超净工作台(苏州净化设备有限公司);ELX800 型全自动酶标仪(美国Bio-Rad 公司);5475R 型高速低温离心机(德国Eppendorf 公司);RCO3000T-5-VBC 型CO2培养箱(美国Thermo 公司);TS100 型倒置生物显微镜(日本Nikon 公司);1300 Series 4'A2 型生物安全柜(美国Thermo 公司);YC-300L 型医用冰箱(中科美菱低温科技有限责任公司);DW-YL270 型低温冰箱(中科美菱低温科技有限责任公司);平衡盐溶液PBS(北京欣经科公司);细胞培养皿(美国Costar 公司);96 孔板(美国Corning 公司);RPMI-1640 培养液(北京赛默飞生物化学制品有限公司);Acutase 酶(美国Gibco 公司);10%胎牛血清(美国Gibco 公司);双抗(青霉素和链霉素)(美国HyClone 公司);CCK-8 试剂盒(南京诺唯赞生物科技有限公司);MTT 试剂盒(上海碧云天生物技术有限公司);顺铂(江苏豪森药业股份有限公司);色谱柱(三爱思有限公司)。柱色谱用硅胶(100~200 目,青岛海洋化工有限公司);MCI 填料(75~150 μm,北京元宝山色谱技术有限公司);反相柱色谱ODS C18填料(40~63 μm,德国Merck 公司生产);石油醚、醋酸乙酯、甲醇、正丁醇(国药集团化学试剂有限公司);纯净水(杭州娃哈哈集团有限公司)。顺铂(批号153593,江苏豪森药业股份有限对公司)。
人肺癌A549 细胞、人宫颈癌HeLa 细胞、人肝癌HepG2 细胞、胃癌HGC-27 细胞、胃腺癌AGS细胞和胃粘膜上皮细胞GES 均购于中国科学院上海细胞库。
留萼木药材于2019 年3 月采于海南省乐东县,由中国医学科学院药用植物研究所云南分所李海涛副研究员鉴定为留萼木属植物留萼木B.pentzii(Muell.Arg.) Benth.,标本(CSYBP20190301)存放于扬州大学医学院药学系植物标本室。
2 提取与分离
留萼木干燥叶7.0 kg 粉碎后,每次加95%乙醇30 L,浸泡7 d,进行3 次。收集并回收溶剂,干燥后得乙醇提取浸膏450.0 g。用水分散后,分别用石油醚、醋酸乙酯、正丁醇萃取3 次,得石油醚部位浸膏(A,126.7 g),醋酸乙酯部位浸膏(B,13.7 g),正丁醇部位浸膏(C,23.0 g)。醋酸乙酯萃取部位浸膏B 用硅胶柱色谱法以石油醚-醋酸乙酯混合溶剂(20∶1→10∶1→6∶1→3∶1→1∶1→1∶2)按极性递增方式进行梯度洗脱,分成10 个组分(Fr.B.1~B.10)。Fr.B.4 通过MCI 柱色谱,用甲醇-水的梯度混合物(3∶7→1∶1→7∶3→1∶0)洗脱,得到6个主要组分(Fr.B.4.1~B.4.6)。Fr.B.4.2 经过半制备HPLC 色谱(乙腈-水2∶8)纯化,得到化合物1(3.0 mg,tR=14 min)。石油醚萃取部位浸膏A 用硅胶柱色谱法以石油醚-醋酸乙酯混合溶剂(100∶0→80 ∶1→50 ∶1→30 ∶1→15 ∶1→8 ∶1→5 ∶1→3∶1→1∶1→0∶1)按极性递增方式进行梯度洗脱,分成14 个组分(Fr.A.1~A.14)。Fr.A.5 通过硅胶柱色谱,用石油醚-醋酸乙酯(20∶1→10∶1→6∶1→3∶1→1∶1)梯度洗脱,得到8 个主要组分(Fr.A.5.1~A.5.8),Fr.A.5.4 通过MCI 柱色谱,用甲醇-水的梯度混合物(3∶7→1∶1→7∶3→1∶0)洗脱,得到5 个主要组分(Fr.A.5.4.1~A.5.4.5),Fr.A.5.4.1 经过重结晶得到化合物2(12.0 mg)。
3 结构鉴定
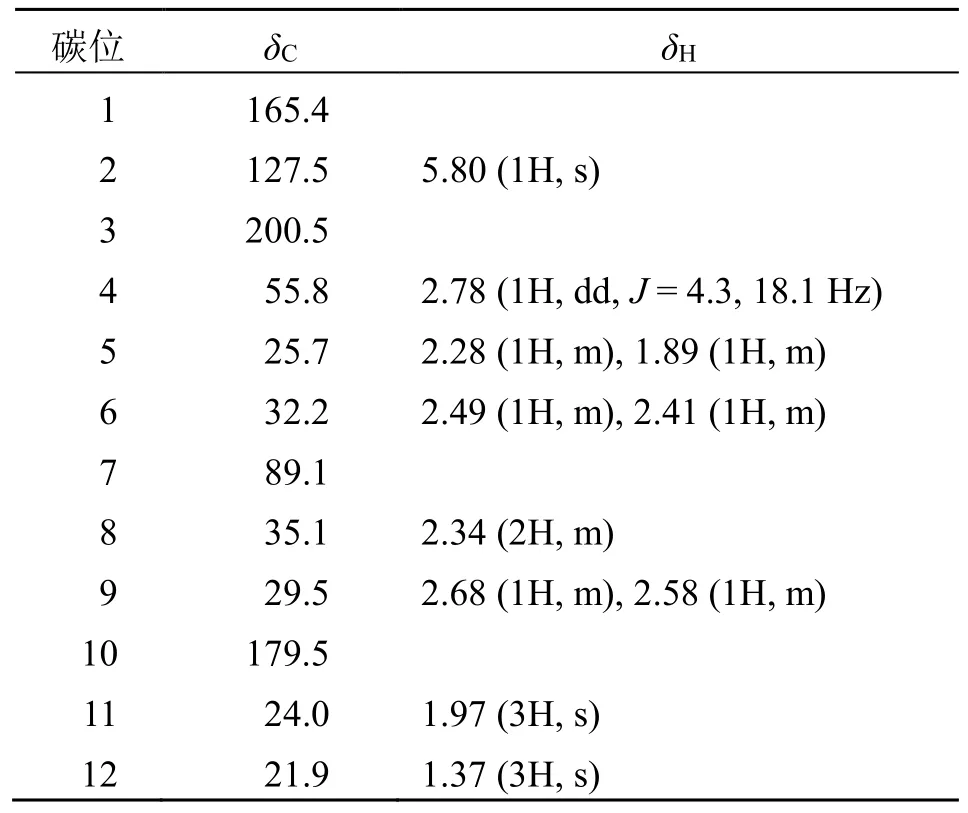
表1 化合物1 的1H-NMR 和13C-NMR 数据 (600/150 MHz, CD3OD)Table 1 1H-NMR and 13C-NMR data of compound 1(600/150 MHz, CD3OD)
1H-、13C-NMR 结合HSQC 谱图结果表明化合物1 存在2 个甲基(δC21.9,δC24.0)、4 个亚甲基、2 个次甲基(包括1 个不饱和的次甲基δH5.80,δC127.5)和4 个季碳(包括1 个季烯碳δC165.4 和2个羰基碳δC179.5, 200.5)。HMBC 信号表明,季烯碳(δC165.4)和次甲基(δH5.80;δC127.5)构成1对双键,上述基团已占据3 个不饱和度,分子结构还存在2 个环。
在HMBC 谱图(图2)中,存在从H-4 到C-3,从H-5 到C-1 和C-3,从H-2 到C-4 和C-6,从11-Me 到C-1、C-2、C-6 的相关信号;结合1H-1H COSY 谱图,存在H-4/H-5,H-5/H-6 的相关信号,同时在1H-NMR 中,H-2(δH5.80, s)单峰信号的存在表明H-2 不存在偶合体系,说明存在1 个在C-1有甲基取代,C-3 有羰基取代的六元环A。1H-1H COSY 谱图同样存在1 个H-8/H-9 相关,结合HMBC谱图中,H-8 与C-7、C-9、C-10 相关;H-9 与C-7、C-10 相关;12-Me 分别与C-7、C-8 相关,共同组成五元内酯环B,且C-7 上存在甲基取代。再根据HMBC 谱图,H-8 与C-4 相关;H-4 与C-7、12-Me相关;说明环A 和环B 通过C-4 和C-7 相连。至此,化合物1 的平面结构由此确立。
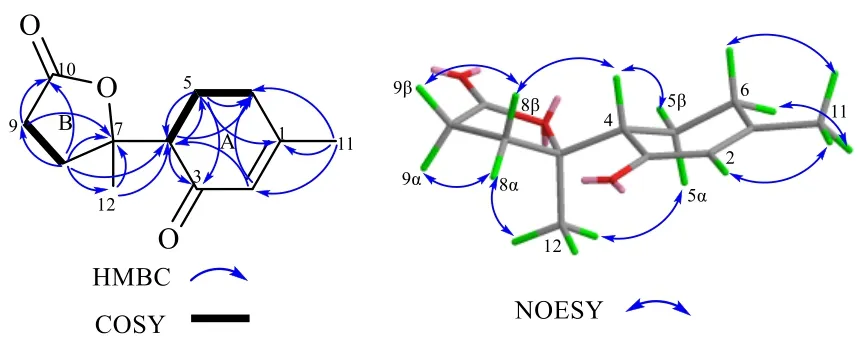
图2 化合物1 的主要HMBC、COSY 和NOESY 相关Fig.2 Key HMBC, COSY and NOESY correlations of compound 1
在NOESY 谱图中,以H-4 (δH2.79)为β 相对构型。H-4/H-5β 信号强烈,也为β 构型。12-Me/H-5α 的相关表明12-Me 为α 构型。12-Me 与H-4 没有相关。因此1 的相对构型为4S*, 7R*。接下来,应用电子圆二色谱(electronic circular dichroism,ECD)解决化合物1 的绝对构型。采用量子化学软件Gaussion 09[16]计算化合物的ECD,并通过SpecDis 1.71[17]进行拟合。通过MMFF94 分子力场搜索构象,使用密度泛函理论计算(density functional theory,DFT)在b3lyp/6-31 g (d) 计算水平上以SMD溶剂模型进一步优化。经实验与计算ECD 比较(图3),与4S, 7R构型的CD 曲线一致,可确定化合物1 的立体构型为4S, 7R,通过SciFinder 库检索为新化合物,命名为留萼木素A(blapenin A),是没药烷型(bisabolane)倍半萜的11, 12, 13 三降衍生物(图4)。
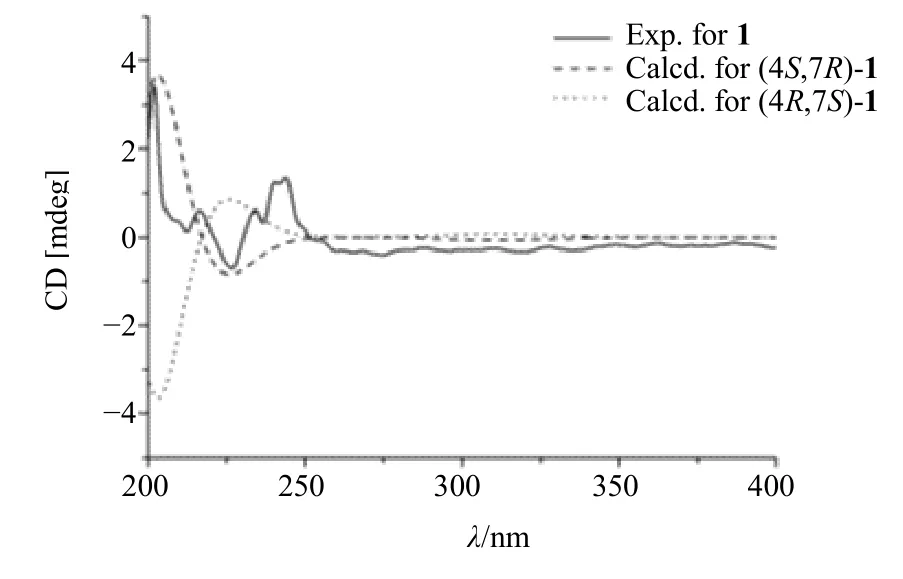
图3 化合物1 的ECD 谱图Fig.3 ECD spectra of compound 1
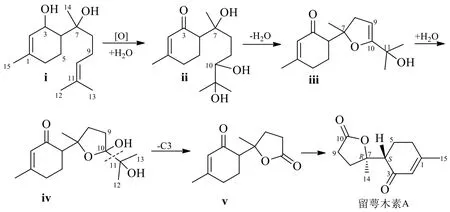
图4 化合物1 的生源途径Fig.4 Biogenic pathway of compound 1
根据没药烷型倍半萜骨架及取代情况,对其生源关系推导(图4):以化合物i 作为其前体,3-OH及7-OH 取代是常见现象,通过3-OH 发生氧化变为羰基,经C-10 和C-11 双键位置发生水加成,生成中间体ii,其7-OH 和10-OH 发生脱水环合,得到中间体iii,随后C-9 和C-10 双键位置再发生水加成,得到10-OH 取代产物iv,其具有环内与环外链上的邻位双羟基结构特点,根据醇裂解反应机理[18],可发生降碳反应,最终得到留萼木素A(1)的结构。
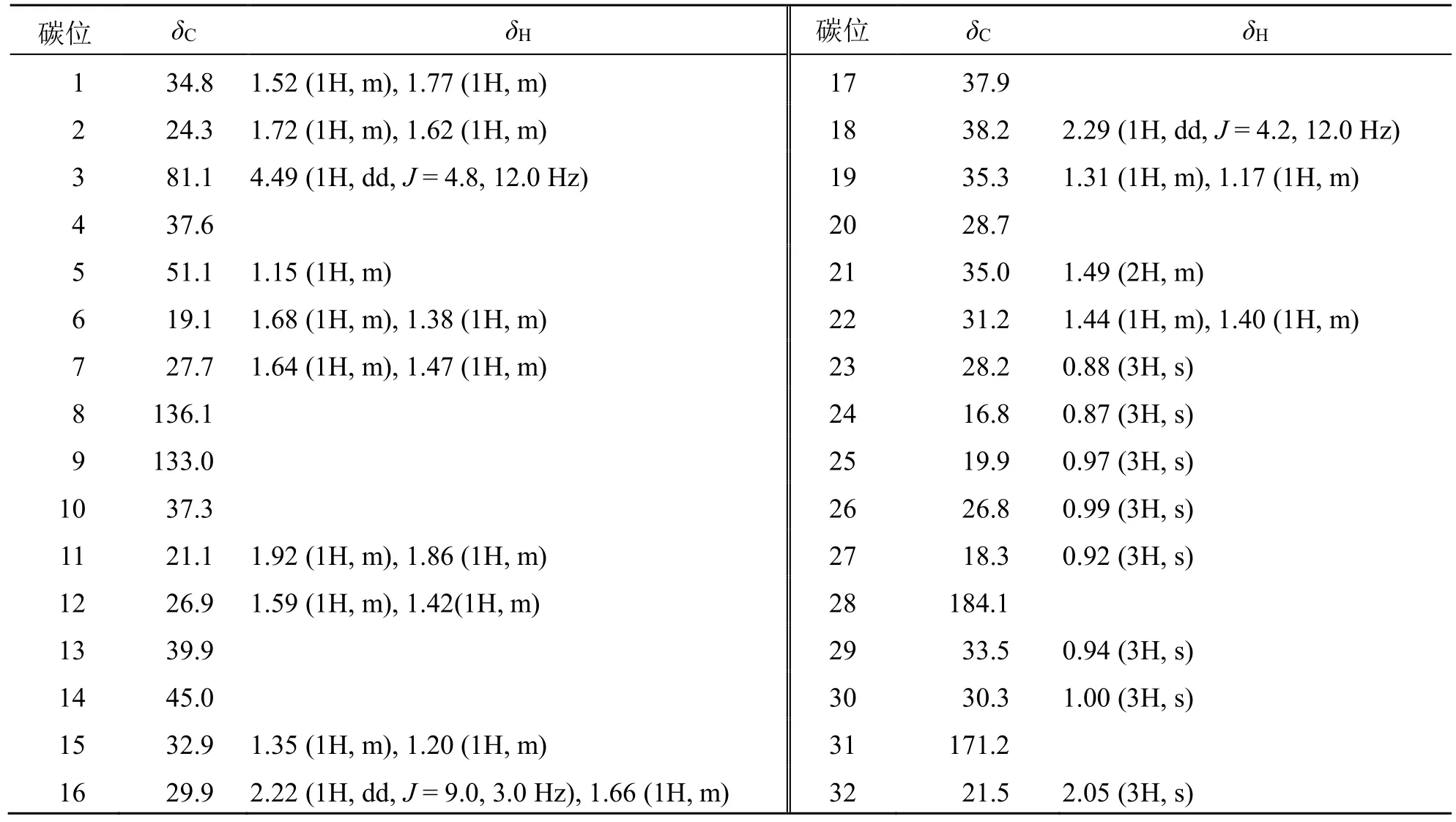
表2 化合物2 的1H-NMR 和13C-NMR 数据 (600/150 MHz, CDCl3)Table 2 1H-NMR and 13C-NMR data of compound 2 (600/150 MHz, CDCl3)
通过与文献数据对比,2 与化合物 3βhydroxymultiflora-8-en-17-oic acid[19]核磁数据高度相似,仅多1 个乙酰基信号 (δC171.2, 21.5;δH2.05,3H, s)。进一步通过1H-1H COSY 和HMBC 谱相关信号解析(图5),除了乙酰基,其他位置连接一致。如,存在H-1 与H-2、H-2 与H-3、H-6 与H-7、H-11 与H-12、H-15 与H-16、H-18 与H-19、H-11 与H-22 的1H-1H COSY 相关信号;在HMBC 谱中,30-Me (δH1.00 s) 到C-19 (δC35.3),C-20 (δC28.7);从29-Me (δH0.94 s) 到C-20 (δC28.7),C-21 (δC35.0)的相关信号,说明C-20 处存在偕二甲基;从H-16(δH2.25, dd,J= 9.0, 3.0 Hz) 和H-18 (δH2.32, dd,J=4.2, 12.0 Hz) 到28-COOH (δC183.0) 的信号说明28-COOH 与C-17 相连。NOESY 谱中,以H-3 (δH4.49)和23-CH3为α 相对构型,存在关键的H-3/23-CH3,23-CH3/H-5,H-3/H-5,25-CH3/H-11β,H-18/30-CH3,H-18/CH3-26 等相关信号(图5),则H-3、H-5 均为α构型,H-18、25-CH3、26-CH3均为β 构型,对比化合物3β-hydroxymultiflora-8-en-17-oic acid 构型,比旋光方向一致,可确定化合物2 具有与其一致的相对构型。最终化合物2 的结构及构型见图5,经SciFinder库检索为新化合物,因结构也同isomultiflorenylacetate[20]高度相似,仅在28 位的甲基氧化为羧基,故将化合物2 命名为3β-乙酰基多花独尾草-8 烯-17 酸。
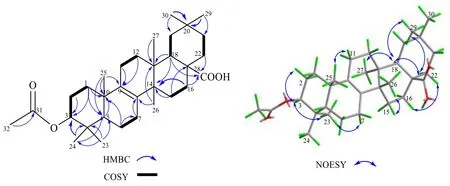
图5 化合物2 的关键HMBC、COSY、NOESY 相关Fig.5 Key HMBC, COSY and NOESY correlations of compound 2
4 细胞毒实验
4.1 部位浸膏及新化合物对A549、HeLa 和HepG2的细胞毒活性
根据课题组前期研究[10],采用CCK-8 法分别测定化合物1 和2 和各萃取部位浸膏对A549 细胞、HeLa 细胞和HepG2 细胞的细胞毒活性,顺铂为阳性药。结果醋酸乙酯部位浸膏对3 种肿瘤细胞的半数抑制浓度(half inhibitory concentration,IC50)值分别为(21.37±1.98)、(22.91±0.33)、(22.14±4.95)μg/mL,石油醚部位部位浸膏的IC50大于50 μg/mL,95%乙醇总提取物的IC50大于100 μg/mL;化合物1和2 对3 种肿瘤细胞的IC50值均大于40 μmol/L;顺铂对3 种肿瘤细胞的IC50值分别为(11.15±1.01)、(16.95±1.44)、(16.95±1.44)μmol/L。
4.2 新化合物对胃癌细胞的细胞毒活性
所得个别化合物活性测试结果不能代表整体浸膏活性。由于所选细胞株对测试结果存在差异性,为了进一步寻找可能的药效物质,另采用MTT 法又分别测定化合物1 和2 对胃癌细胞HGC-27、AGS的细胞毒活性,并对比胃正常细胞GES,顺铂为阳性药。发现化合物2 在80 μmol/L 对2 种胃癌细胞HGC-27、AGS 抑制率分别达到81.9%和89.2%,而对胃正常细胞GES 基本无影响,抑制率仅为14.4%,相对安全,值得后期深入开展机制探索研究。
5 讨论
本实验从海南产的留萼木属植物留萼木的叶子中分离鉴定了2 个新的萜类化合物,分别为留萼木素A(1)和3β-乙酰基多花独尾草-8-烯-17-酸(2),分别属于降倍半萜类和三萜类。生物活性测试显示醋酸乙酯萃取部位对几种肿瘤细胞具有较好的细胞毒性,化合物2 对胃癌细胞具有一定的增殖抑制作用,表明该植物含有具有潜在抗肿瘤活性成分,后期可对其开展深入化学及生物学研究,为新药研发提供新分子实体。根据大戟科植物亲缘关系和化学分类学,本属植物值得引起关注,并进行深入系统地研究,为留萼木属植物资源综合开发利用奠定前期物质基础。
利益冲突所有作者均声明不存在利益冲突