载冬凌草甲素和黄芪多糖-丝素蛋白-甲基纤维素复合伤口敷料的制备及其促进皮肤伤口愈合的研究
董儒银,左琬钰,张吉仲,王伟钰,鲁雪梅,程冰宇,董儒团,吕露阳
西南民族大学药学院,四川 成都 610041
伤口敷料是一类用于伤口修复的医用材料,其主要作用是防止细菌侵入和感染,吸收伤口渗出液和有毒物质,从而为伤口的愈合创造一个理想的环境[1]。伤口愈合过程是一个明确的生物过程,主要分为3 个阶段,包括炎症、增殖和成熟。伤口愈合机制包括各种细胞类型、细胞外基质成分和细胞因子介质之间的复杂相互作用[2]。虽然伤口的自然愈合机制是在伤口出现时启动的,但一个理想的伤口敷料能更好地促进伤口愈合[3]。
冬凌草是唇形科香茶菜属植物碎米桠Rabdosia rubescens(Hemsl.) Hara 的干燥地上部分,被《中国药典》2020 年版收录[4]。冬凌草不仅能药用,还有悠久的食用历史,安全有效。冬凌草甲素(oridonin)是冬凌草的主要活性成分,难溶于水,可溶于乙醚、甲醇、乙醇等有机溶剂。现代药理学研究表明,冬凌草甲素的药理作用十分广泛,如抗肿瘤、消炎抗菌、抗氧化等[5-8]。
黄芪为豆科黄芪属植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus(Bge.)Hsiao 或膜荚黄芪A.membranaceus(Fisch.) Bge.的干燥根,能托毒排脓,敛疮生肌。黄芪中的黄芪多糖(Astragaluspolysaccharides),为可溶于水的杂多糖[4,9],具有调节免疫、抗肿瘤、降血糖、抗衰老和抗炎等药理作用[10-11],是黄芪促进伤口的愈合的主要有效成分。
丝素蛋白(silk fibrion)是从蚕茧中提取的一种天然高分子敷料,能吸收渗出物,保持潮湿的环境有利于细胞迁移,提供氧气渗透和舒缓皮肤,是伤口敷料及药物载体的理想材料[12-13],可制备成水凝胶[12,14-15]、海绵[16]、薄膜[17-18]、伤口敷料[19]等各种外用制剂,用于口腔颌面部及全身皮肤创面的修复中,在化妆品、医药、食品等领域中具有潜在的用途[20]。但丝素蛋白本身无抗菌性,可通过不同的抗菌性修饰赋予丝素蛋白材料抗菌性能,是近年研究的热点[21]。甲基纤维素(methyl cellulose,MC)是纤维素的衍生物之一,是常用黏合剂[22]。
药典记载冬凌草可内服,也可外用,用于咽喉肿痛、癥瘕痞块、蛇虫咬伤的治疗,但目前几乎未见冬凌草及其活性成分冬凌草甲素外用制剂的研究报道,以冬凌草甲素为药效成分的临床制剂多经口服或注射给药。本实验以丝素蛋白负载冬凌草甲素和黄芪多糖,以MC 为黏合剂,采用冷冻干燥法制备冬凌草甲素和黄芪多糖-丝素蛋白-甲基纤维素(oridonin &Astragaluspolysaccharides-silk fibroinmethyl cellulose,Ori&APS-SF-MC)复合伤口敷料,以增加冬凌草甲素和黄芪多糖的皮肤黏附性,协同增加冬凌草甲素和黄芪多糖药效,对其体外抗菌和皮肤伤口愈合的效果进行考察,为研究安全无毒、使用便捷和加速伤口愈合的相关外用制剂提供实验依据。
1 仪器与材料
1.1 仪器
TU-1950 型紫外分光光度计,北京普析通用仪器有限责任有限公司;SPD-16 型高效液相色谱仪,岛津仪器(苏州)有限公司;Scientz-12N 型冷冻干燥机,宁波新芝生物科技股份有限公司;DT35C 型低速台式离心机,湖南可成仪器设备有限公司;Alpha II 型傅里叶变换红外吸收光谱仪,德国布鲁克光谱仪器公司;Quattro S 型扫描电子显微镜(SEM),赛默飞世尔科技公司;Eclipse Ci-L 型正置白光拍照显微镜,日本Nikon 公司;Milli-Q 纯水仪,美国Millipore 公司。
1.2 材料
冬凌草甲素,批号18091701,质量分数98%,西安昊轩生物科技有限公司;黄芪多糖,质量分数80%,自制;蚕茧,西北养蚕工业基地;MC,成都市科隆化学有限公司;透析袋,截留相对分子质量3 500,Biovake 北京怡康盛世生物科技有限公司;模具,直径为10 mm,南通范思贝生物科技有限公司;金黄色葡萄球菌,编号ATCC25923,批号20220516,青岛高科技工业海博生物技术有限公司;大肠杆菌,编号ATCC25922,批号22032010,北京保藏生物技术有限公司;所用试剂均为分析纯;水为超纯水。
1.3 实验动物
昆明小鼠,30 只,雄性,体质量(30±2)g,6~7 周龄,由成都达硕实验动物有限公司提供。动物许可证编号SYXK(川)2019-0216。动物饲养条件:西南民族大学药学院清洁动物房,恒温恒湿,正常饮食饮水。动物实验方案均经过西南民族大学动物伦理委员会审核批准(批准号No.2022-1207)。
2 方法与结果
2.1 丝素蛋白的提取纯化
将蚕茧剪成块状,按料液比1∶100 放入0.5%碳酸钠水溶液中,置于90 ℃水浴加热1.5 h 进行第1 次脱胶,清洗3 次,再放入碳酸钠水溶液中水浴加热30 min 进行第2 次脱胶,清洗3 次。干燥后得到丝素蛋白,丢失比25%~30%[23]。再将其采用CaCl2-C2H5OH-H2O(物质的量比1∶2∶8)三元体系溶解,料液比为1∶30,置于70 ℃的水浴加热4 h,搅拌溶解直至完全反应,透析浓缩即得质量分数为4%的丝素蛋白溶液,4 ℃储存。
2.2 MC 溶液的制备
称取1 g MC 粉末,溶于50 mL 水中,水浴加热溶解,即得0.02 g/mL 的MC 溶液。
2.3 复合伤口敷料的制备
由于冬凌草甲素在水中难溶(溶解度为0.75 mg/mL),因此加入1%聚山梨酯80 作增溶剂,采用冷冻干燥法制备复合伤口敷料[24-26],具体操作如下。
2.3.1 APS-SF-MC 复合伤口敷料溶液的制备 分别精密称定5、10、20 mg 黄芪多糖溶解于0.15 mL 4%丝素蛋白溶液中,即得低、中、高质量浓度(33.3、66.7、133.3 mg/mL)的黄芪多糖溶液,分别加入到0.15 mL 0.02 g/mL MC 溶液中,漩涡混合均匀,静置消除气泡,冷冻干燥,即可分别得到低、中、高质量浓度组APS-SF-MC 复合伤口敷料溶液。
2.3.2 Ori&APS-SF-MC 复合伤口敷料的制备 分别精密称定0.2、0.4、0.8 mg 冬凌草甲素溶于0.25 mL 1%聚山梨酯80 中,即得低、中、高质量浓度(0.8、1.6、3.2 mg/mL)的冬凌草甲素溶液;随后再精密称定20 mg 黄芪多糖溶于0.15 mL 4%丝素蛋白溶液中,即得高质量浓度(133.3 mg/mL)的黄芪多糖溶液;最后将上述2 种溶液一起加入到0.15 mL 0.02 g/mL MC 溶液中,漩涡混合均匀,倒入模具,静置消除气泡,冷冻干燥,即可分别得到低、中、高质量浓度组Ori&APS-SF-MC 复合伤口敷料。
2.3.3 Ori-SF-MC 复合伤口敷料的制备 精密称定0.8 mg 冬凌草甲素溶于0.25 mL 1%聚山梨酯80 中,即得冬凌草甲素溶液;随后加入0.15 mL 4%丝素蛋白溶液和0.15 mL 0.02 g/mL MC 溶液,漩涡混合均匀,倒入模具,静置消除气泡,冷冻干燥,即可得到Ori-SF-MC 复合伤口敷料。
2.3.4 SF-MC 复合伤口敷料的制备 精密量取0.15 mL 4%丝素蛋白溶液加入到0.15 mL 0.02 g/mL MC 溶液中,漩涡混合均匀,倒入模具,静置消除气泡,冷冻干燥,即可得到SF-MC 复合伤口敷料。
2.4 表面形貌
对复合伤口敷料的外观形态进行拍照记录。复合伤口敷料外观形貌见图1,制备得到的Ori&APSSF-MC 复合伤口敷料与模具尺寸一致,直径为10 mm,高度为2.5 mm,呈淡黄色,十分柔软,按压后可回弹。

图1 Ori&APS-SF-MC 复合伤口敷料实物图 (直径10 mm, 高度2.5 mm)Fig.1 Physical picture of Ori&APS-SF-MC composite wound dressing (diameter 10 mm, height 2.5 mm)

图2 冬凌草甲素、黄芪多糖、SF-MC 及Ori&APS-SFMC 的红外光谱图Fig.2 Infrared spectra of oridonin, Astragalus polysaccharides, SF-MC and Ori&APS-SF-MC
2.5 复合伤口敷料红外光谱分析
采用傅里叶变换红外吸收光谱仪对复合伤口敷料进行红外光谱表征,研究其红外吸收特性,扫描范围为500~4 000 cm−1。记录数据,分析复合伤口敷料的光谱图,通过解析黄芪多糖、冬凌草甲素、SF-MC 以及Ori&APS-SF-MC 复合伤口敷料红外光谱的差异,判断黄芪多糖与冬凌草甲素是否成功负载在Ori&APS-SF-MC 复合伤口敷料上。结果如图2 所示,可见冬凌草甲素在2 930、1 720、1 420、1 060、760 cm−1处有特征峰[27]。黄芪多糖在3 430、2 930、1 640、1 420、1 160、1 010、618 cm−1处有特征峰,其中3 430 cm−1处有1 个-OH 伸缩振动的宽峰,1 010 cm−1处有1 个由C-O 伸缩振动引起的强峰,说明黄芪多糖中存在氢键。2 930 cm−1处有CH2次甲基中C-H 键伸缩振动引起的吸收峰,1 640 cm−1处有羧基中O-H 键震动引起的吸收峰,1 420 cm−1处有羧基中的C-O 键伸缩振动引起的吸收峰,1 160 cm−1处有由多糖糖苷结构中C-O-C 的不对称缩振动引起的吸收峰[28-29]。SF-MC 在1 645、1 520 cm−1处有特征峰,代表着丝素蛋白β-折叠结构[30]。
Ori&APS-SF-MC 的特征峰为3 430、2 930、1 640、1 520、1 420、1 010、760、618 cm−1。除了共同特征吸收峰基本一致外,Ori&APS-SF-MC 复合伤口敷料在760、618 cm−1出现了特征吸收峰,对照黄芪多糖和冬凌草甲素红外吸收峰。可知此处为黄芪多糖和冬凌草甲素特征吸收峰,而在SF-MC 中没有其特征吸收峰,由此可以说明Ori&APS-SF-MC复合伤口敷料中含有黄芪多糖和冬凌草甲素,且未改变有效成分,在SF-MC 中加入冬凌草甲素和黄芪多糖后峰型变尖,表明了冬凌草甲素和黄芪多糖通过氢键与SF-MC 相互作用。
2.6 复合伤口敷料SEM 分析
将复合伤口敷料进行喷金处理,采用SEM 对复合伤口敷料的表面微观形貌进行观察。表面微观形貌见图3,制备得到的Ori&APS-SF-MC 复合伤口敷料达到较为理想的三维网络结构,微观呈现疏松多孔结构相互连接分布均匀且饱满,可以吸收伤口渗出液,有利于促进伤口愈合。

图3 不同倍数下Ori&APS-SF-MC 复合伤口敷料的SEM图像 (倍数×500, ×1 000)Fig.3 SEM images of Ori&APS-SF-MC composite wound dressings at different multiples (multiple × 500, × 1 000)
2.7 包封率与载药量的测定
采用HPLC 法测定Ori&APS-SF-MC 复合伤口敷料中冬凌草甲素的包封率和载药量[31];采用硫酸-苯酚法测定Ori&APS-SF-MC 复合伤口敷料中黄芪多糖的包封率和载药量[32],根据下列公式计算,实验平行3 次。
包封率=复合伤口敷料中药物的质量/投药量
载药量=复合伤口敷料中药物的质量/复合伤口敷料的质量
经测定,Ori&APS-SF-MC 中冬凌草甲素的包封率为(99.70±0.04)%,载药量为(3.66±0.05)%;黄芪多糖的包封率为(92.47±0.14)%,载药量为(83.57±0.12)%。即制备得到的复合伤口敷料中冬凌草甲素和黄芪多糖包封率高,载药量与理论载药量相近,分析这是由于在制备过程中药物损失较少,药物溶液稳定分散在复合伤口敷料中。
2.8 体外药物累积释放测定
2.8.1 冬凌草甲素体外药物累积释放 将复合伤口敷料浸入5 mL 的pH 7.4 磷酸盐缓冲液(phosphate buffer saline,PBS)中,置于37 ℃恒温水浴摇床中以100 r/min 震荡,定时吸取液体测定药物释放量,并加入等体积的PBS 来补偿释放介质。HPLC 法测定冬凌草甲素的累积释放量[33-34],评价冬凌草甲素的释放行为,绘制药物累积释放曲线。
2.8.2 黄芪多糖体外药物累积释放 将复合伤口敷料浸入10 mL PBS 缓冲液中,置于37 ℃恒温水浴摇床中以100 r/min 震荡,定时吸取1 mL 液体测定药物释放量,并加入等体积的PBS 来补偿释放介质。通过硫酸-苯酚法测定释放介质中多糖的质量浓度[35],评价黄芪多糖的体外释放行为,绘制药物累积释放曲线。
2.8.3 药物释放结果 复合伤口敷料在PBS 中的冬凌草甲素和黄芪多糖累积释放曲线如图4 所示,在20 min 以内冬凌草甲素和黄芪多糖内快速释放,在20 min 时累积释放率分别为(90.90±0.35)%和(89.17±2.35)%;当30 min 时,药物累积释放率分别达到(96.79±0.82)%和(92.52±1.03)%。表明该药物作为伤口敷料释药性能优异。
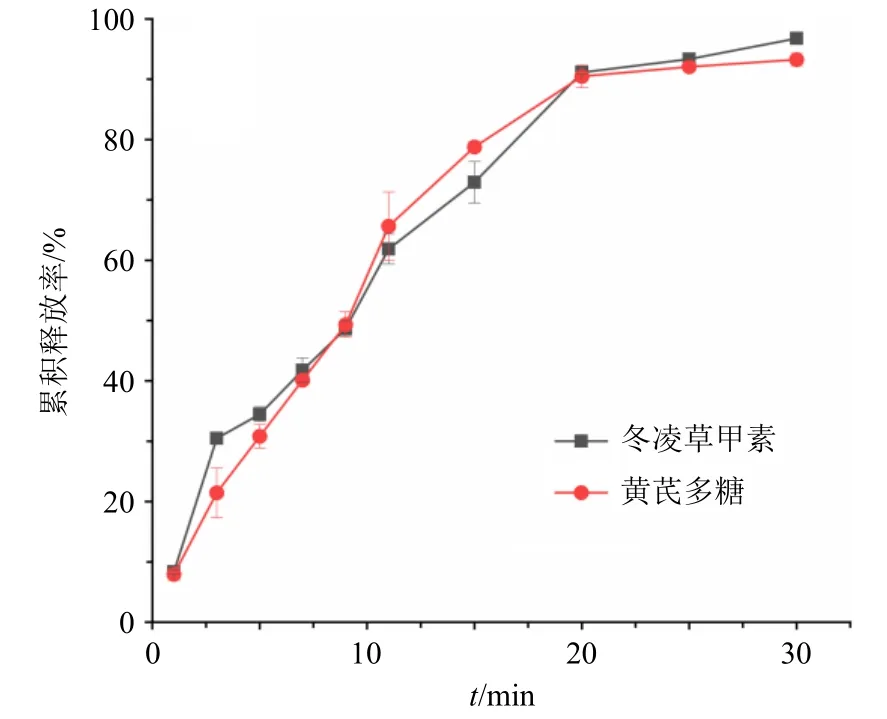
图4 复合伤口敷料药物释放曲线 (±s , n = 3)Fig.4 Drug release curve of composite wound dressing(±s , n = 3)
2.9 抗菌实验
伤口被细菌等微生物感染是制约伤口愈合的一个重要因素,所以伤口敷料通常要具有良好的抗菌能力,可以有效杀死细菌,抑制伤口处细菌以及有害微生物的繁殖滋生,并且可以抵抗细菌对人体的感染,从而大大降低患者伤口处部位有害微生物的感染风险,进而加速伤口愈合,因此,敷料具有抗菌性是非常必要的[18,36]。本实验考察不同质量浓度的冬凌草甲素、黄芪多糖、SF-MC 对革兰阳性菌金黄色葡萄球菌和革兰阴性菌大肠肝菌的抗菌效果。
2.9.1 菌悬液的制备 采用菌落稀释法,挑取平板上2 或3 个菌落,使其悬浮于装有0.9%无菌生理盐水的试管中,充分震荡,混匀后与0.5(1×108/mL)标准麦氏比浊管进行比对,分别制成浓度为0.5 麦氏单位的金黄色葡萄球菌和大肠杆菌菌悬液备用。
2.9.2 牛津杯扩散法 在无菌条件下,用已灭菌的培养基制成平板,待冷却凝固后,分别加入200 μL 2 种菌悬液,然后用无菌涂布器涂布均匀。待表面干燥后,并用镊子将无菌的牛津杯轻轻放入培养平板中,在水平放置的平板中均匀地放置3 只牛津杯。
以SF-MC 复合伤口敷料溶液为对照组,将载有低、中、高质量浓度(0.8、1.6、3.2 mg/mL 冬凌草甲素)Ori&APS-SF-MC 复合伤口敷料溶液和载有低、中、高质量浓度(33.3、66.7、133.3 mg/mL 黄芪多糖)APS-SF-MC 复合伤口敷料溶液100 μL,分别加入牛津杯中(金黄色葡萄球菌平板),以及将载有高质量浓度的APS-SF-MC 复合伤口敷料溶液和高质量浓度的Ori&APS-SF-MC 复合伤口敷料溶液100 μL,分别加入牛津杯中(大肠杆菌平板),每种加3 孔作为平行样。置于恒温培养箱中37 ℃条件下,培养24 h。分别观察并测量抑菌圈直径大小。结果如表1 和图5-A 所示,抑菌圈的直径与冬凌草甲素的质量浓度呈正相关,具有极其显著性差异(P<0.000 1)。在高质量浓度时抑菌圈直径为(22.37±0.23)mm,中质量浓度时抑菌圈直径为(18.17±0.31)mm,低质量浓度时抑菌圈直径为(15.83±0.25)mm。如图5-C 所示,低、中、高质量浓度(33.3、66.7、133.3 mg/mL)组APS-SF-MC 复合伤口敷料溶液对金黄色葡萄球菌皆无抗菌作用。
表1 各复合伤口敷料对金黄色葡萄球菌的抗菌效果(牛津杯扩散法,±s , n = 3)Table 1 Antibacterial effect of each composite wound dressing on Staphylococcus aureus (Oxford cup diffusion method,±s , n = 3)

表1 各复合伤口敷料对金黄色葡萄球菌的抗菌效果(牛津杯扩散法,±s , n = 3)Table 1 Antibacterial effect of each composite wound dressing on Staphylococcus aureus (Oxford cup diffusion method,±s , n = 3)
“−”表示不含;与SF-MC 组比较:****P<0.000 1;表2 同。“−” indicating that it does not contain; ****P<0.000 1 vs SF-MC group;same as table 2.
样品 质量浓度/(mg∙mL−1) 抑菌圈直径/mm 冬凌草甲素 黄芪多糖SF-MC 复合伤口敷料 − − 0.00 Ori&APS-SF-MC 3.2 133.3 22.37±0.23****复合伤口敷料 1.6 133.3 18.17±0.31****0.8 133.3 15.83±0.25****APS-SF-MC 复合 − 33.3 0.00伤口敷料 − 66.7 0.00− 133.3 0.00

图5 各组代表性抑菌圈结果 (n = 3)Fig.5 Results of representative inhibition zone of each group (n = 3)
如图5-D 所示,复合伤口敷料对大肠杆菌无抗菌作用,这一结果与已有报道的研究结果一致[6]。
2.9.3 直接放置法 在无菌条件下,用已灭菌的培养基制成平板,待冷却凝固后,分别加入200 μL 菌悬液,然后用无菌涂布器涂布均匀。待表面干燥后,以SF-MC 复合伤口敷料为对照组,直接将不同质量浓度的复合伤口敷料贴在平板上。置于恒温培养箱中37 ℃条件下,培养24 h。分别观察并测量抑菌圈直径大小。结果如表2 和图5-B 所示,与对照组相比,随着冬凌草甲素质量浓度的增加,抗菌能力加强,具有极其显著性差异(P<0.000 1)。在高质量浓度时抑菌圈直径为(27.43±0.31)mm,中质量浓度时抑菌圈直径为(25.60±0.26)mm,低质量浓度时抑菌圈直径为(22.40±0.20)mm。
表2 各复合伤口敷料对金黄色葡萄球菌的抗菌效果(直接放置法,±s , n = 3)Table 2 Antibacterial effect of each composite wound dressing on S.aureus (direct placement method,±s , n = 3)
样品 冬凌草甲素质量浓度/(mg∙mL−1)抑菌圈直径/mm SF-MC 复合伤口敷料 − 0.00 Ori&APS-SF-MC 3.2 27.43±0.31****复合伤口敷料 1.6 25.60±0.26****0.8 22.40±0.20****
2.9.4 涂布平板法 在无菌条件下,以1×105菌悬液为空白组,SF-MC 复合伤口敷料为对照组,将不同质量浓度的复合伤口敷料放入1×108菌悬液中均匀混合,置于恒温培养箱中37 ℃条件下,培养24 h 后,再将其质量浓度稀释到1×105倍,然后用己灭菌的培养基制成平板,待冷却凝固后,分别加入100 μL 菌悬液,然后用无菌涂布器涂布均匀。置于恒温培养箱中37 ℃条件下,培养24 h。取出观察琼脂平板上的菌落数。结果如图6 所示,与空白组和对照组相比,随着冬凌草甲素质量浓度的增加,抗菌能力加强。表明冬凌草甲素对金黄色葡萄球菌有明显的抑制作用。冬凌草甲素抗菌主要是通过抑制金黄色葡萄球菌的细胞膜形成和抑制呼吸代谢进行抑菌[37]。
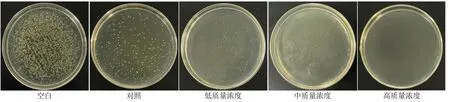
图6 涂布平板法的结果 (金黄色葡萄球菌)Fig.6 Results of coating plate method (S.aureus)
综上,抗菌实验结果表明,0.8 mg 的冬凌草甲素对金黄色葡萄球菌有较强的抗菌效果,但对大肠杆菌无作用,黄芪多糖高达20 mg 对金黄色葡萄球菌和大肠杆菌皆无作用,与文献报道的不同[38-39]。空白复合伤口敷料对金黄色葡萄球菌和大肠杆菌都无作用。金黄色葡萄球菌是伤口感染最常见的细菌,本实验复合伤口敷料处方分别选用0.8 mg 冬凌草甲素和20 mg 黄芪多糖制备。
2.10 伤口愈合性能测试
2.10.1 模型制作 雄性昆明小鼠,6~7 周龄,30只,体质量(30±2)g,腹腔麻醉后使用脱毛膏将背部细毛脱去,随后使用皮肤打孔器在小鼠背部打出一个直径为8 mm 的圆形全层伤口,拍照记录,作为伤口愈合全过程的第0 天。
2.10.2 实验分组和给药方法 实验分为5 组,每组6 只。本实验分为给药组(Ori&APS-SF-MC)、冬凌草甲素组(Ori-SF-MC)、多糖组(APS-SF-MC)、阴性对照组(SF-MC)及空白对照组。将不同组别的复合伤口敷料在254 nm 的紫外光下照射30 min 灭菌随后覆盖小鼠背部皮肤缺损区域,选用适宜的无菌弹性胶带覆盖并固定在缺损皮肤创面周围,避免小鼠啃咬皮肤缺损区域,空白对照组伤口不做任何处理。第0、1、3、5 天更换敷料。恒温恒湿喂养。
2.10.3 统计学分析 数据用Graphpad Prism 8、Origin 以及Image J 软件系统分析处理。符合正态分布的数据统计采用Two-way ANOVA 法分析,以P<0.05 为差异有显著性意义,P<0.01 为差异有非常显著性意义,P<0.001为差异有极其显著性意义。
2.10.4 伤口愈合情况分析及愈合率测定 观察不同组别中小鼠伤口随时间的愈合情况,在特定时间点,第0、3、7、10、14 进行拍照,以供后期观察、比较和分析。采用Image J 软件和Graphpad Prism 8软件进行计算机图形处理和计算小鼠伤口的面积,并对伤口愈合率进行计算。采用以下公式计算伤口愈合率[40]。
愈合率=(初始伤口面积-未愈合伤口面积)/初始伤口面积
结果如图7 所示,各组在造模当天(第0 天)伤口近圆形,有组织液渗出及脓性物分泌;造模后第3 天,各组伤口结痂,无组织液渗出,有红肿现象及轻微炎症现象,伤口明显缩小;造模后的第7天,各组伤口结痂部分脱落,缩痂明显,但仍存在红肿现象;造模后第10 天,Ori&APS-SF-MC 组、APS-SF-MC 组以及SF-MC 组的伤口结痂皮几乎已全部脱落,Ori-SF-MC 组和空白对照组的伤口结痂皮还未全部脱落;造模后第14 天,各组的伤口进一步缩小,其中Ori&APS-SF-MC 组的伤口结痂皮已全部脱落,无红肿及炎症现象,说明伤口愈合完全,APS-SF-MC 组的伤口处还有小块淤血,Ori-SF-MC组、SF-MC 组及空白对照组仍有痂皮未脱落,说明伤口愈合不完全,且空白对照组仍有大片痂皮未脱落,伤口周边还有轻微红肿现象,说明伤口还没有愈合,肉眼可见各组伤口愈合情况出现差异。

图7 小鼠伤口愈合的直观展示 (标尺1 mm)Fig.7 Visual display of wound healing in mice (scale bar 1 mm)
结果如表3 和图8 所示,对于愈合率来说,在给药7 d 后,Ori&APS-SF-MC 组(P<0.000 1)、Ori-SF-MC 组(P<0.05)、APS-SF-MC 组(P<0.000 1)和SF-MC 组(P<0.000 1)的伤口愈合率均显著高于空白对照组;在第10 天后,与空白对照组相比,APS-SF-MC(P<0.000 1)组和Ori&APS-SF-MC 组(P<0.000 1)的伤口愈合率均显著高于空白对照组,与SF-MC 组相比,APS-SF-MC(P<0.001)组和Ori&APS-SF-MC 组(P<0.001)的伤口愈合率均显著高于SF-MC 组,而空白对照组、SF-MC 组和Ori-SF-MC 组的伤口愈合率均无显著性差异,这说明可能是黄芪多糖对伤口愈合有促进作用;在第14天后,与空白对照组相比较,Ori&APS-SF-MC 组(P<0.000 1)、Ori-SF-MC 组(P<0.001)、APS-SFMC 组(P<0.001)的伤口愈合率均显著高于空白对照组,与SF-MC 组相比,Ori&APS-SF-MC 组(P<0.001)、Ori-SF-MC 组(P<0.05)、APS-SF-MC 组(P<0.05)的伤口愈合率均显著高于SF-MC 组,但总体来说,Ori&APS-SF-MC 组的伤口愈合率高于Ori-SF-MC 组和APS-SF-MC 组。
表3 不同时间点不同复合敷料组的伤口愈合率 (±s, n = 6)Table 3 Wound healing rate of different composite dressing groups at different time points (±s , n = 6)

表3 不同时间点不同复合敷料组的伤口愈合率 (±s, n = 6)Table 3 Wound healing rate of different composite dressing groups at different time points (±s , n = 6)
与空白对照组比较:*P<0.05 ***P<0.001 ****P<0.000 1;与SF-MC 组比较:#P<0.05 ###P<0.001。*P < 0.05 ***P < 0.001 ****P < 0.000 1 vs blank control group; #P < 0.05 ###P < 0.001 vs SF-MC group.
样品 伤口愈合率/%3 d 7 d 10 d 14 d空白对照 25.48±4.59 44.25±1.71 62.32±0.71 80.58±0.19 SF-MC 26.54±1.74 61.37±3.46**** 69.11±1.73 84.30±0.68 APS-SF-MC 33.42±6.78 59.85±2.70**** 80.70±0.42****### 93.40±1.15***#Ori-SF-MC 36.85±3.40 53.47±0.42* 68.42±4.15 92.75±0.73***#Ori&APS-SF-MC 38.11±3.20 62.53±2.07**** 81.78±1.25****### 97.38±0.68****###
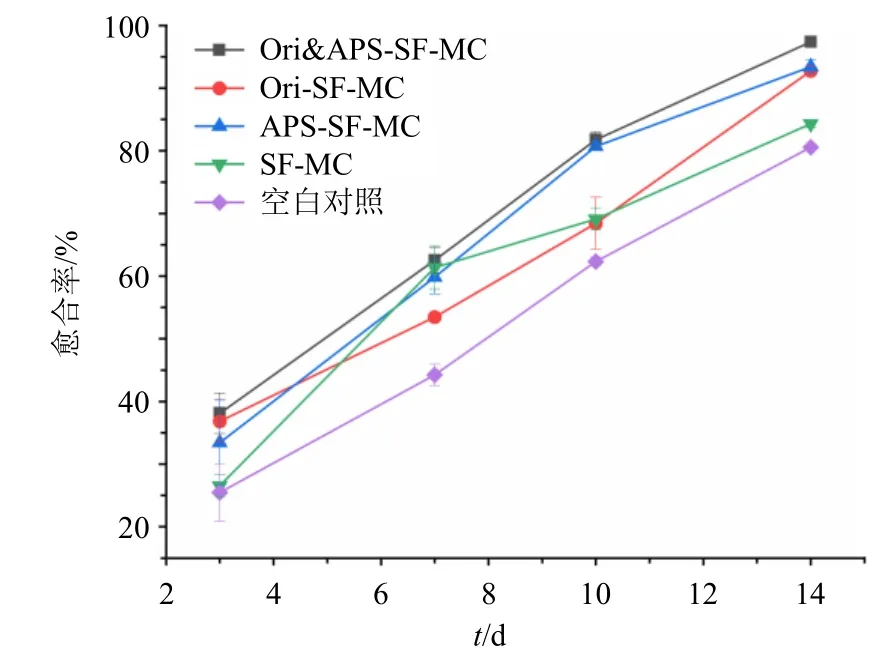
图8 各组愈合率比较 (±s , n = 6)Fig.8 Comparison of wound healing rate in each group(±s , n = 6)
综上所述,结果表明冬凌草甲素和黄芪多糖联用具有抗菌和加速伤口愈合的功效。
2.10.5 剪取伤口组织 清洗小鼠皮肤伤口组织,处死后,迅速切取包含整个伤口区域的边长为1.2 mm的正方形全层皮肤组织样品并置于生理盐水中充分漂洗残余血液,随后将其浸没于 4%多聚甲醛(paraformaldehyde,PFA)中固定。
2.10.6 苏木精-伊红染色 取出固定好的伤口组织,乙醇分级脱水,石蜡包埋,切片,部分伤口组织进行苏木精-伊红(H&E)染色,封片,最后于显微镜下观察表皮结构、真皮-表皮连接状态、炎性细胞浸润和新生血管等伤口愈合情况,并摄片记录。在显微镜下观察伤口的H&E 染色病理切片,结果如图9 所示,空白对照组的皮肤损伤中心表面未见愈合,表皮层以及真皮层浅层仍处于坏死阶段,可见大量的坏死细胞和坏死组织成分,可见较多的炎性细胞坏死。SF-MC 组皮肤损伤处表皮基本愈合,表皮增厚,真皮层可见大量的成纤维细胞以及新生血管,局部伴有轻度出血,并伴有较多的炎性细胞浸润,但未见明显的新生附属器官,其伤口愈合原因可能是由于纯丝素蛋白材料会被机体降解成短肽链而被吸收,可以促进伤口的愈合,与已有研究结果一致[41]。APS-SF-MC 组皮肤损伤处表皮愈合,愈合表皮增厚,角质层增厚;真皮层可见大量的成纤维细胞以及新生血管,这可能是黄芪多糖促进新生血管的生成,从而促使伤口愈合。Ori-SF-MC 组皮肤损伤中心表皮、真皮未愈合,外侧可见脓肿灶,损伤两侧表皮明显增厚,真皮层伴有较多的炎性细胞浸润。因此,与其他对照组相比,Ori&APS-SF-MC组的皮肤损伤表面基本愈合,表皮层增厚,真皮层可见大量的成纤维细胞以及新生血管修复。
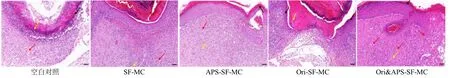
图9 HE 染色评价各组皮肤病理变化 (标尺50 μm)Fig.9 Pathological changes of skin in each experimental group detected by HE staining (scale bar 50 μm)
2.10.7 Masson染色 对剩余组织切片进行Masson染色,胶原纤维会被染成蓝色,观察各组动物真皮内胶原纤维排列状态和新生血管情况。选择合适的区域和放大倍数进行摄片记录。采用Image J 软件进行胶原纤维面积百分比的计算。Masson 胶原纤维面积百分比分析方法是指每组内每张切片随机挑选至少3 个200 倍视野进行拍照,拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。
Masson 染色是胶原纤维的经典染色,胶原纤维也是真皮层的主要成分。结果如表4 和图10 所示,在第14 天时,空白对照组、SF-MC 组、APS-SF-MC组、Ori-SF-MC 组以及Ori&APS-SF-MC 组的胶原纤维面积百分比分别为25.45%、26.26%、29.46%、27.60%、47.73%,其中,空白对照组的纤维组织最小,其次是SF-MC 组,APS-SF-MC 组、Ori-SF-MC组,Ori&APS-SF-MC 组的纤维组织面积最大,高达40%以上;Ori&APS-SF-MC 组的胶原纤维很明显多于其他对照组,并达到峰值伴有胶原沉积现象。空白对照组、SF-MC 组以及APS-SF-MC 组皮肤损伤处可见大量的新生胶原纤维,但胶原纤维排列紊乱、走形不一致;Ori-SF-MC 组胶原排列欠规则,损伤中心处未愈合;即与其他对照组相比,Ori&APS-SFMC 组的皮肤损伤处可见较多的新生胶原纤维,胶原排列较规则有序。从中可以进一步得出结论,使用Ori&APS-SF-MC 复合伤口敷料的组织切片中纤维组织面积最大,说明伤口愈合效果最好,协同作用对伤口愈合的促进效果最佳。

表4 皮肤组织内胶原纤维组织表达面积百分比Table 4 Percentage of fibrous tissue expression area in skin tissue
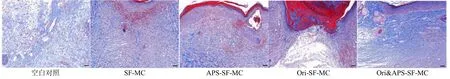
图10 Masson 染色评价各组皮肤胶原含量 (标尺50 μm)Fig.10 Evaluation of collagen content in skin of each group by Masson staining (scale bar 50 μm)
3 讨论
由伤口愈合情况与伤口组织学形态结果证明,与空白对照组和SF-MC 组相比,APS-SF-MC 组的愈合率较高,说明黄芪多糖对伤口愈合有促进作用而无抗菌作用。现已有报道黄芪多糖可通过促进成纤维细胞增殖、改善微循环、改变伤口局部微环境、提供能量代谢物质以及促进代谢产物的清除、促进新生血管的生成、上调内皮细胞表面黏附分子ICAM-1 的表达、增强中性粒细胞与血管内皮细胞的黏附、从而促进中性粒细胞穿越血管内皮渗出在伤口局部聚集,吞噬消化细菌、清除坏死组织等途径促进伤口愈合,并体现了中医学“去腐生肌、偎脓长肉”理论的现代生物学基础[29,42-43]。因此,黄芪多糖是用于制备包括敷料、水凝胶、薄膜等在内的伤口愈合治疗产品的重要成分,制备的产品具有良好的生物相容性、降低毒性等方面的优势[44]。
而与空白对照组和SF-MC 组相比,Ori-SF-MC组的愈合率较高,说明可能是冬凌草甲素的抗菌作用进一步促进伤口愈合。但与Ori-SF-MC 组和APSSF-MC 组相比,Ori&APS-SF-MC 组愈合率更高,说明可能是冬凌草甲素的抗菌作用联合黄芪多糖的促进伤口愈合作用,进一步提高伤口愈合率,加速伤口的愈合。
综上所述,本研究制备得到的复合伤口敷料抗菌效果好、包封率高、载药量与理论载药量相近,体外释药性能优异,促进伤口愈合效果显著,Ori&APS-SF-MC 复合伤口敷料在医用伤口敷料领域具有较高的应用潜力。
利益冲突所有作者均声明不存在利益冲突