酸性硫酸钙处理对采后鲜糯玉米贮藏品质的影响
王春芳,王娟紫,柳洪入,刘晨霞,张 怡,乔勇进,,韩 晴,范晓华
(1.上海市农业科学院作物育种栽培研究所,上海 201403;2.上海农产品保鲜加工工程技术研究中心,上海 201403;3.上海海洋大学食品学院,上海 201306;4.嘉定区农业技术推广服务中心,上海 201800)
糯玉米(Zea maysL.sinensis Kulesh),又称蜡质玉米,因其粘性、耐嚼的质地、味道和营养而在中国、韩国、越南、老挝、缅甸和泰国等国家被广泛消费[1]。由于鲜糯玉米收获后籽粒呼吸依然旺盛,易出现苞叶失绿变黄、籽粒失水皱缩等品质劣变问题,对鲜糯玉米的食用价值、营养价值及商业价值等造成严重影响。为满足鲜糯玉米的消费需求,寻找安全有效的鲜糯玉米采后保鲜技术显得尤为重要。
酸性硫酸钙(acidic calcium sulfate,ACS)是由一定比例的Ca(OH)2、CaSO4、H2SO4和H2O 混合制备的杀菌防腐保鲜产品,兼具酸性强、易溶于水、低腐蚀、安全环保等优点[2]。目前,ACS 在国外广泛应用于肉制品的保鲜及饮水杀菌等[3],也可用于新鲜果蔬的防腐保鲜。将ACS 原液用蒸馏水稀释103倍后浸泡水蜜桃,能有效地降低果实细胞膜脂质过氧化程度,保持较高的过氧化物酶活性,延缓水蜜桃软化衰老进程,延长果实保鲜期[4]。张恺洳等[3]研究发现,采用pH5.45 的ACS 喷洒处理葡萄20 s,可有效地控制果实失重和硬度下降,减少营养物质损耗,维持果实贮藏品质。Wang 等[5]研究表明,经ACS 处理的荔枝果皮的总黄酮含量高于对照组,果皮总酚和花青素含量随ACS 处理浓度的增加而增加,经ACS 处理的样品可有效清除超氧阴离子等活性氧自由基,增强果实贮藏期间的抗氧化酶活性,从而维持荔枝果实品质。目前,还未见将ACS 用于采后鲜糯玉米的报道。
本研究以‘沪红糯1 号’糯玉米为试材,研究ACS 处理对采后鲜糯玉米营养品质及抗氧化活性的影响,以期为鲜糯玉米采后贮藏保鲜、延长货架期提供理论参考和技术借鉴。
1 材料与方法
1.1 材料与仪器
‘沪红糯1 号’糯玉米 采购自上海惠和南瓜种植合作社,采收后的新鲜糯玉米整果穗2 h 内运回实验室冷库,预冷10 h 后挑选苞衣颜色均一、玉米穗型大小一致,无病虫害和机械损伤的玉米备用;浓硫酸、丙酮、甲醇、浓盐酸、芦丁、没食子酸等 分析纯,国药集团化学试剂有限公司;ACS 原液 美国Mionix 公司;芍药素 上海源叶生物科技有限公司;过氧化氢(H2O2)含量试剂盒 北京盒子生工科技有限公司;可溶性糖含量试剂盒、超氧阴离子清除能力试剂盒、过氧化氢酶(CAT)试剂盒 苏州梦犀生物医药科技有限公司。
TA.XT plus 型物性测试仪(质构仪)英国Stable Micro Systems 公司;WYA-ZT 型阿贝折射仪上海仪电物理光学仪器有限公司;V20S 水分测定仪 瑞士梅特勒拖利多公司;Osterode 型高速冷冻离心机 德国Biofuge 公司;μQuant 型酶标仪 美国BIO-TEK 公司。
1.2 实验方法
1.2.1 样品处理 实验设置对照组(CK)和ACS 处理组,两组分别将去除最外面两层苞衣的玉米穗充分浸入蒸馏水和ACS 稀释液(pH 2.26±0.04)中,浸泡10 min 后倒立控水30 min,擦干表面残留水分,放置于冷库(4±0.5 ℃,90%±5% RH)贮藏。ACS 稀释液为原液用蒸馏水稀释103倍[4]。贮藏期间,每组果实每8 d 随机取6 个玉米果穗,取出后去除玉米苞衣,测定果穗中部籽粒的质构特性(果皮硬度),后用手动脱粒装置收集果穗中部玉米籽粒,取一部分籽粒打浆后测定水分含量和可溶性固形物含量,把其余籽粒用液氮速冻并粉碎成粉,然后保存于-80 ℃冰箱,用于后续实验。
1.2.2 测定指标和方法
1.2.2.1 失重率 采用称重法[6]测定失重率,按照下式计算:
式中:m1和m2分别为贮藏前和贮藏不同时间后玉米的质量(g)。
1.2.2.2 水分含量 水分含量使用V20S 水分测定仪测定,结果以%表示。
1.2.2.3 果皮硬度 鲜糯玉米果穗去除苞衣后,对其中部的玉米粒使用质构仪(圆柱形探头直径2 mm)测定,结果以kg 表示[7]。
1.2.2.4 可溶性固形物(soluble solids,TSS)含量采用折光仪测定法[8],结果以%表示。
1.2.2.5 可溶性糖含量 精确称取0.1 g 样品,加入1 mL 蒸馏水,匀浆后95 ℃水浴10 min,冷却后在25℃条件下以8000 r/min 离心10 min,收集上清液,采用试剂盒测定可溶性糖含量。结果以mg/g表示。
1.2.2.6 花青素、类黄酮和总酚含量 参照曹建康等[8]的方法稍作改动,结果以mg/g 表示。以不同浓度的没食子酸制作标准曲线,为y=0.0256x+0.0657(R2=1),计算总酚物质含量;以不同浓度的芦丁制作标准曲线,为y=0.0079x+0.0402(R2=0.9989),计算类黄酮含量;以不同浓度的芍药素制作标准曲线,为y=0.0522x+0.009(R2=0.9994),计算花青素含量。
1.2.2.7 过氧化氢(H2O2)含量 精确称取0.1 g 样品,加入1 mL 经4 ℃预冷的丙酮,冰浴匀浆后于4 ℃ 8000 r/min 离心10 min,取上清液,采用试剂盒测定H2O2含量。结果以μmol/g 表示。
1.2.2.8 超氧阴离子自由基(O2-·)清除能力 精确称取0.1 g 样品,加入1 mL 提取液,冰浴匀浆后于4 ℃、10 000 r/min 离心10 min,取上清液,采用试剂盒测定O2-·清除能力。结果以%表示。
1.2.2.9 过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性 精确称取0.1 g 样品,加入1 mL 提取液,冰浴匀浆后于12000 r/min,4 ℃离心10 min,取上清液,采用试剂盒测定CAT 活性。结果以μmol/min/g 表示。
精确称取1.0 g 样品,加入5.0 mL 经4 ℃预冷的提取缓冲液(含0.1 mol/L EDTA、1 mmol/L 抗坏血酸和2% PVPP),冰浴匀浆,4 ℃、12000 r/min 离心30 min,收集上清液作为酶提取液,测定APX 活性[8]。结果以U/g 表示。
1.3 数据处理
每个指标测定重复3 次。采用Origin 2018 版软件绘图和主成分分析(Principal Component Analysis,PCA),利用SPSS 17.0 进行统计分析和显著性分析(独立样本T检验,单因素方差分析),P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 ACS 对鲜糯玉米水分含量、失重率和果皮硬度的影响
水分含量对果蔬品质有很大影响,在一定范围内,水分含量高的玉米籽粒鲜嫩多汁,口感更好[9]。如图1A 所示,ACS 处理组的鲜糯玉米的水分含量始终高于同期贮藏的对照组,且在第16 和40 d 二者间差异显著(P<0.05)。CK 组样品从第32 d 开始与贮藏第0 d 的水分含量(58.05%)出现显著性差异(P<0.05),在第40 d 时,对照组的水分含量显著下降至54.25%。而贮藏期间ACS 处理组的水分含量未出现显著下降(P>0.05)。这可能与果实内部结合水、不易流动水和自由水三种水分转变有关,它们会在贮藏期间不断地发生转化和损失[10]。在贮藏前期果实的生命活动主要是大分子分解成小分子的化学反应,这使得大分子物质与水分的结合程度降低,自由水含量升高,但随着果实的持续性脱水以及一系列不可逆转的变化,即果实走向衰老阶段,水分含量下降[11]。综上可知,ACS 处理可减缓鲜糯玉米籽粒在贮藏期间的水分流失。
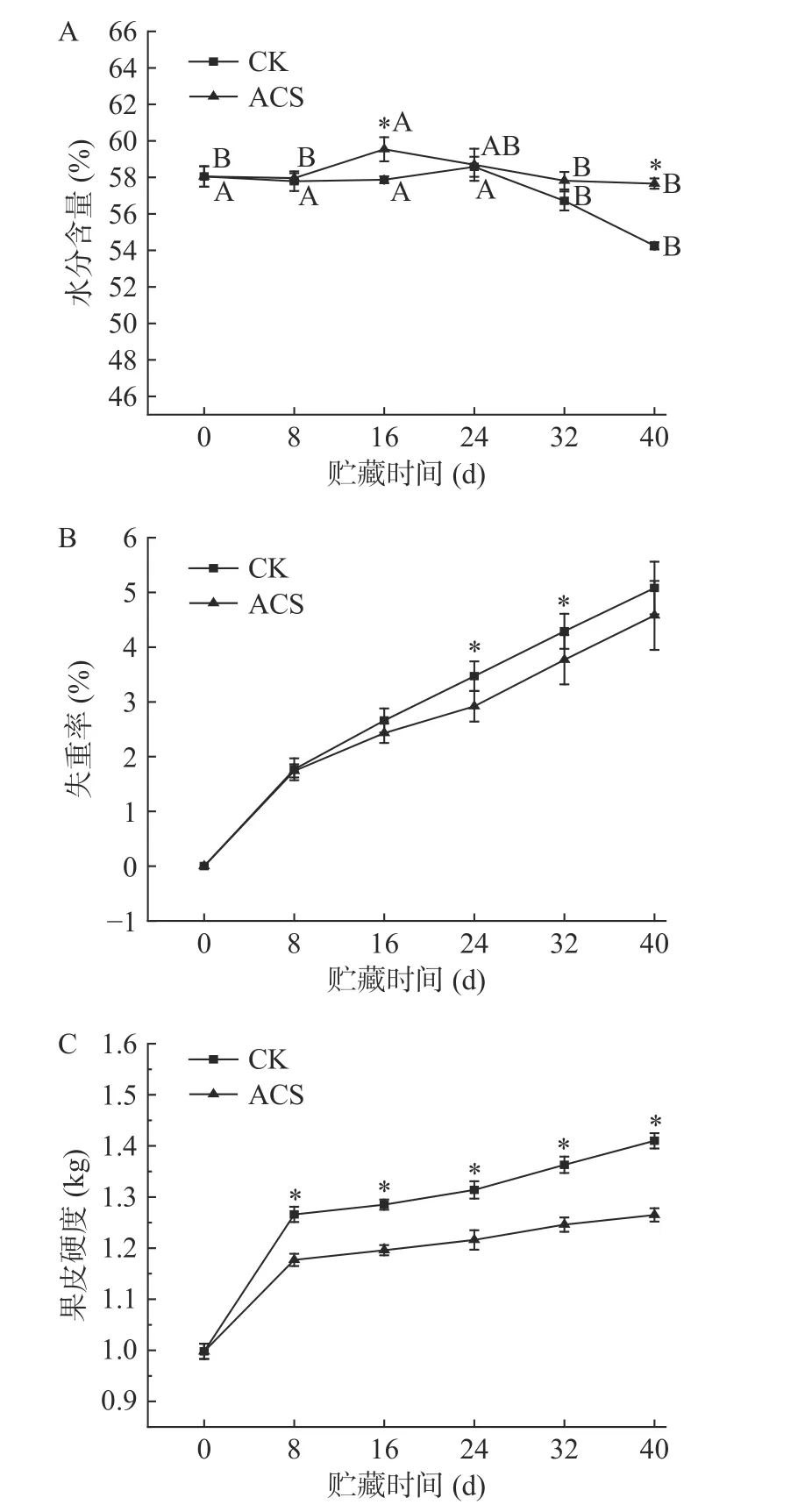
图1 ACS 处理对鲜糯玉米水分含量(A)、失重率(B)和果皮硬度(C)的影响Fig.1 Effects of ACS on moisture content (A),weight loss rate(B),and fruit skin hardness (C) of fresh waxy corn
鲜食果蔬在采后贮藏期间,由于蒸腾作用和自身呼吸作用对有机物质的分解都会导致其质量的损失[12],因此,失重率是评价鲜食果蔬新鲜度的重要指标。如图1B 所示,鲜糯玉米的失重率在整个采后贮藏期失重率持续上升。贮藏至第8 d 时,鲜糯玉米的失重率均有较大程度的升高,这可能是由于采后鲜食玉米呼吸强度较大,生理代谢依然旺盛,自身的有机物质易被分解,这与司婉芳[13]的研究一致。在整个贮藏过程中,CK 组的失重率始终高于ACS 处理组,并在第24 和32 d 时差异显著(P<0.05)。说明ACS处理能有效抑制鲜糯玉米失重率的上升,在一定程度上延缓玉米质量的损失。
鲜糯玉米贮藏过程中,由于玉米组织木质化和纤维化过程的进行,导致细胞壁硬化,果皮硬度增加[14]。而果皮硬度的变化直接反映采后玉米品质的变化。如图1C 所示,采后鲜糯玉米的果皮硬度呈逐渐上升趋势。第0 d 时,果皮硬度较低,为0.998 kg,这是因为在乳熟期采收的玉米籽粒饱满,柔嫩适口,弹性较好。贮藏至第8 d 时,CK 组和ACS 处理组的果皮硬度显著增加(P<0.05),分别为1.266、1.177 kg,这表明鲜糯玉米采后初期的呼吸强度较高,生理代谢旺盛,籽粒果皮变硬,CK 组的果皮硬度增加速度明显大于ACS 处理组。这与司婉芳[13]的研究结果较一致,因鲜食玉米采后呼吸强度高,营养成分变化迅速,导致贮藏初期硬度上升迅速。在贮藏期间,ACS 处理组的果皮硬度均显著低于对照组(P<0.05),说明ACS 处理可有效延缓鲜糯玉米整个贮藏期间籽粒果皮硬度的增加。
2.2 ACS 处理对鲜糯玉米TSS 和可溶性糖含量影响
随着贮藏时间的增加,TSS 含量会伴随着玉米籽粒内部可溶性糖和蛋白等营养物质的分解而下降,从而影响鲜食玉米的营养品质[15]。可溶性糖是评价鲜食玉米食用品质的重要指标,与鲜食玉米的甜度密切相关,对果蔬的风味品质有较大影响[16]。如图2所示,在整个贮藏期间,对照组和ACS 组的TSS 含量(图2A)和可溶性糖含量(图2B)均呈下降趋势,并在前8 d 下降最为迅速。原因可能是采收时淀粉合成酶活性处于最强时期,可溶性糖向淀粉转化的代谢反应仍在进行,导致可溶性糖含量表现为较大程度的下降[17]。在8~32 d 贮藏期间,ACS 处理组的TSS含量和可溶性糖含量始终极显著高于CK 组(P<0.01)。贮藏至末期(第40 d)时,CK 组TSS 和可溶性糖含量出现小幅上升,二组间无显著差异(P>0.05)。这可能与CK 组失水较多有关[18-19],贮藏末期ACS 组仍保持较高的水分含量,而CK 组水分大量流失,从而导致CK 组的可溶性固形物含量及可溶性糖含量上升,与ACS 处理组间的差异减小。以上结果表明,ACS 处理可有效地抑制鲜糯玉米采后TSS 含量及可溶性糖含量的下降。
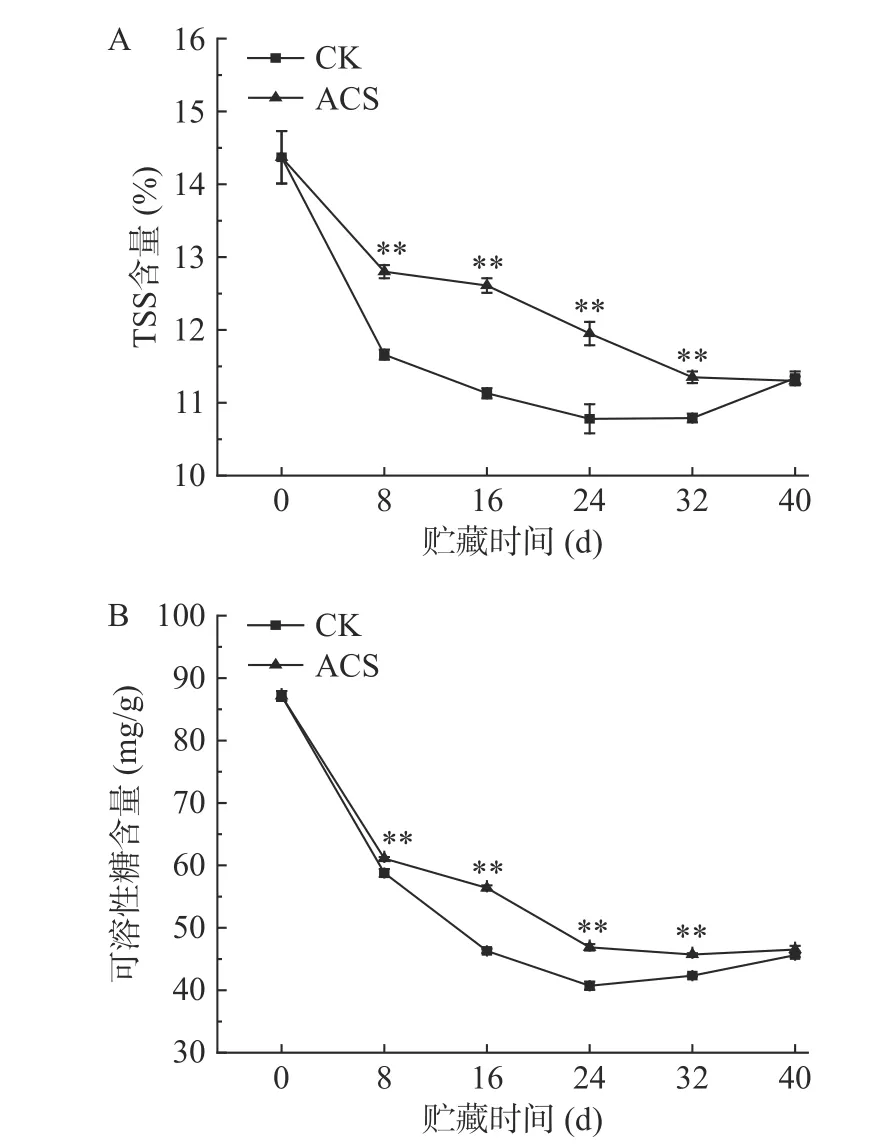
图2 ACS 处理对鲜糯玉米TSS(A)和可溶性糖(B)含量的影响Fig.2 Effects of ACS on TSS (A) and soluble sugar (B)contents of fresh waxy corn
2.3 ACS 处理对鲜糯玉米酚类、类黄酮类和花青素的影响
果蔬中的酚类、类黄酮类和花青素等是植物组织内的非酶抗氧化物质。酚类物质的积累可修复果蔬的组织伤害[20]。类黄酮是极具代表的多酚类物质[21],是果蔬中的重要代谢产物[22]。花青素是存在于植物中的水溶性类黄酮色素[23],具有较强的抗氧化作用[24]。如图3 所示,在贮藏前24 d,两组鲜糯玉米中总酚、类黄酮和花青素含量均呈明显下降趋势,其中,ACS 处理组总酚在第8 d 和16 d 分别下降了4.46%和11.74%,而对照组下降了11.27%和16.43%,ACS处理组类黄酮含量在第16 d 时下降了20.37%,而对照组下降了29.14%。随后两组果实中总酚和类黄酮含量有所增加。而同期两组果实中花青素含量继续下降但明显趋缓。在整个贮藏过程中,ACS 处理组的总酚、类黄酮和花青素含量几乎均极显著高于对照组(P<0.01)。这与Wang 等[5]的研究结果较一致,经ACS 处理的荔枝果皮的总黄酮、总酚和花青素含量均高于对照组,说明ACS 处理可在一定程度上抑制玉米籽粒总酚、类黄酮和花青素含量的下降,从而保持较好的抗氧化能力。
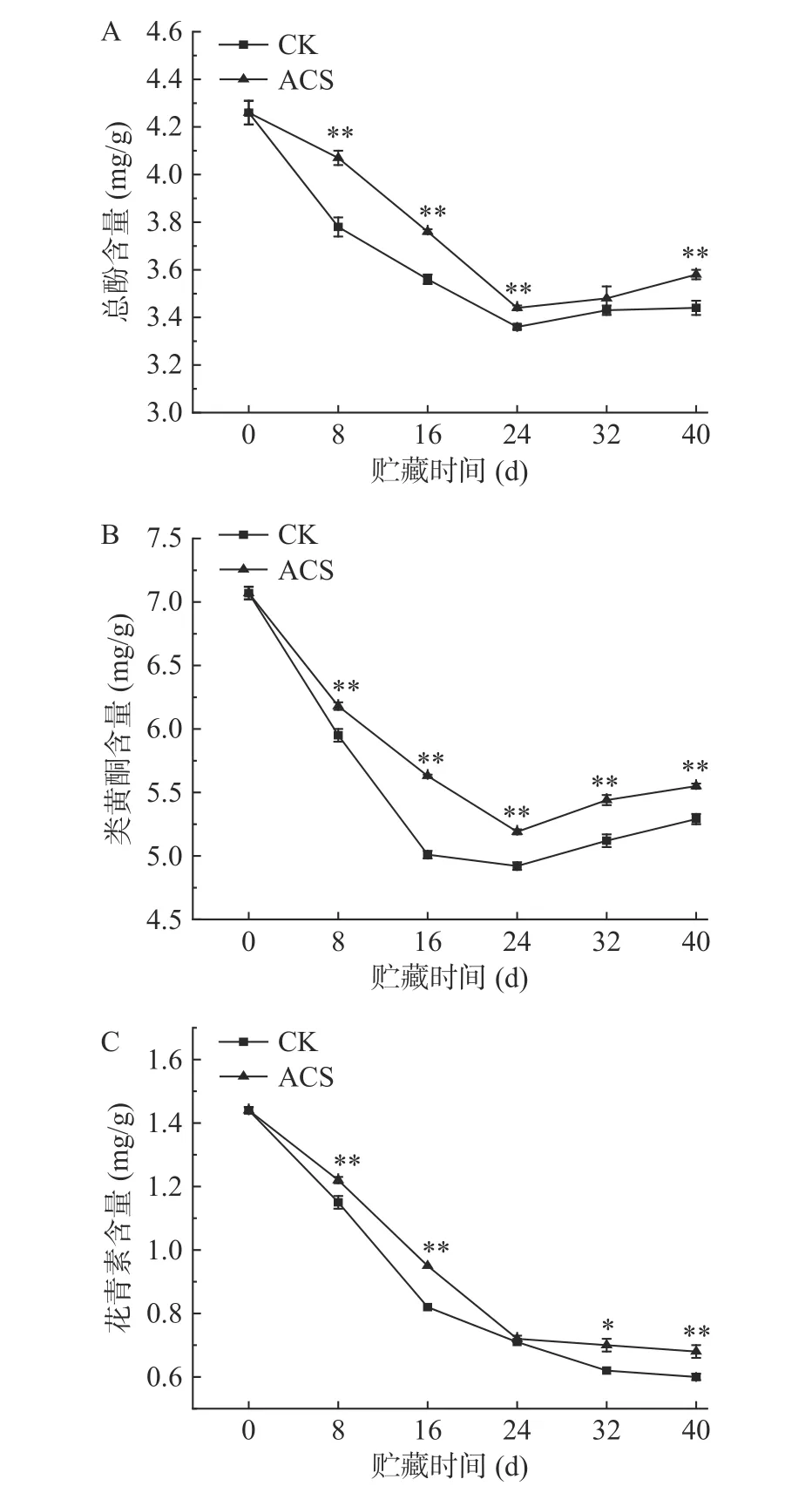
图3 ACS 处理对鲜糯玉米总酚(A)、类黄酮(B)和花青素(C)含量的影响Fig.3 Effects of ACS on total phenol (A),flavonoids (B) and anthocyanin (C) content in fresh waxy maize
2.4 ACS 处理对鲜糯玉米H2O2 含量的影响
活性氧自由基(ROS)是植物代谢的正常产物[25]。采后果蔬在维持生命代谢活动时均会产生ROS,当果蔬受到逆境胁迫时,ROS 的产生速率会增加,低含量的ROS 在调节果实衰老中起着至关重要的作用[26],而ROS 的过量积累会破坏细胞内ROS 代谢平衡,造成果实细胞质膜的损伤[27]。H2O2是果蔬采后新陈代谢过程中产生的ROS 之一,积累的H2O2可导致细胞膜脂质过氧化损害,加速细胞衰老[28]。如图4所示,贮藏至第8 d 时,CK 组和ACS 处理组的H2O2含量分别为3.14、2.03 μmol/g,ACS 处理组此时的H2O2含量仅为CK 组的64.65%,至第24 d 时才达到峰值(2.16 μmol/g),这可能是由于采后损伤导致CK 组玉米在贮藏初期H2O2含量迅速积累,而ACS处理可以有效减缓H2O2含量的积累,延缓H2O2含量峰值的出现,从而有效减轻玉米籽粒细胞膜脂质过氧化损害,延缓果实衰老。这与张恺洳等[3]的研究结果相似,ACS 处理红地球葡萄可降低细胞膜破坏程度,延缓葡萄果实衰老。贮藏8 d 后,CK 组H2O2含量下降以及之后两组H2O2含量的波动变化,可能是玉米果实逐渐衰老与玉米内部活性氧清除系统综合作用的结果,但ACS 处理组的H2O2含量始终低于对照组,并在第8、32 d 时存在极显著差异(P<0.01),第16 d 时差异显著(P<0.05)。上述结果表明,ACS 处理可有效减少H2O2含量的积累,从而保持玉米贮藏品质。
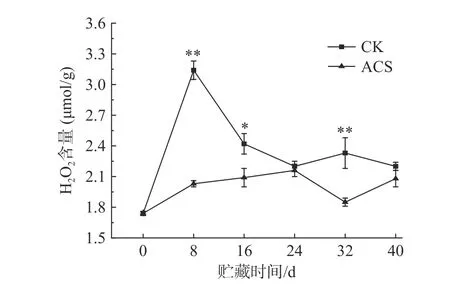
图4 ACS 处理对鲜糯玉米H2O2 含量影响Fig.4 Effect of ACS on H2O2 content in fresh waxy corn
2.5 ACS 处理对鲜糯玉米O2-·清除率的影响
O2-·在植物代谢过程中产生,O2-·的过量积累会引起细胞结构和功能的破坏[29]。如图5 所示,各处理组的O2-·清除率均呈上升趋势,ACS 处理组的O2-·清除率始终高于CK 组,在第16 d 时差异显著(P<0.05),在第40 d 时差异极显著(P<0.01)。说明ACS 处理对鲜糯玉米的O2-·清除作用明显,具有较好的抗氧化效果,从而延缓果蔬衰老。
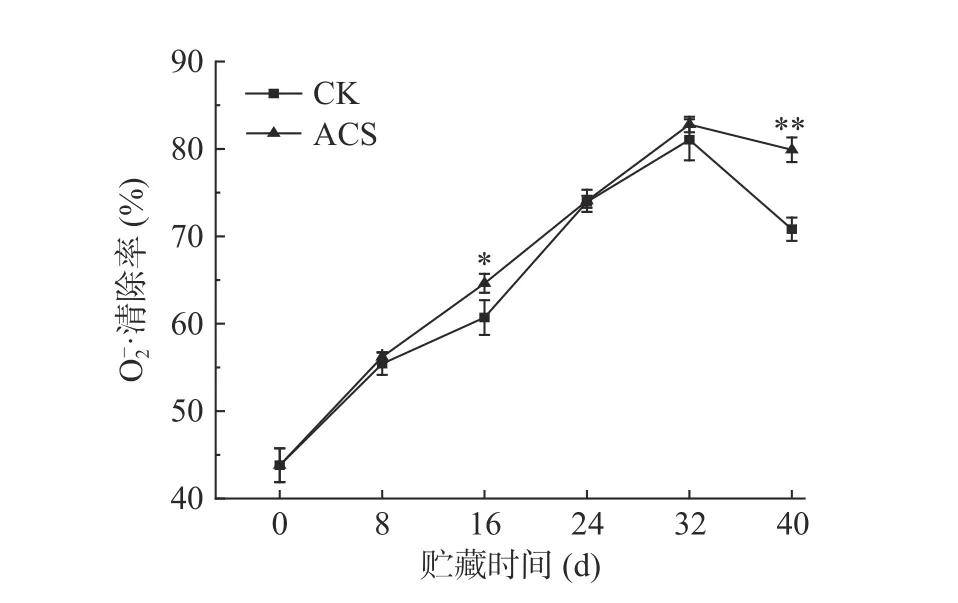
图5 ACS 处理对鲜糯玉米O2-·清除率的影响Fig.5 Effect of ACS on O2-· removal rate in fresh waxy corn
2.6 ACS 处理对鲜糯玉米抗氧化酶的影响
果蔬体内存在较完整的活性氧清除系统,CAT和APX 是果蔬体内重要的ROS 清除酶[30]。CAT能够催化H2O2分解为水和分子氧,维持细胞的ROS 代谢平衡[31]。APX 在催化抗坏血酸与H2O2发生氧化还原反应的过程中将H2O2分解清除[32],减缓植物细胞的过氧化作用[33]。如图6 所示,各组CAT活性和APX 活性均随贮藏时间的延长呈下降趋势。在40 d 贮藏期间,ACS 处理组的CAT 活性显著高于同一贮藏时间的对照组(P<0.05),APX 活性也始终高于对照组,并在贮藏第8、40 d 时差异显著(P<0.05)。贮藏40 d 时,ACS 处理组的CAT 和APX 酶活性分别下降了4.99%和28.74%,而CK 组分别下降了8.07%和55.67%。高抗氧化酶活性通常与减轻氧化损伤和减少果实品质劣变有关[34]。Tang 等[35]研究发现,酸性电解水处理龙眼可以提高CAT、APX 和超氧化物歧化酶等抗氧化酶活性,这些酶在维持龙眼贮藏期间活性氧代谢和抑制果实病害方面发挥重要作用。上述结果说明ACS 处理可有效地抑制采后鲜糯玉米CAT 和APX 活性的下降,从而减缓玉米籽粒的过氧化作用,延缓果实衰老。
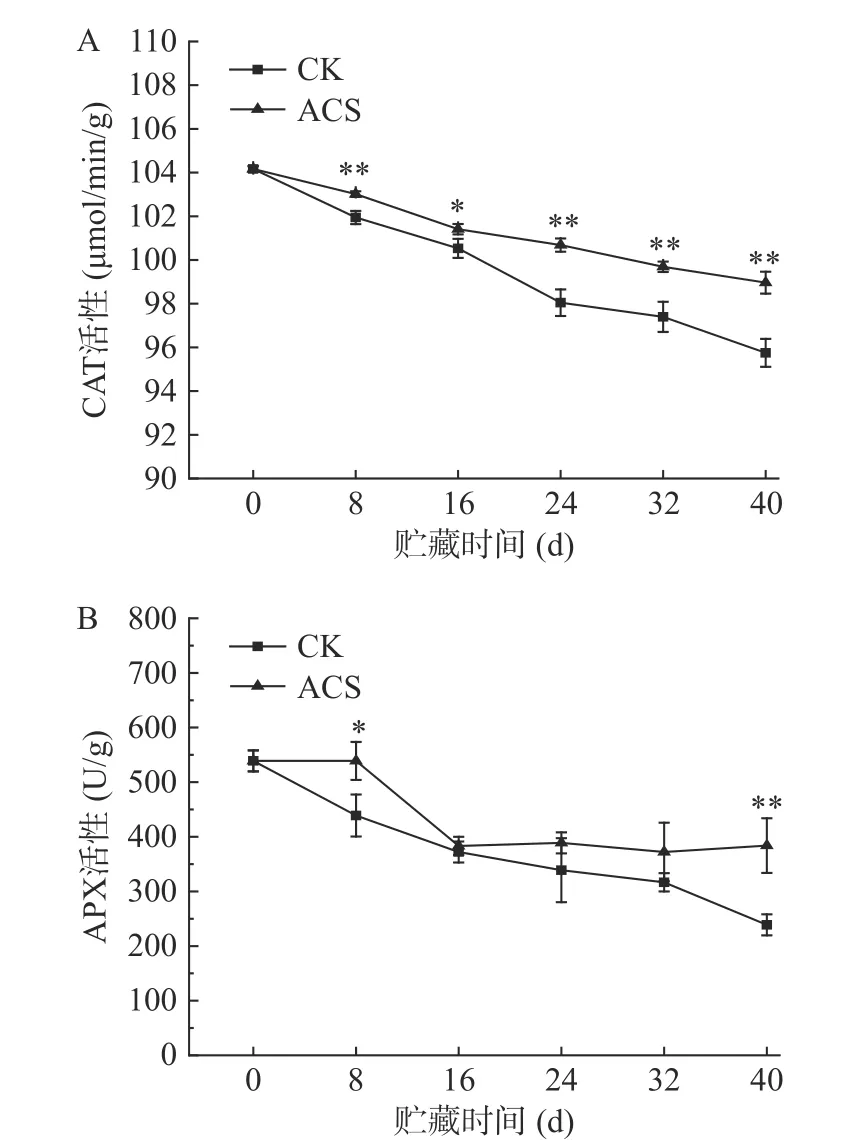
图6 ACS 处理对鲜糯玉米CAT 和APX 活性的影响Fig.6 Effects of ACS on CAT (A) and APX (B) activity in fresh waxy corn
2.7 PCA 综合分析鲜糯玉米品质变化
PCA 图可以直观表现不同处理对鲜糯玉米品质稳定性的影响,置信圈越窄小,表明各指标在贮藏期间的变化越小,即品质越稳定,保鲜效果越佳[36]。采用PCA 法综合分析不同处理后鲜糯玉米品质随贮藏时间的变化,得出PCA 图。由图7 可知,ACS 处理组的置信圈比CK 组窄小,表明ACS 处理组的鲜糯玉米各项指标在贮藏期间变化更小,即ACS 处理对鲜糯玉米有较好的保鲜效果。
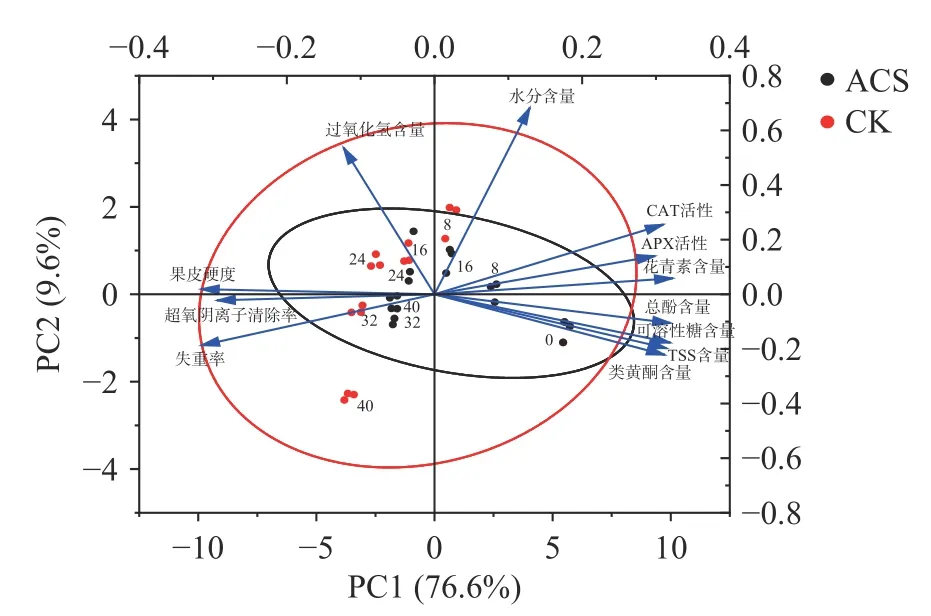
图7 不同处理对鲜糯玉米贮藏期品质影响的主成分图Fig.7 Principal component analysis of the effect of different treatments on the qualities of fresh waxy corn during storage
3 结论
鲜糯玉米籽粒含水率高,采后呼吸作用依然旺盛,其营养物质不断分解以维持采后鲜糯玉米的生理代谢进程,导致鲜糯玉米的营养品质随贮藏时间的延长而下降。本试验结果表明,ACS 能有效延缓鲜糯玉米的水分流失;抑制鲜糯玉米在贮藏期间失重率和果皮硬度的上升;维持鲜糯玉米TSS 和可溶性糖含量;抑制非酶抗氧化物质(总酚、类黄酮、花青素)含量的下降,并保持较高的鲜糯玉米CAT 和APX 活性,加速超氧阴离子的清除速率,有效减缓H2O2的积累,进而提高鲜糯玉米的贮藏品质。本研究结果为ACS 应用于鲜糯玉米采后保鲜及保鲜剂开发提供了理论依据,但目前有关ACS 的保鲜机制研究还不多,还需从分子水平进一步深入研究。

